离子液体中纳米铜催化Huisgen-Click反应
2016-10-25吕和平朱德育毛龙飞姜玉钦
吕和平, 赵 杰, 朱德育, 樊 振, 毛龙飞, 姜玉钦*
(1. 天方药业有限公司,河南 驻马店 463000; 2. 河南师范大学 化学化工学院河南省手性醇类药物工程技术研究中心,河南 新乡 453007)
离子液体中纳米铜催化Huisgen-Click反应
吕和平1, 赵杰1, 朱德育1, 樊振1, 毛龙飞2, 姜玉钦2*
(1. 天方药业有限公司,河南 驻马店463000; 2. 河南师范大学 化学化工学院河南省手性醇类药物工程技术研究中心,河南 新乡453007)
在绿色溶剂离子液体中,经纳米铜催化叠氮化合物和炔烃反应合成了10个1,2,3-三氮唑化合物,其结构经1H NMR,13C NMR和MS(ESI)确证。研究了催化剂、原料摩尔比、催化剂用量、反应温度和反应时间对产率的影响。结果表明:以1-丁基-3-甲基咪唑六氟磷酸盐为溶剂,n(叠氮苯) ∶n(苯乙炔)=1.0 ∶1.2,于60 ℃反应1 h,收率高达95%。
叠氮苯; 苯乙炔; 1,2,3-三氮唑; 离子液体; 纳米铜; click反应; 合成
1,2,3-三氮唑类化合物具有较强的络合金属离子和氢键的能力,广泛应用于医药[1-5]、农药[6]、生物[7-8]、材料[9-12]等领域。1963年,德国化学家Huisgen发现叠氮与炔烃进行反应可以生成1,2,3-三氮唑,提出了1,3-偶极环加成反应的概念[13]。但该反应选择性较差,需较高的温度和较长的反应时间。2002年,Sharpless小组[14]发现亚铜盐可以有效地催化叠氮化合物和末端炔的环加成反应,得到区域选择性的1,4-二取代-1,2,3-三氮唑产物。此后,铜催化体系成为叠氮与端基炔环加成反应的研究热点,包括Cu、 Cu(I)、 Cu(II)/还原体系和Cu(II),其中金属铜(铜丝、铜屑等)的催化效率非常低[15]。2005年,Rothenberg等[16]发现纳米铜簇的催化效果较好,主要原因是其比表面积较大。此后,纳米铜或者负载纳米铜逐渐用于催化Click反应[17-22]。
近年来,离子液体作为一类新型绿色介质, 环保高效,在有机合成中得到广泛应用[23-27]。而在离子液体中用纳米铜催化click反应报道较少[20]。
本文研究了在离子液体1-丁基-3-甲基咪唑六氟磷酸盐[Bmim]PF6中,通过纳米铜催化叠氮化合物(1a~1d, 1f, 1g, 1i )和炔烃(2a, 2e, 2h )反应合成10个1,2,3-三氮唑化合物,其结构经1H NMR,13C NMR和MS(ESI)确证。此方法操作简单,反应时间短,产率高,催化剂用量少,是一种环保绿色高效合成1,2,3-三氮唑的新方法。
1 实验部分
1.1仪器与试剂
Bruker Avance 400型核磁共振仪(CDCl3为溶剂,TMS为内标);D8Advance型全自动X-射线衍射仪;SUPRA40型场发射扫描电镜;Waters Acquity型液相色谱-质谱联用仪。
所用试剂均为分析纯。
1.2合成
(1) 纳米铜的合成
室温条件下将CuSO4·5H2O 2.50 g (10.0 mmol)溶于水(50 mL)中,加入锌粒0.85 g(13.0 mmol),不断搅拌(极细颗粒的暗红色铜粉析出,溶液由蓝色变成无色),滴入适量盐酸溶解过量的锌粒,反应至无气泡生成。过滤,滤饼用盐酸充分洗涤后干燥得纳米铜0.58 g。
(2) 3a~3j的合成(以3e为例)
在圆底烧瓶中加入纳米铜催化剂0.02 g(0.3 mmol), [Bmim]PF62.5 mL,叠氮苯(1a)1.2 g(10.0 mmol)和对甲基苯乙炔(2a)1.4 g(12.0 mmol),于60 ℃反应1 h[TLC检测(展开剂:A=石油醚/乙酸乙酯=6/1,V/V)]。反应液用乙醚(10 mL)萃取,有机相减压蒸除乙醚,经柱层析(洗脱剂:A=15 ∶1)纯化得三氮唑化合物3e 2.47 g,收率95%。
用类似方法合成3a~3d, 3f~3j。其结构及产率见表1。

Scheme 1

表1 3a~3j的结构与产率
3a:1H NMRδ: 8.20(s, 1H), 7.95~7.89(m, 2H), 7.82~7.77(m, 2H), 7.55(t,J=7.7 Hz, 2H), 7.50~7.43(m, 3H), 7.38(t,J=7.4 Hz, 1H);13C NMRδ: 148.4, 137.1, 130.3, 129.8, 128.9, 128.4, 125.9, 120.5, 117.6; MS(ESI)m/z: 222{ [M+H]+}。
3b:1H NMRδ: 8.16(s, 1H), 7.91(d,J=7.1 Hz, 2H), 7.66(d,J=8.4 Hz, 2H), 7.46(t,J=7.5 Hz, 2H), 7.35(dd,J=16.8 Hz, 7.9 Hz, 3H), 2.43(s, 3H);13C NMRδ: 148.3, 138.9, 134.8, 130.3, 128.92, 128.4, 125.9, 120.4, 117.7, 21.1; MS(ESI)m/z: 236{ [M+H]+}。
3c:1H NMRδ: 8.21(s, 1H), 7.95~7.90(m, 2H), 7.68(dd,J=6.1 Hz, 3.4 Hz, 1H), 7.62~7.57(m, 1H), 7.50~7.43(m, 4H), 7.37(t,J=7.4 Hz, 1H);13C NMRδ: 147.6, 134.9, 130.8, 130.2, 129.0, 128.5, 128.0, 127.8, 125.9, 121.6; MS(ESI)m/z: 256 { [M+H]+}。
3d:1H NMRδ: 7.97(s, 1H), 7.94~7.91(m, 2H), 7.41~7.35(m, 7H), 2.28(s, 3H);13C NMRδ: 147.6, 136.5, 133.8, 131.6, 130.4, 130.0, 129.0, 128.4, 126.9, 125.9, 121.2, 18.0; MS(ESI)m/z: 236{ [M+H]+}。
3e:1H NMRδ: 8.16(s, 1H), 7.80(dd,J=7.8 Hz, 5.9 Hz, 4H), 7.57~7.43(m, 3H), 7.27(d,J=8.1 Hz, 2H), 2.40(s, 3H);13C NMRδ: 148.5, 138.3, 137.1, 129.7, 128.7, 127.4, 125.8, 120.5, 117.3, 21.4; MS(ESI)m/z: 236{ [M+H]+}。
3f:1H NMRδ: 7.69(d,J=7.9 Hz, 2H), 7.62(s, 1H), 7.42~7.27(m, 5H), 7.20(d,J=7.7 Hz, 2H), 5.55(s, 2H), 2.36(s, 3H);13C NMRδ: 148.3, 138.0, 134.8, 129.5, 129.1, 128.8, 128.1, 127.7, 125.6, 119.2, 54.2, 21.3; MS(ESI)m/z: 250{ [M+H]+}。
3g:1H NMRδ: 8.17(d,J=8.3 Hz, 2H), 7.75(s, 1H), 7.68(d,J=7.8 Hz, 2H), 7.40(d,J=8.3 Hz, 2H), 7.20(d,J=7.8 Hz, 2H), 5.65(s, 2H), 2.35(s, 3H);13C NMRδ: 148.7, 148.0, 141.9, 138.4, 129.6, 128.6, 127.3, 125.6, 124.3, 119.6, 53.1, 21.3; MS(ESI)m/z: 295 { [M+H]+}。
3h:1H NMRδ: 8.05(s, 1H), 7.73(d,J=7.6 Hz, 2H), 7.48(dt,J=31.9 Hz, 7.4 Hz, 3H), 7.31(dd,J=8.4 Hz, 7.6 Hz, 2H), 7.06~6.96(m, 3H), 5.30(s, 2H);13C NMRδ: 158.2, 145.1, 137.0, 129.7, 128.9, 121.4, 120.9, 120.6, 114.8, 62.0; MS(ESI)m/z: 252{ [M+H]+}。
3i:1H NMRδ: 7.97(s, 1H), 7.64~7.59(m, 2H), 7.34~7.27(m, 2H), 7.04~6.97(m, 5H), 5.28(s, 2H), 3.85(s, 3H);13C NMRδ: 159.9, 158.2, 144.8 , 130.4, 129.6, 122.3, 121.3, 121.1, 114.8, 62.0, 55.7; MS(ESI)m/z: 282{ [M+H]+}。
3j:1H NMRδ: 7.81(s, 1H), 7.45~7.29(m, 6H), 7.06~6.97(m, 3H), 5.33(s, 2H), 2.22(s, 3H);13C NMRδ: 158.2, 144.1, 136.4, 133.7, 131.5, 130.0, 129.6, 126.9, 126.0, 124.3, 121.4, 114.9, 62.0, 17.9; MS(ESI)m/z: 266{ [M+H]+}。
2 结果与讨论
2.1表征
纳米铜的XRD谱图和FE-SEM图谱分别见图1和图2。由图2可见,纳米铜颗粒在制备过程中发生了团聚,用其催化Huisgen-click反应,用量少,反应条件温和,产率高,证明其催化活性仍然很好。经检测,该纳米铜颗粒比表面积约为510 m2·g-1。

2θ/(°)

图2 纳米铜的FE-SEM谱图
2.2反应条件优化
以合成3a为例,研究了催化剂、原料配比r= [n(叠氮化合物)∶n(芳基炔)]、催化剂用量、反应温度、反应时间对产率的影响。
(1) 催化剂的形态
1a 10 mmol,其余反应条件同1.2(2),考察催化剂的形态对3a收率的影响,结果见表2。由表2可见,纳米铜在其制备过程中,虽然发生了团聚,但其催化效果仍远远优于铜片、铜丝等,进一步验证了铜的催化效果与比表面积紧密相关[16]。

表2 铜的形态对反应的影响
(2)r
以纳米铜为催化剂,其余反应条件同2.2(1),考察r对产率的影响,结果见图3。由图3可知,随着苯乙炔物质的量的增加,3a产率提高,当r=1.0 ∶1.2时,产率最高(74%)。
(3) 催化剂用量
r=1.0 ∶1.2,其余条件同2.2(2),考察纳米铜的用量对产率的影响,结果见图4。由图4可知,随着纳米铜用量的增加,产率增加,当纳米铜用量大于3%时,产率不再增加。因此,催化剂最佳用量为3%。
(4) 反应温度
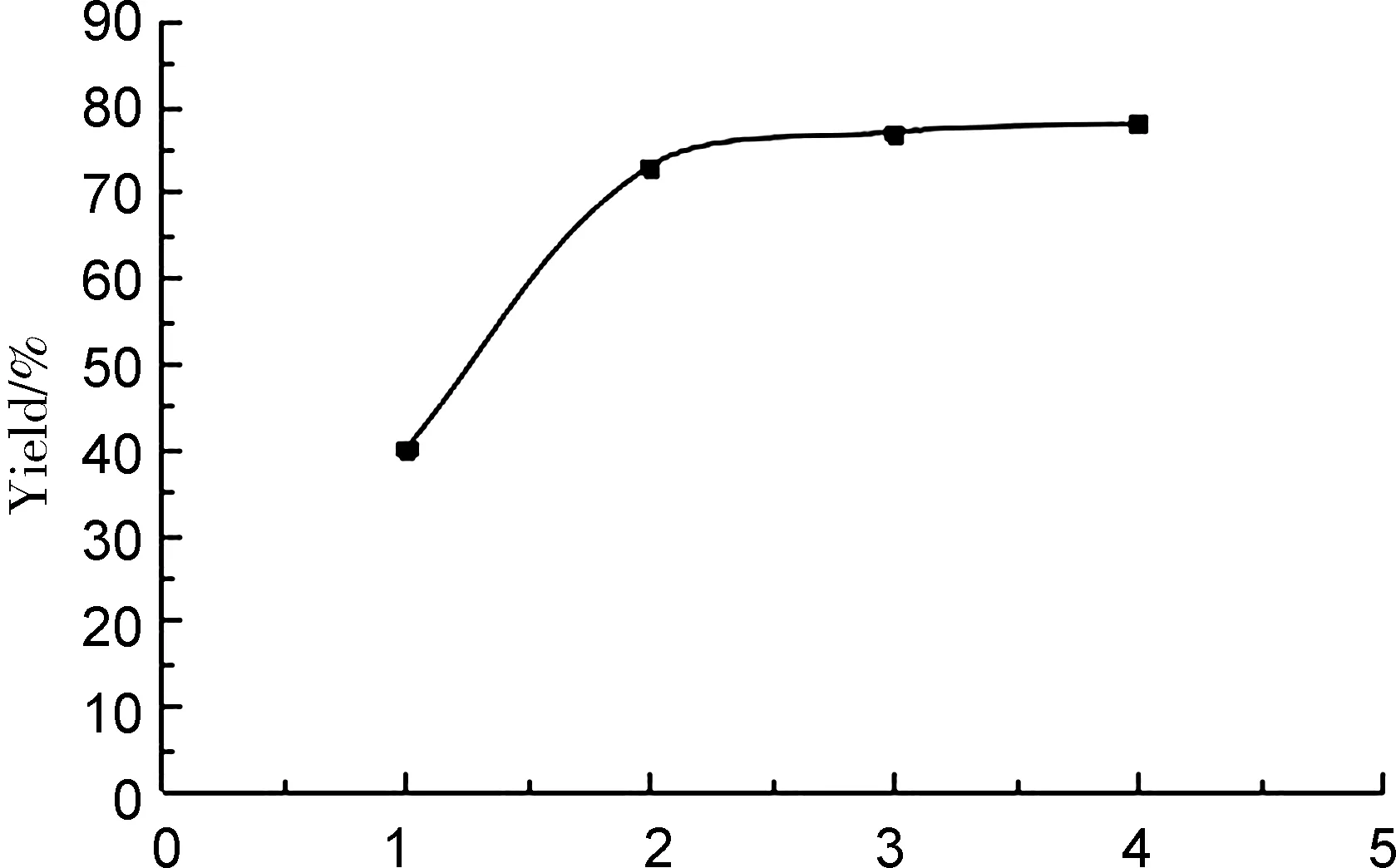
催化剂用量3%,其余条件同2.2(3),考察反应温度对产率的影响,结果见图5。由图5可知,随着温度的升高,产率增加,当温度达到60 ℃时,产率最高(92%),而后降低。因此,最佳反应温度为60 ℃。

r
纳米铜用量/mol%

Tempreture/℃

Time/min
(5) 反应时间
反应温度为60 ℃,其余条件同2.2(4),考察反应时间对产率的影响,结果见图6。由图6可知,当反应时间达到1 h时,产率基本不再增加。因此,最佳反应时间为1 h。
(6) 催化体系的循环使用
探究了该纳米铜催化体系能否重复使用,结果见图7。由图7可见,该催化体系能够多次循环使用,而且催化效果不变。纳米铜比表面积较大,易发生团聚,往往需要加入稳定剂[20],另外纳米铜均匀地分散到反应溶液而不能重复使用,用量较大[21]。本文所涉及的纳米铜在制备过程中,无需加入稳定剂,制备过程相对简单[22],用量少,虽然其表面发生了团聚,但并不影响其催化效果,有效地解决了催化剂的循环使用问题。
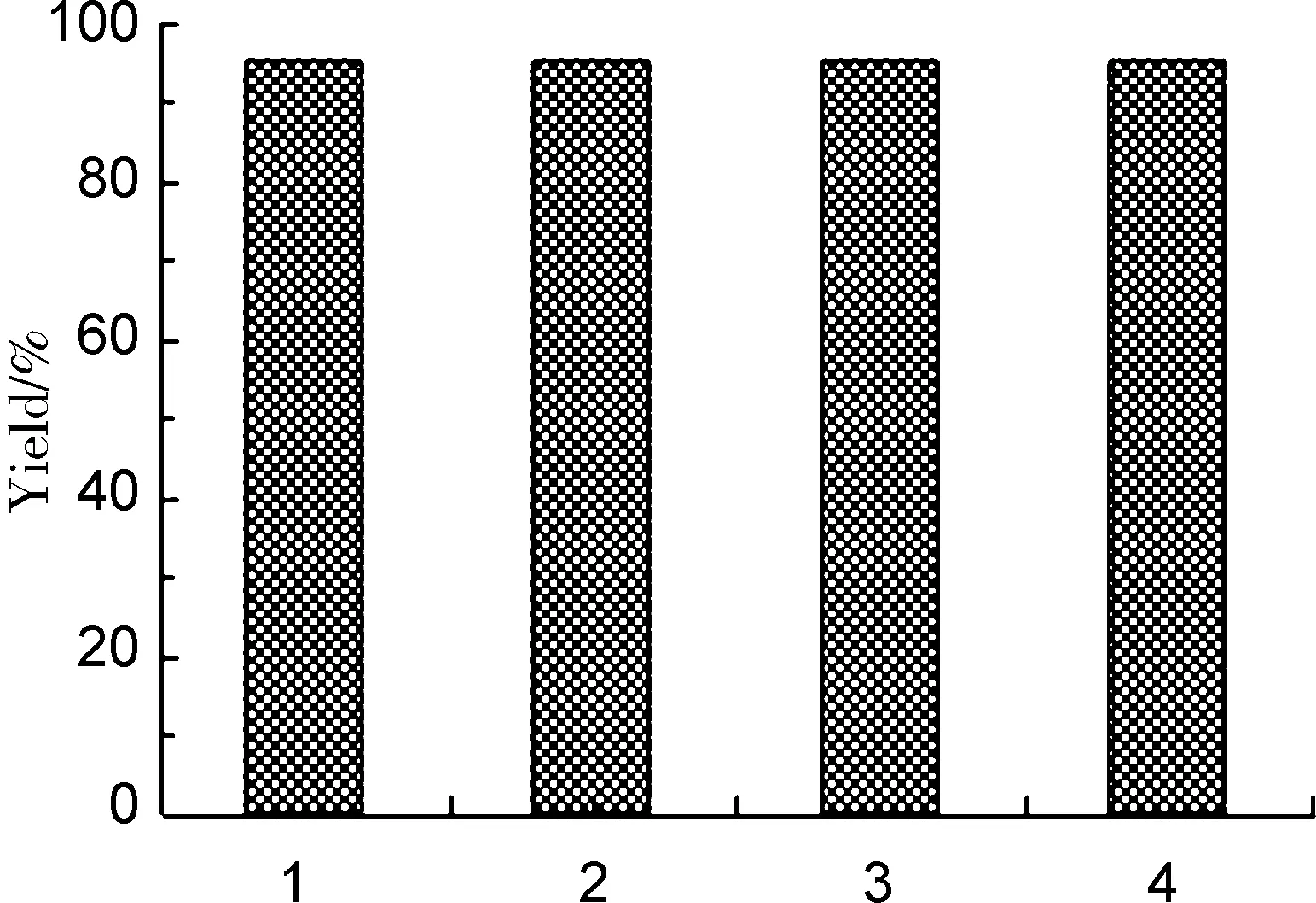
循环次数
在绿色溶剂离子液体[Bmim]PF6中,用纳米铜催化叠氮化物和炔烃的反应,合成了一系列1,2,3-三氮唑化合物。该方法绿色高效,反应温和,催化剂制备简单、用量少、可循环使用,操作安全且底物适用范围较广,具有重要的实用价值。
[1]Dabak K, Sezer Ö, Akar A,etal. Synthesis and investigation of tuberculosis inhibition activities of some 1,2,3-triazole derivatives[J].Eur J Med Chem,2003,38(2):215-218.
[2]贾淑红,李翠平,何兴,等. 哌啶链接1,2,3-三氮唑化合物的合成及抗细菌活性研究[J].化学研究与应用, 2016,28(2):158-163.
[3]郭永彪,刘海波,许明. 用“点击化学”法合成新型他克林-四氢异喹啉异二联体[J].合成化学,2011,19(3):299-303.
[4]Mohapatra D K, Shabab P K M, Khan M I. Click chemistry based rapid one-pot synthesis and evaluation for protease inhibition of new tetracyclic triazole fused benzodiazepine derivatives[J].Bioorg Med Chem Lett,2009,19(17):5241-5245.
[5]杨雪梅,陈紫琳,贾振斌. 新型含1,2,3-三氮唑的燃料木素糖缀合物的合成[J].合成化学,2015,23(10):952-956.
[6]Wang M J, Zhao X B, Wu D,etal. Design,synthesis,crystal structure,insecticidal activity,molecular docking,and QSAR studies of novel N3-substituted imidacloprid derivatives[J].J Agric Food Chem,2014,62(24):5429-5442.
[7]Anegundi R I, Puranik V G, Hoth S. Synthesis of 1,2,3-triazole and 1,2,3,4-tetrazole-fused glycosides and nucleosides by an intramolecular 1,3-dipolar cycloaddition reaction[J].Org Biomol Chem,2008,6(4):779-786.
[8]Niu T F, Lv M F, Wang L,etal. Chemoselective preparation of 1,2,3-triazole-isoxazole bisfunctional derivatives and their application in peptidomimetic synthesis[J].Org Biomol Chem,2013,11(6):1040-1048.
[9]Li G L, Wan D, Neoh K G,etal. Binary polymer brushes on silica@polymer hybrid nanospheres and hollow polymer nanospheres by combined alkyne-azide and thiol-ene surface click reactions[J].Macromolecules,2010,43(24):10275-10282.
[10]Slater M, Snauko M, Svec F,etal. “Click Chemistry” in the preparation of porous polymer-based particulate stationary phases forμ-HPLC separation of peptides and proteins[J]. Anal Chem,2006,78(14):4969-4975.
[11]Obadia M M, Mudraboyina B P, Serghei A,etal. Enhancing properties of anionic poly(ionic liquid)s with 1,2,3-triazolium counter cations[J].ACS Macro Lett,2014,3(7):658-662.
[12]毛龙飞,苑李双,颜铭彦,等. 米拉贝隆的合成研究[J].化学研究与应用,2016,28(4):521-524.
[13]李世宁,孙春玲,张丹丹,等. 5,6,7,8-四氢吡啶并[3,4-d]嘧啶衍生物的合成[J].化学研究与应用,2016,28(2):164-169.
[14]Rostovtsev V V, Green L G, Fokin V V,etal. A stepwise Huisgen cycloaddition process:Copper(I)-catalyzed regioselective “Ligation” of azides and terminal alkynes[J].Angew Chem Int Ed,2002,41(14):2596-2599.
[15]Himo F, Lovell T, Hilgraf R,etal. Copper(I)-catalyzed synthesis of azoles.DFT study predicts unprecedented reactivity and intermediates[J].J Am Chem Soc,2005,127(1):210-216.
[16]Pachón L D, Maarseveen J H, Rothenberg G. Click chemistry:Copper clusters catalyse the cycloaddition of azides with terminal alkynes[J].Adv Synth Catal,2005,347(6):811-815.
[17]Orgueira H A, Fokas D, Isome Y,etal. Regioselective synthesis of [1,2,3]-triazoles catalyzed by Cu(I) generated in situ from Cu(0) nanosize activated powder and amine hydrochloride salts[J].Tetrahedron Lett,2005,46(16):2911-2914.
[18]Alonso F, Moglie Y, Radivoy G,etal. Click chemistry from organic halides,diazonium salts and anilines in water catalysed by copper nanoparticles on activated carbon[J].Org Biomol Chem,2011,9(18):6385-6395.
[19]Kantam M L, Jaya V S, Sreedhar B,etal. Preparation of alumina supported copper nanoparticles and their application in the synthesis of 1,2,3-triazoles[J].J Mol Catal A: Chem,2006,256(1-2):273-276.
[20]Raut D, Wankhede K, Vaidy K,etal. Copper nanoparticles in ionic liquids:Recyclable and efficient catalytic system for 1,3-dipolar cycloaddition reaction[J].Catal Commun,2009,10(8):1240-1243.
[21]Alonso F, Moglie Y, Radivoy G,etal. Copper nanoparticles in click chemistry:An alternative catalytic system for the cycloaddition of terminal alkynes and azides[J].Tetrahedron Lett,2009,50(20):2358-2362.
[22]Shaabani A, Afshari R, Hooshmand S E,etal. Copper supported on MWCNT-guanidine aceticacid@Fe3O4:Synthesis,characterization and application as a novel multi-task nanocatalyst for preparation of triazoles and bis(indolyl)methanes in water[J].RSC Adv,2016,6(22):18113-18125.
[23]Ranu B C, Banerjee S, Jana R. Ionic liquid as catalyst and solvent:The remarkable effect of a basic ionic liquid,[bmIm]OH on Michael addition and alkylation of active methylene compounds[J].Tetrahedron,2007,63(3):776-782.
[24]Formentín P, García H, Leyva A. Assessment of the suitability of imidazolium ionic liquids as reaction med-ium for base-catalysed reactions case of knoevenagel and claisen-schmidt reactions[J].J Mol Catal A:Chem,2004,214(1):137-142.
[25]Ansari I A, Gree R. TEMPO-catalyzed aerobic oxidation of alcohols to aldehydes and ketones in ionic liquid [bmim][PF6][J].Org Lett,2002,4(9):1507-1509.
[26]罗文锋,姚舜,柳加兵,等. 新型离子液体催化合成喹唑啉酮衍生物的研究[J].华西药学杂志,2012,27(1):061-063.
[27]李岑,蒋懿,蒋晔,等. 离子液体相转移催化合成雷尼酸锶中间体[J].华西药学杂志,2009,24(5):479-480.
Huisgen-Click Reaction Catalyzed by Nano-Copper in Ionic liquid
LÜ He-ping1,ZHAO Jie1,ZHU De-yu1,FAN Zhen1,MAO Long-fei2,JIANG Yu-qin2*
(1. Topfond Pharmaceutical Co., Ltd., Zhumadian 463000, China; 2.Henan Engineering Research Center of Chiral Hydroxyl Pharmaceutical, School of Chemistry and Chemical Engineering, Henan Normal University, Xinxiang 453007, China)
Ten 1,2,3-triazoles were synthesized with various azides and alkynes in ionic liquid, using nano-copper as catalyst. The structures were confirmed by1H NMR,13C NMR and MS(ESI). Effects of catalyst, reactants mole ratio, amount of catalyst, reaction temperature and reaction time on the yield were investigated. The results showed that the yield was 95% under the optimum conditions([Bmim]PF6as the solvent,n(phenylazide)∶n(phenylacetylene)=1.0 ∶1.2, reaction at 60 ℃ for 1 h).
phenylazide; phenylacetylene; 1,2,3-triazole; ionic liquid; nano-copper; click reaction; synthesis
2016-06-06
河南省重点科技攻关资助项目(152102310312, 152102210285)
吕和平(1967-),男,汉族,河南驻马店人,高级工程师,主要从事药物化学的研究。
姜玉钦,副教授, E-mail: zzdxjyq@sina.com
O626
ADOI: 10.15952/j.cnki.cjsc.1005-1511.2016.09.16144
