4-酰氧基黄体酮衍生物的合成及其细胞毒性
2016-10-25范宁娟汤江江
范宁娟, 汤江江
(1. 西北农林科技大学 a. 生命科学学院; b. 理学院,陕西 杨凌 712100)
4-酰氧基黄体酮衍生物的合成及其细胞毒性
范宁娟1a, 汤江江1b*
(1. 西北农林科技大学 a. 生命科学学院; b. 理学院,陕西 杨凌712100)
以黄体酮为前体,经4,5-环氧黄体酮合成了4-羟基黄体酮(2); 2与酰氯经酰化反应合成了一系列新型4-酰氧基黄体酮衍生物(4a~4i),其结构经1H NMR,13C NMR和MS(ESI)表征。体外细胞毒性实验结果表明:在用药量为50 μg·mL-1时, 4c, 4d和4e对MCF-7细胞的抑制率分别为26%, 22%和13%。
甾体; 黄体酮; 酰氧基; 细胞毒性; 合成
甾体类衍生物是有机合成中活性比较广泛的化合物,通常具有亲脂性,对细胞膜和某些甾体受体有较强的亲和力,受到了研究人员的广泛关注[1-2]。黄体酮是一种比较廉价的孕甾烷和常用的激素类药物,黄体酮衍生物通常具有广泛的生物活性[3-6]。有专利指出,4-羟基黄体酮的酯类具有治疗功能性子宫出血的功效[7-8],但未提供此类衍生物详细的波谱数据,更未见其具体的药理学研究结果。
近年来本课题组以黄体酮为底物,设计并合成了多个系列的黄体酮类衍生物[9-12]。作为合成工作的延续,本文以黄体酮为前体,经4,5-环氧黄体酮(1)合成了4-羟基黄体酮(2); 2与取代酰氯(3a~3i)经酰化反应合成了系列新型4-酰氧基黄体酮衍生物(4a~4i, Scheme 1),其结构经1H NMR,13C NMR和MS(ESI)表征。考察了4的体外细胞毒性。
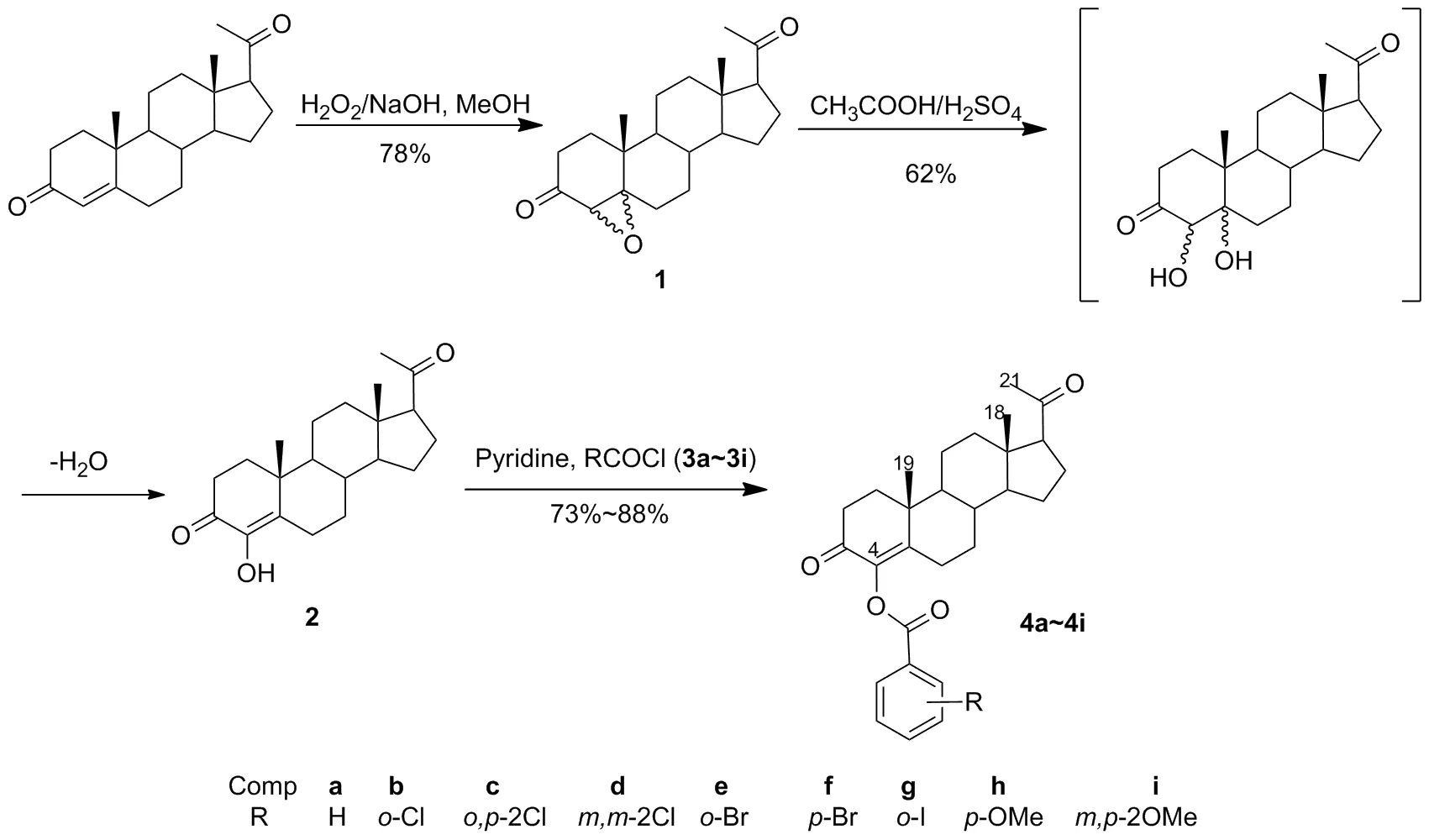
Scheme 1
1 实验部分
1.1仪器与试剂
XT-4型双目显微熔点仪(温度未校正);Bruker Advance III 500型核磁共振仪(CDCl3为溶剂,TMS为内标);LTQ Fleet 型ESI源质谱仪。1按文献[7]方法合成;4-氯黄体酮(5) 按文献[9]方法合成;其余所用试剂均为分析纯。
1.2合成
(1) 2的合成
将1 2.57 g(7.8 mmol)溶于冰醋酸50 mL中,稍微加热使其溶解。于室温加入浓硫酸2.5 mL,搅拌3 min(黄色变成红色),于室温反应24 h(期间伴随偶尔的震荡)。将反应液倒入冰水1 L中(析出白色固体),抽滤,滤饼用水反复洗涤至无刺激气味,加入二氯甲烷150 mL,依次用饱和氯化钠溶液(40 mL)洗涤,无水硫酸钠干燥,减压除溶,残余物用甲醇重结晶得白色固体2 1.59 g,收率62%, m.p.225~227 ℃(m.p. 230~232 ℃[8]);1H NMRδ: 0.67(s, 3H, 18-H), 0.96~1.06(m, 2H), 1.18(s, 3H, 19-H), 1.25~2.08(m, 13H), 2.12(s, 3H, 21-H), 2.17~2.10(m, 1H), 2.49~2.55(m, 3H), 2.99~3.02(m, 1H), 6.09(s, 1H, 4-OH);13C NMRδ: 13.34, 17.13, 20.96, 22.88, 22.93, 24.41, 30.92, 31.50, 31.76, 34.69, 35.16, 37.77, 38.73, 43.92, 54.09, 56.16, 63.58, 139.68, 141.22, 193.51, 209.36; MS(ESI)m/z: 331{[M+H]+}。
(2) 4a~4i的合成通法
将2 33 mg(0.1 mmol)溶于干燥的吡啶中(1.5 mL),冰浴冷却下加入3a~3i 0.14 mmol,于室温反应至终点(TLC检测)。减压浓缩得油状粗产物,经GF254薄层层析[展开剂:(石油醚/丙酮=3/1,V/V)]纯化得4a~4i。
4-(苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4a):白色固体38 mg, 收率88%, m.p.138~140 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.17~2.19(m, 1H), 2.53~2.56(m, 2H), 2.75~2.78(m, 1H), 7.47(m, 2H, ArH), 7.60(m, 1H, ArH), 8.12(d,J=7.5 Hz, 2H, ArH);13C NMRδ: 13.35, 17.74, 21.02, 21.02, 22.87, 24.18, 24.33, 30.92, 31.50, 33.49, 35.12, 38.66, 39.22, 43.91, 53.68, 55.96, 63.48, 126.29, 128.49, 129.08, 130.23, 133.49, 139.31, 164.43, 190.62, 209.26; MS(ESI)m/z: 435 {[M+H]+}。
4-(2′-氯苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4b): 白色固体38 mg, 收率81%, m.p.205~207 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.17~2.19(m, 1H), 2.53~2.56(m, 2H), 2.82~2.85(m, 1H), 7.35(m, 1H, ArH), 7.48(m, 2H, ArH), 8.07(dd,J=1.0 Hz, 8.5 Hz, 1H, ArH);13C NMRδ: 13.36, 17.73, 21.02, 21.02, 22.87, 24.34, 24.34, 30.87, 31.52, 33.45, 35.11, 38.65, 39.29, 43.92, 53.67, 55.93, 63.48, 126.70, 128.93, 131.14, 132.24, 133.08, 134.27, 139.14, 156.30, 163.17, 190.30, 209.35; MS(ESI)m/z: 469{[M+H]+}。
4-(2′,4′-二氯苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4c): 白色固体44 mg, 收率88%, m.p.183~185 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.17~2.20(m, 1H), 2.53~2.56(m, 2H), 2.77~2.80(m, 1H), 7.34(dd,J=2.0 Hz, 8.5 Hz, 1H, ArH), 7.51(d,J=2.0 Hz, 1H, ArH), 8.03(d,J=8.5 Hz, 1H, ArH);13C NMRδ:13.35, 17.73, 21.01, 21.01, 22.87, 24.33, 24.33, 30.87, 31.52, 33.40, 35.09, 38.63, 39.30, 43.90, 53.65, 55.91, 63.46, 127.14, 127.19, 131.08, 133.29, 135.48, 138.93, 139.07, 156.39, 162.32, 190.17, 209.28; MS(ESI)m/z: 503{[M+H]+}。
4-(3′,5′-二氯苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4d): 白色固体43 mg, 收率86%, m.p.145~146 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.18~2.20(m, 1H), 2.53~2.56(m, 2H), 2.70~2.73(m, 1H), 7.58(t,J=2.0 Hz, 1H, ArH), 7.98(d,J=2.0 Hz, 2H, ArH);13C NMRδ: 13.35, 17.75, 21.02, 21.02, 22.87, 24.33, 24.33, 30.90, 31.52, 33.38, 35.08, 38.62, 39.30, 43.90, 53.65, 55.91, 63.46, 128.60, 131.90, 133.31, 135.43, 139.13, 156.44, 162.16, 190.02, 209.28; MS(ESI)m/z: 503{ [M+H]+}。
4-(2′-溴苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4e): 白色固体41 mg, 收率80 %, m.p. 214~216 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.18~2.20(m, 1H), 2.53~2.56(m, 2H), 2.83~2.86(m, 1H), 7.40(m, 2H, ArH), 7.69(dd,J=0.5 Hz, 8.5 Hz, 1H, ArH), 8.06(dd,J=1.5 Hz, 7.5 Hz, 1H, ArH);13C NMRδ: 13.36, 17.73, 21.01, 21.01, 22.87, 24.34, 24.34, 30.87, 31.52, 33.44, 35.11, 38.65, 39.30, 43.91, 53.67, 55.92, 63.48, 122.18, 127.28, 130.99, 132.20, 133.06, 134.41, 139.11, 156.34, 163.66, 190.27, 209.31; MS(ESI)m/z: 513{ [M+H]+}。
4-(4′-溴苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4f): 白色固体43mg, 收率84%, m.p.179~181 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.18~2.20(m, 1H), 2.53~2.56(m, 2H), 2.71~2.74(m, 1H), 7.61(d,J=8.5 Hz, 2H, ArH), 7.97(d,J=8.5 Hz, 2H, ArH);13C NMRδ: 13.36, 17.75, 21.01, 21.01, 22.87, 24.33, 24.33, 30.91, 31.52, 33.44, 35.10, 38.64, 39.25, 43.91, 53.66, 55.94, 63.47, 127.99, 128.72, 131.72, 131.87, 139.21, 156.30, 163.75, 190.59, 209.27; MS(ESI)m/z: 513{ [M+H]+}。
4-(2′-碘苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4g): 白色固体49 mg, 收率88%, m.p.217~219 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(3s, H, 21-H), 2.18~2.20(m, 1H), 2.53~2.56(m, 2H), 2.82~2.85(m, 1H), 7.19(m, 1H, ArH), 7.44(t,J=7.5 Hz, 1H, ArH), 8.02(d,J=8.0 Hz, 1H, ArH), 8.08(dd,J=0.5 Hz, 7.5 Hz, 1H, ArH);13C NMRδ: 13.36, 17.73, 21.01, 21.01, 22.87, 24.35, 24.35, 30.88, 31.52, 33.44, 35.12, 38.65, 39.30, 43.91, 53.65, 55.92, 63.48, 94.64, 128.02, 131.86, 133.13, 133.84, 139.11, 141.43, 156.32, 164.11, 190.27, 209.30; MS(ESI)m/z: 561{ [M+H]+}。
4-(4′-甲氧基苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4h): 白色固体35 mg, 收率76%, m.p. 178~180 ℃;1H NMRδ: 0.67(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.29(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.18~2.20(m, 1H), 2.53~2.56(m, 2H), 2.74~2.77(m, 1H), 3.87(s, 3H, OCH3), 6.94(d,J=8.0 Hz, 2H, ArH), 8.07(d,J=7.5 Hz, 2H, ArH);13C NMRδ: 13.35, 17.72, 21.01, 21.01, 22.84, 24.16, 24.32, 30.92, 31.51, 33.51, 35.11, 38.65, 39.18, 43.90, 53.66, 55.51, 55.95, 63.47, 113.77, 121.37, 132.33, 139.30, 156.12, 163.84, 164.13, 190.77, 209.29; MS(ESI)m/z: 465{ [M+H]+}。
4-(3′,4′-二甲氧基苯甲酰氧基)-孕甾-4-烯-3,20-二酮(4i): 白色固体36 mg, 收率73%, m.p.79~80 ℃;1H NMRδ: 0.68(s, 3H, 18-H), 1.02~1.28(m, 5H), 1.30(s, 3H, 19-H), 1.46~2.10(m, 11H), 2.13(s, 3H, 21-H), 2.18~2.20(m, 1H), 2.53~2.56(m, 2H), 2.75~2.78(m, 1H), 3.93(s, 3H, OCH3), 3.95(s, 3H, OCH3), 6.92(d,J=8.5 Hz, 1H, ArH), 7.60(s, 1H, ArH), 7.79(d,J=8.0 Hz, 1H, ArH);13C NMRδ: 13.36, 17.75, 21.03, 21.03, 22.87, 24.34, 24.34, 30.94, 31.51, 33.50, 35.13, 38.67, 39.22, 43.92, 53.69, 55.98, 56.03, 56.10, 63.49, 110.37, 112.49, 121.43, 124.49, 124.56, 139.34, 148.73, 153.53, 164.26, 190.69, 209.30; MS(ESI)m/z: 495{ [M+H]+}。
(3) 由5 合成 2
氮气保护条件下,将5 348 mg(1 mmol)溶于叔丁醇(25 mL)中,搅拌下加入氢氧化钾细粉末168 mg(3 mmol),回流反应40 min。冷却至室温,加水30 mL,用乙酸乙酯(3×30 mL)抽提,合并有机相,用水洗涤,用无水硫酸钠干燥,减压除溶得粗产物,经薄层层析(展开剂:V(石油醚) ∶V(丙酮)=5 ∶1)纯化得2 276 mg,收率23%。
1.3体外细胞毒活性测试
用四氮唑蓝 (MTT)法测试了4a~4i的体外抑制乳腺癌细胞MCF-7增殖的活性。以完全培养基为溶剂,5-氟尿嘧啶(5-fluorouracil)作为对照药剂,将4a~4i配制成浓度为50 μg·mL-1的药液。将生长至对数生长期的细胞消化、离心, 制成细胞悬液, 吹匀并将其密度调至4~6×104个· mL-1, 以180 μL/孔接种到96孔板中, 将96孔板置于37 ℃含5% CO2的饱和湿度培养箱中孵育24 h。加入不同的受试化合物,每组设定4复孔,继续培养48 h。加入配制好的MTT溶液, 每孔20 μL,放入培养箱中继续孵育4 h。取出孵育4 h的96孔板, 将其中的MTT溶液轻轻甩出, 每孔加DMSO 100 μL,微量振荡仪上振荡5 min使甲瓒完全溶解, 用酶标仪在492 nm下测光密度(OD)值, 并记录数据,根据比值计算抑制率。
2 结果与讨论
2.1合成
黄体酮在碱性过氧化氢介质中生成1[9], 1在酸性介质(浓硫酸和冰醋酸的混合液、冰醋酸和醋酸酐的混合液、冰醋酸和对甲苯磺酸的混合液以及对甲苯磺酸和甲酸混合液)中均能生成中间产物4,5-二羟基黄体酮,5-位的羟基脱水进而生成2。文献[13]报道1和甲酸反应合成2的收率不到40%,本文使用浓硫酸和冰醋酸的混合液进行脱水反应,于室温条件下缓慢分批加入混合液,避免浓硫酸产生热量而产生副反应,收率可达62%,比传统方法提高了20%。
另有报道[14]称4-氯甾体化合物可以在固体氢氧化钾的作用下直接转化为相应的4-羟基甾体化合物。我们用前期合成的5尝试了这种由氯代产物转化为羟基取代的反应,发现5可以直接转化为2(Scheme 2),但收率很低(23%)。
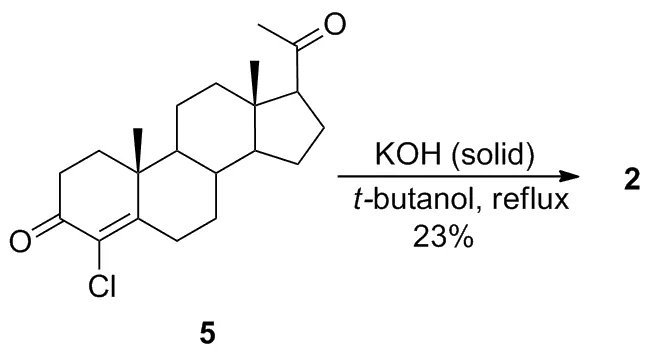
Scheme 2
羟基是一种活性较强的反应基团,很容易和酰氯反应生成酰氧类产物。我们用吡啶作为反应介质和缚酸剂,使2发生酰化反应生成4a~4i,收率为73%~88%。理论上来说,酰氧类衍生物4a~4i的极性应该小于它的底物2,但TLC薄层层析分析结果恰恰相反,产物点在底端,底物点在高端,原因可能是2中3-位的羰基和4-位的羟基形成了分子内氢键,从而降低了分子本身的极性。

表1 4a~4i在50 μg·mL-1时抑制MCF-7细胞增殖的活性*
*NA 表示抑制率低于10%。
2.2体外细胞毒活性
本课题组前期合成的多个系列的黄体酮类衍生物均具有细胞毒活性[9~11],因此本文采用常规的MTT比色实验, 测试了4a~4i对MCF-7的体外细胞毒抑制活性, 实验结果见表1。由表1可见,在浓度为50 μg·mL-1时,大多数4-酰氧基黄体酮类衍生物的抑制率均低于10%, 4c, 4d和4e对MCF-7细胞的抑制率分别为26%, 22%和13%,但抑制活性远逊于阳性对照5-fluorouracil(抑制率达95%)。
以黄体酮为原料,经4,5-环氧化后,在浓硫酸和冰醋酸混合液的条件下,得到了较高收率的关键中间体4-羟基黄体酮(2); 2通过酰化反应进一步得到了新型的4-酰氧基黄体酮衍生物,然而这些衍生物的体外细胞毒性并不强,其结构还有待于进一步优化。
[1]黄燕敏,郑嘉桦,赵丹丹,等. 新型甾体N,N-二甲基缩氨硫腙类化合物的合成及其抗肿瘤活性[J].合成化学,2015,23(12):1106-1110.
[2]张明霞,欧阳贵平. 胆酸衍生物的合成及其应用[J].合成化学,2009,17(12):140-145.
[3]Khuri N, Usubillaga A, Vaz S C,etal. Synthesis,stereochemical analysis,and neuromuscular blocking activity of oximino ether derivatives of progesterone[J].J Pharm Sci,1991,80(7):661-664.
[4]Abdelhamid A O, Mervat M A, Gamal A E. New routes to steroidal heterocyclic derivatives:Synthesis of biologically active pyrazolyl- and isoxazolylpregnene derivatives[J].J Heterocyclic Chem,2007,44(1):7-11.
[5]MacNevin C J, Atif F, Sayeed I,etal. Development and screening of water-soluble analogues of progesterone and allopregnanolone in Models of Brain Injury[J].J Med Chem,2009,52(19):6012-6023.
[6]Mohareb R M, Elmegeed G A, Baiuomy A R,etal. Evaluation of anti-inflammatory,anti-nociceptive,and anti-ulcerogenic activities of novel synthesized thiazolyl and pyrrolyl steroids[J].Arch Pharm Chem Life Sci,2011,344(10):595-604.
[7]Levy H, Mednick M L. 4-Hydroxyprogresterone and esters thereof:US 2 919 286[P].1959.
[8]Fried J. 4-Hydroxyprogresterone and intermediates:US 2 959 584[P],1960.
[9]Fan N J, Bai Y B, Zhang F Y,etal. Synthesis and cytotoxicity of some novel 21E-benzylidene steroidal derivatives[J].Steroids,2013,78(9):874-879.
[10]Fan N J, Tang J J, Li H,etal. Synthesis and cytotoxic activity of some novel steroidal C-17 pyrazolinyl derivatives[J].Eur J Med Chem,2013,69(11):182-190.
[11]Fan N J, He Q R, Duan M,etal. Synthesis and antiproliferative activity of D-ring substituted steroidal benzamidothiazoles[J].Steroids,2016,112:103-108.
[12]范宁娟,王长如,汤江江,等. 氯化亚锡还原法合成4′-氨基黄体酮类苯亚甲基衍生物[J].应用化学,2013,31(5):520-523.
[13]Haase H, M, Hatzis M, Mann J. New routes to 4-substituted steroids:Synthesis of 4-cyanoprogesterone, a potent inhibitor of the enzyme 5a-reductase[J].J Chem Soc Perkin Trans 1,1993,23:2907-2911.
[14]Ciobanu L C, Boivin R P, Luu T V,etal. Synthesis and steroid sulphatase inhibitory activity of C19- and C21-steroidal derivatives bearing a benzyl-inhibiting group[J].Eur J Med Chem,2001,36(8):659-671.
Synthesis and Cytotoxicity of 4-Acyloxy Modified Derivatives from Progesterone
FAN Ning-juan1a,TANG Jiang-jiang1b
(a. College of Life Science; b. College of Science, Northwest Agriculture and Forestry University, Yangling 712100, China)
The 4-hydroxyprogesterone(2) was prepared from 4,5-epoxy progesterone, using progesterone as raw material. A series of novel 4-acyloxy progesterones(4a~4i) were synthesized by acetylation reaction of 2 with different acyl chlorides(3a~3i). The structures were characterized by1H NMR,13C NMR and MS(ESI). Theinvitrocytotoxicity results showed that 4c, 4d and 4e exhibited weak activity against the MCF-7 cells at the concentrations of 50 mg·mL-1, with inhibition rate of 26%, 22% and 13%, respectively.
steroid; progesterone; acyloxy; cytotoxicity; synthesis
2016-06-27
国家自然科学基金资助项目(21402156)
范宁娟(1980-),女,汉族,陕西岐山人,博士,主要从事天然有机合成研究。
汤江江,副教授, Tel. 029-87092226, E-mail: tangjiang11@nwsuaf.edu.cn
O629; O621.3
ADOI: 10.15952/j.cnki.cjsc.1005-1511.2016.09.16162
