沉默肝星状细胞神经菌毛素-1抑制肝癌生长的实验研究
2016-10-25徐之超慎浩鑫李文智耿智敏
徐之超,陈 晨,慎浩鑫,马 丽,李文智,王 林,耿智敏
(西安交通大学第一附属医院:1.急诊科;2.肝胆外科,陕西西安 710061)
◇基础研究◇
沉默肝星状细胞神经菌毛素-1抑制肝癌生长的实验研究
徐之超1,陈晨2,慎浩鑫2,马丽2,李文智2,王林2,耿智敏2
(西安交通大学第一附属医院:1.急诊科;2.肝胆外科,陕西西安710061)
目的探讨沉默肝星状细胞神经菌毛素-1(neuropilin-1,NRP-1)表达后,是否会影响其对肝癌的促生长作用,并初步探讨可能存在的作用机制。方法细胞免疫荧光及细胞荧光双重染色观察NRP-1在肝星状细胞LX2中的表达及其与血小板源性生长因子受体β(platelet-derivedgrowthfactorreceptor-β,PDGFR-β)的共表达;MTT法检测沉默肝星状细胞NRP-1后对肝癌细胞体外增殖能力影响;建立裸鼠皮下肝癌移植瘤模型,绘制生长曲线,免疫组化法观察各组瘤体α-平滑肌肌动蛋白(α-smoothmuscleactin,α-SMA)、NRP-1、PDGFR-β表达强度的差异。结果LX2表面存在NRP-1表达,且NRP-1与PDGFR-β共表达于LX2;沉默LX2NRP-1后对HepG2促增殖作用降低(P<0.05);NRP-1KG移植瘤体积较NRP-1CG、NRP-1NG小(P<0.05),进一步对各组瘤体行免疫组化染色并进行表达强度积分分析,发现NRP-1KG瘤体间质NRP-1、PDGFR-β表达均较NRP-1CG弱(χ2=25.89,P<0.05;χ2=28.12,P<0.05)。结论沉默肝星状细胞NRP-1表达后,其对肝癌细胞促增殖作用降低,在体内环境中其对肝癌皮下移植瘤促生长作用也降低,其机制与肝星状细胞活化减弱有关,而肝星状细胞NRP-1表面共受体PDGFR-β表达减弱也可能参与这一过程。
神经菌毛素-1;肝星状细胞;肝癌;肿瘤微环境
肝癌微环境中除了肝癌细胞(hepatocellularcarcinomacells,HCCs),还包括多种间质细胞及细胞外基质成分,这些间质成分一定程度上决定肿瘤的发生发展。肝星状细胞(hepaticstellatecells,HSCs)作为肝癌微环境主要间质细胞之一,在血小板源性生长因子(platelet-derivedgrowthfactor,PDGF)等细胞因子作用下,转化为活化的HSC,自身增殖能力增强,进而促进肝癌发生发展[1-2]。同时,活化的HSC自分泌PDGF能力增强,反过来又可促进自身活化。神经菌毛素-1(neuropilin-1,NRP-1)是一种Ⅰ型跨膜糖蛋白,表达于多种细胞,可促进大多数肿瘤的发生发展。已有研究证实,沉默HCCNRP-1表达可抑制其增殖能力[3]。我们前期研究证实,NRP-1可通过促进HSCs活化来增强HCC增殖、迁移及侵袭能力[4]。那么沉默HSCsNRP-1表达,体内外环境下其对HCC促增殖作用是否会降低,目前还未见研究报道。本研究在观察HSCsNRP-1表达及NRP-1与PDGFR-β共表达的基础上,探讨沉默HSCsNRP-1表达对肝癌生长的影响,并进一步分析可能存在的作用机制。
1 材料与方法
1.1主要试剂DMEM、新生胎牛血清、胰酶购自美国Gibco公司;噻唑蓝(MTT)试剂、二甲基亚砜(DMSO)购自美国Sigma公司;抗Neuropilin-1兔抗人抗体、抗α-SMA兔抗人抗体、抗PDGFR-β兔抗人抗体、抗PDGFR-β猴抗人抗体、羊抗兔二抗、羊抗兔荧光二抗、羊抗猴荧光二抗购自美国Abcam公司。
1.2细胞系及裸鼠人肝癌细胞系HepG2由西安交通大学医学部中心实验室提供,人肝星状细胞系LX2购自中南大学湘雅中心实验室。上述两种细胞均以含100mL/L新生胎牛血清的DMEM培养,置于50mL/LCO2、37 ℃培养箱中培养。4周龄BALB/C裸鼠,SPF级别,雌雄各半,平均体质量(20±5)g,由西安交通大学医学部动物实验中心提供。动物实验在西安交通大学医学部动物实验中心完成。经西安交通大学医学部伦理委员会同意。
1.3方法
1.3.1细胞免疫荧光及激光共聚焦取5×103/mL密度肝星状细胞500μL接种于24孔板,培养24h后PBS清洗,多聚甲醛固定,再漂洗,封闭,加入一抗(兔抗人NRP-1,羊抗人PDGFR-β),孵育2h后加入二抗(避光条件下操作),漂洗,加入DAPI后再加入封片剂并迅速在荧光显微镜或激光共聚焦显微镜下观察。
1.3.2慢病毒转染及Westernblot检测NRP-1蛋白表达应用前期已构建的慢病毒pGCSIL-RFPshNRP1[5]。接种5×103个LX2细胞于96孔培养板中,24h后按照设定感染复数加入稀释的病毒液及5μg/mLpolybrene,其中转染慢病毒空载体LX2为NRP-1CG(NRP-1controlgroup),转染siRNA慢病毒的LX2为NRP-1KG(NRP-1knockdowngroup),未转染慢病毒载体的LX2为NRP-1NG(NRP-1normalgroup),72h后观察感染效果。转染并培养一定量后提取蛋白,应用Westernblot检测NRP-1蛋白表达,以β-actin作为内参,采用ECLTMWesternblot分析系统显影。
1.3.3MTT法检测细胞增殖将HepG2细胞以1×105/mL密度(无血清培养基稀释)取100μL分别接种于3张96孔板(包含调零孔和对照孔),分别加入不同组LX2无血清上清液(离心后收集),未加LX2上清液HepG2组为HCCG;于24、48、72h三个时间点各取一张96孔板加入新鲜配置的MTT溶液,继续培养4h并弃上清液后加DMSO摇床振荡,20min后在酶联免疫检测仪选择490nm波长下测定各孔的吸光度值。
1.3.4裸鼠肝癌皮下移植瘤的建立将24只裸鼠随机分组为NRP-1KG(NRP-1KG组肝星状细胞与肝癌细胞混悬液)、NRP-1CG(NRP-1CG组肝星状细胞与肝癌细胞混悬液)、NRP-1NG(NRP-1NG组肝星状细胞与肝癌细胞混悬液)及HCCG组(单纯注射肝癌细胞悬液)。分别于裸鼠腋窝皮下注射LX2(2×105)与HepG2(1×106)细胞混悬液或HepG2(1×106),建立皮下移植瘤模型。注射后第7日开始,每隔1周测量4组中每只裸鼠移植肿瘤长径及与短径,计算其体积(V=长径×短径×短径/2)及平均体积。4周后取材。
1.3.5免疫组化观察裸鼠瘤体NRP-1与PDGFR-β表达不同瘤体组织标本经固定、脱水、透明、包埋后制成厚度为5μm切片。再经脱蜡、水化、漂洗,依次孵育NRP-1单克隆抗体(1∶100)或者PDGFR-β(1∶50)、二抗,DAB显色,苏木素复染,以PBS代替一抗作为阴性对照,阳性对照为已知Neuropilin-1或PDGFR-β,最后于显微镜下观察。阳性表达呈现棕黄色。结果判定标准:每张切片选取5个高倍镜视野,对每个视野下阳性细胞百分比和着色强度进行计分。着色强度计分:细胞无着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分;阳性细胞百分比,0分为百分比为0,1分为0~25%,2分为26%~50%,3分为51%~75%,4分为>75%。上述计分结果相加,0分为阴性(-),1~3分为弱阳性(+),4~5分为中等阳性(),6~7分为强阳性()。
1.4统计学处理所有数据统计均采用SPSS13.0统计软件进行分析处理。对两组或多组计量资料采用独立样本的t检验,多组数据间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1NRP-1在LX2中的表达及其与PDGFR-β在LX2中共表达情况NRP-1表达于多种细胞表面,应用细胞免疫荧光检测可观察到LX2细胞表面NRP-1表达,主要表达于细胞膜。细胞荧光双重染色可观察到PDGFR-β在LX2也有表达,且两者共表达于LX2细胞膜(图1)。

图1NRP-1在LX2中的表达及其与PDGFR-β的共表达
Fig.1ExpressionofNRP-1andco-expressionwithPDGFR-βinhepaticstellatecells
A:红色荧光表示NRP-1表达(×200);B:绿色荧光表示PDGFR-β表达(×200);Merge:黄色荧光表示NRP-1与PDGFR-β共表达(×400)
2.2慢病毒转染LX2感染复数复核及NRP-1蛋白的表达当MOI=30时LX2感染细胞数基本达到80%以上,可以将30确定为慢病毒感染LX2的感染复数,进行后续实验。按照MOI为30感染LX2,对NRP-1KG、NRP-1CG、NRP-1NGLX2应用Westernblot检测NRP-1表达,结果显示NRP-1KG组NRP-1表达降低(图2,P<0.05),证实了我们构建的慢病毒载体NRP-1shRNA可以有效沉默LX2NRP-1表达。
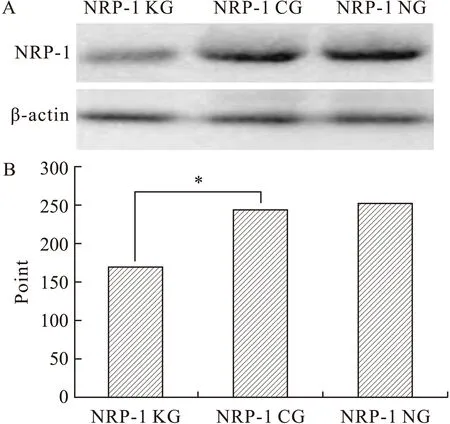
图2Westernblot检测NRP-1KG、NRP-1CG、NRP-1NGLX2细胞NRP-1的表达
Fig.2LX2NRP-1expressionofNRP-1KG,NRP-1CG,andNRP-1NGdetectedbyWesternblot
2.3ShRNA干扰LX2NRP-1表达后对HepG2增殖能力的影响为了检测沉默LX2NRP-1后对HepG2增殖能力影响,对NRP-1KG、NRP-1CG、NRP-1NG及HCCG各组应用MTT法分别检测不同时间点(24、48、72h)的吸光度(A值)变化。结果显示,NRP-1KG吸光值较NRP-1CG低,NRP-1NG吸光值较HCCG组高(图3,P<0.05)。说明LX2可以促进HepG2的增殖能力,而沉默LX2NRP-1表达后,其对HepG2的促增殖作用减弱。

图3HepG2不同组吸光值柱状图
Fig.3AvalueofNRP-1indifferentgroups*P<0.05。
2.4裸鼠皮下移植瘤的生长情况裸鼠肝癌皮下移植瘤模型建立后,从注射后第7天开始,每周测量4组中各只裸鼠移植肿瘤长径及与短径,28d后处死裸鼠,计算每周瘤体体积并绘制生长曲线(图4)。统计结果显示,NRP-1KG组瘤体体积较NRP-1CG和NRP-1NG组小(P<0.05),HCCG组瘤体体积小于NRP-1CG与NRP-1NG组(P<0.05),表明在体内环境下LX2可促进HepG2增殖,而沉默NRP-1LX2对HepG2促增殖作用降低。
2.5皮下移植瘤小动物的成像情况对NRP-1KG、NRP-1CG两组裸鼠处死前进行小动物成像,两组随机选取面积及背景相同区域,得到荧光强度值总和。结果显示,两组肿瘤组织内荧光强度不同(图5),相同区域内NRP-1KG荧光值低于NRP-1CG荧光强度(P<0.05),说明NRP-1KG瘤体中LX2数目低于NRP-1CG。

图4裸鼠皮下移植瘤的生长情况
Fig.4Growthofsubcutaneouslytransplantedtumorinnudemice
A:不同组裸鼠皮下成瘤;B:不同组移植瘤瘤体;C:不同组裸鼠瘤体生长曲线。黑箭头为移植瘤瘤体,*P<0.05。

图5裸鼠成像图及两组荧光强度的比较
Fig.5Nudemiceimagingandcomparisonoffluorescenceintensityinthetwogroups
A、B:NRP-1KG;C、D:NRP-1CG。*P<0.05。
2.6移植瘤体免疫组化检测结果NRP-1KG、NRP-1CG、NRP-1NG各组HE染色可见肿瘤间质较多,并分隔、包绕肿瘤组织形成多个肿瘤结节,结节中心有时可以看到坏死的肿瘤组织,周边为未坏死的肿瘤组织,NRP-1KG较多见。各组瘤体α-SMA染色后可见不同组别之间α-SMA表达情况不同(图6)。为进一步比较不同组间质中NRP-1与PDGFR-β表达情况,各组染色后分别进行人工计数排除肝癌细胞和血管内皮细胞表达。统计结果显示,NRP-1KG组间质细胞NRP-1与PDGFR-β表达低于NRP-1CG组(P<0.05,图7、图8、表1、表2)。

图6各组α-SMA的免疫组化染色
Fig.6α-SMAexpressionindifferentgroupsbyimmunohistochemistry(DAB, ×200)
A:NRP-1KG组;B:NRP-1CG组;C:NRP-1NG组;D:HCCG。
3 讨 论
NRP-1作为多种细胞因子共受体,可促进细胞因子与其受体结合,放大下游信号传导,参与血管形成、肿瘤生长、免疫调节等过程[6-8]。既往多项研究已证实,HSCs在体内外环境下可促进肝癌生长,并可将HSCs作为肝癌靶向治疗靶标及评估肝癌患者预后指标之一[9]。目前关于HSCs促HCC增殖相关机制的研究较多,如HSCs促进FAK-MMP9信号传导[10],分泌TGF、PDGF、VEGF、MMP-2、MMP-9[11-12],促进骨桥蛋白形成[13],参与肝癌细胞耐药性产生[14]等多种不同机制。除上述机制,HSCs还可以通过促进肝癌细胞发生免疫逃逸和肝癌细胞上皮细胞间质化(epithelial-mesenchymaltransition,EMT)间接促进肝癌发展[15-17]。我们体内及体外实验证实,HSCs促进HCC增殖及肝癌生长同时,也发现沉默HSCsNRP-1表达,其对HCC促增殖作用降低,这提示我们HSCsNRP-1基因可以考虑作为肝癌靶向治疗的靶点之一。而关于沉默HSCsNRP-1表达后,通过何种机制影响肝癌生长,目前还未见相关报道。我们推测,这一作用机制可能是通过影响HSCs活化状态、细胞外基质分泌及细胞表面部分受体表达改变,进一步影响肝癌细胞内相关促增殖信号传导。由于HSCs活化的重要标志是α-SMA表达,α-SMA表达强度越弱,HSCs活化程度越弱,对肝癌间接促生长作用也降低。随后,我们对各组瘤体进行α-SMA免疫组化染色可观察到各组均有表达,但表达范围及强度不同,尤其是NRP-1KG与NRP-1CG两组。HCCG瘤体内仅有少量表达或不表达α-SMA。这说明沉默LX2NRP-1表达后对肝癌促生长作用降低的机制之一是LX2活化状态发生改变,当然这也需要后期Westernblot进一步验证。

图7各组NRP-1的免疫组化染色
Fig.7NRP-1expressionindifferentgroupsbyimmunohistochemistry(DAB, ×200)
A:NRP-1KG组;B:NRP-1CG组;C:NRP-1NG组;D:HCCG组。

图8各组PDGFR-β的免疫组化染色
Fig.8PDGFR-βexpressionindifferentgroupsbyimmunohistochemistry(DAB, ×200)
A:NRP-1KG组;B:NRP-1CG组;C:NRP-1NG组;D:HCCG组。
表1两组间质细胞NRP-1表达的人工计数结果分析
Tab.1ArtificialcountinganalysisofNRP-1expressioninmesenchymalcellsinthetwogroups
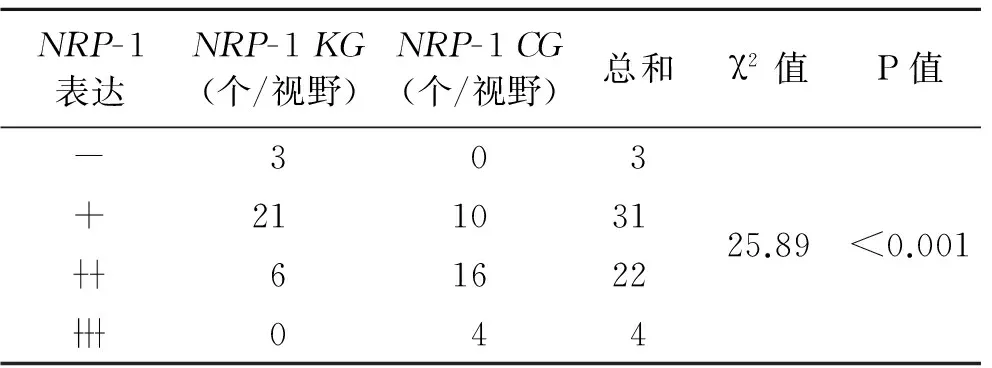
NRP-1表达NRP-1KG(个/视野)NRP-1CG(个/视野)总和χ2值P值-303+2110316162204425.89<0.001
表2两组间质细胞中PDGFR-β表达的人工计数结果分析
Tab.2ArtificialcountinganalysisofPDGFR-βexpressioninmesenchymalcellsinthetwogroups

PDGFR-β表达NRP-1KG(个/视野)NRP-1CG(个/视野)总和χ2值P值-527+204245182306628.12<0.001
研究中我们对NRP-1KG与NRP-1CG两组裸鼠处死前进行小动物成像,取相同大小及背景统计后发现两组荧光强度不同,提示在体内环境下沉默HSCsNRP-1表达后,HSCs自身增殖能力减弱。由于HCC与HSCs之间对话是相互的,HSCs可以促进HCC增殖,反过来HCC也可以促进HSCs的活化增殖[18]。因此,NRP-1KGHSCs数目相对较少也需要考虑由于肝癌实质细胞对沉默NRP-1表达后的HSCs促增殖能力减弱有关,但后者作用相对较弱。
体外研究可观察到LX2细胞表面NRP-1与PDGFR-β共定位表达,体内研究中两者在NRP-1KG、NRP-1CG及NRP-1NG瘤体肝癌实质高表达,而在间质中NRP-1KG表达比例较低,NRP-1CG及NRP-1NG间质中表达比例较高。在HCCG除了肝癌实质较高表达外,间质几乎没有表达或少量表达NRP-1与PDGFR-β。NRP-1KG可见少量NRP-1表达,主要是由于对LX2转染效率并非100%及部分LX2转染后NRP-1未被完全有效沉默。同样,PDGFR-β在肝癌细胞均呈现高表达,在各组间质细胞中NRP-1KG间质中表达比例较低,NRP-1CG及NRP-1NG间质中PDGFR-β表达比例较高,这与CAO等[19]证实HSCs中NRP-1的高表达与PDGFR-β高表达具有相关性的结论一致。而PDGFR-β高表达是否会影响肝癌细胞增殖,目前也同样未见相关报道,但PDGFR-β高表达是会影响HSCs自身活化过程,这也会间接影响肝癌细胞增殖。
理想的分子靶向治疗是仅作用于肿瘤细胞本身,而由于在大多数肿瘤微环境中其他细胞也会表达肿瘤相关蛋白,那么了解目的基因蛋白在肿瘤微环境中所发挥的作用显得尤为重要。本研究证实了沉默HSCsNRP-1表达会抑制肝癌细胞增殖,那么以NRP-1为靶点的分子治疗不仅会抑制肝癌本身,也会抑制肝癌微环境中相关促癌成分,这为后期进一步探究肝癌靶向治疗靶点提供了方向和思路。
[1]SHINHW,PARKSY,LEEKB,etal.TranscriptionalprofilingandWntsignalingactivationinproliferationofhumanhepaticstellatecellsinducedbyPDGF-BB[J].KoreanJHepatol, 2009, 15(4):486-495.
[2]GENGZM,LIQH,LIWZ,etal.Activatedhumanhepaticstellatecellspromotegrowthofhumanhepatocellularcarcinomainasubcutaneousxenograftnudemousemodel[J].CellBiochemBiophys,2014, 70(1):337-347.
[3]XUJ,XIAJ.NRP-1silencingsuppresseshepatocellularcarcinomacellgrowthin vitroandin vivo[J].ExpTherMed, 2013, 5:150-154.
[4] 陈晨,李波,耿智敏,等. 神经菌毛素-1促进肝星状细胞活化对人肝癌细胞HepG2细胞增殖,迁移及侵袭影响[J]. 中华实验外科杂志, 2014, 31(10):2105-2107.
[5]ZHENGJB,GENGZM,WANGL,etal.ConstructionofrecombinantlentiviralvectorcontainingshRNAforhumanneuropilin-1gene[J].ChinJCellMolImmunol, 2012, 28(11):1200-1203.
[6] 徐之超,王林,耿智敏,等. 神经菌毛素-1促进VEGF介导的血管生成作用及其机制研究进展[J]. 肿瘤防治研究, 2014, 4(41):409-412.
[7]ZHUH,CAIH,TANGM,etal.Neuropilin-1isoverexpressedinosteosarcomaandcontributestotumorprogressionandpoorprognosis[J].ClinTranslOncol, 2014, 16(8):732-738.
[8]KUMANOGOHA,KIKUTANIH.Immunologicalfunctionsofneuropilinsandplexinsasreceptorsforsemaphorins[J].NatRevImmunol, 2013, 13(11):802-814.
[9]SUNB,ZHANGX,CHENGX,etal.Intratumoralhepaticstellatecellsasapoorprognosticmarkerandanewtreatmenttargetforhepatocellularcarcinoma[J].PLoSOne, 2013, 8(11):e80212.
[10]HANS,HANL,YAOY,etal.ActivatedhepaticstellatecellspromotehepatocellularcarcinomacellmigrationandinvasionviatheactivationofFAK-MMP9signaling[J].OncolRep, 2014, 31(2):641-648.
[11]CARLONIV,LUONGTV,ROMBOUTSK,etal.Hepaticstellatecellsandextracellularmatrixinhepatocellularcarcinoma:morecomplicatedthanever[J].LiverInt, 2014, 34(6):834-843.
[12]WANGBB,CHENGJY,GAOHH,etal.Hepaticstellatecellsininflammation-fibrosis-carcinomaaxis[J].AnatRec, 2010, 293(9):1492-1496.
[13]SONGJ,GEZ,YANGX,etal.Hepaticstellatecellsactivatedbyacidictumormicroenvironmentpromotethemetastasisofhepatocellularcarcinomaviaosteopontin[J].CancerLett, 2015, 356(2):713-720.
[14]YUG,JINGY,KOUX,etal.Hepaticstellatecellssecretedhepatocytegrowthfactorcontributestothechemoresistanceofhepatocellularcarcinoma[J].PLoSOne, 2013, 8(9):e73312.
[15]YANGMC,WANGCJ,LIAOPC,etal.HepaticstellatecellssecretestypeIcollagentotriggerepithelialmesenchymaltransitionofhepatomacells[J].AmJCancerRes, 2014, 4(6):751-763.
[16]ZHAOW,SUW,KUANGP,etal.TheroleofhepaticstellatecellsintheregulationofT-cellfunctionandthepromotionofhepatocellularcarcinoma[J].IntJOncol, 2012, 41(2):457-464.
[17]ZHAOW,ZHANGL,YINZ,etal.Activatedhepaticstellatecellspromotehepatocellularcarcinomadevelopmentinimmunocompetentmice[J].IntJCancer, 2011, 129(11):2651-2661.
[18] 唐有为,姚希贤. 肝癌细胞对肝星状细胞活化的调控作用[J]. 世界华人消化杂志, 2001, 9(2):202-204.
[19]CAOS,YAQOOBU,DASA,etal.Neuropilin-1promotescirrhosisoftherodentandhumanliverbyenhancingPDGF/TGF-betasignalinginhepaticstellatecells[J].JClinInvest, 2010, 120(7):2379-2394.
(编辑卓选鹏)
Silencingneuropilin-1expressionofhepaticstellatecellsinhibitsthegrowthofhepatocellularcarcinoma
XUZhi-chao1,CHENChen2,SHENHao-xin2,MALi2,LIWen-zhi2,WANGLin2,GENGZhi-min2
(1.EmergencyDepartment; 2.DepartmentofHepatobiliarySurgery,theFirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China)
ObjectiveToinvestigatewhethertheexpressionofhepaticstellatecellsneuropilin-1silenced(NRP-1)affectsthegrowthofhepatocellularcarcinomacells(HCCs)andtoexplorethepossiblemechanism.MethodsExpressionofNRP-1andco-expressionwithplatelet-derivedgrowthfactorreceptor-β(PDGFR-β)inhepaticstellatecellswereobservedbyimmunofluorescenceandfluorescentdoublestaining.TheeffectofsilencingNRP-1ofHSCsontheproliferationofHCCcellswasdetectedbyMTTin vitro.Axenografthepatocellularcarcinomamodelofnudemousewasestablishedsubcutaneously.Thegrowthcurvewasdrawnandtheexpressionsofα-SMA,NRP-1andPDGFR-βintumorswereobservedbyimmunohistochemistrystainingafterthemicewerekilled.ResultsNRP-1wasexpressedinthemembraneofLX2andwasco-expressedwithPDGFR-β.SilencingNRP-1ofLX2reducedtheproliferationofHepG2 in vitro (P<0.05).ThetumorvolumeinNRP-1KGgroupreducedobviouslycomparedwiththatinNRP-1CGgroup(P<0.05).TheexpressionsofNRP-1andPDGFR-βinNRP-1KGgroupwereweakerthanthoseinNRP-1CGgroupbyimmunohistochemistry(χ2=25.89, P<0.05; χ2=28.12, P<0.05).ConclusionSilencingNRP-1expressionofHSCscandecreaseitseffectontheproliferationofHCCsin vitroandthegrowth-promotingeffectofHSCsonHCCsisalsodecreasedin vivo,whichisduetotheinhibitionofHSCsactivation,andthedecreasedexpressionofco-receptorPDGFR-βmayplayaroleinthisprocess.
neuropilin-1;hepaticstellatecell;hepatocellularcarcinoma;tumormicroenvironment
2015-06-05
2016-04-29
国家自然科学基金资助项目(No.30971340)
耿智敏.E-mail:gengzhimin@mail.xjtu.edu.cn
R735.7
A
10.7652/jdyxb201605007
SupportedbytheNationalNaturalScienceFoundationofChina(No.30971340)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160802.1150.010.html(2016-08-02)
