新疆多民族食管癌患者癌组织中p53蛋白表达及其临床意义
2016-10-22阿卜拉江阿卜杜热合曼伊地力斯阿吾提侯志超阿不都艾尼吐尔洪张力为居来提艾尼瓦尔买地尼也提尼亚孜
阿卜拉江·阿卜杜热合曼,伊地力斯·阿吾提,侯志超,阿不都艾尼·吐尔洪,张力为,居来提·艾尼瓦尔,刘 辉,才 仁, 买地尼也提·尼亚孜
(新疆医科大学第一附属医院1临床医学研究院, 2胸外科, 乌鲁木齐 830054)
·民族肿瘤学·
新疆多民族食管癌患者癌组织中p53蛋白表达及其临床意义
阿卜拉江·阿卜杜热合曼1,2,伊地力斯·阿吾提2,侯志超2,阿不都艾尼·吐尔洪2,张力为2,居来提·艾尼瓦尔2,刘辉1,才仁1, 买地尼也提·尼亚孜1
(新疆医科大学第一附属医院1临床医学研究院,2胸外科, 乌鲁木齐830054)
目的探讨新疆多民族食管癌患者癌组织及癌旁组织中 p53 蛋白表达情况及其临床意义。方法采用免疫组织化学EnVision法检测214例维吾尔族、汉族、哈萨克族食管癌患者癌组织以及100例癌旁正常组织中p53蛋白表达情况,并结合不同民族、肿瘤分化程度等临床病理特点进行分析。结果44.3%的食管癌病例检测到p53蛋白的阳性表达,p53蛋白在癌组织的阳性表达率高于癌旁正常组织,差异有统计学意义(P<0.05)。维吾尔族、汉族、哈萨克族食管癌组织中p53蛋白阳性表达率分别为45.6%、38.4%、49.3%,各民族间差异无统计学意义(P>0.05),p53在不同性别、分化程度和淋巴结转移之间的阳性表达差异有统计学意义(P<0.05)。患者的预后与淋巴结转移、脉管侵犯、浸润程度状况有关(P<0.05)。结论p53基因在新疆不同民族食管癌的发生、发展及淋巴结转移中可能有重要作用,可作为预测转移潜能的参考指标。
食管癌; 多民族; p53蛋白; 免疫组织化学
食管癌是最具有侵袭性的恶性肿瘤之一,死亡率居全球癌症死因的第六位[1-2]。中国是世界食管癌高发区,其中90%以上为食管鳞癌[3-4]。新疆是我国多民族居住区,也是食管癌集中高发区之一,主要以哈萨克族食管癌发病率最高,最高达155.9/10万,远远高于全国的平均水平(14.95/10万),其次为维吾尔族和汉族[5]。p53是重要的肿瘤抑制基因,在包括食管癌在内的许多肿瘤中发现了p53基因的突变,正常情况下,p53可通过诱导G1期细胞周期阻滞或被DNA损伤信号激活后诱导细胞凋亡来抑制细胞恶变[2]。本研究采用免疫组织化学法检测哈萨克族、维吾尔族和汉族食管癌患者癌组织及癌旁组织中p53蛋白表达情况,探讨其在不同民族食管癌发生发、展中的作用及其临床意义。
1 资料与方法
1.1临床资料收集新疆医科大学第一附属医院胸外科2009-2014年收治并行食管癌根治术的214例食管鳞癌患者的食管癌组织及100例癌旁正常组织(距癌组织>5 cm的组织)。其中维吾尔族68例,汉族73例,哈萨克族73例,男性152例,女性62例,年龄37~83岁,中位年龄60.8岁。按第七版TNM分期标准进行pTNM分期,据WHO 2010年肿瘤组织学分类标准进行组织学分类及分化程度分级[6]:肿瘤分化程度:高分化64例,中分化96例,低分化54例。肿瘤T分期:T1 12例,T2 76例,T3 111例,T4 15。N分期:N0 123例,N1 91例。所有患者术前均未接受过放疗、化疗或其他特殊治疗。所有患者均在签署知情同意书后留取手术标本。本研究通过了本院医学伦理委员会的批准。
1.2方法标本经4%中性甲醛固定,石蜡包埋,4 μm厚度连续切片,进行HE染色及免疫组织化学染色(EnVision法)。小鼠抗人p53单克隆抗体及免疫组化试剂盒均购自北京中杉金桥生物技术有限公司,严格按说明书进行,一抗浓度选用1∶50,用0.01 mol/L PBS 替代一抗作为阴性对照,用已知乳腺癌阳性组织切片为阳性对照。由2位病理科医师采取双盲法观察切片并诊断,结果一致则记录结果,如有争议,以2个相同意见为准。p53蛋白阳性标准:原发灶≥10% 的癌细胞有明显的核棕黄色或棕褐色染色,包括一些黏膜的基底细胞层中≥10% 的细胞有相应的 p53 特征染色。只限于基底细胞的很弱的染色被认为阴性[7]。
1.3统计学处理采用SPSS 21.0统计软件包对数据进行统计学分析,组间采用非参数2个或多个独立样本检验,2个指标间采用卡方检验。分别采用Kaplan-Meier 法、COX回归模型进行单因素和多因素生存分析,以P<0.05为差异有统计学意义。
2 结果
2.1不同民族食管癌患者癌组织中p53蛋白的表达情况p53蛋白的阳性细胞染色定位于肿瘤细胞核,在所有214例食管鳞癌组织标本中p53蛋白阳性表达率为44.3%(95/214),癌旁正常食管组织中p53阳性蛋白表达率为5.6%(12/214),癌组织与癌旁正常组织p53蛋白阳性表达率差异有统计学意义(P<0.05)(图1)。
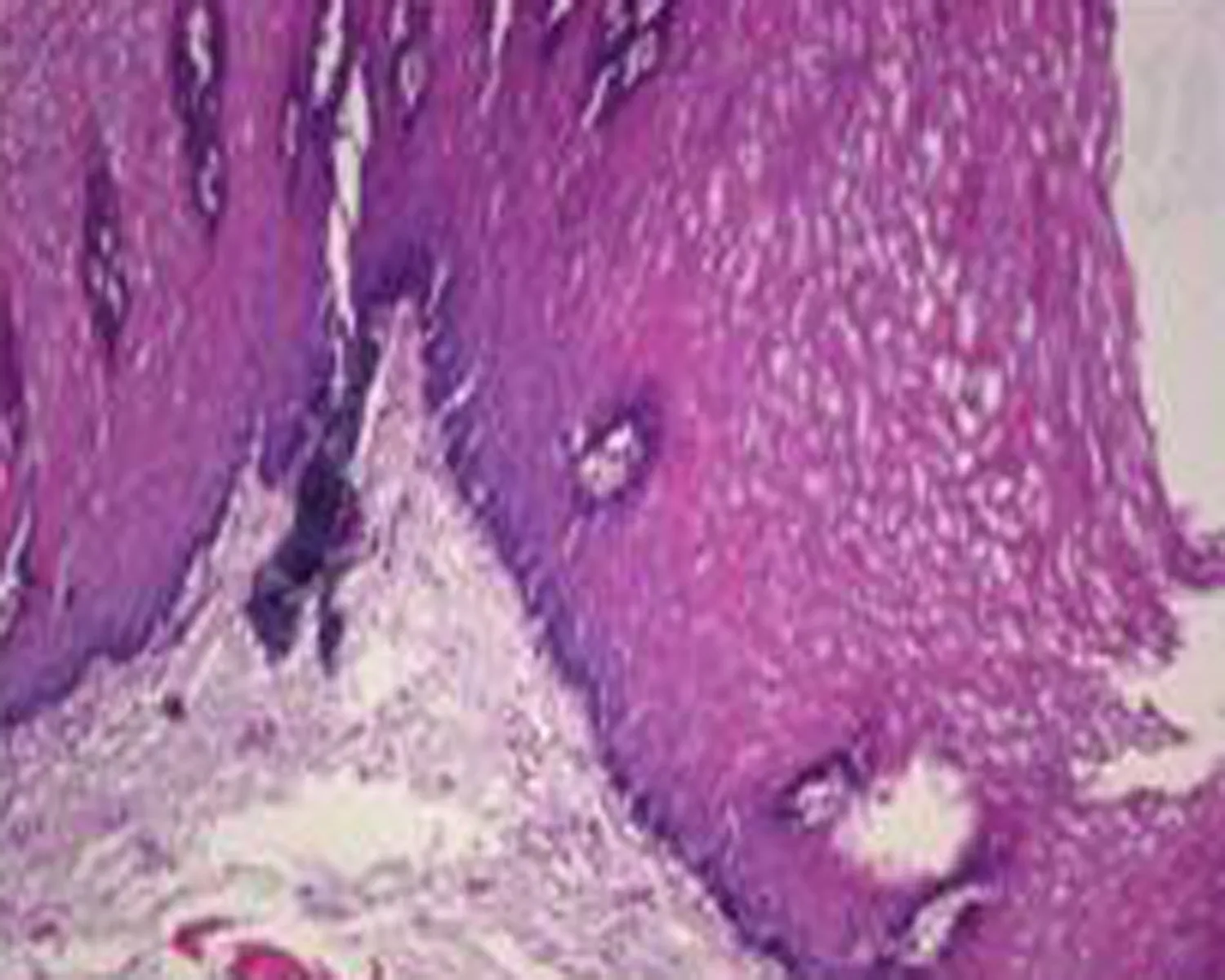
a: A.正常食管黏膜组织HE染色(×100倍)
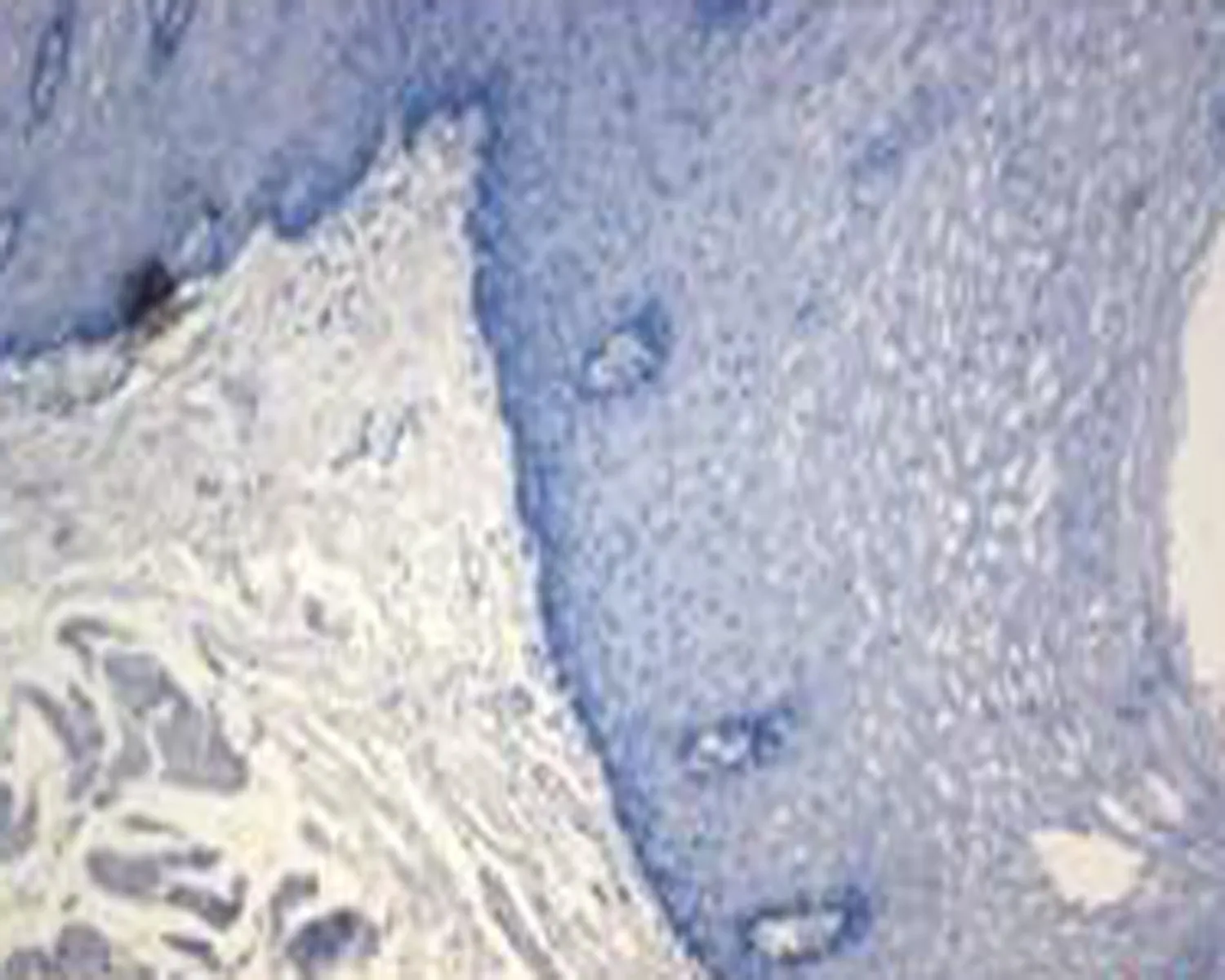
b: 正常食管黏膜组织p53 免疫组织化学染色阴性表达(×100倍)
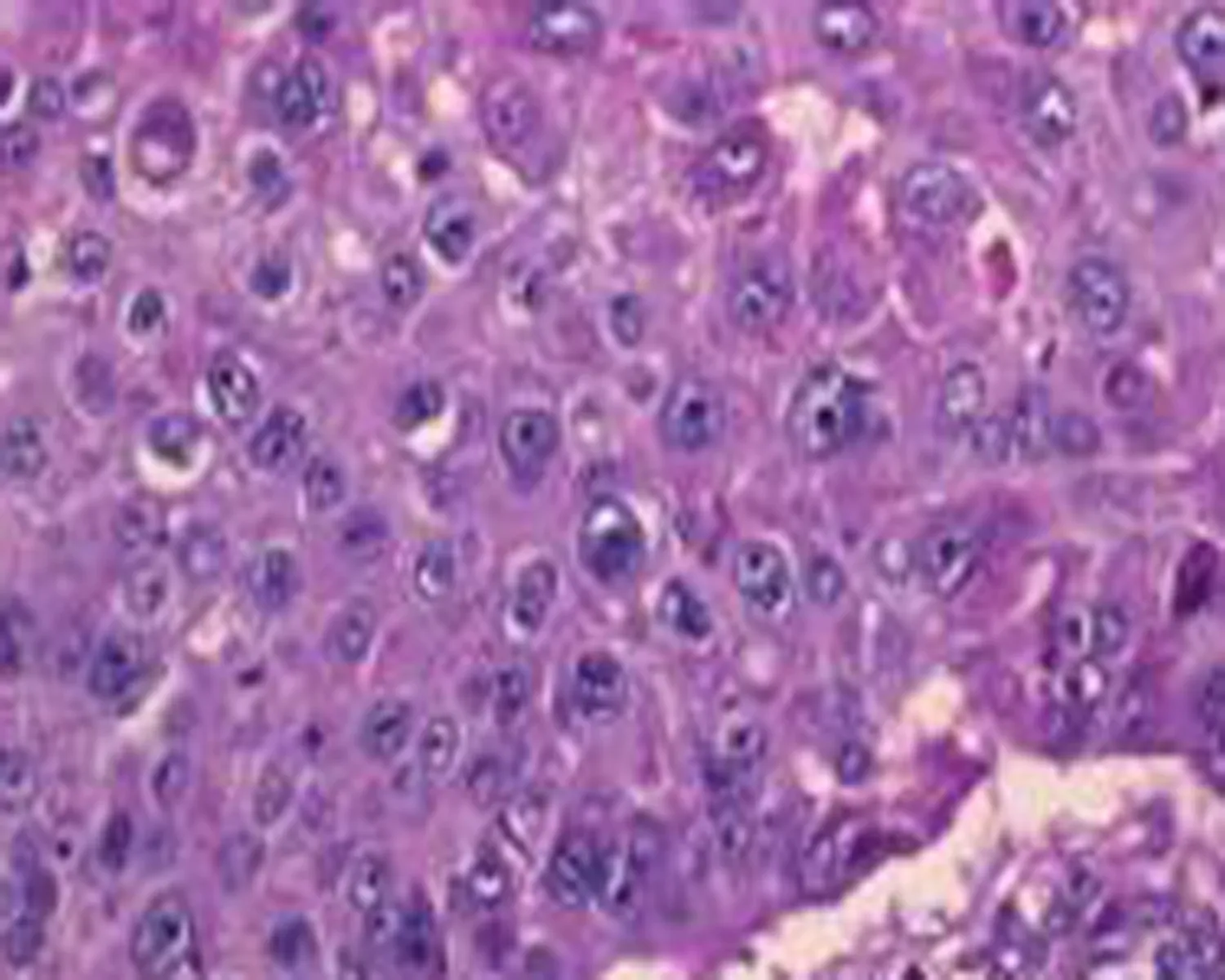
c: 高分化鳞状细胞癌HE染色(×400倍)
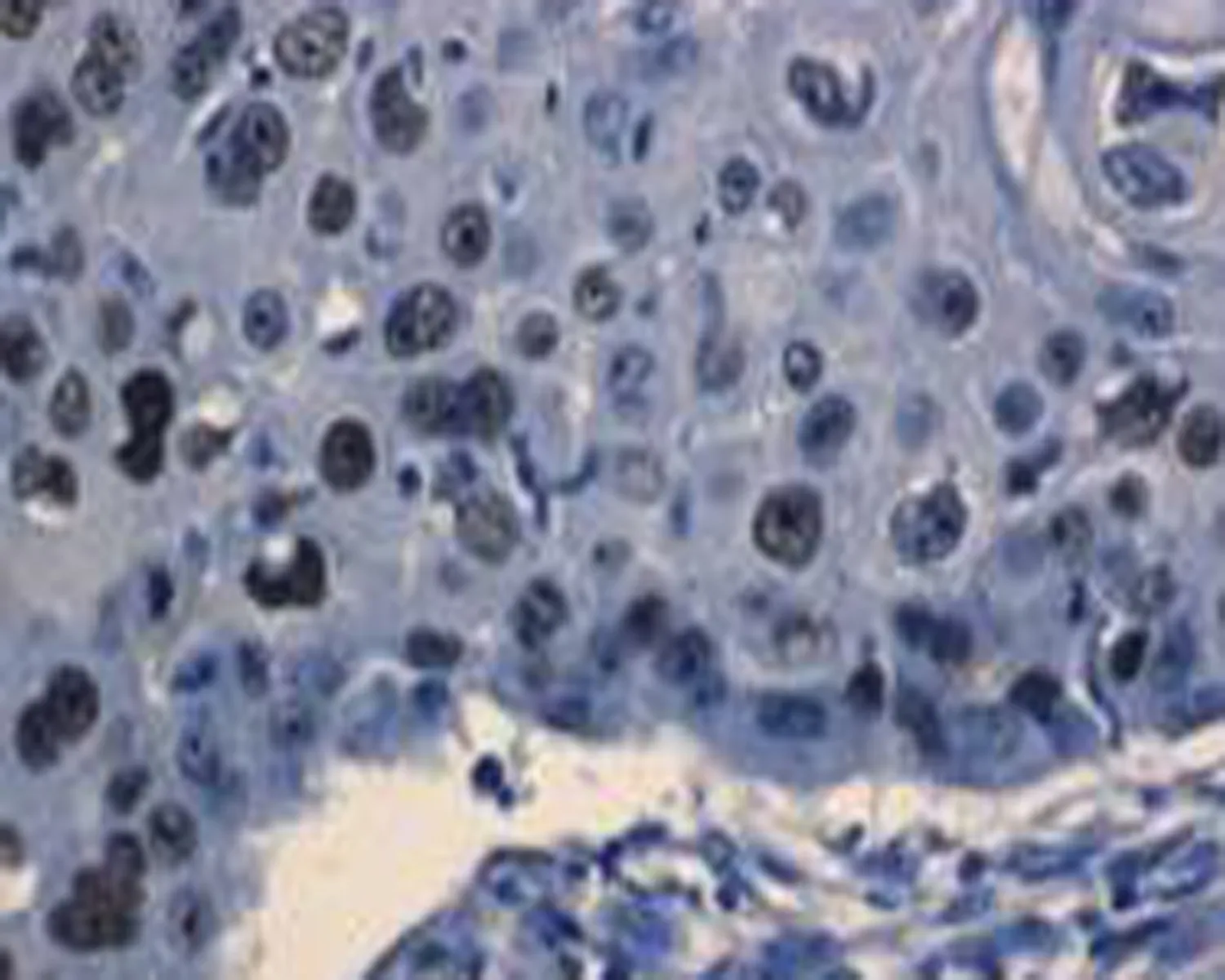
d: 高分化鳞状细胞癌p53免疫组织化学染色阳性表达,p53阳性细胞染色定位于肿瘤细胞核(×400)
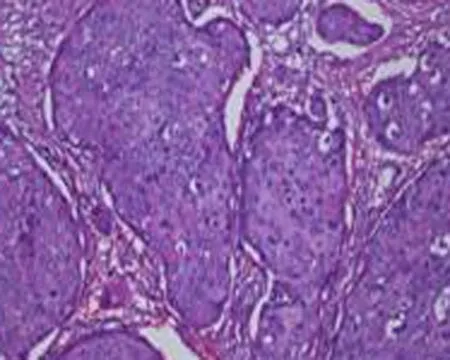
e: 中分化鳞状细胞癌HE染色(×200倍)

f: 中分化鳞状细胞癌p53免疫组织化学染色阳性表达(×200倍)
图1食管正常组织和癌组织HE染色及p53免疫组化染色结果
维吾尔族、汉族、哈萨克族癌组织中p53蛋白阳性表达率分别为45.6%、38.4%、49.3%,3个民族间p53蛋白阳性表达率差异无统计学意义(P>0.05)(表1)。
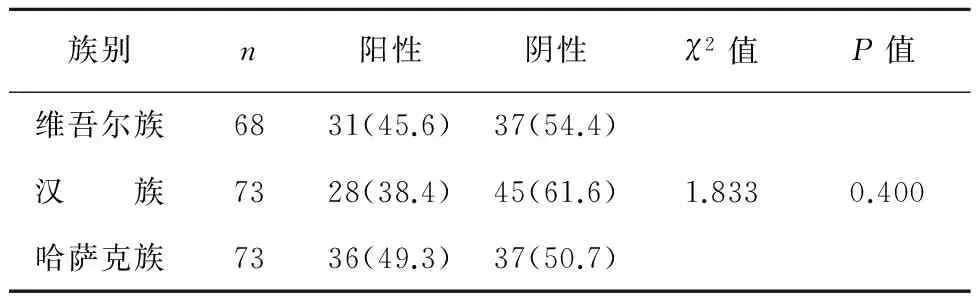
表1 不同民族食管癌患者p53表达情况/例(%)
2.2p53蛋白表达与临床病理特征之间的关系女性患者p53蛋白阳性率(54.8%)明显高于男性(40.1%),且女性食管癌患者出现p53蛋白阳性的概率是男性的1.811倍(OR=1.811,95%CI:0.998~3.288);不同分化程度患者的p53蛋白表达阳性率差异有统计学意义(χ2=4.956,P<0.05),其中低分化食管癌患者的p53蛋白阳性率(57.4%)明显高于高、中分化者(40.1%),且低分化食管癌患者出现p53蛋白阳性的概率是高、中分化者的2.022倍(OR=2.022,95%CI:1.082~3.778);不同淋巴结转移状况患者的p53蛋白表达阳性率差异有统计学意义(χ2=5.461,P<0.05),其中有淋巴结转移患者的p53蛋白阳性率(51.2%)明显高于无淋巴结转移者(35.2%),且有转移的食管癌患者出现p53蛋白阳性的概率是无转移者的1.934倍(OR=1.934,95%CI:1.109~3.378)(表2)。
2.3患者术后生存状况214例各民族食管鳞癌患者术后6、12、18、24、30、36个月生存率分别为67%、55%、55%、34%、32%和32%,平均生存期为(15.87±12.26)个月,中位生存期为18.00个月。患者整体的生存曲线显示患者术后36个月内,曲线较为陡峭,生存率下降趋势较为明显。
表2新疆食管癌 p53表达与临床病理因素的关系/例(%)
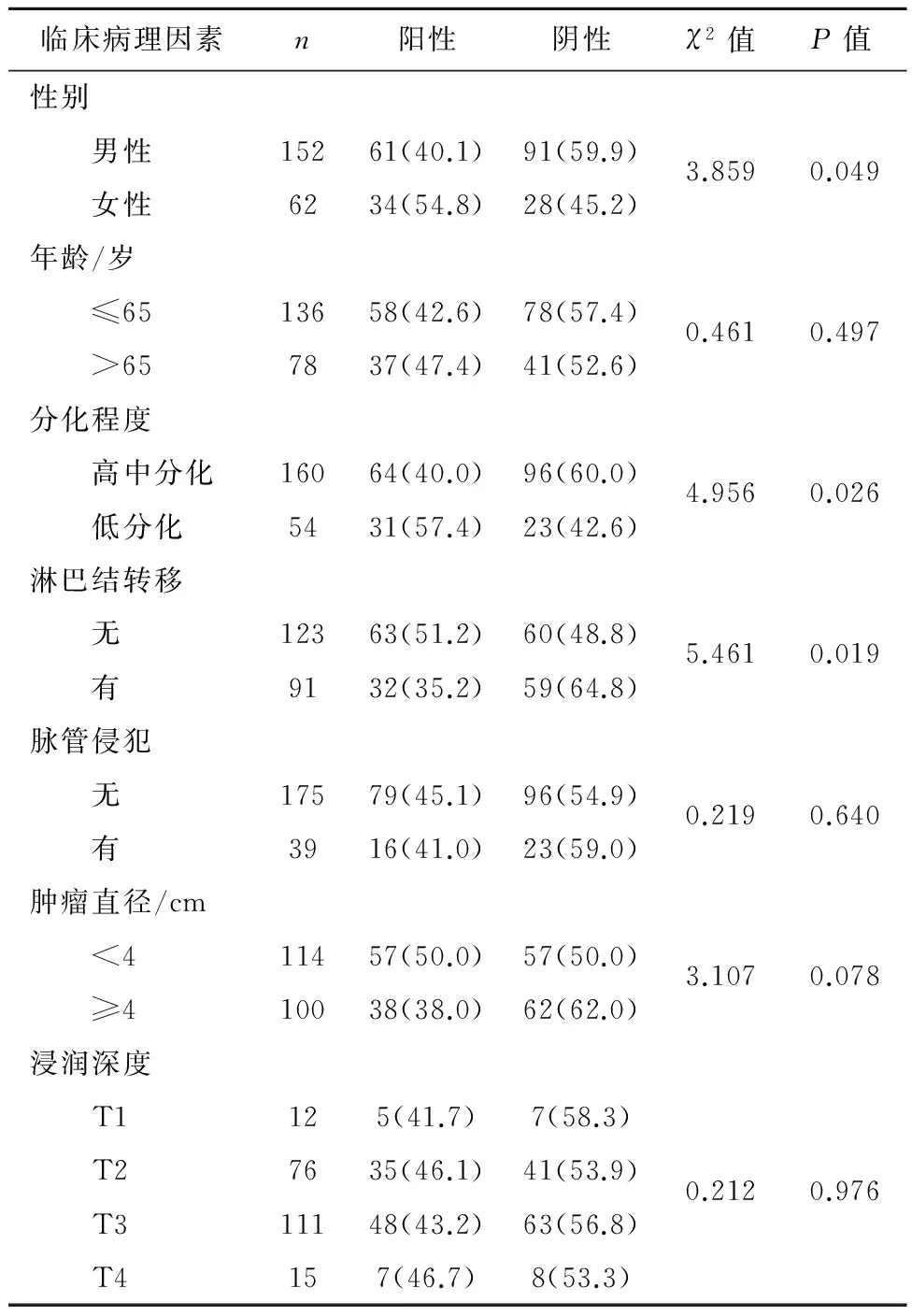
临床病理因素n阳性阴性χ2值P值性别 男性15261(40.1)91(59.9)3.8590.049 女性6234(54.8)28(45.2)年龄/岁 ≤6513658(42.6)78(57.4)0.4610.497 >657837(47.4)41(52.6)分化程度 高中分化16064(40.0)96(60.0)4.9560.026 低分化5431(57.4)23(42.6)淋巴结转移 无12363(51.2)60(48.8)5.4610.019 有9132(35.2)59(64.8)脉管侵犯 无17579(45.1)96(54.9)0.2190.640 有3916(41.0)23(59.0)肿瘤直径/cm <411457(50.0)57(50.0)3.1070.078 ≥410038(38.0)62(62.0)浸润深度 T1125(41.7)7(58.3) T27635(46.1)41(53.9)0.2120.976 T311148(43.2)63(56.8) T4157(46.7)8(53.3)
2.4食管鳞癌患者临床及病理指标与预后的关系不同淋巴结转移状况患者的预后差异有统计学意义(χ2=24.001,P<0.05),其中无淋巴结转移的平均生存期(23.645个月,95%CI:21.177~26.113)明显长于有淋巴结转移患者(12.241个月, 95%CI:12.170~17.096),且中位生存期也是相似的结果;不同脉管侵犯患者的预后差异有统计学意义(χ2=15.382,P<0.05),其中无脉管侵犯患者的平均生存期(21.020个月,95%CI:19.535~23.717)明显长于有脉管侵犯患者(12.241个月,95%CI:9.059~15.423),且中位生存期差异更显著;不同浸润深度患者的预后差异有统计学意义(χ2=10.407,P<0.05),其中T4患者的平均生存期(8.896个月,95%CI:5.938~11.854)明显低于T1-T3患者(19.250~21.677个月),且中位生存期差异同样显著。本研究中单因素分析也显示,不同性别、不同年龄段、不同民族、分化程度、肿瘤大小、不同p53蛋白表达与食管鳞癌预后差异无统计学意义(P>0.05)(表3)。
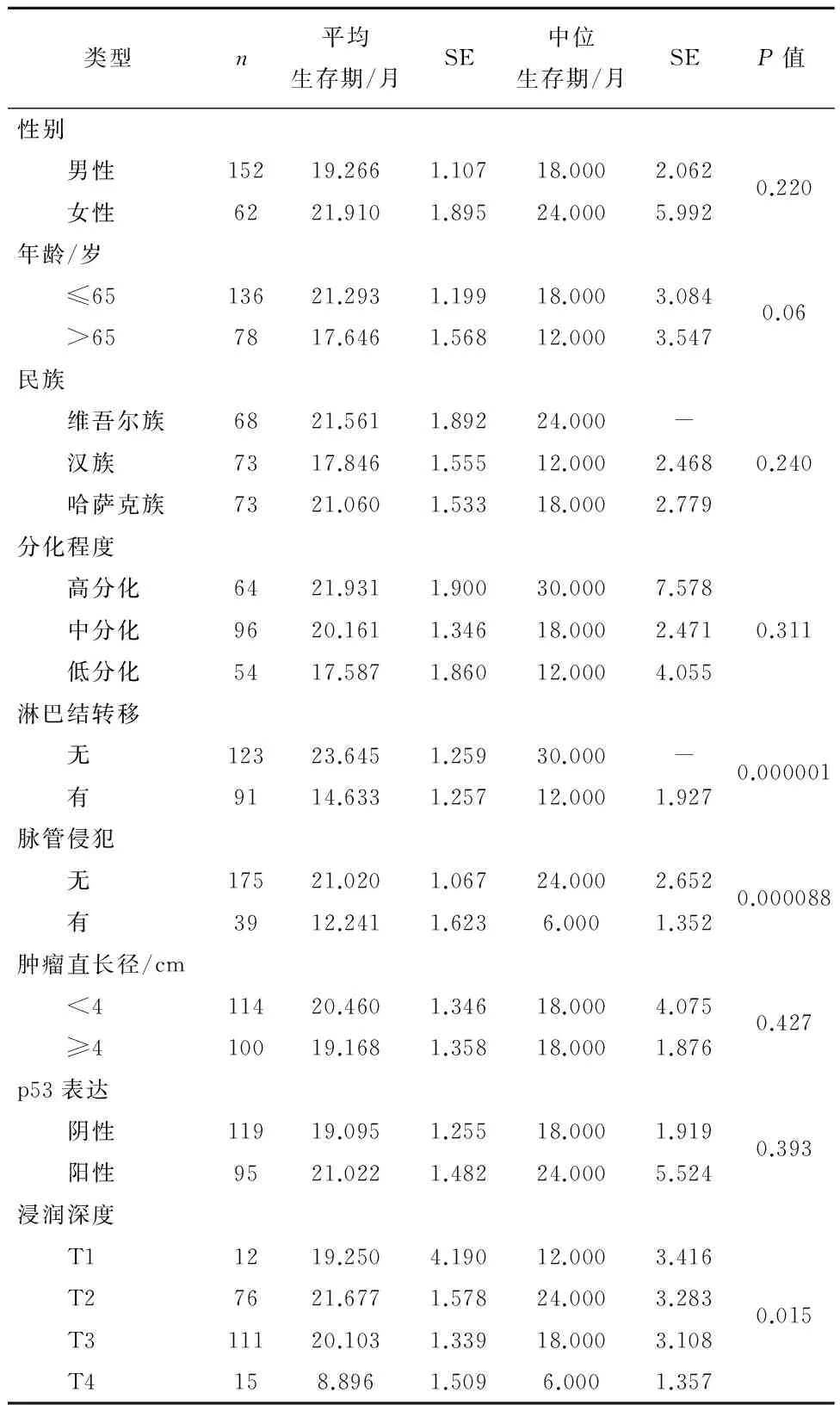
表3 新疆多民族食管癌患者临床病理特征与预后的关系
将单因素分析有统计学差异的3个指标(不同淋巴结转移、脉管侵犯、浸润程度)纳入COX回归分析模型,结果显示:淋巴结转移和肿瘤侵犯脉管是新疆多民族食管癌预后的独立危险因素(χ2分别为11.164和4.399,P<0.05)。其中,无淋巴结转移患者的死亡风险仅为有淋巴结转移患者的51.2%(RR=0.512,95%CI:0.345~0.758);无肿瘤侵犯脉管患者的死亡风险仅为有侵犯患者的62.5%(RR=0.625,95%CI:0.403~0.970)。
进一步将以上3个指标纳入ROC曲线模型,分析指标预测预后的特异度,结果显示:浸润深度、淋巴结转移和肿瘤侵犯脉管的预测特异度均不够理想,分别为54.3%、54.8%和50.3%,差异无统计学意义(P>0.05)(表4)。
表4ROC曲线评价肿瘤侵润深度、淋巴结转移和脉管浸润的预后准确度
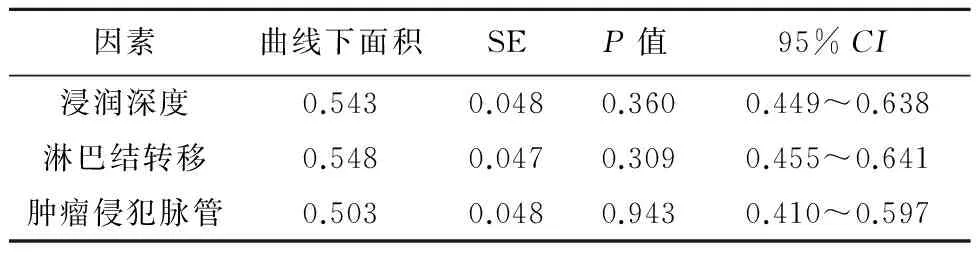
因素曲线下面积SEP值95%CI浸润深度0.5430.0480.3600.449~0.638淋巴结转移0.5480.0470.3090.455~0.641肿瘤侵犯脉管0.5030.0480.9430.410~0.597
3 讨论
作为一种重要的抑癌基因,p53基因编码的53 kDa蛋白在细胞周期过程中发挥着重要的作用,具有抑制肿瘤生长的作用。但是,当该基因发生突变时反而会促进肿瘤的发生、发展[8]。正常细胞中野生型p53蛋白半衰期短,很难用免疫组化检出,而当p53基因突变后,其产物蛋白稳定性增加,半衰期明显延长,用免疫组化法检出的p53蛋白可代表突变型p53的存在[9-10]。在食管癌中p53过表达能够促进肿瘤血管生成,加速肿瘤浸润转移,细胞周期及细胞凋亡调控平衡遭到破坏,因此与不良预后关系密切,已基本明确该基因突变可作为一种独立可靠的生物学指标来判断患者的预后[11]。本研究采用免疫组织化学EnVision法检测214例食管癌组织及癌旁组织中p53蛋白表达情况,在癌组织中 p53 蛋白阳性表达率为44.3%,明显高于癌旁正常食管组织(5.6%),差异有统计学意义(P<0.05),提示p53突变与食管癌发生密切相关,这也与大多数研究结果相一致[12-13]。
有研究报道,食管癌不同的高、低发区中p53蛋白阳性表达率差异无统计学意义(P>0.05),说明在高、低发区食管癌p53蛋白的积聚是类同的[14]。本研究对新疆维吾尔族、汉族、哈萨克族食管鳞癌患者p53蛋白表达情况进行分析,结果显示各民族间p53蛋白表达率差异无统计学意义(P>0.05),提示p53蛋白在不同民族食管癌中的表达也是类同的。进一步分析p53蛋白表达与临床病理因素的关系,不同性别食管癌患者p53蛋白阳性表达率差异有统计学意义(P<0.05),且女性患者p53蛋白阳性率明显高于男性。肿瘤分化程度和淋巴结转移是判定食管癌预后的重要因素。有研究表明,肿瘤分化程度越差、存在淋巴结转移的食管癌组织中p53蛋白阳性率越高,患者预后越差[15-16]。本研究结果显示,低分化患者的p53蛋白阳性率高于高、中分化患者,有淋巴结转移者p53蛋白阳性率高于无淋巴结转移者(P<0.05),提示p53过表达与新疆多民族食管癌患者的预后有关。而p53蛋白表达水平与患者年龄、肿瘤大小、有无脉管侵犯、浸润深度等指标无关(P>0.05)。
本研究对患者术后生存情况和预后进行了分析,各民族食管鳞癌患者术后平均生存期为(15.87±12.26)个月,中位生存期为18.00个月。Kaplan-Meier法分析临床病理因素与预后的关系,发现不同淋巴结转移、脉管侵犯、浸润程度状况患者的预后差异有统计学意义(P<0.05),无淋巴结转移及脉管侵犯、浸润深度越浅,患者预后更好,平均生存期更长。用COX回归模型进一步分析显示:淋巴结转移和肿瘤侵犯脉管是新疆多民族食管癌预后的独立危险因素(P均<0.05)。
综上所述,原癌基因激活、抑癌基因失活是肿瘤发生与发展过程中重要的分子遗传学基础。p53基因作为一个重要的抑癌基因在新疆多民族食管癌的发生、发展中可能起着重要作用,也可作为预测转移潜能的重要参考指标。但是,本研究只使用了免疫组织化学法进行检测,检测方法比较单一,局限于蛋白层面,没有充分分析p53基因状态与生存期的相关性,在后期研究中可采用荧光原位杂交等方法在基因层面进行进一步研究。
[1]Reddish MA, Maclean GD,Koganty RR,et al. Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J]. J Clin Oncol,2006,24(14):2137-2150.
[2]Li Y,An J,Huang S,et al. PLCE1 suppresses p53 expression in esophageal cancer cells[J]. Cancer Invest, 2014, 32(6):236-240.
[3]Xu Y,Yu X,Chen Q,et al. Neoadjuvant versus adjuvant treatment: which one is better for resectable esophageal squamous cell carcinoma?[J]. World J Surg Oncol,2012,10(2):1-8.
[4]张思维,张敏,李光琳,等. 2003~2007年中国食管癌发病与死亡分析[J]. 中国肿瘤, 2012, 21(4):241-247.
[5]王慧,李梦妍,袁媛,等. 172例新疆哈萨克族食管鳞状细胞癌临床病理资料分析[J]. 现代肿瘤医学,2016(4):562-565.
[6]Rice TW,Blackstone EH,Rusch VW. 7th Edition of the AJCC cancer staging manual:esophagus and esophagogastric junction[J]. Ann Surg Oncol,2010,17(7):1721-4.
[7]Fagundes RB,Melo CR,Pütten ACK,et al. p53 immunoexpression: an aid to conventional methods in the screening of precursor lesions of squamous esophageal cancer in patients at high-risk?[J]. Cancer Detect Prev,2005,29(3):227-32.
[8]钟亚莉,刘超,赵治国. p53、MDR-1基因在中老年食管癌患者中的表达及临床运用分析[J]. 转化医学电子杂志,2016,3(1):12-14.
[9]占向鸿,张晓膺,狄冬梅,等. 65例食管癌患者的nm23、p53、PCNA的表达及其临床预后意义[J]. 苏州大学学报:医学版,2006,26(5):830-831.
[10]杜日昌,陈玉英,谭丽珊,等. 食管癌中Caveolin-1与p53的表达及临床意义[J]. 中外医学研究,2011,9(14):7-10.
[11]李翠翠,李苏宜. 食管癌突变型p53过表达临床研究新进展[J]. 癌症进展,2012,10(3):225-227.
[12]费素娟,黄水平,周力新,等. 食管癌组织中COX-2、p53和PCNA的表达及意义[J]. 中国癌症杂志,2003,13(1):17-20.
[13]王根进,胡建军. 食管癌组织中p53基因蛋白过度表达及其临床意义[J]. 华中医学杂志,2003,27(1):18-19.
[14]陶仪声,武世伍,宗永生. 抑癌基因p53在不同地区食管癌中的表达及临床预后分析[J]. 肿瘤学杂志,2002,8(2):79-79.
[15]袁嘉敏,凌志强,毛伟敏. p53在食管癌中的研究进展[J]. 国际消化病杂志, 2012, 32(2):90-92.
[16]孙海涛,高宏,张艺,等. p53、PCNA及P-gp在食管癌中表达的研究[J]. 航空航天医学杂志,2012,23(1):35-37.
(本文编辑杨晨晨)
Expression of p53 and its clinical significance in esophageal cancer of multi-ethnics in Xinjiang
Abulajiang Abudureheman1,2, Yidilisi Awuti2, HOU Zhichao2, Abuduaini Tuerhong2, ZHANG Liwei2,Julaiti Ainiwaer2, LIU Hui1, CAI Ren1, Maidiniyeti Niyazi1
(1ClinicalMedicalResearchInstitute,1DepartmentofThoracicSurgery,theFirstAffiliatedHospital,XinjiangMedicalUniversity,Urumqi830054,China)
ObjectiveTo study the expression of p53 gene and its clinical significance in esophageal squamous cell carcinoma (ESCC) and adjacent normal tissues of Multi-ethnic groups in Xinjiang. MethodsImmunohistochemistry Envision method was used to detect the p53 gene expression of 214 cases with ESCC and 100 cases of adjacent normal tissues,including Uyghur, Han, Kazak three different ethnic groups. And the differences of clinicopathological characteristics among them were analyzed. Resultsp53 protein positively expressed in 44.3% cases of ESCC. The positive rate of p53 protein expression in ESCC tissues and adjacent normal tissues was significantly different (P<0.05). The positive rate of p53 protein expression in Uyghur, Han, Kazak ESCC patients was 45.6%, 38.4%, 49.3%, respectively. There was no significant differences among the three different ethnic groups (P>0.05). However, the positive expression of p53 protein had statistical differences among genders,degrees of tumor differentiation and lymph node metastasis (P<0.05). After analyzing the correlation between clinical pathological factors and prognosis, we found that the prognosis of patients had significant differences according to lymph node metastasis,vascular invasion and depth of tumor invasion (P<0.05). Conclusionp53 gene may play an important role in the occurrence and development of esophageal carcinoma and lymph node metastasis in different ethnic groups in Xinjiang, and it can be used as a reference index for predicting the metastatic potential of ESCC.
ESCC; Multi-ethnic groups; p53 protein; immunohistochemistry
国家自然科学基金(81360305)
阿卜拉江·阿卜杜热合曼(1987-),男(维吾尔族),在读博士,研究方向:胸部肿瘤。
买地尼也提·尼亚孜,女(维吾尔族),博士,副研究员,研究方向:消化道肿瘤分子生物学,E-mail: mdnyn5@yahoo.com。
R735.1
A
1009-5551(2016)10-1329-05
10.3969/j.issn.1009-5551.2016.10.029
2016-07-02]
