cRGD肽偶联去氢骆驼蓬碱磁纳米脂质体的包封率测定方法研究
2016-10-22赵娟娟陈真真朱思曼
赵娟娟, 陈真真, 朱思曼, 李 蕊, 王 梅
(新疆医科大学药学院, 乌鲁木齐 830011)
cRGD肽偶联去氢骆驼蓬碱磁纳米脂质体的包封率测定方法研究
赵娟娟, 陈真真, 朱思曼, 李蕊, 王梅
(新疆医科大学药学院, 乌鲁木齐830011)
目的建立葡聚糖凝胶柱洗脱法测定cRGD偶联去氢骆驼蓬碱磁纳米脂质体的包封率方法。方法逆相蒸发法制备cRGD偶联的去氢骆驼蓬碱磁纳米脂质体,紫外分光光度法测定去氢骆驼蓬碱的含量,葡聚糖凝胶柱洗脱法测定cRGD偶联的去氢骆驼蓬碱磁纳米粒脂质体的包封率,并考察葡聚糖凝胶类型、径高比、洗脱液、上样量对游离药物去氢骆驼蓬碱洗脱的影响。结果选择葡聚糖凝胶柱洗脱法,以sephadexG-50(100~300 μm)装柱、径高比为1∶10、上样量为0.5 mL及PBS缓冲液为洗脱溶剂,能有效分离去氢骆驼蓬碱磁纳米脂质体中游离药物和脂质体,测得洗脱回收率为(98.68±1.08)% ,3批去氢骆驼蓬碱磁纳米脂质体的平均包封率为78.52%。结论葡聚糖凝胶柱洗脱法可以作为cRGD偶联的去氢骆驼蓬碱磁纳米脂质体的包封率测定方法,该法较简单可行。
去氢骆驼蓬碱; 脂质体; 包封率; 葡聚糖凝胶柱洗脱法
磁纳米脂质体(Magnetoliposomes, ML)是近年来新发展起来的一种脂质体,它是将磁纳米粒包裹在脂质体的内水相或镶嵌在脂质双分子层内形成的具有磁性的脂质体[1-2]。磁纳米脂质体兼具磁纳米粒和脂质体的双重特性。一方面,磁纳米脂质体将磁纳米粒包裹在脂质体内,可克服磁纳米粒在体内代谢、半衰期短的缺点,同时在外加交变磁场的作用下还可保留磁纳米粒所具有的磁靶向及局部热疗作用;另一方面,磁纳米脂质体还具有脂质体的易于包载药物、靶向、缓释、提高药物稳定性、减少药物毒性等特点,从而磁纳米脂质体在肿瘤的治疗研究中显示出良好的应用前景[3,4]。本研究将去氢骆驼蓬碱(Harmine, HM)包裹入磁纳米脂质体内,并在表面连接cRGD肽,制备具有双重靶向功能的cRGD肽偶联的去氢骆驼蓬碱磁纳米脂质体(cRGD conjugated harmine magnetoliposomes, cRGD-HM-MP),并采用葡聚糖凝胶柱洗脱法测定脂质体的包封率,对影响柱洗脱法的因素进行了考察,建立了包封率测定方法,为cRGD肽偶联的去氢骆驼蓬碱磁纳米脂质体的质量控制提供理论依据。
1 仪器与试药
1.1仪器AB135-S分析天平(瑞士Metter telodo公司),UV-9100D紫外可见分光光度计 (北京莱伯泰科仪器有限公司),EYELAN-1100旋转蒸发仪(上海爱朗仪器有限公司),OSB-2100水浴锅(上海爱朗仪器有限公司),Malvern Nano-2S90型激光粒径测定仪(英国马尔文仪器有限公司),85-1磁力搅拌器(金坛市医疗仪器厂),KQ-50B超声波清洗器(昆山市超声仪器有限公司)。
1.2试药去氢骆驼蓬碱(HM,南京泽朗医药科技有限公司,含量98.02 %,批号:20140108),大豆磷脂(批号:201406,西安瑞禧生物有限公司),二棕榈酰磷脂酰胆碱DPPC(美国,Avanti lipid公司),胆固醇(美国,Avanti lipid公司),马来酰基-二硬脂酸磷脂酰乙醇胺-聚乙二2000( Mal-DSPE-PEG-2000) (美国 Avanti lipid 公司),cRGD-DSPE-PEG2000(实验室自制),柠檬酸包裹的磁纳米粒(实验室自制),其余试剂均为分析纯。
2 方法与结果
2.1cRGD偶联的HM磁纳米脂质体的制备称取大豆磷脂、DPPC、胆固醇、DSPE-PEG2000、cRGD-DSPE-PEG2000 (质量比10∶10∶5∶1∶1)置于100 mL的圆底烧瓶中,用适量氯仿和乙醚混合溶剂溶解成溶液后,加入1.25 mg HM和制好的磁纳米粒适量,冰浴超声1.5 h,直至形成稳定的乳剂,旋转蒸发除去有机溶剂,达到胶态后,加入适量水,继续减压蒸发除去残留溶剂,得到HM磁纳米脂质体,将脂质体液置于4 ℃冰箱内放置4 h,备用。
2.2cRGD-HM-MP中HM含量测定方法建立称取1 mgHM置于100 mL容量瓶中,用甲醇溶解并定容成10 μg/mL的贮备液,从中吸取一定量,分别用甲醇溶解,制得1、2、4、8、10、20 μg/mL的标准溶液。取10 μg/mL的标准溶液置于紫外分光光度计下200~800 nm范围内扫描波长,结果显示HM在299 nm处有最大吸收,空白脂质体在此处没有吸收,选定299 nm为最大吸收波长。在最大吸收波长处分别测定不同浓度标准溶液的吸光度,得HM标准曲线方程为Y=11.289X-0.282 6,R2=0.999 2,线性范围1~20 μg/mL。经日内精密度、日间精密度、回收率考察,结果日内精密度RSD为(1.11±0.42)%,日间精密度为(1.07±1.04)%,RSD均<2%。回收率为(98.68±1.16)%,RSD为1.08%,说明该法准确性好,可作为HM含量的测定方法。
2.3葡聚糖凝胶柱洗脱法测定包封率
2.3.1葡聚糖凝胶的选择分别采用葡聚糖凝胶(SephadexG-50)50~150 μm和100~300 μm 2种不同型号分别装柱,柱径高比保持在1∶10(cm∶cm),洗脱液选择pH7.2磷酸盐缓冲液,洗脱速度控制在1 mL/min,吸取0.5 mL脂质体上柱洗脱,每2毫升接取1个流份,共接取25个流份,接得流份用甲醇稀释,测定吸光度,以流份作为横坐标,以吸光度作为纵坐标,绘制洗脱曲线。结果用50~150 μm的sephadexG-50制得的洗脱曲线游离药物洗脱较慢,而100~300 μm的sephadexG-50游离药物较易洗脱完全,而且本实验还对不同粒径的sephadexG-50测定的包封率进行了比较,50~150 μm的sephadexG-50测得的包封率很低,可能是粒径较小的sephadexG-50使脂质体不易通过,从而使包封率降低,因此在包封率的测定中选择100~300 μm的sephadexG-50,见图1。
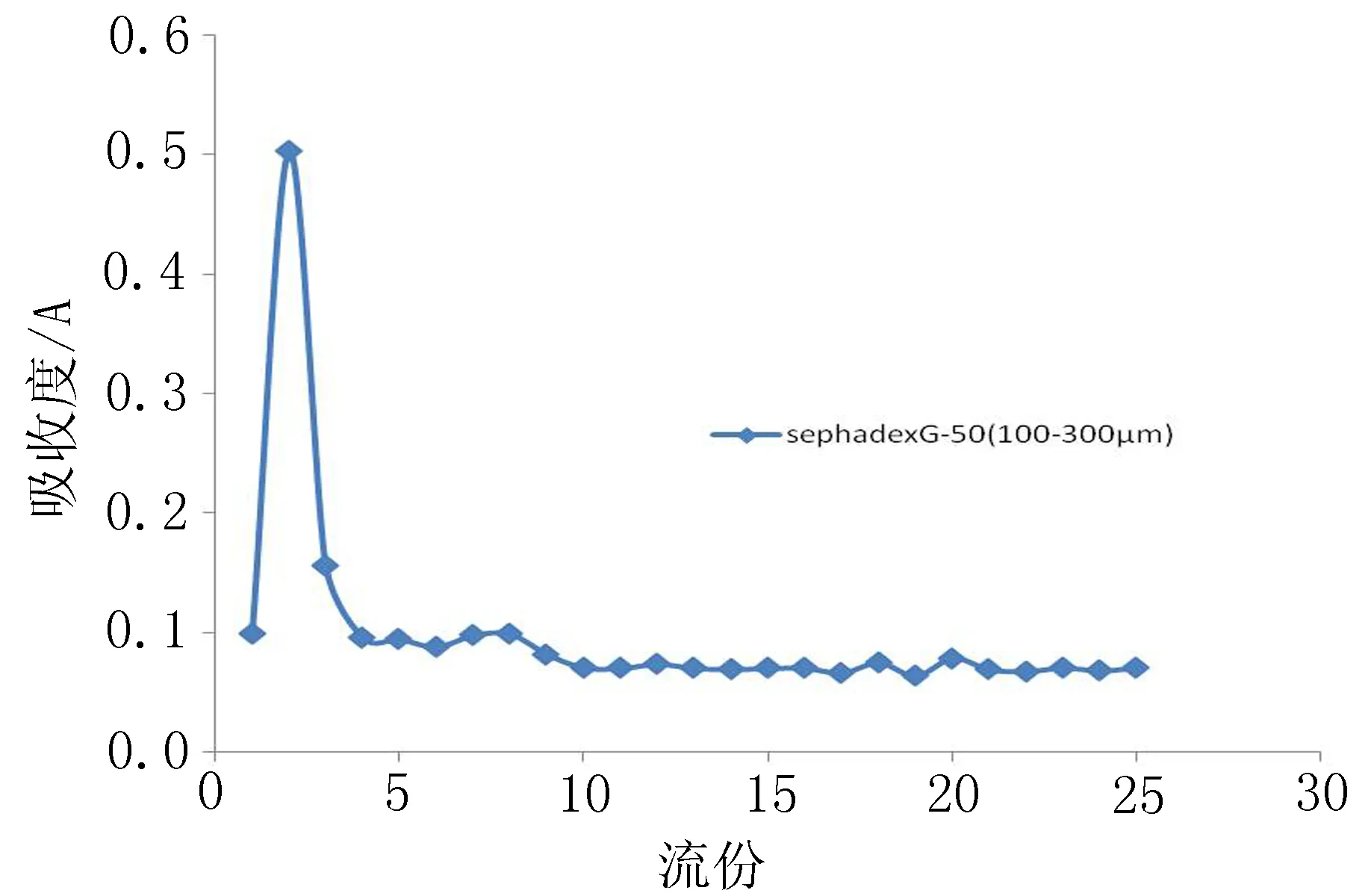
图1 SephadexG-50(100~300 μm)的洗脱曲线
2.3.2径高比的选择选用柱内径为1 cm和1.5 cm2种洗脱柱,用已溶胀好的100~300 μm的SephadexG-50装柱,使径高比分别为1∶10和1.5∶10(cm∶cm),吸取0.5 mLcRGD-HM-MP液上柱,采用PBS缓冲溶液洗脱,每2毫升为1个流份,共接取25个流份,每一流份用甲醇稀释至10 mL,摇匀后,置于紫外分光光度计下299 nm处测定吸光度,代入标准曲线计算含量,以药物含量为纵坐标,流份为横坐标,绘制洗脱曲线,见图2、3。由洗脱曲线结果可知,2种径高比的柱均可以将脂质体和游离药物分开。对于径高比1∶10的葡聚糖凝胶柱,脂质体流份在3~8 mL流出。对于径高比1.5∶10的葡聚糖凝胶柱,脂质体流份在5~11 mL流出。从节约葡聚糖凝胶和洗脱液的角度考虑,本研究采用径高比为1∶10的葡聚糖凝胶柱测定脂质体包封率。

图2 径高比1∶10的洗脱曲线(n=3)
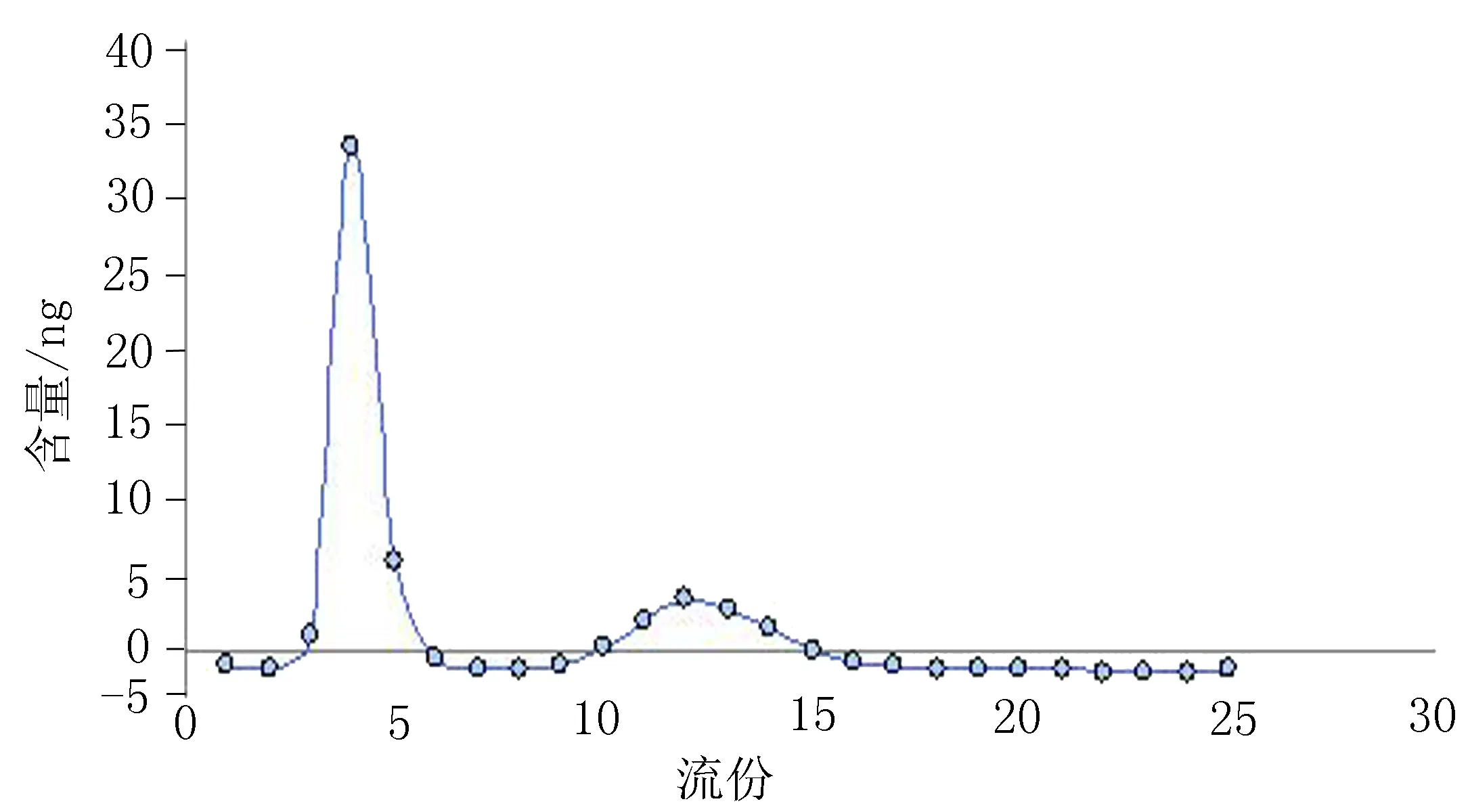
图3 径高比1.5∶10的洗脱曲线(n=3)
2.3.3上样量的考察已溶胀好的粒径为100~300 μm的SephadexG-50装柱,保持径高比为1∶10,洗脱液为pH7.2磷酸盐缓冲液,控制洗脱流速为1mL/min。取制得的脂质体1 mL和0.5 mL分别上样洗脱,采用“2.3.1”项下方法分别测定洗脱曲线,见图4。不同上样量洗脱曲线基本一致,故从成本考虑,选择0.5 mL上样量为测定包封率的上样量。
2.3.4洗脱液的考察按照“2.3.3”项下方法装柱后,选择PBS和水作为洗脱液,分别测定脂质体洗脱曲线,见图5。结果洗脱液对洗脱曲线有较大影响,PBS液可使游离药物更好地洗脱下来,而水作洗脱液时,基本看不到游离药物的洗脱峰,说明游离药物洗脱较慢,25个流份后仍可见有少量游离药物的吸光度,所以本研究选择PBS即pH=7.2的磷酸盐缓冲液作为洗脱液。
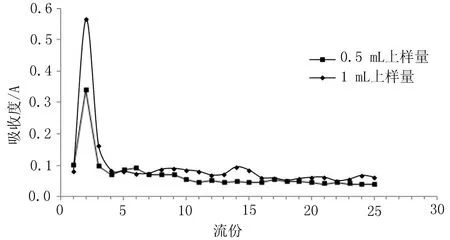
图4 不同上样量的洗脱曲线

图5 不同洗脱液的洗脱曲线
2.3.5包封率测定方法的回收率考察取0.5 mL的cRGD偶联的去氢骆驼蓬碱磁纳米脂质体上柱洗脱,柱径高比为1:10(cm:cm),接取第3~8 mL流份共6 mL为纯脂质体流份,从纯脂质体流份中取0.5 mL第二次上柱洗脱,接取第3~8 mL流份共6 mL作为第二次过柱的纯脂质体流份,将第二次过柱纯脂质体流份和第一次过柱的纯脂质体流份分别取3 mL用甲醇溶解后,置于紫外分光光度计下299 nm处测定吸光度,代入标准曲线计算浓度,求算含量,以第二次过柱纯脂质体流份和第一次过柱的纯脂质体流份的含量进行对比,计算回收率,平均回收率为98.68 μg,见表1。
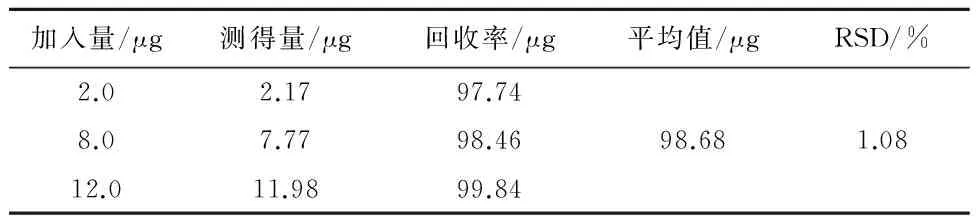
表1 回收测定结果(n=3)
2.4cRGD-HM-MP包封率的测定取已溶胀好的SephedexG-50装柱,使径高比为1∶10,用100 mL磷酸盐缓冲液液平衡葡聚糖凝胶柱后,分别取3批制得的0.5 mLcRGD-HM-MP液上样洗脱,弃去前2 mL流份,接取第3~8 mL流份共6 mL为纯脂质体流份,从中取3 mL用甲醇10 mL破乳溶解,取未过柱的脂质体0.5 mL直接用甲醇破乳溶解并定容至10 mL,每个样品共做3份;将制得的样品置于紫外分光光度计下299 nm处测定吸光度,代入标准曲线计算浓度,计算包封率。包封率的计算公式为:包封率=过柱后含量/过柱前含量×100%,平均包封率为78.52%,见表2。
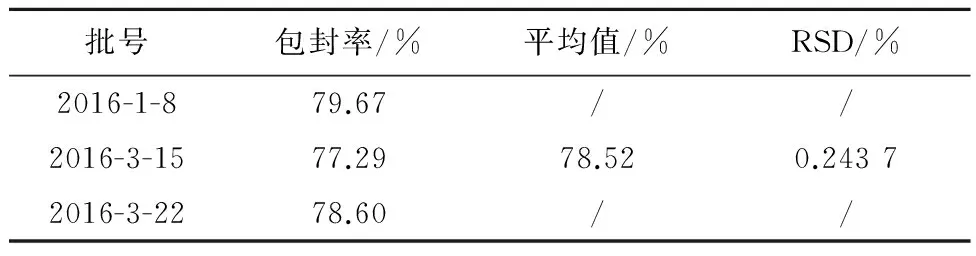
表2 样品包封率的测定结果(n=3)
3 讨论
包封率测定方法有多种,如葡聚糖凝胶柱法、鱼精蛋白沉淀法、冷冻超速离心法、微型柱法、透析法及超滤法等,其原理都是采用一定的方法使包封的药物和游离药物分离,测定包封或游离药物的浓度,计算包封率[11-14]。其中葡聚糖凝胶柱色谱法,利用分子排阻色谱原理及吸附原理将不同尺寸的微粒分离,使脂质体和游离药物分开,从而测定包封率。国外选用的凝胶范围较广,不同交联度的葡聚糖凝胶和羟丙基交联葡聚糖均有应用,而国内多沿用葡聚糖凝胶SephedexG-50[14]。选用SephadexG-50测定包封率时,凝胶的选择要考虑被分离化合物的分子量大小和溶解度。另外在分离时,所用葡聚糖凝胶柱的径高比、洗脱液的流速及上样量的多少都会影响脂质体与游离药物的分离, 宜选择能使脂质体达到最大分离程度的洗脱条件,才能保证包封率测定准确[14]。本研究通过葡聚糖凝胶柱洗脱法测定脂质体的包封率,并对凝胶种类、径高比、上样量进行考察,建立了cRGD偶联的HM磁纳米脂质体的包封率测定方法,通过回收率考察,表明该法较准确可行。
[1]马勇杰.磁性纳米粒子的细胞内吞及基因转染研究[D].上海:上海交通大学,2012.
[2]周平红.磁性阿霉素纳米脂质体靶向治疗裸鼠大肠癌的实验研究[D].上海:复旦大学,2003.
[3]Daniela F, Demens D, Gunter A, et al. Ultrasmall Superparamagnetic Iron Oxide(USPIO)-based liposomes as magnetic resonance imaging probes[J]. Int J Nanomed, 2012,7(2): 2349-2359.
[4]范玉,满昌峰,徐娟,等.榄香烯超顺磁性隐形纳米脂质体对肿瘤Hep-2细胞克隆形成和侵袭的影响[J].中华实验外科杂志,2014,31(3):619-620.
[5]温悦,毕小婷.主动靶向脂质体药物的研究进展[J].医药导报,2010,29(6):754-757.
[6]游本刚.复合机制介导的α-常春藤皂苷肝肿瘤主动靶向给药系统研究[D].苏州:苏州大学,2013.
[7]Kunath K, Merdan T, Hegener O, et al. Integrin targeting using RGD-PEI conjugates for in vitro, gene transfer[J]. J Gene Med, 2003, 5(7):588-599.
[8]肖斌,朱永红,邹全明.RGD肽在肿瘤治疗中的研究进展[J].中国肿瘤临床,2005,32(19):1135-1137.
[9]黄发珍.Gell肽介导的靶向脂质体抗肿瘤作用及其摄取机制的研究[D].苏州:苏州大学,2013.
[10]王文喜.脂质体表面的高聚物修饰与细胞转运[D].杭州:浙江大学,2011.
[11]陈云,陈涛,卢婷利.HPLC法测定炔雌醇脂质体的含量及包封率[J].广东药学院学报,2008,24(3):217- 219.
[12]鞠静红,张志荣,韩静,等.穿琥宁脂质体包封率的测定[J].中国医药工业杂志,2008,39(7):514- 516.
[13]隋因,刘宝庆,夏东亚.冷冻干燥法制备阿糖胞苷冻干脂质体粉针研究[J].中国医院药学杂志,1995,15(11):487-490.
[14]黄川生,王新春,王鲁妹,等.去氢骆驼蓬碱固体脂质纳米粒包封率测定方法研究[J].中成药,2011,33(3):516-518.
(本文编辑施洋)
Determination of entrapment efficiency of cRGD conjugated HM magnetoliposomes
ZHAO Juanjuan, CHEN Zhenzhen, ZHU Siman, LI Rui, WANG Mei
(CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China)
ObjectiveTo establish sephadex G-50 method to determine entrapment efficiency of cRGD conjugated Harmine magnetonanoliposomes. MethodsReverse phase evaporation method was used to prepare cRGD conjugated Harmin magnetonanoliposomes. UV spectrophotometric method was used to determine drug content. Sephadex G-50 column filtration method was used to determine the entrapment efficiency of Harmine. Furthermore, the type of sephadexG-50, ratio of diameter and height of column, sample amount and dilution solution were optimized. ResultsSepadex G-50 gel filtration method can be used to effectively separate liposomes and free drugs. SephadexG-50 (100-300μm) was chosen. The ratio of diameter and height of column was 1∶10. The volume of added sample was 0.5mLand the dilution solution was PBS solution. Recovery rate was (98.68±1.08)%. Average entrapment efficiency of Harmine magnetic nanoliposomes in three batches were 78.52%. ConclusionSephadex G-50 column filtration method can be used to determine the entrapment efficiency of Harmine magnetic nanoliposomes, and this method is simple and feasible.
Harmine; magneto nanoliposomes; Entrapment efficiency; Sephadex G-50 column filtration method
国家自然科学基金(81460539)
赵娟娟(1992-),女,本科,研究方向:药学研究,E-mail:1226862870@qq.com。
王梅(1977-),女,博士,副教授,研究方向:药物传输系统的研究,E-mail:wm630@163.com。
R943
A
1009-5551(2016)10-1315-04
10.3969/j.issn.1009-5551.2016.10.025
2016-6-1]
