系统毒理学
——法医毒物学发展的机遇与挑战
2016-10-22沈敏严慧施妍向平
沈敏,严慧,施妍,向平
(司法部司法鉴定科学技术研究所上海市法医学重点实验室上海市司法鉴定专业技术服务平台,上海200063)
鉴定综述
R e v i e w
系统毒理学
——法医毒物学发展的机遇与挑战
沈敏,严慧,施妍,向平
(司法部司法鉴定科学技术研究所上海市法医学重点实验室上海市司法鉴定专业技术服务平台,上海200063)
随着生命科学新理论和新技术的发展和渗透,形成了基于基因组学、蛋白组学和代谢组学等组学技术的系统毒理学,赋予法医毒物学新的研究平台,使之从研究思路、方法和理念发生了根本性转变。综述了组学技术及其在法医毒物学领域的研究进展,以及组学技术发展和应用亟待突破的方法标准化、组学数据库和多组学信息集成等关键问题,提出法医毒物学研究应更加注重人群研究和应用价值。系统毒理学有望在探索毒物代谢酶的基因多态性与毒物代谢规律之间的关系、阐明毒物对机体毒性作用和机制、寻找中毒相关生物标志物,以及确定毒性剂量阈值等方面取得突破,是法医毒物学未来发展的机遇与挑战。
法医毒物学;系统毒理学;组学;基因组学;蛋白组学;代谢组学
法医毒物学是研究毒物的来源、性质、体内变化、毒性、作用机制及其与生物体、外界环境之间的相互关系,并为司法实践提供科学依据的一门学科。评价所涉毒物对行为能力的损伤程度或对中毒/死亡的参与程度,给出科学、合理的结果解释是法医毒物学研究与实践的核心问题,而阐明毒物与机体交互作用对毒性作用的影响以及生物标志物研究是学界关注的重点。随着生命科学新理论和新技术的飞速发展和不断渗透,“系统毒理学(systems toxicology)”概念和“组学(omics)”技术应运而生,赋予法医毒物学新的研究平台,使之从研究思路、方法和理念发生了根本性转变。
1 系统毒理学及其组学技术
“系统毒理学”由系统生物学的概念和内涵演变而来[1]。人类基因组计划完成后,诞生了在系统水平上研究生命的结构、功能和调节网络的科学——系统生物学,其强调生命过程应该作为统一整体来研究,而不是各部分的简单加和。外源性化学物质进入机体以后,并非遵循单一机制,而是作用于细胞、组织、器官不同水平的分子网络体系,毒性则是机体网络系统对外源性化学物质应激源免疫、代偿后表现的不良结局。于此,基于系统生物学整体思路的系统毒理学应运而生。系统毒理学是通过了解机体暴露后在不同剂量、不同时点的基因表达谱、蛋白质谱和代谢物谱的改变以及传统毒理学的研究参数,借助生物信息学和计算毒理学技术对其进行整合,从而系统地研究外源性化学物质和环境应激等与机体相互作用的一门学科。
系统毒理学主要包括组学技术和计算毒理学两大部分[2-3]。组学一词源于拉丁文后缀“-ome”,指一个组或群,目前把对细胞内RNA、DNA、蛋白质、代谢中间产物的整体分析手段称为组学技术,主要包括基因组学(genomics)、蛋白质组学(proteomics)及代谢组学(metabolomics)等。组学技术平台的建立得益于高通量分子生物学技术、分析化学技术和生物信息学的发展。新一代测序技术、基因表达谱分析、实时定量聚合酶链式反应(PCR)技术促进了基因组学的发展;蛋白质芯片、高通量蛋白分离分析技术极大地扩展了蛋白组学的内涵;新型质谱和核磁共振对体内代谢变化的精确分析和鉴定,推动了代谢组学的进步;体外高通量实验,为测定大批量化合物提供可能。基于组学技术的系统毒理学的发展,不仅依赖于高通量测量技术的进步,更重要的是对海量数据的收集、整理,建立量化的数据驱动的模型以便理解细胞内不同层次调控的相互作用,从而抽提出各层次间相互作用的信息,以实现对相关数据的解读。
由于组学技术可从基因型到表现型不同层次揭示外源性化学物质与机体相互作用的机制和规律,故有望成为解决生命科学相关领域科学问题的有效工具。
1.1基因组学
基因组学包括以全基因组测序为目标的结构基因组学(structural genomics)和以基因功能鉴定为目标的功能基因组学(functional genomics)。毒物基因组学(toxicogenomics)来源于毒理学与基因组学的交叉与整合,是将基因组学的理论与技术应用于毒理学的一门新兴学科。毒物基因组学的研究目标是阐明外来毒性物质对基因活性和基因产物的影响及相互作用。毒物基因组学的基本方法是通过观察生物在接触毒物后基因表达谱的变化,筛选毒性相关基因、揭示毒作用的基因表达谱、快速筛选毒物、筛选和检测基因多态性、检测基因突变、进行安全性评价等,从而解决化学物质的联合作用、高通量筛选对人体有毒性作用或者潜在毒性作用的化学物质、研究毒作用机制等毒理学研究的关键问题。近十几年来,已出版了多本毒物基因组学专著,如Toxicogenomics(Inoue,2002)、Handbook of Toxicogenomics:StrategiesandApplications(Borlak,2005)、Toxicogenomics and Proteomics(Valdes,2004)等,表明毒物基因组学发展迅速,受到人们的普遍关注[4]。
毒物基因组学可应用于[5-6]:(1)毒性预测及毒作用机制。传统毒理学的动物实验所获反映毒性终点的各种表型改变、形态学指标等通常较为复杂、间接,而基因组学提供了更加灵敏、全面的机制研究方法。利用基因组学技术进行基因表达谱的分析,可以有效监测接触有害物质后基因水平的改变,可通过化学结构的相似性和基因表达模式的匹配性来确定未知毒物的作用机制。转录谱技术实现了生物样本中基因转录活性的定量测量,推进了毒物毒性机制的研究,并有利于新的或者未知化合物的毒性预测。(2)剂量-反应关系评价。传统毒理学方法在对某些剂量-反应关系曲线的解释上存在欠缺,尤其是确定低剂量水平下化学物质的毒性作用,而基因组学技术为评价包括非线性模式在内的多种量效关系模式提供了更为有效、准确、快捷的方法。(3)毒性作用种属间的外推。传统的毒理学实验模式所给予的毒物剂量远远大于人的真实暴露水平,且所用动物模型的种属差异,其结果并不适宜外推至人。应用基因组学技术可以很大程度地改善实验结果由动物外推至人时所产生的误差,更真实地反映暴露水平下人体对外源性化学物质的反应;可通过比较不同物种间的基因表达谱寻找与人类最接近的实验动物,使毒理学研究更接近人类实际情况。(4)生物标志物、基因多态性与易感性。生物标志物包括接触生物标志物、效应生物标志物及易感性生物标志物,可阐明毒物接触与人体损害之间的关系,是毒理学的研究重点。利用基因组学技术探测基因突变位点及对基因多态性进行分类,对于确定易感人群,进行毒物毒性作用的个体评价具有重要价值。(5)毒物的联合毒性效应。人类经常同时接触多种毒性物质,不同毒物之间可能产生协同、相加或拮抗等交互作用。传统毒理学通常都是对单个毒物的毒性作用进行研究,简单地将一系列单一物质的实验结果用于解释混合物的作用效应是不合理的。基因组学技术通过将混合物作用下基因表达的改变与单一化学物作用下基因表达的改变作比较,可明确交互作用的类型和规律。
1.2蛋白组学
蛋白质组是指由基因组表达产生的所有相应的蛋白质。蛋白质组学多应用大规模蛋白质分离和识别技术研究蛋白质组。蛋白质组学的研究策略有两种:一种是完全蛋白组学,目的是检测一种细胞类型或一种组织内基因组所表达的全部蛋白质;另一种是差异蛋白质组学,主要是筛选和鉴定不同种类或状态下各样本之间蛋白质组的区别与变化。毒物蛋白质组学整合了经典毒理学、病理学和蛋白质差异表达分析技术,通过比较特定细胞、组织或器官在毒物作用前后的蛋白质表达谱的变化,筛选出毒物相关的特征性表达蛋白,再通过抗体分析技术可发现新的毒性蛋白标志物,利用这些标志物能够实现在安全剂量下进行人体作用机制的研究。
毒物蛋白组学研究的核心技术为蛋白质组分分离技术、蛋白质组分的鉴定技术以及利用蛋白质信息学进行蛋白质结构、功能分析及预测。主要研究手段是采用高通量的分析方法,如二维凝胶电泳/质谱联用技术(2DE-MS)、液相色谱/质谱联用技术(LCMS)以及蛋白芯片技术(protein chips)等。定量蛋白质组学可以检测机体或组织在正常状态与外界刺激(疾病或中毒等)状态下所表达的蛋白质在量上的差别,是蛋白质组学研究的热点[7]。基于多种高效富集技术(磁性微球和免疫亲和)和质谱技术的定量蛋白质组学研究方法拥有高通量和高灵敏度的特点,可以准确检测在复杂体系中的低丰度蛋白质。
由于蛋白质是生命体功能的执行者和体现者,故蛋白质组研究可以很好地弥补基因组研究中基因表达时空差异的缺陷,直接指向影响表型的蛋白质。蛋白组学技术的建立和应用,为生物标志物的探寻提供了有效的工具。蛋白质组研究所获信息具有动态性、时间性、空间性和特异性,更能在细胞和生命的整体水平上阐明生命现象的本质和活动规律。
1.3代谢组学
代谢组学的研究对象是生命活动链条下游的代谢物的集合。代谢组可以认为是一个细胞、组织、器官或者一个生物体在某一特定状态下的所有内源性小分子代谢产物的集合。代谢物包括分子大小、结构、极性和功能都各不相同的多种小分子化合物,如氨基酸、糖、有机酸、脂肪酸、核苷、核苷酸等,是细胞内各种生物学途径和代谢过程的终产物,直接反映了生命活动的整体状态和功能,以及其动态变化过程。代谢组学通过系统研究代谢组的组成和变化规律,从而揭示机体新陈代谢活动本质的学科[8]。
代谢组学研究是利用各种高通量分析化学方法对生物体液、细胞或组织进行系统分析,对其中的内源性小分子代谢产物的组成、含量及其随时间的变化进行定性和定量分析,并利用模式识别方法对这种变化进行分类和预测,进而对机体的整体的生物学状况和功能做出评价。由于代谢组所包含的分子种类及其浓度范围的复杂性,任何单一的技术手段都不足以对一个特定对象进行全面的研究,只有通过组合不同的分析技术,才能够比较全面地了解一个特定的代谢组所包含的内容。目前代谢组学研究常用核磁共振(NMR)和质谱技术,其中质谱技术主要包括电子轰击质谱(EI/MS)、电喷雾电离质谱(ESI/MS)、串联质谱(tandem MS)、飞行时间质谱(TOF/ MS)、傅里叶变换质谱(FTMS)等。
代谢组学研究同样需借助于信息学平台,将多维、分散的数据进行总结、分类及判别分析,发现数据间的定性、定量关系,解读数据中蕴藏的生物学意义。主成分分析法(principal components analysis,PCA)是最常用的分析方法。其他的模式识别技术,如族类分析(hierarchical clusteranalysis,HCA)、簇类独立软模式法(soft independent modeling of class analogy,SIMCA)、偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA)、非线性映射分析(nonlinear mapping,NLM)及人工神经元网络(artificial neuronal network,ANN)等在代谢组学研究中亦能发挥其重要作用。
代谢组学通过对与毒性作用机制密切相关的生物体中内源性代谢产物的动态定性定量分析,可发现由毒物作用引起的异常代谢变化,获得毒物毒性效应、作用机制和生物标志物的信息。(1)毒物毒性的评价。通过研究生物体整体代谢变化,筛选出毒物作用后特征性表达的代谢物群,可以准确、快速、敏感反映外源性化合物对生物体的毒性作用,该技术目前已广泛应用于新药的毒性评价。(2)毒物作用靶器官及相应的生物标志物。代谢物组成的变化可以直接反映毒物对机体造成的影响,快速分析多条代谢通路,帮助定位毒物作用靶器官及寻找相应的生物标志物。(3)毒物作用机制的研究。代谢组学可在整体水平上灵敏、全面的检测机体在毒物作用后各种代谢物的浓度、流量及相互比例的变化,从而协助对毒物作用机制进行解析。(4)物质滥用及成瘾研究。物质滥用对机体代谢物产生一定具有特异性和可重复性的影响,代谢组学通过分析相关代谢物的变化,可筛选毒品成瘾的特异性生物标志物,评价毒品滥用程度,推断滥用史或复吸史。
1.4计算毒理学
组学技术的发展,不仅依赖于高通量测量技术的进步,更重要的是对海量数据的处理。计算毒理学可为大数据的处理和分析提供有效的手段。计算毒理学是一广义术语,涵盖所有与毒理学相关的计算机辅助信息学、数据挖掘及计算模拟技术等,涉及计算化学、分子生物学、计算生物学(生物信息学)和系统生物学等学科[9-11]。随着系统毒理学实验数据的增多,计算毒理学已突破传统的理念和方法体系,故有学者提出计算系统毒理学的概念[2]。其主要研究内容包括:(1)通过对化合物暴露高通量实验数据的挖掘,得到化合物影响复杂生命体和环境的相关知识库;(2)通过构建毒理组学网络模型,并用数学方法表示和模拟中间过程,全面理解外源物致毒的中间机制;(3)发展具有预测功能的毒理学综合模型,以期定量全面评估化合物的安全性。计算毒理学构建计算模型的基础是高质量的数据,同时也需要其他化学组学相关数据库如化合物-基因-疾病关联数据库CTD、毒物-靶标数据库T3DB、化合物-蛋白关系数据库Chemprot、STITCH、ChEMBL、BindingDB等,及传统毒理学数据库来丰富信息空间。与国外成果丰硕的研究现状相比,我国计算毒理学研究尚处于发展初期,体外高通量筛选数据的分析方法、计算预测模型的构建方法等都还处于探索阶段。
2 组学技术在法医毒物学领域研究进展
评价所涉毒物对中毒或死亡的参与度,给出科学、合理的结果解释是法医毒物学实践的核心问题。组学技术整合了基因组、蛋白质组、代谢组等不同水平上的多种信息,有望在探索毒物代谢酶的基因多态性与毒物代谢规律之间的关系、阐明毒物对机体毒性作用和损伤机制、寻找中毒相关的生物标志物,以及确定毒性剂量阈值、毒性作用在种属间的外推等方面取得突破。
法医毒物学领域已开展组学技术的探索研究。检索与法医毒物学密切相关的学术刊物Forensic Science International、International Journal of Legal Medicine、Journal of Analytical Toxicology、Journal of Forensic Sciences、Journal of Forensic and Legal Medicine、Forensic toxicology等,有关法医毒物组学研究论文近10年发表37篇,近5年占21篇,虽然不尽全面,但大体反映了在该领域的平稳发展趋势。最近5年的成果中,涉及基因组学的12篇,蛋白组学的7篇,代谢组学的2篇。国内的法医毒物学研究在这些组学领域均有涉及,发表论文不限于上述刊物范围。目前国内期刊仅见关于代谢组学的综述报导[12-14]和司法部司法鉴定科学技术研究所有关基因组学、蛋白组学、代谢组学的博士论文。
2.1基因多态性与毒性效应
毒物的毒性效应存在很大的个体差异,摄取相同剂量的毒物后其体内浓度差异与遗传、生理、病理、环境有关,其中个体的遗传因素关系最为密切。个体差异的15%~30%是由基因因素决定的,根据CYP P450酶的基因多态性可将人群分为四种类型:弱代谢者(poor metabolizer,PM)、中间代谢者(intermediate metabolizer,IM)、强代谢者(extensive metabolizer,EM)和超强代谢者(ultraextensive metabolize,UM)。若CYP基因出现碱基缺失、插入、替换、颠换等类型的突变,会导致所表达的CYP酶降低活性或者丧失活性。
法医毒物学工作者认识到个体差异在毒物鉴定结果解释中的重要性,已关注并开展毒物基因组学研究[11]。CYP基因多态性与毒物效应多样性之间的关系研究也成为法医毒物学的研究前沿和国际新热点,在年度国际法医毒物学会议上设专场研讨。广泛存在的基因多态性可以导致明显的个体差异,目前已经证实CYP1A1,CYP1A2,CYP1B1,CYP2A6,CYP2C9,CYP2C19,CYP2D6,CYP2E1,CYP3A4,CYP3A5等基因存在多态性[15]。CYP基因的某些突变可影响毒药物代谢速率,造成用药的个体差异。Jannetto等[16]和Jin等[17]通过分析羟考酮和芬太尼中毒案件,检测白人、美国黑人和印第安人的P450酶基因型,显示CYP2D6可以作为法医毒物学鉴定的辅助手段,给出合理的结果解释。Zackrisson等[18]通过242例药物中毒死亡者和正常人的单核苷酸多态性(SNP)分型检测,发现在瑞典人群中,中毒死亡者中CYP2D6 PM发生频率(4.7%)反而低于正常人群中PM频率(8.5%);中毒死亡者中CYP2D6*4等位基因频率明显低(P<0.005)。Levo等[19]分析芬兰人中33个曲马多中毒死亡案例,发现功能性CYP2D6等位基因数量与曲马多及其代谢物O-去甲曲马多和N-去甲曲马多的浓度比率有关联性。Koski等[20]分析芬兰人中202个阿米替林中毒死亡案例,结果发现CYP2D6缺陷基因数量与阿米替林及其羟基代谢物浓度比率存在正相关性,CYP2C19缺陷基因数量与阿米替林及其去甲基代谢物浓度比率存在关联性。沈敏等[21]报道中国汉族人群和高加索人群CYP基因座上的SNP位点分布频率有显著性差异,并发现新精神活性物质唑吡坦的代谢与CYP3A4、CYP2C19基因座上的2个SNP位点的多态性相关。
毒物基因组学的研究特点及趋势为:(1)毒物代谢相关基因研究聚焦于CYP2D6。目前国内外研究最多的为CYP2D6等位基因突变与药物代谢的相关性,其次为CYP2C19,其他包括CYP2C9、CYP3A4、CYP2B6(图1)。由于种族差异,CYP2D6等位基因分布频率不同,因而其表达的特定代谢酶活性在不同人群中也不尽相同。表1总结了目前6个人种的CYP2D6等位基因分布频率,其中CYP2D6*10在中国汉族人群中发生频率较高,若发生此类突变,则会降低CYP2D6酶的活性,导致弱代谢。(2)新精神活性物质成为研究热点。新精神活性物质的出现及滥用趋势使其成为近年法医毒物学的主要研究对象。丹麦学者发现合成大麻素的代谢与CYP3A4基因多态性相关[22],挪威学者在国际法医学杂志中报道了4-甲氧基甲基苯丙胺(PMMA)与CYP2D6基因多态性相关[23]。苯丙胺类药物主要在肝脏内通过CYP2D6酶进行代谢,若表达CYP2D6酶的基因发生突变,则会造成药物代谢异常[24]。据报道,2010—2013年挪威因滥用PMMA致死的案件就多达29起,其中大部分都是由于PMMA代谢异常所造成的急性死亡。
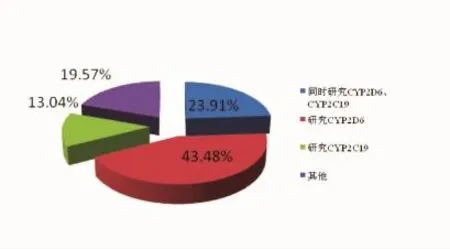
图1 研究热点基因分布
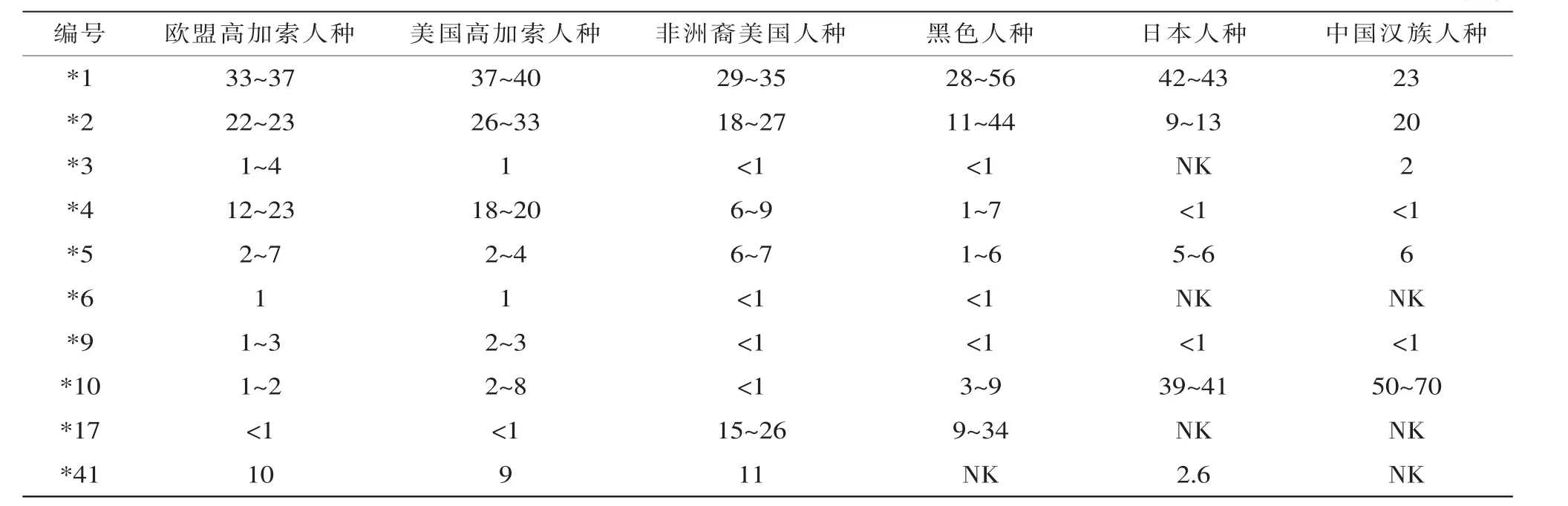
表1 不同种族主要的CYP2D6等位基因频率 (%)
基因多态性研究与其他组学技术明显不同的是相对成熟,国际上已将该成果应用于鉴定实践,以科学解释毒物摄入量、毒物代谢、个体遗传因素与中毒或死亡结果的关系。
[案例1]某62岁的男性患者因咳嗽和肺炎住院,服用治疗剂量的可待因(25mg/次,每天3次),4天后该患者病情突然恶化,出现意识丧失,昏迷,呼吸抑制,瞳孔散大等症状[25]。血液毒药物定量分析及CYP2D6和CYP3A4基因型分析结果表明:(1)该患者出现急性中毒反应时,血液中可待因及其代谢物可待因葡萄糖结合物、吗啡、3-吗啡葡萄糖醛酸苷、6-吗啡葡萄糖醛酸苷的浓度分别为114、361、80、580、136ng/mL(表2),其中吗啡、3-吗啡葡萄糖醛酸苷、6-吗啡葡萄糖醛酸苷的浓度远高于正常人群。(2)该患者CYP2D6分型结果为携带两个以上拷贝的功能等位基因(CYP2D6*1/*1xN),为超快代谢类型。可待因经P450亚酶3A4作用代谢成去甲可待因,经尿苷二磷酸葡萄糖醛酸基转移酶UGT酶(UDP-glucuronosyltransferase,UGT)亚酶2B7作用形成6-可待因葡萄糖结合物,经CYP2D6作用代谢成吗啡,再进一步与葡萄糖醛酸结合成6-吗啡葡萄糖醛酸苷和3-吗啡葡萄糖醛酸苷。当发生CYP基因突变(超快代谢类型)而使CYP2D6酶活性增加,促进可待因更快更彻底地转化为吗啡,而高浓度的吗啡可引起呼吸困难甚至死亡。
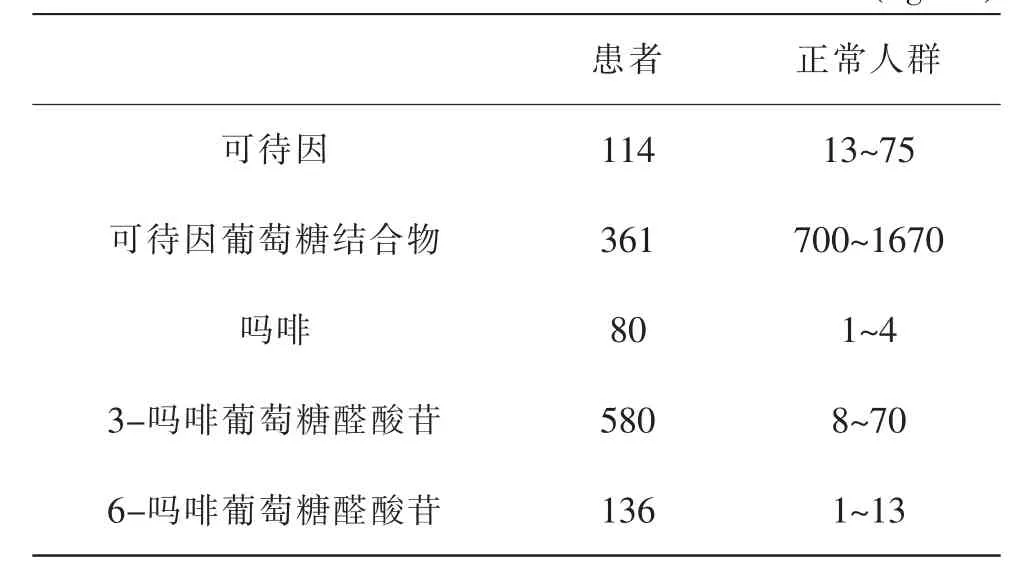
表2 患者与正常人群血液中可待因及其代谢物的浓度比较(ng/mL)
[案例2]某34岁的男性死于家中,经调查排除自杀和谋杀的可能性[26]。其家庭医生证明死者有精神病史,长期服用文拉法辛(VEN)治疗,2年前因治疗需要增至1天2次,150mg/次。尸体解剖无异常。死者血液毒药物定量分析结果:血液中文拉法辛及其代谢物O-去甲文拉法辛(ODV)、N-去甲文拉法辛(NDV)的浓度分别为4.5、0.025、0.54mg/kg,其中原体文拉法辛浓度远高于正常人群。死者CYP2D6和CYP2C19的基因分型结果为CYP2D6*4/*5(弱代谢类型),CYP2C19*2/*2(弱代谢类型),弱代谢人群服药后会造成文拉法辛在体内蓄积(表3),从而引起中毒死亡。
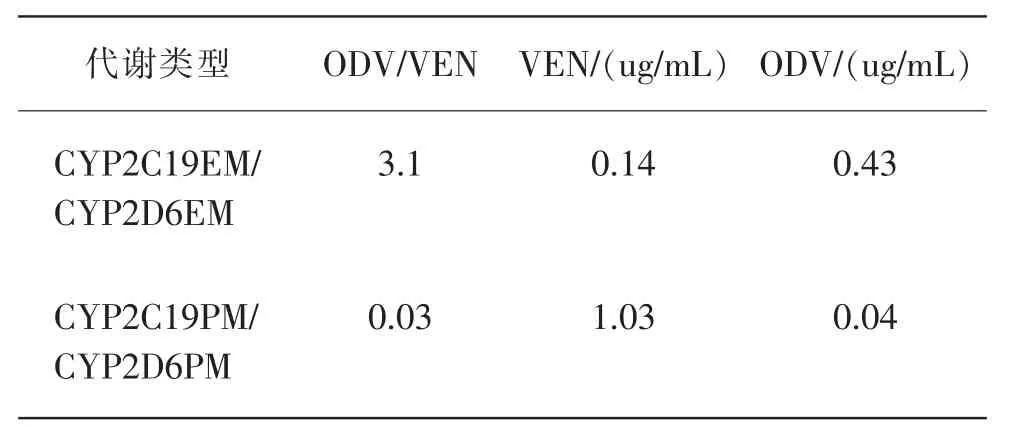
表3 正常代谢人群和慢代谢人群体内文拉法辛及其代谢物浓度的比较
涉毒案件应考虑个体遗传因素,结合不同个体的毒物代谢差异与DNA多态性的关系,进行结果解释,更加科学地判断毒物剂量对死亡或行为能力的作用程度,为法医或法庭提供有效的证据。
2.2毒物作用机制和生物标志物的探寻
毒物代谢组学通过对各种代谢路径底物和产物的小分子代谢物进行动态的定性和定量分析,来揭示代谢组与毒物作用的相互关系,定位毒物作用的靶器官及选择相应的生物标志物。法医毒物学领域的代谢组学研究报导较为罕见,而与之关联的药物基因组学受到了国内外学者的高度关注。
(1)毒品滥用成瘾判定。毒品滥用对机体代谢物产生一定具有特异性和可重复性的影响,利用代谢组学方法检测相关代谢物的变化,可用于筛选毒品成瘾的特异性生物标记物,评价毒品滥用程度、推断滥用种类及推断复吸史。如Zheng等通过代谢组学研究获得“海洛因的使用导致了代谢模式的偏差,而海洛因停用后代谢模式恢复到基线,海洛因的重新使用导致代谢模式再次偏离”的结果;对代谢物进行分析发现海洛因加速了三羧酸循环,且游离脂肪酸的代谢可能导致海洛因组大鼠体质量减轻[27]。Yang等[28]利用氢质子-磁共振波谱(1HMRS)比较14名可卡因长期滥用者和14名健康志愿者体内代谢物浓度。可卡因长期滥用者谷氨酸与总肌酐比值比对照组显著降低,且降低程度与可卡因使用年限明显相关,这可能表明谷氨酸在调节可卡因成瘾的重要作用,并对可卡因成瘾者前扣带皮层活动减弱进行合理的解释。通过对初次吸毒人群和吸毒成瘾人群代谢组的比较,可为吸毒成瘾的界定提供依据。
(2)毒性作用和生物标志物。代谢物组成的变化是毒物对机体造成的最终影响,能够反应毒性损伤特征的代谢物变化,可以作为器官特异性的标志物。Feng等[29]利用基于UPLC-MS的代谢组学对长期、低剂量暴露乐果毒性进行评价。血液和尿液中大量代谢物如L-酪氨酸、乙嘧硫磷(DMTP)、二甲基二硫代磷酸酯(DMDTP)、柠檬酸、尿酸和辛二酸的明显变化表明长期低剂量的乐果暴露会影响脂质、葡萄糖、脂肪酸等代谢,并损害肝功能、抗氧化和神经系统。在所有生物标记物中,DMTP和DMDTP可被看作早期、灵敏的乐果暴露生物标记物。Hao等[30]应用基于UPLC-MS的代谢组学方法研究乙酰甲胺磷给药后24周尿液中代谢物的变化,与其他生物标记物相比,尿液中乙嘧硫磷出现时间较早、上升幅度最大,可认为是乙酰甲胺磷早期暴露、敏感的生物标记物。日本大阪法医实验室开展了甲基苯丙胺急性中毒大鼠的尿液和血浆代谢组学研究,认为代谢组学研究不仅可以揭示毒性作用机制,而且无需检测到药物就可确定中毒[31]。Shima等[32]采用基于质谱的代谢组学技术研究甲基苯丙胺的急性毒性作用。5-氧脯氨酸、葡萄糖二酸、尿嘧啶、3-羟基丁酸酯、脂肪酸、葡萄糖、6-磷酸葡萄糖、果糖、1,6-二磷酸盐和三羧酸循环中间体例如延胡索酸盐很可能是甲基苯丙胺诱导中毒的生物标记物。减少的三羧酸循环中间体、3-羟基丁酸酯以及增加的葡萄糖表明高剂量的甲基苯丙胺抑制了经三羧酸循环的糖酵解、氧化磷酸化以及脂肪酸的β-氧化作用。Dudka[33]等利用NMR对389名砷、镉和铅职业暴露的健康熔炉工人血清代谢组学进行研究。代谢轮廓分析表明,这些工人体内能量代谢平衡受到干扰,脂蛋白、不饱和脂质和氨基酸水平的变化表明脂质代谢和氨基酸代谢受到干扰。国内受国家自然科学基金资助的温州医科大学Deng[34]研究硫化氢慢性中毒的血清代谢组学,认为代谢组学方法可能为慢性硫化氢中毒提供新的检测手段;司法部司法鉴定科学技术研究所严慧运用基于GC-MS和LC-MS/MS的血浆代谢组学、多元统计分析阐述了溴鼠灵中毒后的血浆代谢轮廓变化并筛选出与溴鼠灵毒性相关的血浆生物标志物。构建多剂量溴鼠灵中毒模型后发现溴鼠灵毒性显示出剂量-依赖效应。溴鼠灵可能是通过干扰氨基酸分解代谢、糖酵解、线粒体氧化代谢、脂肪酸氧化发挥其毒性作用。
差异蛋白组学是从整体水平研究蛋白质组在外界刺激过程中(疾病或中毒等)的变化规律。通过比较毒药物刺激后体内蛋白的变化,可寻找反映中毒本质特征的蛋白标志物即“毒性靶标”,挖掘毒物性质、剂量、入体时间等深层信息,诠释其作用方式和致毒机制。目前蛋白质组学研究多见于疾病的预防和治疗,法医毒物学领域仅见西班牙圣保罗大学药学院开展了氧化应激相关蛋白研究,揭示可卡因诱导神经毒性和神经元退变机制[35];东京医科齿科大学研究了甲基苯丙胺对小鼠心房心肌细胞的自噬-溶酶体和泛素-蛋白酶体体系作用效应[36];复旦大学法医系开展了甲醇中毒后大鼠视网膜的蛋白组分析[37];司法部司法鉴定科学技术研究所研究了中华眼镜蛇毒、五步蛇毒、金环蛇毒和银环蛇毒的蛋白质组成特点,观察了四种蛇毒在生物体内引起的血清和组织内源蛋白质表达差异。在对差异蛋白IPA分析的基础上获悉了蛇毒引起的生物学变化,并从中筛出了蛇毒中毒的血清生物标志物和组织生物标志物。
3 展望
基于组学技术的系统毒理学呈现蓬勃发展的态势,基因组学、蛋白质组学和代谢组学在机理阐述方面已经显示出较大的优势,但作为前沿科学技术,还存在着很多亟待突破的技术难题[2,35],主要包括:一是组学技术尚没有形成统一标准。实验室一般根据自己的特点开发利用自己感兴趣的相关组群,这些技术的所有权限制了实验室间的交流与合作,也不可避免地造成某些结果不能被重复,被验证。同时作为一类新的检测指标或生物标志物,其敏感性和特异性的判断尚缺少金标准,因此对实验结果的解释和运用尤应谨慎。二是缺乏组学数据库和有效的分析工具。三是多种组学技术的联用尚未实现。基因组学、蛋白质组学、代谢组学均属系统毒理学的重要组成部分,通过现单一组学技术所获数据和结果仅能在反映某一层面上的生物信息,而多组学数据整合和集成分析才能更全面、系统地了解整个生命活动规律,才能够实现将数据转化成知识[38]。此外,由于多年来对复杂生物学的有限认识,充分发挥潜力的组学数据集成尚需时间。即便如此,系统毒理学仍然代表了未来的发展方向。
目前法医毒物组学技术尚处于起步阶段,运用组学技术构建法医毒物学的研究和鉴定体系尚有距离,应用价值尚为有限。纵观国内外法医毒物学领域的研究特点,值得我们关注和反思。一是国际上更注重应用性研究,如运用毒物基因组学技术解决基因多态性与毒性效应多样性的问题,已在鉴定实践中发挥了重要作用,而对于偏重于探索研究的蛋白组学和代谢组学研究较为少见。二是国际上更注重人群研究,如研究对象主要是人群或来源于案件对象的积累,研究结果具有可应用性和可推广性,而国内大部分研究的实验对象为动物,由于种属差异其结果仅有参考价值或没有实践价值。当然,法医组学作为前沿研究手段需要发展的时间和空间,关联、整合代谢组学、基因组学、蛋白质组学的信息,给出科学的解释是法医毒物学面临的机遇与挑战。不可否认的是,传统的毒物代谢动力学研究和死后毒物学研究,包括毒物的体内过程(吸收、分布、代谢、排泄)、死后变化、死后生成等,在法医毒物毒性研究中仍然占有重要的地位。
[1]王先良,徐顺清.系统毒理学及其应用[J].生态毒理学报,2006,(4):289-294.
[2]李杰,李柯佳,张臣,等.计算系统毒理学:形成、发展及应用[J].科学通报,2015,60(19):1751-1760.
[3]楼宜嘉.基于系统生物学的药物毒理学研究进展[J].中国药理学与毒理学杂志,2012,26(4):476-481.
[4]张天宝.毒物基因组学的研究现状和对毒理学今后发展的影响[J].毒理学杂志,2005,19(2):83-88.
[5]Waters M,Boorall G,Bushel P,et al.Toxicogenomics and Systems Toxicology:Aims and Prospects[J].Nature Review Genetics,2004,5:936-948.
[6]Heijne W H,Kienhuis A S,Van Ommen B,et al.Systems Toxicology:ApplicationofToxicogenomics,Transcriptomics,Proteomics and Metabolomics in Toxicology[J].Expert Review of Proteomics,2005,2:767-780.
[7]张伟.定量蛋白质组学质谱采集技术进展[J].分析化学,2014,42(12):1859-1868.
[8]Roux A,Lison D,Junot C,et al.Applications of Liquid Chromatography Coupled to Mass Spectrometry-Based Metabolomics in Clinical Chemistry and Toxicology:A Review[J].Clinical Biochemistry,2011,44:119-135.
[9]王中钰,陈景文,乔显亮,等.面向化学品风险评价的计算(预测)毒理学[J].中国科学:化学,2016,46(2):222-240.
[10]朱永亮,叶祖光.计算毒理学与中药毒性预测的研究进展[J].中国新药杂志,2011,20(24):2424-2429.
[11]唐才明,金佳滨,彭先芝.环境污染物计算毒理学分析及环境行为模拟研究进展[J].环境监控与预警,2016,8(2): 1-9.
[12]吴明健,王玫,杨瑞琴,等.代谢组学及其在法医毒理学中的应用[J].中国法医学杂志,2013,28(1):37-40.
[13]严慧,沈敏.代谢组学在法医毒理学的应用进展[J].法医学杂志,2015,(3):219-226.
[14]Musshoff A F,Stamer U M,Madea B.Pharmacogenetics and Forensic Toxicology[J].Forensic Sci Int,2010,203: 53-62.
[15]施妍.法医毒理学中药物代谢与中国汉族人群CYP基因多态性的关联分析[D].上海:复旦大学基础医学院,2013.
[16]Jannetto P J,Wong S H,Gock S B,et al.Pharmacogenomics as Molecular Autopsy for Postmortem Forensic Toxicology:Genotyping Cytochrome P450 2D6 for Oxycodone Cases[J].J Anal Toxicol,2002,26(7):438-447.
[17]Jin M,Gock S B,Jannetto P J,et al.Pharmacogenomics as Molecular Autopsy for Forensic Toxicology:Genotyping Cytochrome P450 3A4*1B and 3A5*3 for 25 Fentanyl Cases[J].J Anal Toxicol,2005,29(7):590-598.
[18]Zackrisson A L,Holmgren P,Gladh A B,et al.Fatal Intoxication Cases:Cytochrome P450 2D6 and 2C19 Genotype Distributions[J].Eur J Clin Pharmacol,2004,60(8): 547-552.
[19]Levo A,Koski A,Ojanperä I,et al.Post-Mortem SNP Analysis of CYP2D6 Gene Reveals Correlation between Genotype and Opioid Drug(Tramadol)Metabolite Ratios in Blood[J].Forensic Sci Int,2003,135(1):9-15.
[20]Koski A,Sistonen J,Ojanperä I,et al.CYP2D6 and CYP2C19 Genotypes and Amitriptyline Metabolite Ratios in a Series of Medicolegal Autopsies[J].Forensic Sci Int,2006,158(2-3):177-183.
[21]Shen M,Shi Y,Xiang P.CYP3A4 and CYP2C19 Genetic Polymorphisms and Zolpidem Metabolism in the Chinese Han Population:A Pilot Study[J].Forensic Sci Int,2013,(227):77-81.
[22]Holm N B,Nielsen L M,Linnet K.CYP3A4 Mediates Oxidative Metabolism of the Synthetic Cannabinoid AKB-48[J].AAPS J,2015,17(5):1237-1245.
[23]Vevelstad M,Øiestad E L,Bremer S,et al.Is Toxicity of PMMA (paramethoxymethamphetamine)Associated withCytochrome P450 Pharmacogenetics?[J].Forensic Sci Int,2016,261:137-147.
[24]Haufroid V,Hantson Philippe.CYP2D6 Genetic Polymorphisms and Their Relevance for Poisoning Due to Amfetamines,Opioid Analgesics and Antidepressants[J].Clinical Toxicology,2015,53:501-510.
[25]Gasche Y.Codeine Intoxication Associated with Ultrarapid CYP2D6 Metabolism[J].N Engl J Med,2004,351(27): 2827-2831.
[26]Jornil J.A Poor Metabolier of Both CYP2C19 and CYP2D6 Identified by Mechanistic Pharmacokinetic Simulation in a Fatal Drug Poisoning Case Involving Venlafaxine[J].Forensic Sci Int,2013,226:26-31.
[27]Zheng T,Liu L,Aa J,et al.Metabolic Phenotype of Rats ExposedtoHeroinandPotentialMarkersofHeroin Abuse[J].Drug Alcohol Depend,2013,127(1-3):177-186.
[28]Yang S,Salmeron B J,Ross T J,et al.Lower Glutamate Levels in Rostral Anterior Cingulate of Chronic Cocaine Users-A1H-MRS Study Using TE-Averaged PRESS at 3T with an Optimized Quantification Strategystrategy[J].Psychiatry Res,2009,174(3):171-176.
[29]Feng Z,Sun X,Yang J,et al.Metabonomics Analysis of Urine and Plasma from Rats Given Long-Term and Low-Dose Dimethoate by Ultra-Performance Liquid Chromatography-Mass Spectrometry[J].Chem Biol Interact,2012,199(3):143-153.
[30]Hao D F,Xu W,Wang H,et al.Metabolomic Analysis of the Toxic Effect of Chronic Low-Dose Exposure to A-cephate on Rats Using Ultra-Performance Liquid Chromatography-Mass Spectrometry[J].Ecotoxicol Environ Saf,2012,83:25-33.
[31]Shima N,Miyawaki I,Bando K,et al.Influences of Methamphetamine-Induced Acute Intoxication on Urinary and Plasma Metabolic Profiles in the Rat[J].Toxicology,2011,287:29-37.
[32]Shima N,Miyawaki I,Bando K,et al.Influences of Methamphetamine-Induced Acute Intoxication on Urinary and Plasma Metabolic Profiles in the Rat[J].Toxicology,2011,287(1-3):29-37.
[33]Dudka I,Kossowska B,Senhadri H,et al.Metabonomic Analysis of Serum of Workers Occupationally Exposed to Arsenic,Cadmium and Lead for Biomarker Research:A Prelim inary Study[J].Environ Int,2014,68:71-81.
[34]Deng M,Zhang M,Huang X,et al.A Gas Chromatography-Mass Spectrometry Based Study on Serum Metabolomics in Rats Chronically Poisoned with Hydrogen Sulfide[J].J Forensic Leg Med,2015,(32):59-63.
[35]Vicente-Rodríguez M,Gramage E,Herradón G,et al. Phosphoproteomic Analysis of the Striatum from Pleiotrophin Knockout and Midkine Knockout Mice Treated with Cocaine Reveals Regulation of Oxidative Stress-Related Proteins Potentially Underlying Cocaine-Induced Neurotoxicity and Neurodegeneration[J].Toxicology,2013,314:166-173.
[36]Funakoshi-Hirose I,Aki T,Unuma K,et al.Distinct Effects of Methamphetamine on Autophagy-Lysosome and U-biquitin-Proteasome Systems in HL-1 Cultured Mouse A-trial Cardiomyocytes[J].Toxicology,2013,312:74-82.
[37]Chen J,Zhu G,Xia W,et al.Proteomic Analysis of Rat Retina after Methanol Intoxication[J].Toxicology,2012,293: 89-96.
[38]颜贤忠,孙博,杜祥博.代谢组学技术在毒理学研究中的应用进展[J].国际药学研究杂志,2014,41(4):379-393.
(本文编辑:卓先义)
Systems Toxicology-Opportunity and Challenge for Forensic Toxicology
SHEN Min,YAN Hui,SHI Yan,XIANG Ping
(Shanghai Key Laboratory of Forensic Medicine,Shanghai Forensic Service Platform,Institute of Forensic Science,Ministry of Justice,Shanghai 200063,China)
With the development of new technology in life science,based on genomics,proteomics,metabolomics and other techniques,systems toxicology has come into being,providing a new research platform for forensic toxicology and presenting fundamental changes in research idea and approach.This paper mainly reviews applications of omics technology in forensic toxicology,as well as key issues such as method standardization,omics database and integration of multi-omics information. The forensic toxicology studies should pay more attention to population study and application value.Systems toxicology is a promising tool to explore the relationship between gene polymorphisms of metabolic enzyme and poison metabolism,clarify toxic effect and mechanism of toxicants,discover poisoning related biomarkers,and determine dose threshold of poisons.It raises opportunities and challenges for forensic toxicology.
forensic toxicology;systems toxicology;omics;genomics;proteomics;metabolomics
DF795.4
Adoi:10.3969/j.issn.1671-2072.2016.05.010
1671-2072-(2016)05-0057-09
2016-07-15
上海市科技攻关项目(15DZ1207500);上海市法医学重点实验室资助项目(14DZ2270800);上海市司法鉴定专业技术服务平台资助项目(16DZ2290900)
沈敏(1955—),女,研究员,博士研究生导师,主要从事法医毒物鉴定研究和司法鉴定管理工作。
E-mail:shenm@ssfjd.cn。
