亲水作用色谱—四极杆/静电场轨道阱高分辨率质谱快速测定水样中氨基脲
2016-10-21谢冬冬沈金灿淮文蓓卞学海��叶刚康海宁
谢冬冬 沈金灿 淮文蓓 卞学海��叶刚 康海宁
摘要建立了亲水作用色谱四极杆/静电场轨道阱高分辨质谱快速检测水中氨基脲的方法。水样中加入0.1 mol/L NaOH溶液后,以乙腈为提取剂,加入过量Na2SO4,使乙腈与水分层,乙腈提取液再经无水Na2SO4脱水后,采用亲水作用色谱柱Amide色谱柱分离,以0.1%甲酸水溶液及0.1%甲酸乙腈溶液为流动相进行梯度洗脱,四极杆/静电场轨道阱高分辨率质谱电喷雾正离子、选择离子监测模式检测,同位素内标法进行定量分析。在最优实验条件下,氨基脲在 0.2~20 μg/L浓度范围内线性相关系数为0.997,方法的检出限为0.09 μg/L,定量限为0.30 μg/L。以淡水和海水为空白样品,在添加浓度为0.5, 1.0和5.0 μg/kg水平下,氨基脲的加标回收率为 82.3%~92.0% ,相对标准偏差小于7.6%。本方法适用于环境水样中氨基脲的快速分析。
关键词 亲水作用色谱; 高分辨质谱; 水样; 氨基脲
1引言
氨基脲(Semicarbazide,SEM)属于联胺类化合物中的一种,它是一种重要的工业原料,可用于制备热敏记录纸上的光色染料,也用于医药、农药等有机合成的中间体[1]。研究表明, 它不仅具有致诱变性和潜在的致癌性,而且还可对神经系统、内分泌系统的功能产生影响[2,3]。在日常生产活动中多种因素容易导致SEM的产生,如某些含SEM工业废水的排放,食品添加剂偶氮甲酰胺在高温加工条件下分解产生SEM[4,5],消毒水处理食物产生SEM[6,7],水产养殖业中非法使用呋喃西林药物在动物体内也可代谢成为SEM[8,9]。由于SEM为水溶性物质,各种途径产生的SEM最终随着环境进入水体,SEM已逐渐成为环境中一种全新的环境污染物[10]。目前,检测SEM的主要方法有胶体金免疫层析法[11]、酶联免疫分析法[12]、高效液相色谱/串联质谱法[8,13,14]等。胶体金免疫层析法和酶联免疫法通常用于样品的快速筛选,方法易受样品基质中类似物质干扰而产生假阳性;最为常用的分析方法为高效液相色谱/串联质谱法,检测的样品基质包括动物组织、婴幼儿食品、甲壳类水产品等。由于SEM分子小、极性强,难以直接进行分析,因此目前所报道的方法通常是先将样品经过2硝基苯甲醛长时间衍生、衍生液经有机溶剂提取、固相萃取柱净化后,再通过反相液相色谱柱分离SEM衍生物,最后以电喷雾质谱进行检测。该方法灵敏度高,能对样品进行确证检测,但也存在样品前处理十分繁琐、耗时长的缺点。由于SEM极性很强,在常规的反相色谱柱上没有保留,质谱检测时受基质背景干扰严重,因此难以采用液相色谱电喷雾质谱方法直接对SEM进行检测。
亲水作用色谱技术[15,16]是近年来发展起来的新的分离手段,可以保留一些用反相色谱无法简单保留的碱性化合物,因此可以在不衍生的条件下实现对强极性分子SEM与其它物质的分离。四极杆/静电场轨道阱是一种高分辨质谱技术,能够提供化合物精确分子质量测定, 实现化合物的快速定性与定量分析[17],非常适于復杂基质中化合物的快速分析,已广泛应用于蛋白质组学、代谢组学和食品安全领域中小分子和大分子的快速测定[18~20]。采用亲水作用色谱高分辨质谱技术直接对SEM进行测定尚未见报道。本研究通过采用亲水作用色谱技术,并结合四极杆/静电场轨道阱高分辨率质谱技术,建立了一种环境水样中SEM的灵敏检测方法,适用于环境水样中痕量SEM污染物的快速分析。
2实验部分
2.1仪器与试剂
QExactive四极杆/静电场轨道阱高分辨质谱仪(美国 Thermo Fisher 公司),Dionex UltiMate 3000液相色谱(美国 Thermo Fisher 公司);XBrige Amide液相色谱柱(150 mm×2.1 mm,3.5 μm,美国Waters公司)。
氨基脲盐酸盐和13C15N标记的氨基脲同位素标准品(纯度≥99%, 德国Dr. Ehrenstorfer 公司);甲醇、乙腈(色谱纯,Merck公司);甲酸(分析纯,天津市大茂化学试剂厂);无水Na2SO4 (分析纯,天津市科密欧化学试剂有限公司);NaH2PO4(分析纯,天津市福晨化学试剂厂);实验用水由MilliQ 纯水仪制备。
2.2标准溶液的配制
SEM标准储备液配制:准确称取2.0 mg SEM盐酸盐标准品,用甲醇溶解并定容至10 mL棕色容量瓶中,即得200 mg/L的标准储备液,
Symbolm@@ 18℃保存。SEM同位素内标储备液配制:准确称取2.0 mg SEM同位素内标标准品,用甲醇溶解并定容至10 mL棕色容量瓶中,即得200 mg/L 内标标准储备液, Symbolm@@ 18℃保存。用乙腈逐级稀释SEM与其同位素标准品,获得所需浓度标准溶液。
2.3实验方法
样品处理:取2.0 mL水样,加入40 μL 5.0 mol/L NaOH溶液使其浓度为0.1 mol/L,溶解混匀后加入适量SEM同位素内标溶液使其浓度为5 μg/L,再往混合溶液中加入1.0 mL乙腈,漩涡振荡2 min,然后加入1.0 g无水Na2SO4,振荡提取10 min,然后以10000 r/min离心5min,取上层清液至15 mL离心管中,再加入0.2 g无水Na2SO4脱水,取上层清液于进样瓶中待测。
2.4色谱串联质谱分析条件
色谱柱:Waters XBridgeTM Amide 色谱柱(150 mm×2.1 mm, 3.5 μm);柱温:30 ℃; 流速:250 μL/min; 流动相:A为0.1% (V/V)甲酸溶液,B为0.1%(V/V)甲酸乙腈溶液; 进样量:20 μL; 分析时间:12 min。梯度洗脱条件为: 0~5 min,20%~40% A; 5~6 min,40% A; 6~6.5 min,40%~20% A; 6.5~12 min,20% A。
电喷雾离子源; 离子源温度: 320℃; 传输金属毛细管温度: 350℃; 喷雾电压: 3500 V; 扫描模式为: TaegetedSIM,采用正离子扫描模式; 质谱分辨率为70000; Ctrap 最大容量(AGC target) : 5×104; Ctrap最大注入时间: 100 ms; 鞘气35 unit,辅助气10 unit,扫描分析时间为12 min。SEM的精确质量数76.05054,13C15NSEM(同位素标准品)的精确质量数为79.04871。
3结果与分析
3.1色谱分离
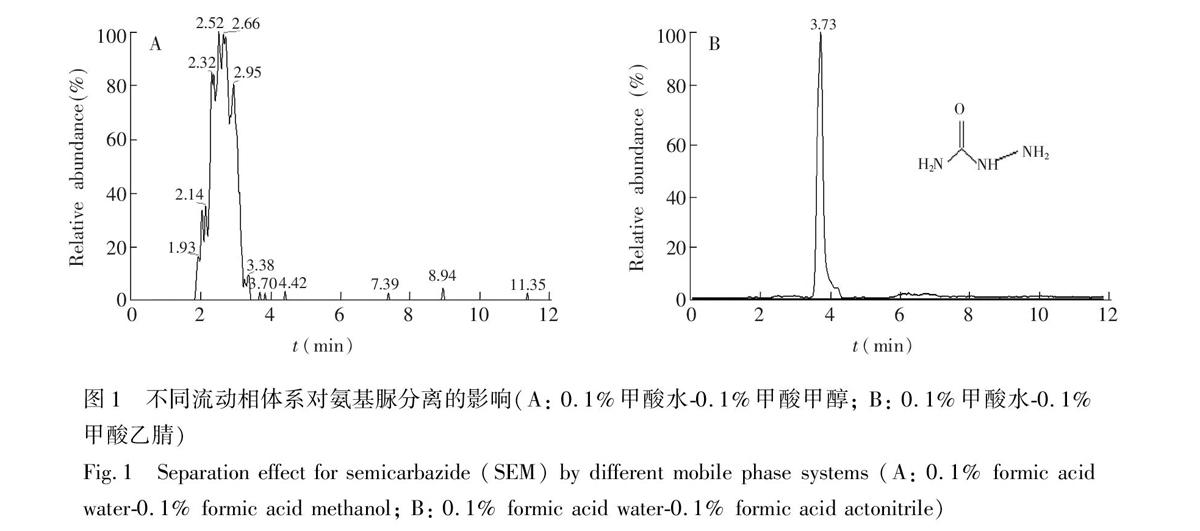
SEM分子上带有多个氨基(图1插图),极性强,实验发现采用常规反相色谱柱(C18)进行分离,化合物完全没有保留。近年来发展的亲水相互作用液相色谱技术被认为是对传统反相色谱方法的有效補充[15,16],它集成了反相液相色谱、正相液相色谱和离子色谱的优点,特别适合于极性化合物的分离分析。为此,实验选择Amide色谱柱(氨基柱)作为分离柱,通过优化条件其对SEM有较好的保留。
流动相的pH值及组成对化合物能否在色谱柱上得到有效分离至关重要。实验表明,在中性条件下,SEM未能在色谱柱上得到有效保留。由于SEM上带有氨基,其在酸性条件下能够质子化,这有利于其在氨基柱上的保留,因此采用含有0.1%甲酸的水相及有机相作为流动相。在保持同样的梯度洗脱条件下,实验比较了甲醇和乙腈两种不同有机相组成对SEM分离的影响(图1)。如图1A所示,以甲醇作为有机相,化合物保留较弱,峰型差,质谱响应信号弱; 相对于甲醇,采用乙腈流动相(图1B),化合物保留得到显著增强,保留时间由原来的2.5 min增加到3.7 min,并且峰形得到明显改善,其质谱信号也相应得到明显提高,信号强度是甲醇的46倍。因此,本实验采用0.1%甲酸(A)0.1%甲酸/乙腈(B)作为流动相体系。
3.2质谱检测条件的优化
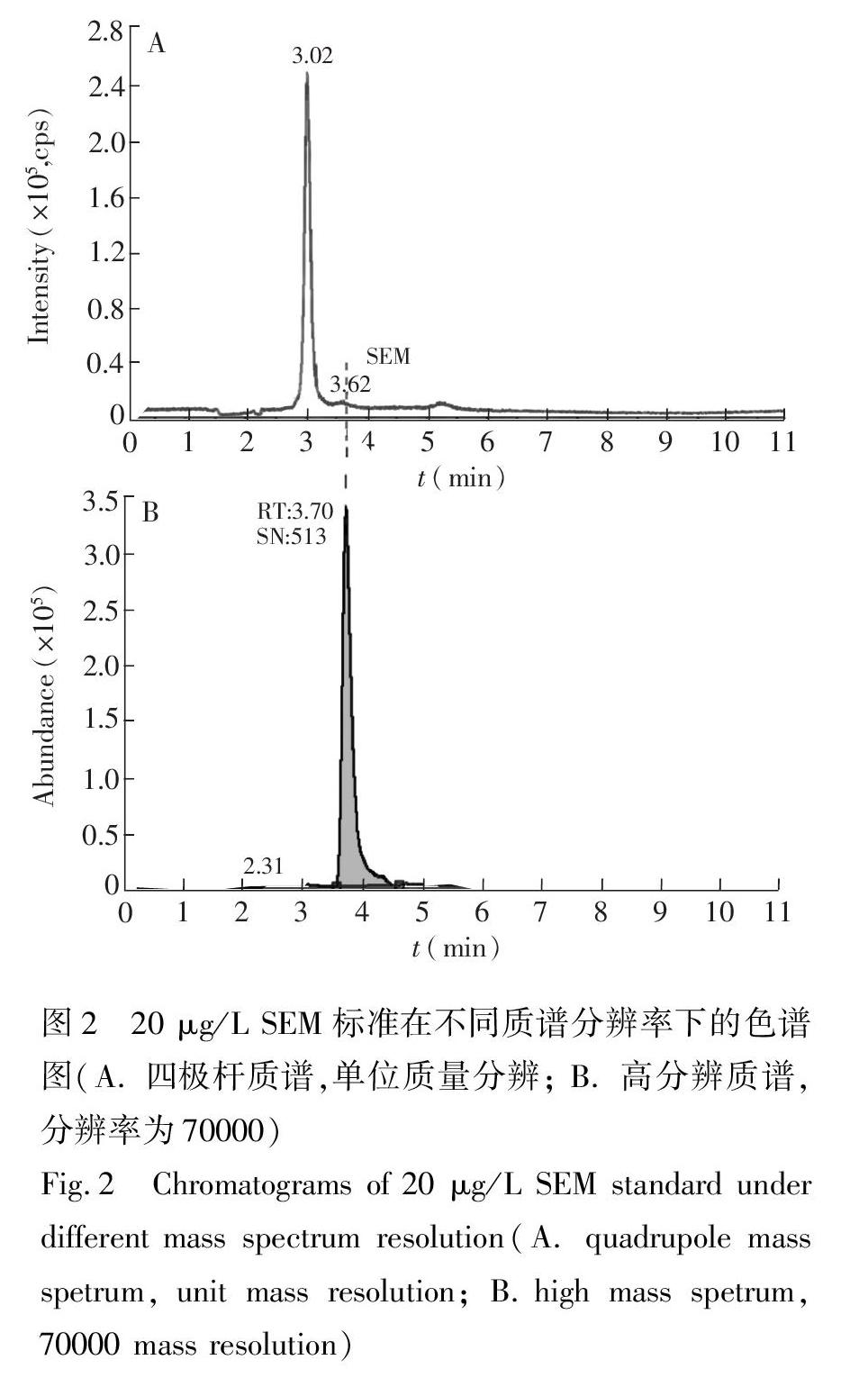
由于SEM分子上带有多个氨基,在酸性条件下极容易质子化而带上正电荷,因此采用正离子模式进行检测。SEM分子小(分子量为75),实验发现采用目前常用的选择离子监测(MRM)模式进行检测,在低于10 μg/L时均无法到明显的质谱信号,这可能是由于其本身分子体积小碰撞后难以获得高丰度的碎片,故灵敏度差。由于环境水样中的SEM含量低 [10],通常在μg/L水平,
因此采用该方法无法实现对环境水样的有效监测。采用质谱的选择离子监测(SIM)模式,由于低质量端的干扰物质较多,因此采用低分辨质谱进行检测,其背景响应值高,信噪比低,检测的灵敏度差; 而通过提高质谱的分辨率,可以有效较少其它化合物的干扰,降低背景的信号值,从而提高目标物质的信噪比。如图2A所示,采用低分辨率的四极杆质谱进行检测,在同等液相条件下,即使在20 μg/L浓度下,在SEM出峰位置(3.7 min)检测不到明显的信号,但是在其出峰位置附近(保留时间3.0 min)有一个很大的干扰峰,该干扰峰在空白溶剂样品中也存在,由此可知,采用低分辨质谱不仅灵敏度低,而且无法排除干扰容易造成误判; 从图2B可见,通过采用四极杆/静电场轨道阱高分辨率质谱(质谱分辨率为70000), 3.0 min处的干扰峰消失了,并且基线水平由104降低至102水平,从而大大提升了信噪比,其信噪比达513,实现了SEM的高灵敏检测。故本实验采用四极杆/静电场轨道阱高分辨质谱(分辨率70000),实现了对SEM的灵敏检测。
3.3样品前处理条件的选择
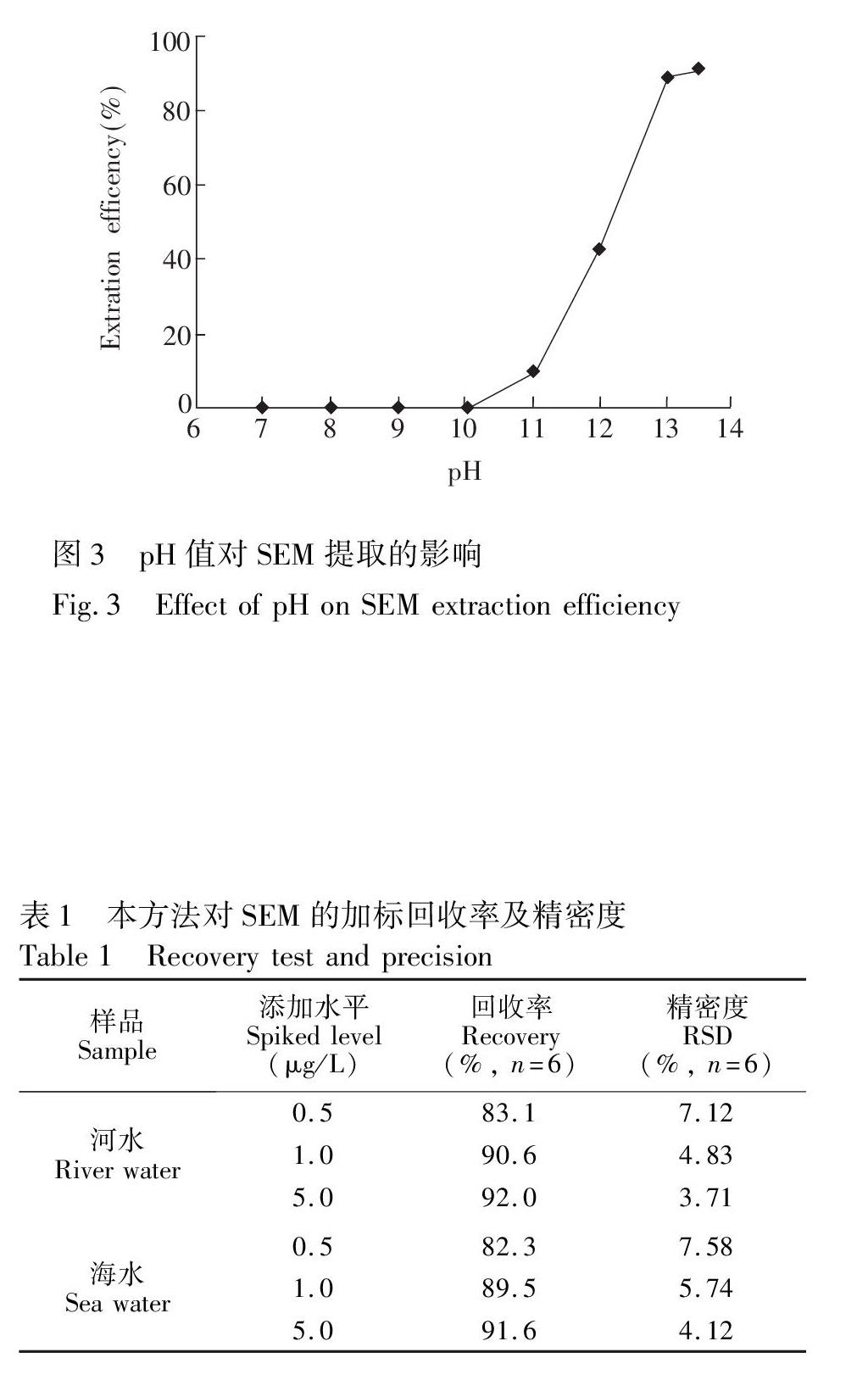
根据3.1节结果,在乙腈溶液中,SEM能够得到较好的分离与检测,因此选择乙腈作为提取剂。SEM的pKa=10.8,在碱性条件下,可以抑制分子上的氨基质子化,使其极性变弱,从而有利于被有机溶液萃取。实验采用0.2 mol/L磷酸盐缓冲溶液,以NaOH为pH值调节剂,考察pH(6~13)对SEM提取的影响。由图3可见,pH<11时,SEM基本不能被乙腈提取(提取效率<10%),随着pH值增加,提取效率快速增长,pH>13后,提取率趋于稳定。SEM为酰胺类物质,溶液碱性太强,会导致其水解。因此实验最终确定通过在样品中加入NaOH溶液,并使其浓度为0.1 mol/L(pH≈13),使SEM能被乙腈有效提取。
亲水作用色谱分离体系对于样品溶液的含水量非常敏感[21],少量水即可导致色谱峰型变差,影响样品的分离。对于乙腈提取液虽然已经通过盐析作用使乙腈层与水层得到分离,但提取液中依然含有少量水,因此需要在提取液中再加入少量无水Na2SO4进行二次脱水,以避免水分对分离的影响。
3.4工作曲线及检出限
在最佳测定条件下测定系列SEM的标准溶液, 其浓度分别为0, 0.2, 0.5, 1.0, 2.0, 5.0, 10.0和20.0 μg/L,用同位素内标法进行定量,以定量离子的峰面积与同位素内标的峰峰面积(y)对含量(x) 进行线性回归计算,结果表明在0.2~20.0 μg/kg范围内线性关系良好,线性方程为y=0.07312x+0.007655(R2=0.997),以3倍信噪比(S/N=3)作为方法的检出限(LOD)、10倍信噪比(S/N=10)作为方法的定量限(LOQ),测得SEM的LOD为0.09 μg/L、LOQ为0.30 μg/L。
以阴性淡水和海水为空白样,添加水平分别为0.5, 1.0和5.0 μg/L,每个添加水平平行测定6个样品,进行回收率和相对标准偏差测试,结果如表1所示。方法的回收率为82.3%~92.0%, RSD<7.6%。林黎明等[8]采用衍生法结合固相萃取高效液相色谱串联质谱技术测定动物组织中呋喃西林代谢物SEM,样品需经过衍生16 h,其检出限为0.5 μg/kg, 回收率为78.9%~85.1%。 本方法的回收率与其相当,但灵敏度更高,且分析时间短(约1 h),可以满足环境水样的快速、准确测定的要求。
3.5实际水样SEM的测定
采集深圳地区不同位置的3份海水样品及3份河流水样运用本方法进行检测,在其中1份河水样品检测出SEM含量0.81 μg/L,海水样品中未检出SEM。
4结 论
采用亲水作用液相色谱四极杆/轨道阱高分辨质谱技术,结合同位素质谱定量技术,建立了快速测定水样中痕量SEM污染物的新方法。与目前所报道的高效液相色谱/串联质谱法相比,本方法更为快速、简便,可满足环境中水中痕量SEM的污染分析。
References
1YANG JiChun, WU Qiao, FAN YuJie, LI XueJian, LIU ChangLing. Agrochemicals, 2010, 49(11): 781-786
杨吉春, 吴 峤, 范玉杰, 李学建, 刘长令. 农药, 2010, 49(11): 781-786
2Choudhary G, Hansen H. Chemosphere, 1998, 37(5): 801-843
3GAO Su, RU ShaoGuo. Research of Environmental Sciences, 2013, 26(6): 637-644
高 素, 汝少國. 环境科学研究, 2013, 26(6): 637-644
4Adam B, Benjamin PY L, David L, Stephen W S. J. Agric. Food Chem., 2004, 52 (18): 5730-5734
5Ye J, Wang X H, Sang Y X, Liu Q. J. Agric. Food Chem., 2011, 59 (17): 9313-9318
6Hoenicke K, Gatermann R, Hartig L. Food Addit. Contam., 2004, 21(6): 526-537
7SHEN JinCan, XIE DongDong, KANG HaiNing, ZHENG ZongKun, ZHAO FengJuan, WANG ZhiWei. Chinese J. Food. Sci., 2015, 10(36): 1-5
沈金灿, 谢冬冬, 康海宁, 郑宗坤, 赵凤娟, 王之维. 食品科学, 2015, 10(36): 1-5
8LIN LiMing , LIN HuiChun, LIU XinTong, WANG ManXia, ZHANG HongWei, WANG JianHua, QIU Fang. Chinese J. Anal. Chem., 2005, 33(5): 707-710
林黎明, 林回春, 刘心同, 王曼霞, 张鸿伟, 王建华, 邱 芳. 分析化学, 2005, 33(5): 707-710
9Kevin M C, Jeanne V S, Laura P, Christopher T E D. Glenn K. Anal. Chim. Acta, 2007, 592(1): 64-71
10XU YingJie, SUN YuZeng, SONG XiuKai, TIAN XiuHui, GONG XiangHong, ZHANG XiuZheng, ZHANG LiMing. Oceanologia Et Limnologia Sinica, 2010, 14(4): 538-542
徐英江, 孙玉增, 宋秀凯, 田秀慧, 宫向红, 张秀珍, 张利民. 海洋与湖沼, 2010, 14(4): 538-542
11XIANG JunJian, WANG WuZhou, TANG Yong, YANG HongYu. Chinese J. Food. Sci., 2009, 30(20): 291-295
向军俭, 王五洲, 唐 勇, 杨红宇. 食品科学, 2009, 30(20): 291-295
12Vass M, Diblikova I, Cernoch I, Franek M. Anal. Chim. Acta, 2008, 608(1): 86-94
13Souza S V C, Junqueira R G, Ginn R. J. Chromatogr. A, 2005, 1077(2) : 151-158
14YU HongJuan, LI Bing, CAI YouQiong, YE FangTing, TAI JianMing, HUI YunHua, XU Jie, FENG Bing. Chinese J. Anal. Chem., 2012, 40(10): 1530-1535
于慧娟, 李 冰, 蔡友琼, 叶芳挺, 台建明, 惠芸华, 徐 捷, 冯 兵. 分析化学, 2012, 40(10): 1530-1535
15WANG Lian, YANG BiXia, ZHANG XinShen, ZHENG HongGuo, RAN LiangJi. Chinese J. Anal. Chem., 2015, 43(5): 714-722
王 炼, 杨碧霞, 张新申, 郑洪国, 冉良骥. 分析化学, 2015, 43(5): 714-722
16Olsen B A. J. Chromatogr. A, 2001, 913(12): 113122
17Jia W, Chu X, Chang J, Zhang F. J. Chromatogr. A, 2015, 1406(8): 337-341
18Noelia L G, Roberto R G, Patricia P B, José LM V, Antonia G F. Food Chem., 2015, 173(4): 607-618
19Jia J, Chen Y, Jiang Y, Li Z, Zhao L, Zhang J, Tang J, Feng L, Liang C, Xu B, Gu P, Ye X. Res. Microbiol., 2015, 166(8): 618-625
20Xu M, Frelon S, Simon O, Lobinski R, Mounicou S. Talanta, 2015, 128(10): 187-195
21ZHANG Ming, TANG FangLiang, FANG XiaoKai, XU JianFen, CHEN Feng, WU ZhiXu. Chinese J. Anal. Chem., 2012, 40(10): 1555-1560
张 明, 唐访良, 范晓开, 徐建芬, 陈 峰, 吴志旭. 分析化学, 2012, 40(10): 1555-1560
