加工蔬菜中亚硝酸盐的消除技术研究进展
2016-10-21谢燕丹刘零怡楼乔明张鑫吴祖芳刘连亮
谢燕丹,刘零怡,楼乔明,张鑫,吴祖芳,刘连亮,3*
1(宁波大学 海洋学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波,315211) 2(武汉轻工大学 食品科学与工程学院,湖北 武汉,430023)
加工蔬菜中亚硝酸盐的消除技术研究进展
谢燕丹1,刘零怡2,楼乔明1,张鑫1,吴祖芳1,刘连亮1,3*
1(宁波大学 海洋学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波,315211)2(武汉轻工大学 食品科学与工程学院,湖北 武汉,430023)
加工蔬菜制品深受广大消费者的喜爱,然而降低其亚硝酸盐的含量也是目前研究关注的焦点之一。文中综述了加工蔬菜中亚硝酸盐的形成机制、亚硝峰产生规律和亚硝酸盐消除技术的最新研究进展。同时阐明了加工蔬菜中亚硝酸盐的来源和产生机理,分析了食品源抗氧化剂(抗坏血酸、柠檬酸、茶多酚、竹叶黄酮、藤茶、苹果提取物等)消除亚硝酸盐的机理和作用剂量关系,以及益生菌代谢清除亚硝酸盐和其他植物提取物消除亚硝酸盐的可能作用机制,并展望了亚硝酸盐的消除技术应用前景和发展方向。
加工蔬菜;亚硝酸盐;抗氧化剂;益生菌
蔬菜是人们生活中必不可少的食物之一,蔬菜可提供人体所必需的多种维生素、矿物质等营养物质,对刺激胃肠蠕动、消化液分泌,调节体内酸碱平衡并有效预防慢性、退行性疾病。而今各种加工蔬菜制品热销国内外,深受广大消费者的喜爱,然而亚硝酸盐的安全问题一直是消费者关注的焦点。根据GB2762—2012《食品安全国家标准 食品中污染物限量》中规定,蔬菜及其制品中亚硝酸盐(以NaNO2计)的限量为20mg/kg。亚硝酸盐的摄入过多会引发食物中毒,还会引发胃癌[1]、肾癌[2]等癌症的风险。研究表明亚硝酸盐可使血液中血红蛋白分子辅基血红素中的亚铁被氧化成三价铁,使血液失去携氧功能,引发高铁血红蛋白血症。此外,在胃肠道中,亚硝酸盐能与仲胺,叔胺,酰胺及氨基酸在酸性环境反应形成具有强致癌作用亚硝胺[1]。因此,加工蔬菜制品的亚硝酸盐检测和消除对食品安全至关重要。本文概述了加工蔬菜中亚硝酸盐的来源及添加食源性抗氧化剂、接种益生菌等消除亚硝酸盐的技术研究现状和最新进展。
1 加工蔬菜中亚硝酸盐的来源
1.1新鲜蔬菜中亚硝酸盐的来源和含量
新鲜蔬菜自身含有的硝酸盐和亚硝酸盐含量很少,主要来源于土壤中固有氮或氮肥经蔬菜吸收后以硝酸盐的形式储存,在硝酸还原酶作用下,被还原成亚硝酸盐,使得新鲜蔬菜中亚硝酸盐积累。摄入的硝酸盐约有5%~7%被舌上的硝酸还原酶还原成亚硝酸盐,硝酸盐流经肠道时由于肠道细菌具有硝酸盐还原酶活性也会被还原成亚硝酸盐[3]。新鲜蔬菜中硝酸盐和亚硝酸盐含量与蔬菜的种属、各部位等内部因素有关,也与蔬菜的采收、温度和贮藏时间等外部因素有关[4]。一般来说,蔬菜吸收过多的硝酸盐会导致硝酸盐富营养化积累,并且各部位硝酸盐和亚硝酸盐的含量,通常呈现叶柄>叶>茎>根>花序>块茎>球茎>果实>种子,此外,在24h的光周期内,光强度变化导致蔬菜中硝酸盐和亚硝酸盐含量的不同,故可在硝酸盐和亚硝酸盐在最小值时来采收蔬菜[4]。升高温度会促进硝酸还原酶还原硝酸盐形成,因此低温储藏的蔬菜亚硝酸盐含量比室温储藏时要低,而且随着贮藏时间的延长,蔬菜中亚硝酸盐含量也会增长[5]。因此,可通过改善加工工艺,调控亚硝酸盐的存在条件,适当地降低亚硝酸盐的含量。
1.2发酵蔬菜中亚硝酸盐的来源和变化规律
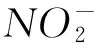
2 蔬菜中亚硝酸盐的测定方法
蔬菜中测定亚硝酸盐最经典的方法是Griess分光光度法[8],近几年也出现了光谱法、高效液相色谱法、离子色谱法、电化学法等一些新的检测方法,来检测亚硝酸盐的含量。尤其以电化学法检测方法尤为突出,具有检出限低,灵敏度高,选择性好,稳定等特点。
2.1光谱法
PADMARAJAIAH等开发了一种简单、快速、灵敏、干扰物质少,且无毒的快速分光光度计法。其原理为重氮分子与4-氨基-5-羟基萘-2,7-二磺酸单钠盐(AHNDMS)的酚基在pH7.5的磷酸盐缓冲溶液中的偶合,它们形成的紫色化合物在560nm有最大光吸收并能稳定6h[9]。此外,荧光分光光度计法,也可用于蔬菜中亚硝酸盐的检测。其原理为利用在442nm波长下AHNSA和亚硝酸盐反应产生荧光。荧光强度与0.005~0.500mg/L亚硝酸盐浓度范围呈线性关系,亚硝酸盐的检出限为2.5×10-3mg/L,此法相对误差低于6%。该方法在黄瓜,甘蓝,莴苣,番茄样品中测定亚硝酸盐的含量相对标准偏差(RSD)值分别为0.12,0.20,0.86,和0.13%之间[10]。此外,一种新型微结构聚合物光纤(MPOF)探针的荧光分光光度计法也可用于亚硝酸盐的检测。该MPOF探针是由罗丹明6G掺杂醋酸经流体涂层工艺制成,探针与硫酸溶液中的亚硝酸根淬火后,荧光强度与2.0×10-4~5.0×10-3g/mL亚硝酸盐浓度范围呈现线性关系[11]。
2.2色谱法
2.2.1高效液相色谱法
CROITORU[12]利用HPLC-UV/VIS方法开发出容易检测哺乳动物的血液,尿液和植物样品低浓度亚硝酸盐和硝酸盐含量的方法,且在蔬菜样品测定中,亚硝酸盐的检测限为369.2μg/kg。
2.2.2离子色谱法
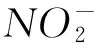
2.3电化学法
在电化学法中,经常采用电极改性的方法制得新型电化学传感器,使得测定亚硝酸盐的含量更加简便、灵敏。
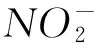
此外还可通过循环伏安法碳测定亚硝酸含量,可采用碳离子液体电极与三铁磁性纳米颗粒形成的改性电极[17]。将二氧化锆电镀在碳纳米管(多壁碳纳米管)改良金电极制作的新型电化学传感器,该氧化锆/碳纳米管复合修饰电极测定亚硝酸盐具有良好的性能[18]。CRISTIANA等人采用反转电渗透流,不需要任何缓冲剂和不进行毛细管涂布的毛细血管电泳法,能快速分析蔬菜样品中的亚硝酸盐[19]。
3 亚硝酸盐消除技术的研究进展
3.1抗坏血酸对亚硝酸盐的消除作用
抗坏血酸是一个多羟基羧酸的内酯,具有一个烯二醇基团,这一基团导致抗坏血酸具有强还原性。在酸性条件下,抗坏血酸能将亚销酸盐还原为一氧化氮,同时生成脱氢抗坏血酸;抗坏血酸的存在使亚稍酸盐可逆反应更偏向于生成CO的方向,通过竞争作用抑制亚硝化反应;当亚硝胺形成后,抗坏血酸也能与其反应,并释放出CO[20]。在模拟胃液条件下,VC清除率随质量分数增加而增加,增加到一定质量分数后清除率变化不大,VC最高的清除能力能达到(88.6 ± 1.0)%[21]。另外,研究表明,不仅L-抗坏血酸(AA)具有清除亚硝酸盐的能力,而且从枸杞水果中分离天然衍生物2-O-β-D-吡喃葡糖基-L-抗坏血酸(AA-2βG)也具有清除亚硝酸盐的能力。在低pH(pH3.0)下,AA-2βG和AA清除亚硝酸盐活性存在剂量依赖性,并从AA-2βG和AA对亚硝酸盐的EC50分别是622.69μmol/L和420.64μmol/L,可看出,AA清除亚硝酸盐的能力比AA-2βG强[22]。由此可知,抗坏血酸具有强抗氧化的能力,良好的清除亚硝酸盐的作用,但也存在在水溶液中易与空气接触从而被氧化,导致对亚硝酸盐的抑制作用减弱。因此探索蔬菜加工或发酵的工艺条件适度添加抗坏血酸,从而抑制亚硝酸盐的生成。
3.2柠檬酸对亚硝酸盐的消除作用
研究表明柠檬酸对亚硝酸根离子有显著消除作用,亚硝酸盐消除率与柠檬酸浓度呈正相关,柠檬酸对亚硝酸盐峰值的抑制趋势与抗坏血酸相似,添加量越高越明显。柠檬酸消除亚硝酸盐的2种途径:一是亚硝酸盐与柠檬酸作用生成HNO2,HNO2极不稳定,进一步分解为:3HNO2→2NO↑+HNO3+H2O。二是柠檬酸解离出的H+,使NO2-还原为NH4+反应方程式:2NO2-+16H++12e-=2NH4++4H2O,2种途径中以哪种为主需要进一步的探讨和研究[23]。
3.3益生菌对腌制食品中亚硝酸盐的影响
乳酸菌分为乳酸杆菌、乳酸球菌两类。腌制食品的制作过程中,一般都可以发现乳酸菌的存在,而且有些乳酸菌对亚硝酸盐具有降解转化能力。
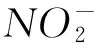
YAN[26]研究表明,6种发酵蔬菜(白菜、花椰菜、芹菜、萝卜、胡萝卜和黄瓜)达到亚硝酸盐峰值之后,分离、筛选能降解亚硝酸盐微生物菌株有285株,并通过亚硝酸盐还原反应试验检测,结果表明,21株可能会减少40%以上的亚硝酸钠;86株可能会减少50%以上的亚硝酸钠;114株可能会减少超过60%的亚硝酸钠;64株可能会减少超过90%的亚硝酸钠。 其中64株乳酸菌通过生物、化学反应和16SrRNA基因鉴定确定为植物乳杆菌、戊糖乳杆菌、肠系膜明串珠菌。由此可知,发酵蔬菜中具有降解亚硝酸盐的益生菌种属众多,降解能力参差不齐。从发酵蔬菜中筛选出高效清除亚硝酸盐、生长能力强的益生菌,应用于工业化生产中亟待解决。此外,发酵蔬菜品质的控制与益生菌消除亚硝酸盐的同步优化条件,也将是未来重点解决的问题之一。
3.4植物提取物中黄酮多酚化合物对亚硝酸盐的消除作用
植物提取物中的黄酮多酚类化合物如茶多酚、竹叶黄酮、二氢杨梅素等具有抗氧化的特性或协同效应,从而使植物提取物对亚硝盐具有积极的消除作用。
3.4.1茶多酚对亚硝酸盐的消除作用
茶多酚是茶叶中提取的一类多羟基酚类化合物的总称,主要化学成分为儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素类、酚酸及缩酚酸类、聚合酚类等化合物的复合体。其中儿茶素类化合物为茶多酚的主体成分。儿茶素类化合物主要包括儿茶素(EC)、没食子儿茶素(EGC)、儿茶素没食子酸酯(ECG)和没食子儿茶素没食子酸酯(EGCG)4种物质。儿茶素类化合物的基本结构均为 2-连(或邻)苯酚基并砒喃衍生物,这种结构中具有多个苯酚基,苯酚基易被氧化,形成醌类化合物,具有还原性,能通过氧化还原交换过程,把亚硝酸盐还原成NO从而抑制亚硝酸盐引起的亚硝化/硝化,同时生成醌类物质[27],而且对有害细菌、真菌和病毒都有杀菌作用,能直接抑制具有硝酸还原酶的细菌的生长繁殖[28]。
3.4.2竹叶提取物对亚硝酸盐的消除作用
竹叶黄酮为竹叶提取物中的主要活性成分,主要是以荭草苷、异荭草苷、牡荆苷和异牡荆苷为代表的碳苷黄酮和香豆酸、阿魏酸等。竹叶黄酮分子结构中具有数量不等的酚羟基,具有较强的还原性,同时对部分食物致病菌具有显著的抑制作用,如细菌、霉菌和酵母菌等[29]。竹叶黄酮的还原性和抑菌性,是竹叶黄酮消除蔬菜中亚硝酸盐主要原因。
3.4.3藤茶提取物对亚硝酸盐的消除作用
二氢杨梅素﹝ (2R,3R)-3,5,7-三羟基-2-(3,4,5一三羟基苯基)苯并二氢吡喃-4-酮﹞是较为特殊的一种黄酮类化合物,对DPPH自由基、ABTS自由基有强清除作用,具有强还原力,是藤茶的主要抗氧化物质之一。藤茶通过分级提取,经HPLC定量分析,乙酸乙酯相和乙醇相都含有较高的二氢杨梅素,分别为678. 5mg/g和381. 1mg/g,表明乙酸乙酯相中二氢杨梅素的含量最高,而且乙酸乙酯相提取率也是最高的。但藤茶各分级相提取物中乙醇相提取物对亚硝酸盐的清除效果最好,对亚硝酸盐的清除率和亚硝胺抑制的半抑制浓度(IC50) 分别为0. 023μg/mL和0. 029μg/mL[30]。藤茶中的二氢杨梅素是其抗氧化和抑制亚硝胺合成的主要活性物质,可以作为天然亚硝胺抑制剂的来源。
3.4.4苹果提取物对亚硝酸盐的消除作用
苹果果实主要多酚化合物包含原花青素B2、(-)-表儿茶素和绿原酸,各浓度呈绿原酸>(-)-表儿茶素﹥原花青素B2。苹果多酚清除亚硝酸盐作用是由于其与亚硝酸根离子在酸性缓冲溶液(pH值2.0)或唾液酸化条件下发生反应,反应中,亚硝酸(pKa=3.3)被多酚转化为一氧化氮(NO),一氧化氮(NO)能与原花青素B2或(-)-表儿茶素的自由基反应形成亚硝基的化合物,从而清除亚硝酸盐,多酚化合物中各成分的反应速度呈原花青素B2 >(-)-表儿茶素>绿原酸[31]。苹果多酚清除亚硝酸盐效果跟其质量分数、作用时间、不同品种等条件有一定关系。在模拟胃液条件下,苹果多酚低质量分数下(0.01%~0.02%)清除亚硝酸盐,清除率随质量分数增加呈对数曲线上升,增加到一定质量分数后清除率变化不大,在质量分数≥0.03%时,苹果多酚的清除能力最高可达(98.2 ± 1.3)%,而且苹果多酚对亚硝酸盐的清除率随作用时间延长而上升,当作用时间达到2h时清除率最高,可达(98.7 ± 0.2)%,若时间继续延长,清除率有下降趋势,研究还表明苹果多酚与VC或茶多酚的复配使用清除效果都比苹果多酚单独使用效果好[21]。对于不同品种的苹果,亚硝酸盐的清除效果又是不同的。研究表明在模拟胃液条件下,对富士苹果,黄元帅和红香蕉苹果提取苹果多酚清除亚硝酸盐的研究有以下结论,红香蕉苹果果皮和果肉的多酚含量较显著高于其他苹果;随着红苹果果肉的多酚浓度增加亚硝酸盐清除率逐步增加,在100μg/mL的浓度,清除率达到了90.9%;在100μg/mL浓度,黄元帅清除亚硝酸盐能力明显高于富士苹果,并且黄元帅果肉清除率高于果皮[32]。另外,在模拟胃环境条件下(pH2),苹果汁与亚硝酸盐反应10min,反应过程中原花青素B1,B2、B5比(+)-儿茶素、表儿茶素更容易与亚硝酸反应,苹果汁中的绿原酸的浓度轻度降低,原花青素B1,(+)-儿茶素,原花青素B2,原花青素B5,(+)-表儿茶素明显下降,亚硝酸盐浓度下降为(2.9±2.6)μm[33]。苹果多酚具有良好的清除亚硝酸盐作用,能将其作为功能成分加入蔬菜制品加工中,对调控亚硝酸盐含量也具有重要意义。
3.4.5甘蔗提取物对亚硝酸盐的消除作用
甘蔗顶部提取物中的酚类化合物对亚硝酸盐具有清除能力,其清除亚硝酸盐能力是由于酚类化合物的羟基可以抑制N-二甲基亚硝基胺的形成。在低pH时,亚硝酸盐转化为亚硝酸和N2O3,N2O3可以通过甘蔗顶部的酚类化合物被快速还原为NO,亚硝胺的形成受到抑制。甘蔗酚类化合物清除亚硝酸盐的效果与其总酚(TP)含量呈正相关,从甘蔗顶部提取物萃取到的8种酚类化合物分别是咖啡酸,顺-对羟基肉桂酸,槲皮素,芹菜素,albaninA,australoneA,桑辛素M,5′-香叶基-5,7,2′,4′-四羟基黄酮[34]。同时甘蔗渣被用于水样去除亚硝酸盐离子,在pH5,亚硝酸初始浓度5mg/L,吸附剂剂量3mg/L和接触时间90min条件下,蔗渣去除达效率90%[35]。但甘蔗顶部提取物中酚类化合物清除亚硝酸盐的构效关系,还需进一步研究。
3.4.6光果甘草提取物对亚硝酸盐的消除作用
光果甘草提取物中黄酮化合物能对亚硝酸盐有良好的清除作用,因为黄酮类是大多数氧自由基的清除剂,因而能阻断亚硝胺的合成,其清除亚硝酸盐的效果与剂量呈依赖关系。光果甘草叶提取物中主要化合物为生松素类黄酮,根提取物的主要化合物是甘草苷,而且光果甘草叶提取物中的总黄酮含量明显高于根提取物。另外,在pH2.0条件下,叶提取物的亚硝酸盐清除能力优于根提取物[36]。因此光果甘草叶提取物可作为亚硝酸盐清除剂应用于加工食品工业。
3.4.7其他植物提取物对亚硝酸盐的消除作用
除此之外,像玉米黄酮、茶黄酮等其他植物提取物对亚硝酸盐都具有一定的消除作用。采用超临界CO2技术从玉米须萃取的黄酮类化合物具有清除亚硝酸盐的作用,在pH3.0,黄酮类化合物提取浓度500μg/mL条件下,对亚硝酸盐的清除率达到(88.1 ± 3.04)%,且实验还表明亚硝酸盐的清除能力可能与提取物浓度存在依赖性,与pH值呈负相关[37]。老鹰茶中的总黄酮也能消除亚硝酸盐,从老鹰茶中提取的50%乙醇提取物,分别采用乙酸乙酯,正丁醇和水液-液分配分馏方法,对亚硝酸盐的清除率大小依次为:乙酸乙酯>正丁醇>水。各层抑制亚硝胺形成能力EC50值,分别为乙酸乙酯0.170mg/mL,正丁醇0.554mg/mL和水0.725mg/mL。根据EC50值,可知老鹰茶乙酸乙酯可溶部分可能对致癌亚硝胺的预防作用尤为明显[38]。干燥的冬瓜籽含有(81.3±1.4)μg没食子酸/g和(486.8±4.1)μg儿茶素/g的酚和类黄酮化合物。对DPPH自由基,ABTS自由基和羟基自由基的清除作用呈剂量依赖性,最大清除率分别为(79.8±0.2)%,(82.3±1.9)%和(95.5±0.8)%,在0.3~3mg/mL冬瓜籽提取物清除亚硝酸盐的效果呈浓度依赖性增加,最高清除率为73.6%[39]。天门冬块茎提取物含有(459 ±1)GAE/g和(642±4)EC/g的酚和类黄酮化合物,对亚硝酸盐清除呈剂量依赖性。天门冬对亚硝酸盐最高的清除效果为(88.6±1.5)%,对亚硝酸盐IC50值为(2.02±0.01)mg/mL[40]。乌桕叶酚类提取物具有清除亚硝酸盐的作用,乌桕叶新叶乙醇提取物(NL)和落叶乙醇提取物(FL) 分别含有(0.646±0.014)和(0.652±0.001)mg没食子酸/mg,NL和FL的IC50值分别为(128.37±9.79)μg/mL和(240.09±29.18)μg/mL,可得NL清除亚硝酸盐能力比FL强[41]。
3.5其他物质和前处理对亚硝酸盐的消除作用
大蒜对亚硝酸盐的清除能力主要是因为大蒜中的巯基化合物(CH2=CH-CH2-S-S-S-CH2-CH=CH2)与亚硝酸盐反应生成巯代亚硝酸酯类化合物,干扰细菌的酶活性从而抑制了亚硝酸盐的含量的增长。CHOI研究发现,大蒜汁能减少由胺和硝酸盐形成亚硝胺,从而减少亚硝酸盐的含量[42]。
HAO[43]研究表明,ClO2具有清除亚硝酸盐的能力,因为它能将硝酸还原酶失活并使细菌数量减少。在新鲜的生菜贮存过程中,用含有ClO2的水处理生菜可以减少亚硝酸盐或延缓峰值出现。
原花青素是花青素的前体,在酸性介质中加热均可产生花青素,在结构上,原花青素是由不同数量的儿茶素(catechin)或表儿茶素(epicatechin)结合而成。在酸性缓冲液中,荞麦粉中的原花青素能与亚硝酸盐反应,原花青素被氧化,发生硝化和亚硝化,同时生成NO,来减少亚硝酸盐的含量[44]。
白灵菇子实体和菌丝体的提取物都具有清除亚硝酸盐的能力,主要与提取物中的多酚类和黄酮类化合物有关。研究表明当用热水提取的子实体的浓度为6mg/mL,清除亚硝酸盐率为89.7%,而用乙醇提取子实体的浓度为6mg/mL,清除率则为76.1%,而分别用热水和乙醇提取的菌丝体浓度为6mg/mL,清除率分别为80.8%和70.3%,由此可知适当提高水提温度时清除亚硝酸盐的效果比乙醇提取效果好而且子实体清除亚硝酸盐的能力比菌丝体强。但是无论提取子实体还是菌丝体,提取物浓度大于9mg/mL,清除率不再提高[45]。
4 展望
加工蔬菜深受消费者喜爱,然而其中含有的亚硝酸盐是人们关注的食品安全问题热点之一。2015年10月26日世界卫生组织将加工肉制品列为致癌物,也反映出加工肉制品中亚硝酸盐的危害性。蔬菜本身就含有硝酸盐和亚硝酸盐,硝酸盐会在 “硝酸还原酶”作用下,还原成亚硝酸盐。蔬菜发酵过程中一些不利条件的影响,也会增加亚硝酸盐的含量,对人体健康有潜在的危险。因此,准确测定亚硝酸盐含量和有效消除亚硝酸盐是近几年的研究热点。亚硝酸盐测定新方法的发展日新月异,但也存在快速检测精度不高,精准检测成本较高等问题,寻求经济、快速、有效的亚硝酸盐检测技术方法显得尤为重要。
在亚硝酸盐的消除方面,可以通过贮存温度、发酵时间等条件降低亚硝酸盐的含量。此外,还可通过在加工蔬菜添加食品源抗氧化剂、植物提取物和益生菌的代谢调控等消除技术来降低亚硝酸盐的含量,使人们更加放心的食用加工蔬菜。然而,食品源抗氧化剂如抗坏血酸、柠檬酸等,植物提取物如茶多酚、竹叶黄酮等易被氧化,亚硝酸盐的抑制作用会随着加工时间的延长而减弱。因此如何控制加工蔬菜内源性抗氧化物的缓释,合理添加抗氧化剂,控制益生菌发酵条件等协同调控消除亚硝酸盐是今后的研究发展方向。
[1]BRYANANS,ALEXANDERBDD,COUGHLINCJR,etal.Ingestednitrateandnitriteandstomachcancerrisk:Anupdatedreview[J].FoodandChemicalToxicology, 2012, 50(10): 3 646-3 665.
[2]DELLAVALLECT,DANIELCR,ASCHEBROOK-KILFOYB,etal.DietaryintakeofnitrateandnitriteandriskofrenalcellcarcinomaintheNIH-AARPDietandHealthStudy[J].BritishJournalofCancer, 2013, 108(1): 205-212.
[3]CHANTYK.Vegetable-bornenitrateandnitriteandtheriskofmethaemoglobinaemia[J].Toxicologyletters, 2011, 200(1): 107-108.
[4]DUShao-ting,ZHANGYong-song,LINXian-yong.Accumulationofnitrateinvegetablesanditspossibleimplicationstohumanhealth[J].AgriculturalSciencesinChina, 2007, 6(10):1 246-1 255.
[5]SINDELARJJ,MILKOWSKIAL.Humansafetycontroversiessurroundingnitrateandnitriteinthediet[J].NitricOxide, 2012, 26(4): 259-266.
[6]HOUJun-cai,JIANGCheng-gang,LONGZhong-chen.NitritelevelofpickledvegetablesinNortheastChina[J].FoodControl, 2013, 29(1): 7-10.
[7]YANPing-mei,XUEWen-tong,TANSze-sze,etal.EffectofinoculatinglacticacidbacteriastarterculturesonthenitriteconcentrationoffermentingChinesepaocaiOriginalResearchArticle[J].FoodControl, 2008, 19(1): 50-55.
[8]张双灵,孙萍,符方映. 青岛市售冬季大棚蔬菜中亚硝酸盐、硝酸盐含量的测定及安全性评价[J]. 现代食品科技, 2012(8): 1 069-1 072.
[9]NAGARAIAP,AL-TAYARNGS,SHIVAKUMARA,etal.Asimpleandsensitivespectrophotometricmethodforthedeterminationoftraceamountsofnitriteinenvironmentalandbiologicalsamplesusing4-amino-5-hydroxynaphthalene-2,7-disulphonicacidmonosodiumsalt[J].SpectrochimicaActaPartA:MolecularandBiomolecularSpectroscopy, 2010, 75(5): 1 411-1 416.
[10]SHARIATI-RADM,IRANDOUSTM,NIAZIF.Asensitivespectrofluorimetricmethodforthedeterminationofnitriteinagriculturalsamples[J].FoodAnalyticalMethods, 2015,8(7): 1 691-1 698.
[11]LIDong-dong,WANGLi-li.Celluloseacetatepolymerfilmmodifiedmicrostructuredpolymeropticalfibertowardsanitriteopticalprobe[J].OpticsCommunications, 2010, 283(14): 2 841-2 844.
[12]CROITORUMD.NitriteandnitratecanbeaccuratelymeasuredinsamplesofvegetalandanimaloriginusinganHPLC-UV/VIStechniqueoriginalresearcharticle[J].JournalofChromatographyB, 2012, 911: 154-161.
[13]LIUWan-yi,WANGRuo-bing,CHENLi-ke,etal.Simultaneousdeterminationofnitriteandnitrateinvegetablesbyimprovedpretreatmentionchromatography[J].ChineseJournalofAnalyticalChemistry, 2013, 41(12): 1 949-1 950.
[14]RAMDANE-TERBOUCHECA,TERBOUCHEA,DJEBBARS,etal.ElectrochemicalsensorsusingmodifiedelectrodesbasedoncoppercomplexesformedwithAlgerianhumicacidmodifiedwithethylenediamineortriethylenetetraminefordeterminationofnitriteinwater[J].Talanta, 2014, 119: 214-215.
[15]ZHANGMing-ying,LIUJiang-tao,NIEFei,etal.FacilesynthesisofTiO2-functionalizedgraphenenanosheet-supportedAgcatalystanditselectrochemicaloxidationofnitrite[J].JournaloftheIranianChemicalSociety, 2015, 12(9): 1 535-1 542.
[16]SONKERPK,GANESANV.Synthesisandcharacterizationofsilvernanoparticle-anchoredamine-functionalizedmesoporoussilicaforelectrocatalyticdeterminationofnitrite[J].JournalofSolidStateElectrochemistry, 2015, 19(7): 2 107-2 115.
[17]ABSALANG,AKHONDM,BANANEJADA,etal.HighlysensitivedeterminationofnitriteusingacarbonionicliquidelectrodemodifiedwithFe3O4magneticnanoparticle[J].JournaloftheIranianChemicalSociety, 2015, 12(7): 1 293-1 301.
[18]MENGZu-chao,ZHANGJian-bin,LIQian-ding.Anitriteelectrochemicalsensorbasedonelectrodepositionofzirconiumdioxidenanoparticlesoncarbonnanotubesmodifiedelectrode[J].JournaloftheIranianChemicalSociety, 2015, 12(6): 1 053-1 060.
[19]MERUSIC,CONTADINIC,CAVAZZAA,etal.Determinationofnitrates,nitritesandoxalatesinfoodproductsbycapillaryelectrophoresiswithpH-dependentelectroosmoticflowreversal[J].FoodChemistry, 2010, 120(2): 615-620.
[20]邹辉.烯二醇类抗氧化剂降解亚硝酸盐动力学研究[D].泰安:山东农业大学, 2014.
[21]李桂星,胡晓丹,孙红男,等. 模拟胃液条件下苹果多酚对亚硝酸盐的清除作用[J]. 食品科学, 2011, 33(11): 1-4.
[22]ZHANGZi-ping,LIUXiao-ming,ZHANGXu,etal.ComparativeevaluationoftheantioxidanteffectsofthenaturalvitaminCanalog2-O-beta-D-glucopyranosyl-L-ascorbicacidisolatedfromgojiberryfruit[J].ArchivesofPharmacalResearch, 2011, 34(5): 801-810.
[23]JIFeng-di,JIBao-ping,LIBo,etal.Efffectoffermentationonnitrate,nitriteandorganicacidcontentsintraditionalpickledchinesecabbage[J].JournalofFoodProcessingandPreservation, 2009, 33(s1): 175-186.
[24]PAIKHD,LEEJY.Investigationofreductionandtolerancecapabilityoflacticacidbacteriaisolatedfromkimchiagainstnitrateandnitriteinfermentedsausagecondition[J].MeatScience, 2014, 97(4): 609-614.
[25]FEIYong-tao,LIUDong-mei,LUOTong-hui,etal.MolecularcharacterizationofLactobacillus plantarumDMDL9010,astrainwithefficientnitritedegradationcapacity[J].PlosOne, 2014, 9(11).
[26]YANPing-mei,CHAIZheng,CHANGXiao-hui,etal.ScreeningandidentificationofmicroorganismdegradingnitriteinChinesesauerkraut[J].AaroFoodIndustryHi-Tech, 2015, 26(1): 20-23.
[27]PANZELLAL,MANINIP,NAPOLITANOA,etal.Theacid-promotedreactionofthegreenteapolyphenolepigallocatechingallatewithnitriteions[J].ChemicalResearchinToxicology, 2005, 18(4): 722-729.
[28]AMANS,NAIMA,SIDDIQIR,etal.Antimicrobialpolyphenolsfromsmalltropicalfruits,teaandspiceoilseeds[J].FoodScienceandTechnologyInternational, 2014, 20(4): 241-251.
[29]HUChong-jiu,LIAOHai-bing,YUANKe,etal.ChemicalcompositionandantioxidantactivityofessentialoilofbambooleavesfromfourspeciesinChina[J].AsianJournalofChemistry, 2011, 23(6): 2 543-2 547.
[30]陈秋平,王晓艳,屠熠凡,等. 藤茶中抗氧化剂阻断N-亚硝胺合成的作用[J]. 核农学报, 2014(9): 1 641-1 646.
[31]HIROTAS,TAKAHAMAU.Reactionsofapplefruitpolyphenolswithnitriteunderconditionsofthegastriclumen:generationofnitricoxideandformationofnitrosocatechins[J].FoodScienceandTechnologyResearch, 2014, 20(2): 439-447.
[32]MAHui,LIUWen-bo,ZHOUYan-xia,etal.Nitritescavengingactivityofapplepolyphenolsinsimulatedgastriccondition[J].AdvancedMaterialsResearch, 2013, 773: 327-330.
[33]HIROTAS,TAKAHAMAU.Reactionsofpolyphenolsinmasticatedapplefruitwithnitriteunderstomachsimulatingconditions:Formationofnitrosocompoundsandthiocyanateconjugates[J].FoodResearchInternational, 2015, 75: 20-26.
[34]SUNJian,HEXue-mei,ZHAOMou-ming,etal.Antioxidantandnitrite-scavengingcapacitiesofphenoliccompoundsfromsugarcane(Saccharum officinarumL.)[J].Molecules, 2014, 19(9), 13 147-13 160.
[35]DIRIBAD,HUSSENA,RAOVM.Removalofnitritefromaqueoussolutionusingsugarcanebagasseandwheatstraw[J].BulletinofEnvironmentalContaminationandToxicology, 2014, 93(1): 126-131.
[36]DONGYi,ZHAOMou-ming,ZHAOTian-tian,etal.CapacitiesandprotectiveeffectsonH2O2-injuredPC12cellsofGlycyrrhiza GlabraL.leafandrootextracts[J].Molecules, 2014, 19(7), 9 101-9 113.
[37]LIUJun,LINSong-yi,WANGZuo-zhao,etal.SupercriticalfluidextractionofflavonoidsfromMaydisstigmaanditsnitrite-scavengingability[J]. 2011, 89(4): 333-339.
[38]JIHong-fang,ZHANGHai-yan,ZHANGLing-wen,etal.Scavengingofnitriteandinhibitionofnitrosamineformationbylaoyingtea(Litsea coreanaL.)Extracts[J]. 2011, 183-185: 452-456.
[39]SAMADNB,DEBNATHT,JINHL,etal.AntioxidantactivityofBenincasa hispidaseeds[J].JournalofFoodBiochemistry, 2013, 37(4): 388-395.
[40]SAMADNB,DEBNATHT,HASNATA,etal.Phenoliccontents,antioxidantandanti-inflammatoryactivitiesofasparaguscochinchinensis(Loureiro)merrill[J].JournalofFoodBiochemistry, 2014, 38(1): 83-91.
[41]FURao,ZHANGYu-ting,GUOYi-ran,etal.Antioxidantandanti-inflammatoryactivitiesofthephenolicextractsofSapium sebiferum (L.)Roxb.leaves[J].JournalofEthnopharmacology, 2013, 147(2): 517-524.
[42]CHOISY,CHUNGMJ,LEESJ,etal.N-nitrosamineinhibitionbystrawberry,garlic,kale,andtheeffectsofnitrite-scavengingandN-nitrosamineformationbyfunctionalcompoundsinstrawberryandgarlic[J].FoodControl, 2007, 18(5): 485-491.
[43]HAOJian-xiong,LIHui-ying,WANYang-fang,etal.Reductionofnitritelevelsinfreshlettuceswithaqueouschlorinedioxidetreatment[J].InternationalJournalofFoodScience&Technology, 2015, 50(3): 652-659.
[44]TAKAHAMAU,TANAKAM,HIROTAS.Proanthocyanidinsinbuckwheatflourcanreducesalivarynitritetonitricoxideinthestomach[J].PlantFoodsforHumanNutrition, 2010, 65(1): 1-7.
[45]KIMBH,CHOID,PIAOYL,etal.ComparativestudyontheantioxidantandnitritescavengingactivityoffruitingbodyandmyceliumextractfromPleurotus ferulae[J].KoreanJournalofChemicalEngineering, 2012, 29(10): 1 393-1 402.
Advancesonnitrite-eliminatinginvegetableprocessing
XIEYan-dan1,LIULing-yi2,LOUQiao-ming1,ZHANGXin1,WUZu-fang1,LIULian-liang1,3*
1(SchoolofMarineSciences,KeyLaboratoryofAnimalProteinFoodDeepProcessingTechnologyofZhejiangProvince,NingboUniversity,Ningbo315211,China)2(ColleageofFoodScienceandEngineering,WuhanPolytechnicUniversity,Wuhan430023,China)
< class="emphasis_italic">ABSTRACT
Processedvegetableproductsarefavoredbythemajorityofconsumers.However,nitritecontentintheproductshasbeentheissueofattention.Thispaperreviewedtheresearchprogressoneliminatingnitriteforvegetableprocess,includingthemechanismofnitriteformationinprocessedvegetables,thenitritepeakgenerationandnitriteeliminationtechnology.Itclarifiedthesourceofnitriteinvegetableprocessing,andanalyzeddose-dependenteffectandmechanismofusingfood-borneoxidationinhibitors(ascorbicacid,citricacid,teapolyphenol,bambooleafflavone, ampelopsis grossedentata,appleextract, etc.)toeliminatenitrite.Itprovidedthepossiblemechanismofnitriteeliminationbyprobioticsfermentationorplantextracts.Theprospectofthetechnologyineliminationofnitriteinvegetableprocessingwasalsoproposed.
processedvegetables;nitrite;antioxidants;probiotics
10.13995/j.cnki.11-1802/ts.201608047
博士,讲师(本文通讯作者,E-mail:hahaliang408@126.com)。
浙江省自然科学基金(LQ15C200002);浙江省教育厅科研项目资助(Y201430696);宁波市自然基金(2014A610201);宁波市农业与社会发展攻关项目(2014C10057)
2015-10-10,改回日期:2015-12-18
