磁纳材料表面可修饰性在食品污染物快速分析中的应用
2016-10-21苏敏马良张宇昊钟红王佳曼
苏敏,马良,张宇昊,钟红,王佳曼
(西南大学 食品科学学院,重庆,400715)
磁纳材料表面可修饰性在食品污染物快速分析中的应用
苏敏,马良*,张宇昊,钟红,王佳曼
(西南大学 食品科学学院,重庆,400715)
磁性纳米材料具有纳米材料比表面积大、尺寸小、偶联容量高、表面可修饰等特性以及独特的磁学性质,通过表面包裹、修饰无机纳米材料、有机小分子和有机高分子等降低粒子表面能获得具有可分散性或功能化的磁性纳米粒子,调节磁性纳米粒子的生物相容性和反应特性,可广泛应用于食品污染物快速分析中的样品前处理,如分离提纯、富集萃取以及检测过程中的信号放大、提高选择性及灵敏度等。基于磁性纳米材料的各种固相萃取方法以及新型传感器的研究发展迅速,文中综述了磁性纳米材料的表面可修饰性在食品安全检测方面的研究现状和应用情况,并展望了该领域发展趋势。
磁性纳米材料;表面可修饰性;快速分析;磁性固相萃取;传感器
磁性纳米材料作为目前最富有生命力的新型材料之一,不仅具有高比表面积、小尺寸效应、量子隧道效应等普通纳米材料所具有的特性,还具有良好的表面可修饰性、特异性、类酶活性、超顺磁性、化学稳定性和生物相容性等特殊性质,在新型食品快速检测过程中具有快速、经济、便携、灵敏等特点[1-2]而广泛应用于诸如重金属离子分离[3]、膜分离、生物分离(如核酸[4]、蛋白质)以及生物标记等技术。由于磁性纳米材料具有诸多良好特性,能够在很大程度上解决传统食品安全检测中设备昂贵、选择性差、耗时长、样品前处理繁杂以及基质干扰等问题[5-6],因此越来越多地用于食品快速检测传感器、便携速测仪等快速检测仪器中。本文主要综述了磁性纳米材料的表面可修饰性,磁性纳米材料在食品污染物快速分析过程中的特殊应用,以及磁性固相萃取和磁纳传感器的研究现状与发展前景等。
1 磁性纳米材料
纳米材料又称纳米结构材料,是指在三维空间中至少有一维处于纳米尺度范围内的材料(0.1~100nm)。而磁性纳米材料则是20世纪70年代开始产生并逐渐得到重视的新型磁性材料,多为铁、钴和镍等过渡金属的氧化物(如Fe3O4,Co3O4),在外加磁场的作用下能快速地与底液分离,操作简便且分离效率高,是一种性能优良的磁性分离载体。目前用于食品分析的磁性纳米材料主要是以Fe3O4为主的无机磁性纳米材料,包括磁性纳米粒子、磁性纳米微球。
1.1磁性纳米粒子
磁性纳米粒子的制备方法主要有化学共沉法、高温热分解法、微乳液法等化学法[7]。
共沉淀法是向含2种或2种以上金属阳离子的可溶性盐溶液中加入适当的沉淀剂,使金属离子均匀沉淀或结晶出来,再将沉淀物脱水或热分解而制得纳米微粒。该方法制得的纳米材料纯度较高、分散性好、粒径小、颗粒均匀且操作简便、反应条件温和,是制备磁性纳米粒子的经典方法之一,但反应过程中的影响因素较多,因此控制产物组成、防止纳米粒子团聚是该类方法面临的最重要的问题之一。
高温分解法是将反应原料快速注入含有表面活性剂的高温溶剂中,实现纳米粒子的快速成核,再通过控制反应温度与时间可得到粒度分布窄的纳米粒子。该法制备的磁性纳米粒子粒径分布窄,尺寸形貌可控,纯度较高。
微乳液法是以水、油和表面活性剂三元体系形成的微乳液为反应空间形成乳液,经成核、聚结、团聚、热处理后制备得到纳米粒子。该方法在粒子的尺寸分布及形貌控制方面体现了一定的优势[8],但所制备的粒子结晶性能较差,使粒子的磁性质受到影响,且产物纯度也较差。
从磁纳粒子的制备方法来看,通过表面修饰制备稳定、可控、单分散的磁性纳米材料,将磁性粒子功能化并应用于食品分析检测将是磁性纳米材料在食品安全检测中的主要应用方式。因此,制备过程简单易行,制备速度快,能制备出磁性纳米粒子粒径分布窄、磁性优良、晶型良好且纯度高的制备方法将是未来的主要研究方向之一。其中共沉淀法反应过程需要调节铁盐的种类、反应温度、pH等条件,可控制产物的尺寸、形状和组成;高温分解法可直接高温热解金属阳离子络合物得到Fe3O4、Cr2O3、Co3O4等,方法简单,粒径和形态可控;微乳液法原理主要是基于溶液界面的相转变以及分离机制,可制备单分散以及粒径较小的Fe3O4和CoFe2O4纳米粒子;在检测应用中可根据具体情况和实际需要选择合适的方法制备相应粒径及形状的磁性纳米粒子。
1.2磁性纳米微球
磁性纳米微球(magneticnanoparticles,MNPs)一般为核壳式结构,以磁性纳米粒子为核,具亲和性的合成高分子或生物高分子等材料为壳,可通过改性在其表面形成—OH、—COOH、—CHO、—NH2等极性官能团,从而进一步进行表面接枝共聚,再以适当的方法将核层与壳层结合起来,形成具有磁性的特殊结构载体。磁性纳米微球中的磁性成分常用Fe3O4,高分子可以是合成的有机聚合物,如聚丙烯酸或聚苯乙烯,或生物高分子如蛋白质、壳聚糖、支链淀粉和葡聚糖等,也可以是碳或无机氧化物(如SiO2[9]、TiO2、Al2O3等)。图1[10]所示为经无机物(a)、有机材料(b)、纳米微球(c)和纳米囊(d)包覆的磁性纳米材料结构。磁性纳米微球的制备主要有包埋法,单体聚合法和原位法,目前广为采用的是单体聚合法。严微等[11]采用甲基丙烯磺酸钠(SMS)为阴离子功能单体,过硫酸钾(KPS)为引发剂,在Fe3O4磁流体的存在下与苯乙烯(St)一起进行乳液聚合,制备得到的Fe3O4/聚(St-SMS)磁性高分子复合微球,其最高饱和磁化强度达到了8.74emu/g。高振宇[12]以不同表面修饰的磁性Fe3O4纳米颗粒为磁性材料来源,以多孔聚苯乙烯微球为模板,制备了亚微米级单分散的磁性聚合物微球。通过在磁性微球表面包被沙门氏菌抗体,得到了可对沙门氏菌抗体进行特异性识别分离的亚微米级免疫磁性微球,实际样品分离检测结果显示,该免疫微球可对沙门氏菌实现高效磁分离。
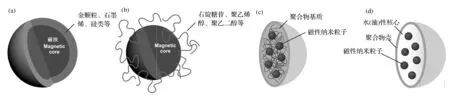
(a)无机物;(b)有机材料;(c)纳米微球;(d)纳米囊图1 经不同材料表面修饰和涂层的磁性纳米材料示意图Fig.1 Schematic representation of the stabilization of MNPs by surface coating with inorganic (a) or organic materials (b) or by encapsulati into nanospheres (c) or nanocapsules (d).
由于磁性纳米粒子表面能较高,易被氧化,一般在使用前进行表面修饰,表面修饰不仅可以提高纳米微球的物理稳定性、化学稳定性,其水溶性还可以实现进一步的功能化,从而提高生物活体或者目标物的结合效率。
2 表面修饰磁性纳米材料在食品污染物快速前处理中的应用
由于磁纳材料本身具有高比表面积及表面可修饰性,因此可用硅类化合物、碳纳米管、离子交换剂、金属螯合剂等化学材料,生物材料以及光学材料进行修饰。修饰后功能化的磁性纳米材料可用于食物污染物检测中的分离和富集、放大检测信号以及提高检测灵敏度等。
2.1经化学材料修饰的磁纳材料
2.1.1硅类化合物
利用硅类化合物修饰磁性纳米材料后可制备具有超顺磁性及高捕获能力的磁性纳米复合材料,可对某些待检测样品进行分离吸附并富集,从而进一步提高检测速度及检测准确性。
ZHANG[13]等人以硅酸四乙酯包覆在Fe3O4磁性纳米粒子表面形成具有磁性的纳米微球,同时用Si-C8硅烷及C18硅烷对其进行表面修饰形成Fe3O4@Si-C8/C18结构。从结果来看,该结构表现出很强的超顺磁性及高效的捕获能力,可以很好地用于食品中农兽药的分离净化和浓缩富集。
2.1.2离子交换剂、金属螯合剂
通过强疏水作用和静电作用将离子交换剂或者金属螯合剂包覆在磁性纳米材料的表面可大大提高磁纳材料的选择性吸附富集作用,通过此法制备的磁纳复合材料具有生物相容性、不易降解和易再生等特点。CHEN等[14]将3个疏水性离子液体1-丁基-3-甲基咪唑六氟磷酸盐([BMIM]PF6),1-己基-3-甲基咪唑六氟磷酸盐([HMIM]PF6),和1-辛基-3-甲基咪唑六氟磷酸盐([OMIM]PF6)涂覆在磁纳材料表面制备得到Fe3O4@SiO2@ILs,此复合材料可用于迅速富集食品中的利谷隆并可重复使用10次以上。MIRABI等[15]用离子交换剂SDS对Fe3O4进行修饰后制备得到吸附稳定性较好的Fe3O4/SDS磁性纳米颗粒,在一定浓度内,对Cd2+的吸附符合Langmuir吸附等温方程,利用此法建立的检测水样中的镉,最低检测限为3.71ng/mL。MAHDAVIAN等[16]制备了以Fe3O4为核的m-PAA-Na金属粒子螯合剂,考查了对Cu2+、Pb2+、Ni2+和Cd2+的移除作用,测试表明对金属离子的选择性吸附强度为Pb2+>Cu2+>Ni2+>Cd2+。WANGX等[17]采用二乙基二硫代螯合物包覆Fe3O4用来测定食品中的Cd、Ni、Cu,通过条件优化后其检测限分别达到了0.007、0.009和0.017mg/L,相对偏差为1.1%~2.6%。
2.1.3碳纳米管
将Fe3O4与碳纳米管(multiwalledcarbonnanotubes,MWCNTs)结合制备的磁性碳纳米管同时具有铁磁性和比表面积大、物理化学性质稳定、吸附性强、毛细管效应、疏水性表面和中空管状结构等优点[18],以磁性碳纳米管为基体材料,不但有效解决了磁性纳米粒子单独存在时的分散性差和容易团聚等难题,还实现了对磁性材料在纳米范围上的设计和组装,在生物医学、分离检测等领域有广阔的应用前景。
姚伟宣等[19]通过共沉淀法制备了Fe3O4/酸化多壁碳纳米管(AMWCNTs)磁性纳米材料,将其用于富集痕量拟除虫菊酯类农药残留,结果证明该复合材料对6种菊酯类农药在10min内就可达到吸附平衡,并在10min内即可解吸。李海芳等[20]通过化学键合的方法制备单壁碳纳米管包覆的Fe3O4/CNTs磁性复合纳米粒子并用于分散固相微萃取富集牛乳中的香精添加剂,同时与高效液相色谱分析联用,实现了香兰素和乙基香兰素的快速高效富集和高灵敏度检测,两者的检出限达10μg/L,回收率大于92%。任晓东等[21]制备得到了磁性多壁碳纳米管(MWCNTs), 将磁性MWCNTs用于吸附水溶液中的3种硝基咪唑类药物(甲硝唑、奥硝唑、替硝唑)。 结果表明,当磁性MWCNTs投加量为5g/L, 溶液pH值为7, 吸附时间为300min时, 甲硝唑、奥硝唑、替硝唑的去除率分别达到92.86%,94.44%,94.91%。该磁性MWCNTs在中性水体中相当稳定,已应用于农药及金属离子等物质的分离,目前逐渐应用到食品分析检测领域之中。 黄昊等[22]通过制备多壁碳纳米管修饰磁性纳米颗粒,以碳纳米管修饰的磁性纳米颗粒为萃取剂,对水样中的铅离子进行分离富集,实现了对重金属离子的分离和富集,进一步用石墨炉原子吸光光度法测定。结果表明,Pb(II)的线性范围为0.40~100ng/mL,检出限为 0.29ng/mL,富集倍数为137。在实际样品分析中,海水样品的加标回收率均在95%以上。TARIGH[23]合成了磁性多璧碳纳米管并以其为吸附剂用于吸附浓缩尿液和大米中的Pb+2和Mn+2,经火焰原子吸收测定,结果显示Pb+2、Mn+2的检测限分别为1.0、0.6μg/L,富集因子分别为390和397。此方法简便、快速、环保、成本低、富集因子高、稳定性好且磁性吸附剂可重复利用。
2.2经功能基修饰的磁纳材料
利用各类功能基团如氨基、羧基等对磁纳材料进行修饰可大大提高磁纳材料吸附的选择性。
HU等[24]采用stober法对Fe3O4进行氨基化后,利用氨基与金属有机纳米框架材料MOF-5结合制备得到一种混合磁性MOF-5。此材料具有金属有机骨架高孔隙率的良好属性并具有磁纳材料的吸附性,可对食品中的多环芳烃及赤霉酸进行高效吸附富集。再用液相色谱-串联质谱(LC-MS/MS)检测,结果表明混合磁性MOF-5表现出优异的浓缩能力,最低检测限达到了0.91~1.96ng/L(多环芳烃)和0.006~0.08ng/L(赤霉酸)。BAI等[25]利用氨基改性后的SiO2包覆磁性纳米颗粒(ASMNPs)来直接萃取原料乳中的病原菌DNA,经PCR后可用来快速、灵敏地检测沙门氏菌、单增李斯特菌等,这两类病原菌的最低检测限可分别达到 8CFU/mL和15CFU/mL。CARPIO等[26]利用羧基对磁性纳米粒子进行修饰后用于对果汁中多种金属元素的测定,经条件优化后对Co,Cu,Zn,Ni,和Cd的检出限为0.004、0.003、0.004、0.008、0.009mg/L。
除氨基、羧基外,一些具有诸如苯环、杂环芳烃等特殊结构的小分子基团也可用来修饰磁纳材料。ZOU等[27]用四苄基-四氮杂环十二烷(TBCD)功能化Fe3O4-SiO2磁性纳米材料。利用四个苯环的π-π键作用,该磁纳材料可特异性吸附多环芳烃,用于水样中多环芳烃的检测,灵敏度可达到3.0×10-2ng/L。MIAOMIAO[28]等合成了柱环芳烃(CP[5]),并用其修饰Fe3O4,CP[5]的柱状效应和苯环的大环效应极大地提高了磁性吸附剂对农药的选择性,用于吸附分离饮料中的多种农药残留,检测最低限可达5.0ng/L。
2.3经生物材料修饰的磁纳材料
2.3.1抗原、抗体
对磁性纳米粒子进行抗体或抗原修饰后可制备具有优良的磁性和抗体优良特性的免疫复合磁纳材料,可快速地特异性识别食品中的真菌毒素及病原微生物等,提高检测灵敏度和检测限。
WANG等[29]人以AFB1人工抗原功能化磁性纳米粒子作为捕获探针,以发光量子点标记免疫球蛋白G(二抗)作为信号探针,利用AFB1人工抗原和样品中AFB1与抗AFB1单克隆抗体之间的竞争免疫结合,建立了针对AFB1的新型检测方法,其荧光强度与AFB1浓度在20~800ng/mL范围内呈良好的线性关系,检测限为12ng/L,用此法测定玉米样品中的AFB1,回收率从92.8%到122.0%不等且准确性良好。
LIU等[30]利用Fe3O4纳米粒子结合特异性抗体制备具有超顺磁性免疫纳米磁珠用于分离肠炎弧菌,结果显示,当肉汤培养基中肠炎弧菌的浓度达到103CFU/mL时,80%的肠炎弧菌细胞可以被快速高效分离。YANG等[31]利用免疫磁珠分离技术结合多重PCR技术和PMA处理(IMS-PMA-mPCR)首次建立了快速、有效、同时检测沙门氏菌、大肠杆菌O157:H7和单增性李斯特菌的检测方法。结果显示此方法在纯培养基中的检出限大约为102CFU/mL,其中沙门氏菌检出限为1.2×102CFU/mL,大肠杆菌O157∶H7为4.0×102CFU/mL,单增性李斯特菌为5.4×102CFU/mL。CHO[32]结合酶侧流免疫层析技术和免疫磁珠分离技术建立了快速检测食品中单增李斯特氏菌的新方法。目标微生物经过加酶的免疫磁珠分离富集后直接用于免疫层析试纸条并诱导产生免疫反应,在试纸条上特定的位置出现颜色变化,并以此可直接判断样品中的单增李斯特氏菌浓度。实验显示,此方法在缓冲液和2%的牛乳样品中的检出分别为95CFU/mL和(97±19.5)CFU/mL,并且特异性好,整个检测时间耗时不到2h。
2.3.2酶类
利用磁纳材料的类酶活性可用酶类对其进行修饰,由于酶促反应较为迅速,可实现对食品中污染物的快速检测。KEEP-SHYUAN等[33]将磷酸酯酶固定在Fe3O4纳米粒子表面, 利用除草剂2-4D抑制磷酸酯酶催化反应而产生的电化学信号的改变实现对果蔬中除草剂2-4D的检测。QIN等[34]首次发现Co3O4纳米颗粒具有内在的氧化酶活性,并能够用来催化辣根过氧化物酶(TMB),通过加入底物2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)可形成有色产物。实验基于此原理制备了TMB-O2-Co3O4磁性纳米粒子,与亚硫酸盐反应后会产生颜色变化。基于此原理可对食品中亚硫酸盐进行测定,其线性检测范围为0.2×10-6~1.6×10-5mol/L,最低检测限为5.3×10-8,回收率为93.8%~100.5%。
2.4经光学材料修饰的磁纳材料
将磁性纳米粒子进行光学修饰后可制备具有优良的磁性和发光性能[35]的磁光双功能纳米材料,同时与核磁共振技术和量子点荧光标记技术等结合[36-38],可进一步放大检测信号,提高检测限。
WENCY等[39]建立了基于免疫磁性纳米微粒(immunemagneticnanoparticles,IMNS)的微生物检测技术,利用荧光材料标记磁性纳米微粒制备合成了免疫荧光纳米微粒(immunefluorescencenanoparticles,IFNS)来特异性识别鼠伤寒沙门氏菌,形成了“IMNS-bacteria-IFNS”夹层结构,再用荧光显微镜和荧光分光光度计进行检测的,此法快速、灵敏且检测限可低至10CFU/mL,同时在(105~107)CFU/mL的浓度范围内呈良好的线性范围。该方法对肠杆菌和弗氏志贺菌均显示阴性结果,特异性强且较传统方法比较具有更强的抗干扰能力。WANG等[40]利用硒化镉(CdSe)/硫化镉(CdS)量子点标记磁性纳米微粒Fe3O4/Au(MCFN)并用来检测瘦肉精其线性检测范围可达到0.5~20 000pg/mL。
3 磁性纳米材料相关技术在食品快速分析中的应用
3.1基于磁性纳米材料的磁性固相萃取技术
1999年,SAFARIKOVAD等[41]首次提出了磁性固相萃取(magneticsolid-phaseextraction,MSPE),以磁性纳米材料作为磁性固相萃取的吸附剂。在MSPE技术中,磁性纳米吸附剂被添加到样品的溶液或悬浮液中,将目标分析物吸附到分散的磁性吸附剂表面,而不需要填充到吸附柱中,在外部磁场作用下就可使目标分析物与样品基质分离开来,然后将目标分析物从磁性吸附剂上洗脱出来,避免了普通固相萃取技术繁琐的过柱操作、吸附柱容易堵塞、重复性差等问题,有良好的净化和富集作用。
BAGHERI等[42]用一种磁性纳米粒子作为吸附剂来富集环境水样中的Pb(II) 、Cd(II)和Cu(II),3种离子的回收率都高达90%。实验表明,MSPE技术在分离、富集重金属离子时能有效排除杂志干扰,即使存在毫克数量级的干扰离子,也不会影响目标分析物的检测限和回收率。近年来,除主要应用于金属离子[43-50]的检测外,MSPE也还用于食品中有机污染物等[51-52]、真菌毒素[53-54]以及农药残留[55-56]的检测(见表1)。

表1 基于磁性纳米材料的固相萃取技术在食品中污染物检测分析中的应用概况
3.2基于磁性纳米材料的磁性传感器
磁性纳米材料与光、热、靶向等特殊功能结合发展出来的现代传感器,可以实现分子水平上的现场、实时和活体检测。磁控生物传感器是直接利用磁性纳米粒子的磁性,通过粒子产生的磁信号进行检测或者控制的传感器。近些年,高灵敏度和高选择性的新型磁传感器如免疫传感器(immunosensor)、电化学传感器(electrochemicalimmunosensor)和以及电化学免疫传感器(Electrochemiluminescenceimmunoassaysensor)得到迅速发展(见表2)。

表2 基于磁性纳米材料的传感器在食品中污染物检测分析中的应用概况
免疫传感器一般是利用抗体对磁性纳米材料进行修饰后作为特异性识别检测物质的载体。具有灵敏度高、选择性号,检测速度快等特点。WANG等[57]用羧基对磁性纳米粒子Fe3O4进行修饰后与抗体连接制备得到可以特异性识别沙门氏菌的免疫传感器,检测线性范围为(5×103~106)CFU/mL,检测限为103CFU/mL,相比酶联免疫检测法更低(ELISA,2×104CFU/mL)。检测时间30min(ELISA,2~4h)也更加快速。
电化学传感器方面,由于磁性纳米材料电催化活性强,表面积大,可增强响应界面及电子传导作用并作为载体起到吸附和支撑的作用[58],因此检测速度较免疫传感器也更快。FERNNDEZ[59]等用磁性纳米颗粒修饰结合波伏安法制备了电化学传感器并成功应用于检测葡萄酒中的赭曲霉毒素A,检测限可达0.02μg/kg,表现出良好的灵敏度(ELISA法检测限为1.9μg/kg),检测时间约为15min。
将电化学与免疫法结合的电化学免疫传感器则兼具二者特点。MASOOMIA等[60]用三羟甲基丙烷三(2-巯基乙酸酯)修饰带有Au纳米磁壳的Fe3O4后标记上抗黄曲霉抗体作为检测电极(GCE/壳聚糖/AuNP/anti-AflatoxinB1)用于黄曲霉毒素B1的检测。此传感器线性检测范围为0.6~110ng/mL,检测限为0.2ng/mL。除此之外,该传感器的重现性和稳定性较好,用同一只传感器对浓度为70ng/mL的黄曲霉毒素B1连续测定18次后,其电化学发光相对变成为2.5%(浓度相对变成为2.6%),变异系数仍可达到0.37%。
4 总论与展望
目前在食品安全检测领域针对磁性纳米材料进行了大量研究和应用,发展了很多简单快速、灵敏度高、特异性强、重现性好的食品检测新技术,显示出磁性纳米材料广阔的应用前景,尤其是磁性纳米材料的特殊性质结合传统的检测技术开发新型的快速检测技术是目前的发展趋势之一。通过对修饰后磁纳材料在食品安全污染物检测中应用研究的综述,分析了磁性纳米材料在修饰和应用中可改进之处,在以下几个方面可进一步研究:
(1) 相比其他纳米材料,磁性纳米材料更易被氧化和团聚,导致吸附性大大降低。因此可对磁性纳米材料的表面修饰改性作深入研究。如使用新型材料如石墨烯等、优化改性条件提高表面修饰改性后磁纳复合材料的稳定性、同时使用多种功能化合物对其进行改性制备出具有多功能化磁性纳米复合材料。在进行表面修饰的同时对磁性纳米材料的磁响应性会有一定的影响,如何保持经表面修饰改性后的磁性纳米材料的磁响应性这一问题还尚待解决。
(2) 近年来,MSPE已经越来越多地应用于环境、食品和生物医药领域中复杂样品的预处理,然而对MSPE效果的影响因素如吸附剂种类及用量、pH值、萃取时间和温度、洗脱剂的种类及用量等条件尚可进一步优化。今后还可在发展高选择性、高效的新型吸附剂,可自动化萃取装置、优化在线联用技术等方向进行探究。磁纳传感器目前也广泛地应用于食品中微生物、农药残留、真菌毒素以及其他化学污染物的检测。磁纳材料在传感器中作为生物分子载体具有不需媒介体仍能够有效促进电子转移,催化活性高,灵敏度、选择性和稳定性好等特点。未来可在提高磁纳传感器机械稳定性、热稳定性、电子传递速率、传感器灵敏度及稳定性和重现性等方面进行研究。
[1]ZHAOM,JOSEPHSONL,TANGY.MagneticSensorsforProteaseAssays[J].JounralofAngewandteChemie., 2003, 42( 12):1 375~1 378.
[2]PEREZJM,JOSEPHSONL,O'LoughlinT,etal.Magneticrelaxationswitchescapableofsensingmolecularinteractions[J].NatureBiotechnology, 2002, 20(8):816-820.
[3]TOWLERPH,SMITHJD,DIXONDR.Magneticrecoveryofradium,leadandpoloniumfromseawatersamplesafterpreconcentrationonamagneticadsorbentofmanganesedioxidecoatedmagnetite[J].AnalyticaChimicaActa, 1996, 328(1):53-59.
[4]SILVAAC,OLIVEIRATR,MAMANIJB,etal.Applicationofhyperthermiainducedbysuperparamagneticironoxidenanoparticlesingliomatreatment[J].IntJNanomedicine, 2011, 6(1):591-603.
[5]TAIYu-lei,WANGLi,YANGuan-qingetal.Recentresearchprogressonthepreparationandapplicationofmagneticnanospheres[J].PolymerInternational,2011,60:976-994.
[6]郭祖鹏, 师存杰, 焉海波. 磁性纳米材料在分离和检测中的应用研究进展[J]. 磁性材料及器件, 2012(01):9-19..
[7]楚华琴, 卢云峰. 功能化纳米材料的制备及在食品安全检测中的应用研究进展[J]. 分析化学, 2010, 38(03):442-448.
[8]SCUÜTH,F.Endo-andexotemplatingtocreatehigh-surface-areainorganicmaterials.[J].AngewandteChemie:internationalEd, 2003, 42(31):3 604-3 622.
[9]FANGF,ZHULZ,QIN-PINGYE,etal.Preparationofmagneticnanosphereswithcore-shellstructureanditsapplicationinnucleicacidextraction[J].ProgressinModernBiomedicine, 2009,9(3):470-473.
[10]REDDYLH,ARIASJL,NICOLASJ,etal.Magneticnanoparticles:designandcharacterization,toxicityandbiocompatibility,pharmaceuticalandbiomedicalapplications.[J].ChemicalReviews, 2012, 112:5 818-5 878.
[11]严微, 彭亮, 李小龙,等. 乳液聚合制备Fe3O4/聚(苯乙烯-甲基丙烯磺酸钠)磁性高分子微球[J]. 纳米技术与精密工程, 2012, 10(2):165-169.
[12]高振宇. 磁性纳米粒子/磁性聚合物微球的制备及初步应用[D]. 吉林:吉林大学, 2013.
[13]ZHANGHeng,LIUQi-song,YANGCheng-li,etal.C18/C8-Functionalizedmagneticsilicananospheres(Fe3O4@Si-C8/C18)ascaptureprobesforhighlyefficientandrapidpurificationofveterinarydrugresidues[J].FoodAnalyticalMethods, 2013, 6(3):933-940.
[14]CHENJ,ZHUX.Ionicliquidcoatedmagneticcore/shellFe3O4@SiO2nanoparticlesfortheseparation/analysisoflinuroninfoodsamples.[J].SpectrochimicaActaPartAMolecular&BiomolecularSpectroscopy, 2015, 137:456-462.
[15]MIRABIA,DALIRANDEHZ,RADAS.Preparationofmodifiedmagneticnanoparticlesasasorbentforthepreconcentrationanddeterminationofcadmiumionsinfoodandenvironmentalwatersamplespriortoflameatomicabsorptionspectrometry[J].JournalofMagnetism&MagneticMaterials, 2015:138-144.
[16]MAHDAVIANAR,MIRRAHIMIMA.Efficientseparationofheavymetalcationsbyanchoringpolyacrylicacidonsuperparamagneticmagnetitenanoparticlesthroughsurfacemodification[J].ChemicalEngineeringJournal,2010,159(1/3):264-271.
[17]WANGXiao-jun,CHENJing-jing,ZHOUYing,etal.Dispersiveliquid-liquidmicroextractionandmicro-solidphaseextractionfortherapiddeterminationofmetalsinfoodandenvironmentalwaters[J].AnalyticalLetters, 2015:1787-1801.
[18]YAOXun-ping,FUZhen-jun,ZHAOYong-gang,etal.Useoftetraethylenepentamine-functionalFe3O4magneticpolymersformatrixsolidphasedispersionextractionandpreconcentrationofCr(VI)inwatersamplesatultratracelevels.[J].Talanta, 2012, 97(16):124-30.
[19]姚伟宣,应剑波,张素玲等.Fe3O4纳米粒子修饰多壁碳纳米管的制备及在水和蜂蜜样品中痕量菊酯类农药分析中的应用[J]. 色谱,2015,33(4):342-347.
[20]李海芳, 杨红云, 张英,等. 四氧化三铁/单壁碳纳米管磁性复合纳米粒子分散固相微萃取-高效液相色谱法测定牛奶中的香精添加剂[J]. 色谱, 2014(4):413-418.
[21]任晓东, 熊振湖. 磁性多壁碳纳米管对水中三种硝基咪唑类药物的吸附行为[J]. 化学学报, 2013, 71(4):625-633.
[22]黄昊. 磁性碳纳米管的合成及其在固相微萃取中的应用[D]. 临汾:山西师范大学, 2013.
[23]DANESHVARTG,SHEMIRANIF.Magneticmulti-wallcarbonnanotubenanocompositeasanadsorbentforpreconcentrationanddeterminationoflead(II)andmanganese(II)invariousmatrices.[J].Talanta, 2013, 115(17):744-750.
[24]HUYu-ling,HUANGZe-lin,LIAOJia,etal.Chemicalbondingapproachforfabricationofhybridmagneticmetal-organicframework-5:highefficientadsorbentsformagneticenrichmentoftraceanalytes.[J].AnalyticalChemistry, 2013, 85(14):6 885-6 893.
[25]BAIYa-long,SONGMing-hui,YANCui,etal.ArapidmethodforthedetectionoffoodbornepathogensbyextractionofatraceamountofDNAfromrawmilkbasedonamino-modifiedsilica-coatedmagneticnanoparticlesandpolymerasechainreaction.[J].AnalyticaChimicaActa, 2013, 787(13):93-101.
[26]CARPIOA,MERCADER‐TREJOF,ARCEL,etal.Useofcarboxylicgroupfunctionalizedmagneticnanoparticlesforthepreconcentrationofmetalsinjuicesamplespriortothedeterminationbycapillaryelectrophoresis.[J].Electrophoresis, 2012, 33(15):2 446-2 453.
[27]ZOUYing,CHENYing-zhuang,YANZhi-hong,etal.Magneticsolid-solid-phaseextractionbasedontetrabenzylmodifiedFe3O4nanoparticlesfortheanalysisoftracepolycyclicaromatichydrocarbonsinenvironmentalwatersamples[J].Analyst,2013,138:5 904-5 912.
[28]TIANMiao-miao,CHENDai-xiong,SUNYu-long,etal.Pillararene-functionalizedFe3O4nanoparticlesasmagneticsolid-phaseextractionadsorbentforpesticideresidueanalysisinbeveragesamples[J].RSCAdvances, 2013,3:22 111-22 119.
[29]WANGXu,NIESSNERR,KNOPPD.MagneticBead-BasedColorimetricImmunoassayforAflatoxinB1UsingGoldNanoparticles[J].Sensors, 2014, 14(11):21 535-21 548.
[30]LIUXue-feng,ZHANGLei,ZENGJing,etal.Superparamagneticnano-immunobeadstowardfoodsafetyinsurance[J].JournalofNanoparticleResearch, 2013,15(7):1-10
[31]YANGYou-jun,XUFeng,XUHeng-yi,etal.Magneticnano-beadsbasedseparationcombinedwithpropidiummonoazidetreatmentandmultiplexPCRassayforsimultaneousdetectionofviableSalmonellaTyphimurium,EscherichiacoliO157∶H7andListeriamonocytogenesinfoodproducts[J].FoodMicrobiology, 2013, 34(2):418-424.
[32]CHOIH,IRUDAYARAJJ.Lateral-flowenzymeimmunoconcentrationforrapiddetectionofListeriamonocytogenes.[J].Analytical&BioanalyticalChemistry, 2013, 405(10):3 313-3 319.
[33]KEE-SHYUANL,YOOKHL,AHMANDM,etal.UseofFe3O4nanoparticlesforenhancementofbiosensorresponsetotheherbicide2,4-dichlorophenoxyaceticacid[J].Sensors, 2008,8(9):5 775-5 791.
[34]QINWen-jie,SULi,YANGChen,etal.ColorimetricdetectionofsulfiteinfoodsbyaTMB-O2-Co3O4Nanoparticlesdetectionsystem.[J].JAgricFoodChem, 2014, 62(25):5 827-5 834.
[35]TAOXiao-qi,CHENMin,JIANGHai-yang,etal.Chemiluminescencecompetitiveindirectenzymeimmunoassayfor20fluoroquinoloneresiduesinfishandshrimpbasedonasingle-chainvariablefragment[J].Analytical&BioanalyticalChemistry, 2013, 405(23):7 477-7 484.
[36]WANGFu-bing,RONGYuan,FANGMin,etal.Recognitionandcaptureofmetastatichepatocellularcarcinomacellsusingaptamer-conjugatedquantumdotsandmagneticparticles.[J].Biomaterials, 2013, 34(15):3 816-3 827.
[37]WANGCheng-quan,QIANJing,WANGKan,etal.Magnetic-fluorescent-targetingmultifunctionalaptasensorforhighlysensitiveandone-steprapiddetectionofochratoxinA.[J].Biosensors&Bioelectronics, 2015, 68(3):783-790.
[38]LIYJ,DONGDY,WANGSL,etal.Focusedionbeamfabricationandmagneto-electricaltransportpropertiesofLa0.67Ca0.33MnO3nanobridge[J].AppliedPhysicsA, 2014, 115(3):791-795.
[39]WENCong-ying,HUJun,ZHANGZhi-ling,etal.One-stepsensitivedetectionofSalmonellatyphimuriumbycouplingmagneticcaptureandfluorescenceidentificationwithfunctionalnanospheres.[J].AnalyticalChemistry, 2013, 85(2):1 223-1 230.
[40]WANGLiu-ling,TAOGuan-hong,MENGYuan-hua.AnovelCdSe/CdSquantumdot-basedcompetitivefluoroimmunoassayforthedetectionofclenbuterolresidueinpigurineusingmagneticcore/shellFe3O4/Aunanoparticlesasasolidcarrier.[J].AnalyticalSciences, 2009, 25(12):1 409-1 413.
[41]SAFARIKI,SAFARIKOVAM.Magneticnano-andmicroparticlesinbiotechnology[J].ChemicalPapers, 2009, 63(5):497-505.
[42]BAGHERIH,AFKHAMIA,SABER-TEHRANIM,etal.PreparationandcharacterizationofmagneticnanocompositeofSchiffbase/silica/magnetiteasapreconcentrationphaseforthetracedeterminationofheavymetalionsinwater,foodandbiologicalsamplesusingatomicabsorptionspectrometry.[J].Talanta, 2012, 97(16):87-95.
[43]WANGXiao-jun,CHENJing-jing,ZHOUYing,etal.DispersiveLiquid-LiquidMicroextractionandMicro-SolidPhaseExtractionfortheRapidDeterminationofMetalsinFoodandEnvironmentalWaters[J].AnalyticalLetters, 2015,48(11):1 787-1 801.
[44]ENSAFIAA,RABIEIS,REZAEIB,etal.Magneticsolid-phaseextractiontopreconcentrateultratraceamountsoflead(II)usingmodified-carbonnanotubesdecoratedwithNiFe2O4magneticnanoparticles[J].AnalyticalMethods, 2013, 5(16):3 903-3 908.
[45]ZHAIYun-hui,DUANShu,HEQun,etal.Solidphaseextractionandpreconcentrationoftracemercury(II)fromaqueoussolutionusingmagneticnanoparticlesdopedwith1,5-diphenylcarbazide[J].MicrochimicaActa, 2010, 169(3/4):353-360.
[46]BAGHBANN,HAJISHABANIAM,DADFARNIAS.Solidphaseextractionoftraceamountsofcadmiumwithcetyltrimethylammoniumbromide-coatedmagneticnanoparticlespriortoitsdeterminationbyflameatomicabsorptionspectrometry[J].JournaloftheChineseChemicalSociety, 2012, 59(6):782-787.
[47]MASHHADIZADEHMH,AMOLIDM,SHAPOURIMR,etal.Solidphaseextractionoftraceamountsofsilver,cadmium,copper,mercury,andleadinvariousfoodsamplesbasedonethyleneglycolbis-mercaptoacetatemodified3-(trimethoxysilyl)-1-propanethiolcoatedFe3O4nanoparticles.[J].FoodChemistry, 2014, 151(20):300-305.
[48]YAOXun-ping,FUZhen-jun,ZHAOYong-gang,etal.Useoftetraethylenepentamine-functionalFe3O4magneticpolymersformatrixsolidphasedispersionextractionandpreconcentrationofCr(VI)inwatersamplesatultratracelevels.[J].Talanta, 2012, 97(16):124-130.
[49]SAMADIA,AMJADIM.MagneticFeO@Cnanoparticlesmodifiedwith1-(2-thiazolylazo)-2-naphtholasanovelsolid-phaseextractionsorbentforpreconcentrationofcopper(II)[J].MicrochimicaActa, 2015,182(1/2):257-264.
[50]WANGYang,CHENHuan-huan,TANGJie,etal.Preparationofmagneticmetalorganicframeworksadsorbentmodifiedwithmercaptogroupsfortheextractionandanalysisofleadinfoodsamplesbyflameatomicabsorptionspectrometry.[J].FoodChemistry, 2015, 181:191-197.
[51]XUBo,WANGYuan-peng,JINRui,etal.Magneticsolid-phaseextractionbasedonFe3O4@polyanilineparticlesfollowedbyultrafastliquidchromatographyfordeterminationofSudandyesinenvironmentalwatersamples[J].AnalyticalMethods,2015,7:1 606-1 624.
[52]YUXi,SUNYing,JIANGChun-Zhu,GAOYan,etal.Magneticsolid-phaseextractionandultrafastliquidchromatographicdetectionofSudandyesinredwines,juices,andmaturevinegars[J].JournalofSeparationScience, 2012,35(23):3 403-3 411.
[53]WUXi-mei,HUJun,ZHUBing-hui,etal.Aptamer-targetedmagneticnanospheresasasolid-phaseextractionsorbentfordeterminationofochratoxinAinfoodsamples.[J].JournalofChromatographyA, 2011, 1 218(41):7 341-7 346.
[54]HASHEMIM,TAHERIMASLAKZ.DeterminationofaflatoxinM1inliquidmilkusinghighperformanceliquidchromatographywithfluorescencedetectionaftermagneticsolidphaseextraction[J].RscAdvances, 2014, 4(63):33 497-33 506.
[55]于希.基于聚苯乙烯磁性纳米颗粒的磁性固相萃取的研究[D].吉林:吉林大学,2013.
[56]WANGLu,ZANGXiao-huan,CHANGQing-yun,etal.Agraphene-coatedmagneticnanocompositefortheenrichmentoffourteenpesticidesintomatoandrapesamplespriortotheirdeterminationbygaschromatography-massspectrometry[J].AnalyticalMethods, 2013, 6(1):253-260.
[57]WANGSong-bai,ZHANGYan,AnW,etal.MagneticrelaxationswitchimmunosensorfortherapiddetectionofthefoodbornepathogenSalmonellaentericainmilksamples[J].FoodControl, 2015, 55:43-48.
[58]VODINHT,LIUY,FALESAM,etal.SERSNanosensorsandNanoreporters:GoldenOpportunitiesinBiomedicalApplications[J].WileyInterdisciplinaryReviews:nanomedicines&snanobiotechnology, 2015, 7(1):17-33.
[59]FERNNDEZ-BALDOMA,BERTOLINOFA,MESSINAGA,etal.ModifiedmagneticnanoparticlesinanelectrochemicalmethodfortheochratoxinAdeterminationinVitisviniferaredgrapestissues.[J].Talanta, 2010, 83(2):651-657.
[60]MASOOMIL,SADEGHIO,BANITABAMH,etal.Anon-enzymaticnanomagneticelectro-immunosensorfordeterminationofAflatoxinB1asamodelantigen[J].Sensors&ActuatorsBChemical, 2013, 177(2):1 122-1 127.
[61]LEEHU,DAUJ,LEEJH,etal.DetectionofglyphosatebyquantitativeanalysisoffluorescenceandsingleDNAusingDNA-labeledfluorescentmagneticcore-shellnanoparticles[J].Sensors&ActuatorsBChemical, 2013, 177(2):879-886.
[62]GABROVSKAKI,IVANOVASI.ImmunofluorescentAnalysiswithMagneticNanoparticlesforSimultaneousDeterminationofAntibioticResiduesinMilk[J].AnalyticalLetters, 2013, 46(10):1 537-1 552.
[63]RAWALR,CHAWLAS,PUNDIRCS.Anelectrochemicalsulfitebiosensorbasedongoldcoatedmagneticnanoparticlesmodifiedgoldelectrode.[J].Biosensors&Bioelectronics, 2012, 31(1):144-150.
[64]WANGXiao-xiao,LIXiang-jun,LUOChuan-nan,etal.Ultrasensitivemolecularlyimprintedelectrochemicalsensorbasedonmagnetismgrapheneoxide/β-cyclodextrin/Aunanoparticlescompositesforchrysoidineanalysis[J].ElectrochimicaActa, 2014,130:519-525.
[65]NGUYENBH,TRANLD,DOQP,etal.Label-freedetectionofaflatoxinM1withelectrochemicalFe3O4/polyaniline-basedaptasensor.[J].MaterialsScience&EngineeringCMaterialsforBiologicalApplications, 2013, 33(4):2 229-2 234.
[66]HAYATA,BARTHELMEBSL,MARTYJL.Enzyme-linkedimmunosensorbasedonsuperparamagneticnanobeadsforeasyandrapiddetectionofokadaicacid[J].AnalyticaChimicaActa, 2011, 690(2):248-252.
[67]LIJian-ping,XUQian,WEIXiao-ping,etal.Anelectrogeneratedchemiluminescenceimmunosensorforbacillusthuringiensiscry1acbasedonFe3O4@Aunanoparticles.[J].JournalofAgricultural&FoodChemistry, 2013, 61(7):1 435-1 440.
[68]ZHUHong-lin,HUYin,JIANGGuan-xin,etal.Peroxidase-likeactivityofaminopropyltriethoxysilane-modifiedironoxidemagneticnanoparticlesanditsapplicationtoclenbuteroldetection[J].EuropeanFoodResearch&Technology, 2011, 233(5):881-887.
Areviewofapplicationofsurfacemodifiedmagneticnano-materialsinrapidfooddetection
SUMin,MALiang*,ZHANGYu-hao,ZHONGhong,WANGJia-man
(CollegeofFoodScience,SouthwestUniversity,Chongqing400715,China)
Magneticnano-materialshavealotofcharacteristicsincludinghighspecificsurface,smallsize,highcouplingcapacity,surfacemodifiabilityandthemagneticproperties.Themagneticnanoparticlescanbecoatedbyinorganicnano-materials,smallorganicmoleculesandorganicpolymerssothattheycouldbedispersedandfunctionthroughreducingthesurfacepotential.Moreover,theappropriatesurfacecoatingofthemagneticnano-materialscanalsoadjustitsbiocompatibilityanditsresponseinrapidfooddetection.Magneticnano-materialscanbewidelyusedinpretreatmentofsamplessuchasseparationandpurification,extractionandconcentrating,signalamplification,selectivityandsensitivityincreasing.Inrecentyears,extractingmethodbasedonmagneticnano-materialsandnewtypeofsensorsweredevelopedrapidly.Inthisarticle,thestudyandapplicationofmagneticnano-materialsincontaminatedeterminationinfoodweresummarizedandanalyzed.Thefurtherresearchtrendwasproposed.
magneticnano-materials;surfacemodification;rapiddetection;magneticsolidphaseextraction;sensor
10.13995/j.cnki.11-1802/ts.201608043
硕士研究生(马良副教授为通讯作者,E-mail:zhyhml@163.com)。
国家重点基础研究发展计划(973计划)项目课题(NO.2013CB127803);国家自然科学基金项目(31301476);中央高校基本科研业务费重大项目(XDJK2015A015)
2015-11-24,改回日期:2016-01-13
