质膜钙ATP酶异构体1~4的剪接体在新生大鼠前庭器官的表达△
2016-10-19罗蜜褚汉启陶雁玲周良强陈金刘云潘春晨陈请国
罗蜜 褚汉启 陶雁玲 周良强 陈金 刘云 潘春晨 陈请国
·实验研究·
质膜钙ATP酶异构体1~4的剪接体在新生大鼠前庭器官的表达△
罗蜜1,2褚汉启1陶雁玲1周良强1陈金1刘云1潘春晨1陈请国1
目的研究质膜钙ATP酶异构体(plasma membrane Ca2+-ATPase isoforms,PMCAs)1~4(PMCA1~4)的A端和C端剪接变异体在新生大鼠前庭器官的表达。方法取出生2天的健康SD大鼠10只, 断头后分离出前庭器官(椭圆囊斑和球囊斑),提取总RNA,通过逆转录聚合酶链反应(RT-PCR)方法,检测PMCA1~4的A端和C端剪接变异体的表达。结果在新生大鼠的椭圆囊斑和球囊斑PMCA1~4表达的剪接体分别为PMCA1x/b, PMCA2w/(a、b),PMCA3z/(a、b、c)和PMCA4 (x、z)/b。结论在新生大鼠前庭器官,PMCA1、PMCA2、PMCA3和PMCA4之间表达的A端和C端剪接变异体类型均不同, 这可能是由于椭圆囊斑和球囊斑对这些PMCA亚型有着不同的Ca2+调节需求。
质膜钙ATP酶异构体1~4;剪接体;椭圆囊斑;球囊斑
在内耳,精准地控制毛细胞内Ca2+浓度对维持正常的听觉和平衡觉十分关键。质膜钙ATP酶异构体(plasma membrane Ca2+-ATPase isoforms,PMCAs)是维持细胞内Ca2+浓度平衡的重要蛋白质之一,其主要作用是将细胞内Ca2+转移到细胞外,从而维持细胞内低Ca2+水平,保证其发挥正常的生理功能。PMCAs存在4种亚型,分别是 PMCA1~4,由ATP2B1~4基因编码,其结构上存在两个位点,分别是PMCAs胞质区的第一个结构环(A端)和PMCAs胞质尾端的C末端(C端)[1]。PMCA1~4结构序列的 A 端和C 端存在着不同形式的剪接体[2],这些剪接体可以通过调节调控元件来影响PMCA1~4的排钙能力[3]。已证实PMCA2突变的小鼠出现平衡功能障碍,主要是由于前庭毛细胞内的Ca2+不能有效地进入内淋巴液,导致球囊和椭圆囊中的耳石无法形成[4],从而无法感受直线加速度运动的刺激。目前有关PMCAs在内耳的研究主要集中在耳蜗,其在前庭的研究甚少[4]。因此,本研究拟通过检测新生大鼠前庭器官(椭圆囊斑和球囊斑)PMCA1~4的A端和C端剪接体的表达,为更深入地研究其在前庭器官的功能提供参考,同时为治疗与PMCAs有关的内耳疾病(如PMCA2基因突变所致的耳聋)提供新的思路。
1 材料与方法
1.1实验动物选择出生后第2天的健康SD大鼠10只,无中耳感染、耳毒性药物应用及强噪声暴露史。所有动物由华中科技大学同济医学院动物中心提供,实验都经过华中科技大学同济医学院动物委员会同意,具备实验合格证书。
1.2主要试剂和仪器Trizol (Invitrogen,美国),逆转录试剂盒(TOYOBO,日本),反转录试剂盒(TOYOBO, 日本),PCR 引物(上海生工公司),GelDoc XR 凝胶成像系统(美国Bio-Rad公司),PCR 仪(美国Bio-Rad公司),显微解剖镊(瑞士Dumont公司),解剖显微镜(日本Nikon 公司)。
1.3实验方法
1.3.1球囊及椭圆囊取材取10只新生大鼠颈椎脱臼法处死,打开前庭窗,用分离针沿前庭窗后下缘挑开前庭外侧骨壁,充分暴露前庭池内的球囊。用微细分离针首先在球囊的前缘划开骨膜,沿球囊背侧与前庭内侧壁之间紧贴骨壁直至分离,直至整个球囊游离,用微细分离针挑开球囊的囊壁并轻轻挑除耳石膜取出球囊斑。同法取椭圆囊斑。
1.3.2逆转录聚合酶链反应(RT-PCR)Trizol法提取总RNA,按照 TOYOBO 逆转录试剂盒逆转录为 cDNA,然后以cDNA为模板,行聚合酶链反应。PMCA1~4的A端和C端剪接体引物见引文[2,5,6]。PMCA1~4的A端剪接体引物如下。PMCA1:F,5′-TAGGCACCTTTGTGGTGCAG-3′,R,5′-CGGCTCTGAATCTTCTATCC-3′;PMCA2:F,5′-GAAAGCTCGCTCACAGGGGAG-3′, R,5′-ACCCATGGTCTCACAGGCG-3′;PMCA3:F,5′-CATGTCATGGAAGGTTCTGG-3′,R ,4′-GTTATTGTCCTTCATCATTTTCTT-3′;PMCA4:F,5′-GTGACTGCTGTG GGAATCAA-3′,R,5′-GTTGTTGTCCTTCATCATTTTCTT-3′;PMCA1~4的C端剪接体引物如下。PMCA1: F, 5′-TAGGCACCTTTGTGG TGCAG-3′,R,5′-CGGCTCTGAATCTTCTATCC-3′; PMCA2: F, 5′-AAGATCCACGGCGAGCGTAAC-3′, R, 5′-GCTCG AGTTCTGCTTGAGCGC-3′;PMCA3: F, 5′-GTCCAATTTGGAGGGAAGCC-3′, R, 5′-CGTTGTTGTTCTGGTT AGGG-3′; PMCA4, F, 5′-ATGCCGA GATGGAGCTTCGC-3′, R, 5′-CAGCATCCGACAGGCGCTTG-3′。内参为β-actin: F, 5′-CCTCTATGCCAACACAGTGC-3, R, 5′-TCTGCTGGAAGGTGGACAGT-3′。PCR循环条件:预变性95 ℃5分钟,变性94 ℃45秒,退火55~60 ℃45秒,延伸72 ℃45秒,终末延伸72 ℃10分钟(变性、退火、延伸共计30个循环);所得产物5 μl在2%的琼脂糖凝胶中电泳,在GelDoc XR凝胶成像系统下成像。
2 结果
2.1PMCA1~4的A端和C端剪接变异体在新生大鼠椭圆囊斑的表达在椭圆囊斑(U)样本,PCR引物在PMCA1的A端和C端分别扩增出519 bp和430 bp大小的条带(图1),分别称为剪接体x和b;在PMCA2的A端和C端分别扩增出762 bp和552 bp、325 bp大小的条带(图2),分别称为剪接体w和a、b,其中b的表达较弱;在PMCA3的A端和C端分别扩增出521 bp和646 bp、492 bp、579 bp大小的条带(图3),分别称为剪接体z和a、b、c;在PMCA4的A端和C端分别扩增出524 bp、488 bp和260bp大小的条带(图4),分别称为剪接体x、z和b。
2.2PMCA1~4的A端和C端剪接变异体在新生大鼠球囊斑的表达在球囊斑(S)样本,PCR引物在PMCA1的A端和C端分别扩增出519 bp和430 bp大小的条带(图1),分别称为剪接体x和b;在PMCA2的A端和C端分别扩增出762 bp和552 bp、325 bp大小的条带(图2),分别称为剪接体w和a、b,其中b的表达较弱;在PMCA3的A端和C端分别扩增出521 bp和646 bp、492 bp、579 bp大小的条带(图3),分别称为剪接体z和a、b、c;在PMCA4的A端和C端分别扩增出524 bp、488 bp和260 bp大小的条带(图4),分别称为剪接体x、z和b。
3 讨论
在内耳,前庭系统的生理功能对维持身体平衡非常重要,而Ca2+参与维持前庭平衡功能[4]。PMCA在未激活状态下对Ca2+的亲和力很低(平衡解离常数Kd约为10 μM),不具备清除细胞内Ca2+的能力,因此,需要启动一些机制来提高它与Ca2+的亲和性。通过调节PMCA结构上的两个位点可激活其钙泵功能,其中一个位点位于PMCA胞质尾端的C末端(C端)[7],通过它可以调节PMCA与钙调节蛋白(calmodulin)的亲和性,而钙调节蛋白是最早被发现的激活剂[8,9],能将Ca2+的Kd从10 μM降到200 nM;另一个位点是位于PMCA胞质区的第一个结构环(A端)[10],磷脂类物质对它的激活作用甚至强于钙调节蛋白,能将Ca2+的Kd从10 μM降到100 nM[11]。PMCA1~4的A端和C端均存在不同的剪接方式[2],其中A端由含33、36、39、42和60个核苷酸的外显子以不同的组合形式剪接而成,产生剪接体w、x、y和z;C端的剪接方式更复杂,由含55、68、87、88、114、154、172和178个核苷酸的外显子以不同的组合形式剪接而成,产生剪接体a、b、c、d、e和f。PMCA1~4的A端和C端的剪接形式影响其排钙能力。
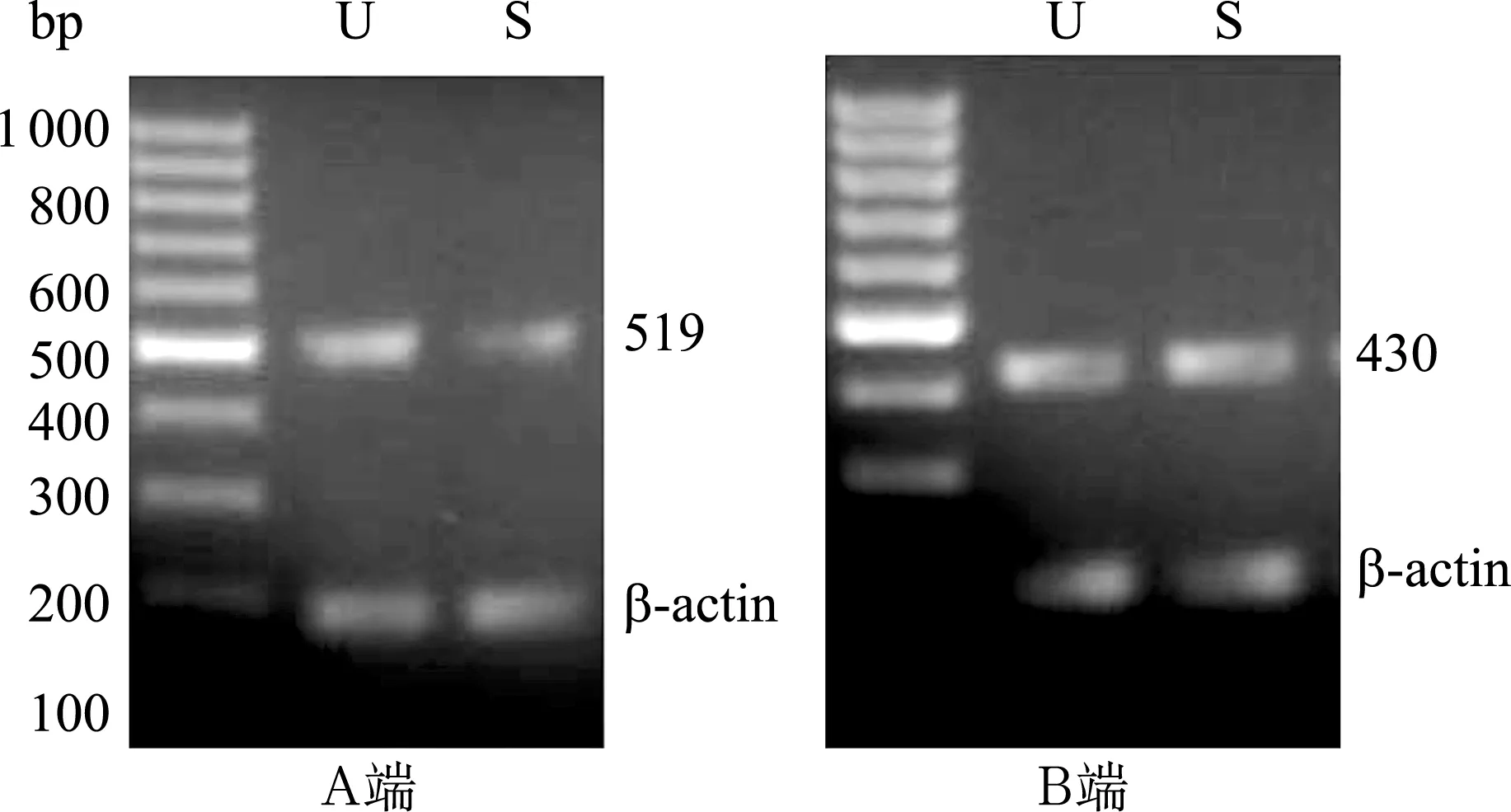
图1RT-PCR方法检测PMCA1在新生大鼠前庭椭圆囊斑(U)和球囊斑(S)表达电泳图
在PMCA1的A端,U和S均扩增出一条 519 bp大小的条带,称为剪接体x;在PMCA1的C端,U和S均扩增出一条430 bp大小的条带,称为剪接体b。左侧条带为标记物Marker。β-actin为内参条带
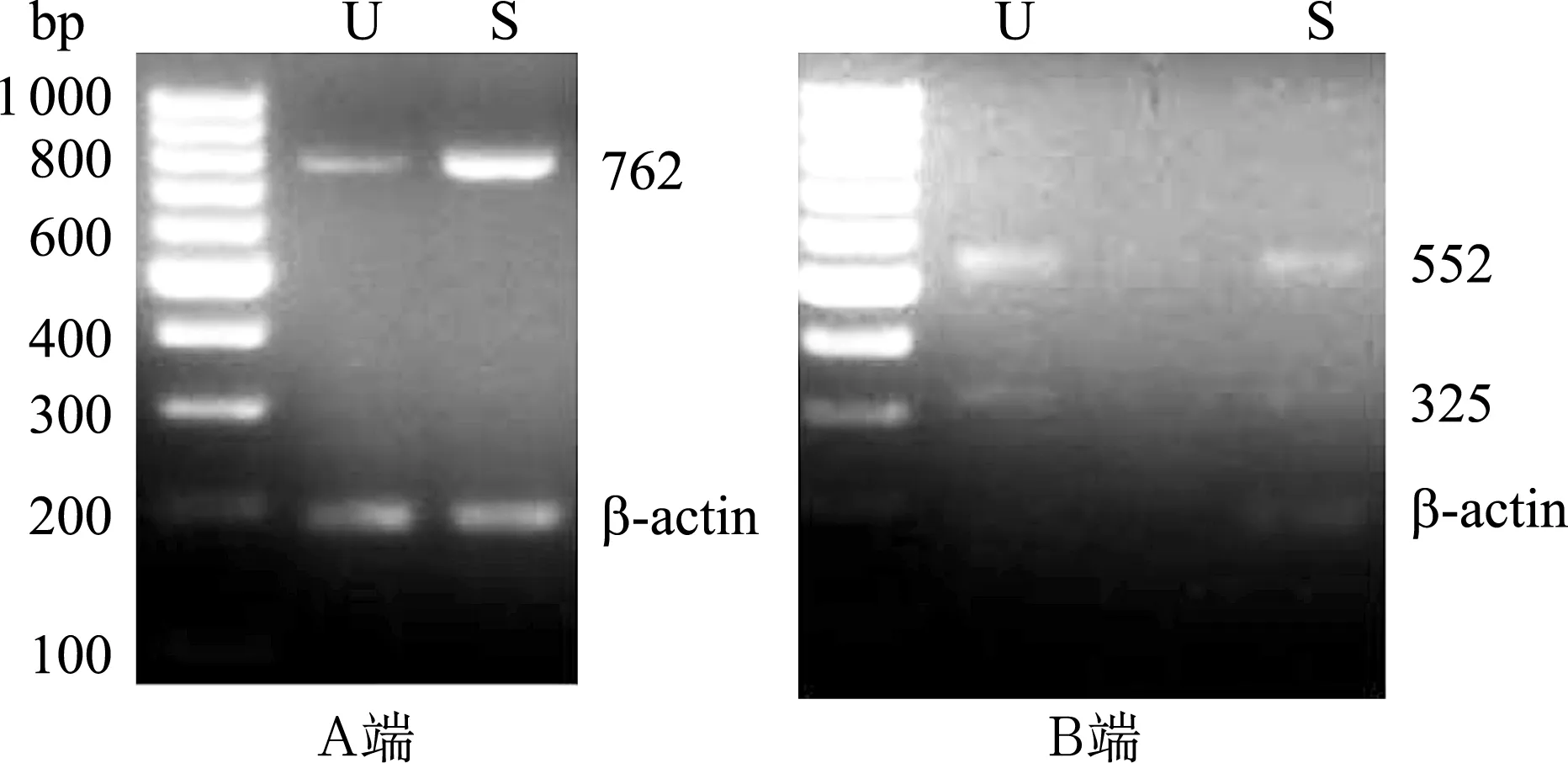
图2RT-PCR方法检测PMCA2在新生大鼠前庭椭圆囊斑(U)和球囊斑(S)表达电泳图
在A端, U和S均扩增出一条762 bp大小的条带,称为剪接体w;在C端, U和S均扩增出两条 552 bp和325 bp 大小的条带,分别称为剪接体a和b,其中b的表达量较弱。左侧条带为标记物Marker。β-actin为内参条带

图3RT-PCR方法检测PMCA3在新生大鼠前庭椭圆囊斑(U)和球囊斑(S)表达电泳图
在A端, U和S均扩增出一条521 bp大小的条带,称为剪接体z;在C端, U和S均扩增出三条646 bp、492 bp和579 bp大小的条带,分别称为剪接体a、b和c。左侧条带为标记物Marker。β-actin为内参条带

图4RT-PCR方法检测PMCA4在新生大鼠前庭椭圆囊斑(U)和球囊斑(S)的表达电泳图
在A端, U和S均扩增出两条524 bp和488 bp大小的条带,称为剪接体x和z;在C端, U和S均扩增出一条260 bp大小的条带,分别称为剪接体b。左侧条带为标记物Marker。β-actin为内参条带
PMCA1和PMCA2是表达于前庭毛细胞的两种主要PMCA亚型,其表达的剪接体类型也有报道[12,13]。由于前庭毛细胞缺少Na/Ca交换体,因此,其主要依靠PMCA1和PMCA2排出细胞内的钙离子,保证前庭毛细胞发挥正常的生理功能。最新研究发现PMCA2的表达水平随着听觉系统的发育成熟逐渐升高[14],PMCA2结构上的一个新的突变位点dfwi5 联合Cdh23突变可导致耳聋和平衡功能失调[15],进一步证实了PMCA2在耳蜗和前庭发挥重要的作用。有关PMCA3和PMCA4在前庭器官的表达也有少量报道[12],但PMCA3和PMCA4的剪接体在哺乳动物前庭器官的表达尚不明确,PMCA3可能参与神经递质释放的调控,PMCA4可能参与协助其他PMCA亚型发挥作用[13]。
本研究结果显示新生大鼠前庭器官的椭圆囊斑和球囊斑表达的PMCA1~4的A端和C端剪接体类型一致,均为PMCA1x/b, PMCA2w/(a、b),PMCA3z/(a、b、c)和PMCA4 (x、z)/b。有研究证实,在大鼠前庭器官,PMCA1主要表达在前庭毛细胞侧膜,PMCA2主要表达在前庭毛细胞纤毛[16]。结合本研究,可以推测PMCA2w/(a、b)是表达于大鼠前庭毛细胞纤毛的剪接体,PMCA1x/b是表达于前庭毛细胞侧膜的剪接体。为了探讨不同类型的剪接体之间的功能差异,有学者将携带z/a、z/b、w/a和w/b的质粒体外转染中国仓鼠卵巢细胞,然后观察其对ATP所激发的短暂的胞内Ca2+电流的峰值及Ca2+浓度恢复到正常水平速度的影响,结果发现z/a、z/b和w/b的排钙能力无明显差异,相比而言,w/a对Ca2+内流的快速反应能力较差,但它在基础Ca2+水平时的排钙能力较强[16]。值得注意的是,大鼠耳蜗毛细胞纤毛表达的主要剪接变异体是PMCA2 w/a[17],而本研究发现前庭毛细胞纤毛表达的剪接体也以PMCA2w/a为主,w/a的这种功能特点符合毛细胞对Ca2+的需求,即在静息状态下毛细胞纤毛保持低Ca2+水平,从而保证其具有最佳的机械电转导敏感性。PMCA2突变的小鼠出现平衡功能障碍[4],结合PMCA2w/a在基础Ca2+水平时排钙能力较强的特点,推测w/a与大鼠发育中前庭囊斑耳石的形成有密切关联。从本研究结果看新生大鼠前庭毛细胞表达的PMCA2的C端剪接体主要是a, 此外还有少许b, 这和Dumont 在成年牛蛙和大鼠感觉上皮毛细胞纤毛的发现相似[12]。毛细胞纤毛偏向“选择”剪接体2a,可能是因为2a与2b在结构上的CaM-BD氨基酸序列不同,2a自我抑制状态较2b不稳定,故2a与Ca2+-钙调蛋白的亲和力低于2b。毛细胞纤毛间不断进行着机械电转导过程,纤毛内Ca2+浓度变化频繁,剪接体2a与钙调蛋白的亲和力低于2b,对钙调蛋白的依赖性低,在钙调蛋白缺如的情况下也可以起作用[18]。
PMCAs的剪接体与PMCAs在极性细胞的定位有一定的关系。剪接体PMCA1x参与其顶端定位,将PMCA1x/b的剪接体b剪切掉后,PMCA1由原来的侧膜定位变成在顶膜、侧膜表达[19],从而可以解释PMCA1x/b表达在毛细胞胞膜(顶膜和侧膜区域)。PMCA1可以通过C末端(即剪接体PMCA1b)与细胞侧膜区域PDZ-domain(PSD95/D1g/ZO-1的缩写,PSD是突触后致密蛋白,ZO-1是紧密连接蛋白-1,基因discs large编码的蛋白称D1g蛋白)结合从而介导其与多种蛋白作用,使之二聚化激活其活力,PDZ-protein有质膜鸟苷酸激酶(MAGUK)家族、胁道相关蛋白(SAP)、钙/钙调蛋白依赖性丝氨酸蛋白激酶(CASK)、Na+/H+交换体调节因素2、PISP、Ania3/Homer protein(Homer蛋白Ania3)[20]。PMCA2 在极性细胞的顶膜定位由其A 端剪接体决定,与 C 端剪接体无关。剪接体w决定PMCA2 在极性细胞的顶膜定位,如毛细胞[12]以及乳腺上皮细胞[21],而z 决定PMCA2 在细胞胞体侧膜定位[1,19]。
目前有关PMCA1和PMCA2在内耳的分布及功能方面的研究较多,但有关PMCA3和PMCA4在内耳的研究很少。PMCA3的表达局限,主要分布在大脑脉络膜血管丛[22]和骨骼肌[23]。在内耳,有学者通过原位杂交方法检测到PMCA3在出生至成年大鼠的耳蜗-前庭神经元表达[6],但PMCA3在前庭组织表达的剪接体类型尚不清楚。本文首次报道新生大鼠前庭上皮表达的PMCA3的A端和C端剪接体分别为z和a、b、c;而在新生大鼠耳蜗, PMCA3表达的C端剪接体也为a、b和c[6],这说明PMCA3在耳蜗和前庭表达的剪接体类型一致。PMCA4是一种管家基因,表达于很多类型的细胞[24],PMCA4除了发挥防止Ca2+超载的基本功能外,也在特定的组织发挥着特殊的功能,比如参与精子活性、平滑肌收缩功能的调节及B淋巴细胞和其他组织内的Ca2+信号调控[4]。PMCA4在发育中的耳蜗组织中表达非常微弱,只在出生后第12天的耳蜗内毛细胞有短暂的高表达[6];本研究首次发现PMCA4在新生大鼠椭圆囊斑和球囊斑表达的剪接体为PMCA4 (x、z)/b;膜相关鸟苷酸激酶家族的成员通过PDZ区域介导的相互反应与PMCA4b关联[25],PMCA4b是一氧化氮合酶1(NOS-1)的负调控因子,这种生理活动的开始同时需要PMCA4的Ca2+转运活动和介于PMCA4b和NOS-1之间的PDZ区域介导的反应[26]。目前尚无研究发现PMCA3和PMCA4与前庭平衡功能直接关联,但不排除它们协助PMCA2维持前庭平衡功能。
PMCA 的四种亚型在同一种属中有75%~85%的同源性和85%~90%的相似性[27],它们的主要功能基本相同,即将细胞内的钙离子排到细胞外,这些PMCA 亚型共同的结构是该钙泵基本的组成部分,而PMCA不同的剪接体则可能与各个钙泵的特异功能有关,从而满足不同的组织或细胞的生理需求。尽管最近几年有关PMCAs 的研究有了很大的进展,但仍远远不够,PMCA 的3D结构的阐明还没有实质性进展;随着PMCAs 在不同组织、细胞甚至细胞某个区域中所发挥的作用引起越来越多的关注,相信以后有关 PMCA 1~4及其剪接体在内耳发挥的功能将得到更充分的认知。
1Chicka MC, Strehler EE. Alternative splicing of the first intracellular loop of plasma membrane Ca2+-ATPase isoform 2 alters its membrane targeting[J]. J Biol Chem, 2003, 278:18464.
2Crouch JJ, Schulte BA. Identification and cloning of site C splice variants of plasma membrane Ca-ATPase in the gerbil cochlea[J]. Hear Res, 1996, 101: 55.
3Carafoli E. Plasma membrane calcium pump: structure, function and relationships[J]. Basic Res Cardiol, 1997, 92:59.
4Prasad V, Okunade G, Liu L, et al. Distinct phenotypes among plasma membrane Ca2+-ATPase knockout mice[J]. Ann NY Acad Sci, 2007, 1099:276.
5Kamagate A, Herchuelz A, Bollen A, et al. Expression of multiple plasma membrane Ca2+-ATPases in rat pancreatic islet cells[J]. Cell Calcium, 2000, 27:231.
6Furuta H, Luo L, Hepler K, et al. Evidence for differential regulation of calcium by outer versus inner hair cells: plasma membrane Ca-ATPase gene expression[J]. Hearing Res, 1998, 123:10.
7Brodin P, Falchetto R, Vorherr T, et al. Identification of two domains which mediate the binding of activating phospholipids to the plasma-membrane Ca2+pump[J]. Eur J Biochem, 1992, 204:939.
8Gopinath RM, Vincenzi FF. Phosphodiesterase protein activator mimics red blood cell cytoplasmic activator of (Ca2+-Mg2+) ATPase[J]. Biochem Biophys Res Commun, 1977, 77:1203.
9Jarrett HW, Penniston JT. Partial purification of the Ca2+-Mg2+ATPase activator from human erythrocytes: its similarity to the activator of 3':5' - cyclic nucleotide phosphodiesterase[J]. Biochem Biophys Res Commun, 1977, 77: 1210.
10Pinto Fde T, Adamo HP. Deletions in the acidic lipid-binding region of the plasma membrane Ca2+pump. A mutant with high affinity for Ca2+resembling the acidic lipid-activated enzyme[J]. J Biol Chem, 2002, 277:12784.
11Enyedi A, Flura M, Sarkadi B, et al. The maximal velocity and the calcium affinity of the red cell calcium pump may be regulated independently[J]. J Biol Chem, 1987, 262:6425.
12Dumont RA, Lins U, Filoteo AG, et al. Plasma membrane Ca2+-ATPase isoform 2a is the PMCA of hair bundles[J]. J Neurosci, 2001, 21:5066.
13Polimeni M, Prigioni I, Russo G, et al. Plasma membrane Ca2+-ATPase isoforms in frog crista ampullaris: identification of PMCA1 and PMCA2 specific splice variants[J]. Hear Res, 2007, 228:11.
14Watson CJ, Lies SM, Minich RR, et al. Changes in cochlear PMCA2 expression correlate with the maturation of auditory sensitivity[J]. J Assoc Res Otolaryngol, 2014, 15:543.
15Watson CJ, Tempel BL.A new Atp2b2 deafwaddler allele, dfw(i5), interacts strongly with Cdh23 and other auditory modifiers[J]. Hear Res, 2013, 304:41.
16Ficarella R, Di Leva F, Bortolozzi M, et al. A functional study of plasma-membrane calcium-pump isoform 2 mutants causing digenic deafness[J]. Proc Natl Acad Sci, 2007, 104: 1516.
17Chen QG, Chu HQ, Wu XH, et al. The expression of plasma membrane Ca2+-ATPase isoform 2 and its splice variants at sites A and C in the neonatal rat cochlea[J]. Int J Pediatr Otorhinolaryngol, 2011, 75:196.
18Elwess NL, Filoteo AG, Enyedi A, et al. Plasma membrane Ca2+pump isoforms 2a and 2b are unusually responsive to calmodulin and Ca2+[J]. J Biol Chem, 1997, 272: 17981.
19Grati M, Aggarwal N, Strehler EE, et al. Molecular determinants for differential membrane trafficking of PMCA1 and PMCA2 in mammalian hair cells[J]. J Cell Sci, 2006, 119:2995.
20Vorherr T, Kessler T, Hofmann F, et al. The calmodulin-binding domain mediates the self-association of the plasma membrane Ca2+pump[J]. J Biol Chem, 1991, 266:22.
21Reinhardt TA, Filoteo AG, Penniston JT, et al. Ca2+-ATPase protein expression in mammary tissue[J].Am J Physiol Cell Physiol, 2000, 279: C1595.
22Stahl WL, Eakin TJ, Owens JW Jr, et al. Plasma membrane Ca2+-ATPase isoforms: distribution of mRNAs in rat brain by in situ hybridization[J].Brain Res Mol Brain Res, 1992,16 :223.
23Greeb J, Shull GE. Molecular cloning of a third isoform of the calmodulin-sensitive plasma membrane Ca2+-transporting ATPase that is expressed predominantly in brain and skeletal muscle[J]. J Biol Chem,1989,264:18569.
24Hammes A, Oberdorf S, Strehler EE, et al, Differentiation-special isoform mRNA expression of the calmodulin-dependent plasma membrane Ca2+-ATPase[J]. FASEB J, 1994, 8:428.
25Kim E, DeMarco SJ, Marfatia SM, et al. Plasma membrane Ca2+ATPase isoform 4b binds to membrane-associated guanylate kinase(MAGUK) proteins via their PDZ(PSD95/Dlg/ZO-1) domains[J]. J Biol Chem, 1998, 273: 1591.
26Schuh K, Uldrijan S, Telkamp M, et al. The plasma membrane calmodulin-dependent calcium pump: a major regulator of nitric oxide synthase I[J]. J Cell Biol, 2001, 155: 201.
27Strehler EE. Recent advances in the molecular characterization of plasma membrane Ca2+pumps[J]. J Membr Biol, 1991, 120: 1.
(2016-02-16收稿)
(本文编辑周涛)
The Expression of Plasma Membrane Ca2+-ATPase Isoforms 1~4 and the Splice Variants at Sites A and C in the Neonatal Rat Vestibular Organ
Luo Mi*, Chu Hanqi, Tao Yanling, Zhou Liangqiang, Chen Jin,Liu Yun, Pan Chunchen, Chen Qingguo
(*Department of Otolaryngology-Head and Neck Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan, 430030,China)
ObjectiveTo study the expression of plasma membrane Ca2+-ATPase isoforms 1-4 and the splice variants at sites A and C in the neonatal rat vestibular organ. MethodsTen rats at postnatal 2 days (P2) were decapitated and their vestibular organs (macula utriculi and macula sacculi) were isolated. The total proteins of the vestibular organs were extracted. The expression of PMCA1-4 splice variants at sites A and C was detected by RT-PCR. ResultsThe splice variants of PMCA1-4 at sites A and C in macula utriculi and macula sacculi of neonatal rat vestibular organs were PMCA1x/b, PMCA2w/(a,b),PMCA3z/(a,b,c)and PMCA4 (x,z)/b.ConclusionThe splice variants at sites A and C among PMCA1, PMCA2, PMCA3 and PMCA4 were different in the vestibular organs of neonatal rats, which could be explained that macula utriculi and macula sacculi had different requirements of Ca2+turning for these PMCA isoforms.
Plasma membrane Ca2+-ATPase isoforms 1~4;Splice variants;Macula utriculi;Macula sacculi
△国家自然科学基金青年基金资助(81300827)
1华中科技大学同济医学院附属同济医院耳鼻咽喉-头颈外科(武汉430030);2湖北文理学院附属襄阳市中心医院耳鼻咽喉-头颈外科
罗蜜,女,湖北人,住院医师,主要研究方向为听觉生理。
陈请国(Email:cqg198292@126.com)
10.3969/j.issn.1006-7299.2016.05.013
R764.3
A
1006-7299(2016)05-0473-05
网络出版时间:2016-6-2916:16
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160629.1616.070.html
