垂盆草不同极性部位体外抗氧化活性的研究
2016-10-19俞雪锋姚晓敏
陈 磊 俞雪锋 姚晓敏▲
1.浙江中医药大学药学院,浙江杭州310053;2.浙江医药高等专科学校药学院,浙江宁波315100
垂盆草不同极性部位体外抗氧化活性的研究
陈磊1,2俞雪锋2姚晓敏2▲
1.浙江中医药大学药学院,浙江杭州310053;2.浙江医药高等专科学校药学院,浙江宁波315100
目的研究垂盆草80%乙醇提取物不同极性部位的体外抗氧化活性。方法采用5种不同极性溶剂(石油醚、氯仿、乙酸乙酯、正丁醇、水)萃取得到5种萃取物,通过总还原能力、DPPH自由基清除能力、羟自由基清除能力和ABTS自由基清除能力4种方法对各萃取物的抗氧化能力进行研究。结果垂盆草不同极性部位提取物均具有一定的抗氧化活性,其中乙酸乙酯萃取部位的抗氧化能力最强,在总还原能力和清除DPPH自由基上,乙酸乙酯萃取部位作用明显强于其他四个极性部位,其清除ABTS自由基的半数浓度IC50为0.0131 mg/mL,清除羟基自由基的半数浓度IC50为1.0730 mg/mL。结论垂盆草醇提物的乙酸乙酯萃取部位具有较强的抗氧化活性,本研究为扩展垂盆草的应用范围和进一步研究其抗氧化活性成分提供了理论依据。
垂盆草;萃取物;抗氧化;自由基
[Abstract]Objective To study the in vivo antioxidant activity of parts with different polarity of the sedum sarmentosum 80%ethanol extract.Methods 5 extracts were obtained by 5 solvent with different polarity(petroleum ether,chloroform,ethyl acetate,n-butyl alcohol and water)and the antioxidant activity of each extract were studied by total reducing capacity,clearance capacity of DPPH free radicals,clearance capacity of hydroxyl radical and the clearance capacity of ABTS free radicals.Results Certain antioxidant activity was presented in the extracts of sedum sarmentosum parts with different polarity,and the activity of extract obtained by ethyl acetate was the strongest and was significantly stronger than the other four extracts in the respect of total reducing capacity and clearance capacity of DPPH free radicals.The IC50of clearing ABTS free radicals was 0.0131mg/mL and the IC50of clearing hydroxyl radicals was 1.0730 mg/mL. Conclusion Sedum sarmentosum extract obtained by ethyl acetate presents the strongest antioxidant activity and the study provide theoretical evidence for the extension of application range of sedum sarmentosum and further study of the antioxidant activity components.
[Key words]Sedum sarmentosum;Extract;Antioxidant;Free radical
人体在新陈代谢过程中会产生大量的自由基,正常情况下,自由基的生成与消除维持着一种动态平衡,但是当这种平衡被破坏时就会引起体内自由基的过量积累,从而对人体造成伤害,如肿瘤、心血管疾病等的发生均与自由基的过量积累及其诱导的系列氧化反应有着密切的联系[1,2]。目前,有研究表明中药的功效与其抗氧化作用有着紧密的联系,中药的黄酮、酚类、皂苷、多糖等物质均具有良好的抗氧化活性[3,4],因此,研究中草药的抗氧化活性具有十分重要的意义。
垂盆草为景天科(Crassulaceae)植物垂盆草(Sedum sarmentosum Bunge)的新鲜或干燥全草,收载于2010版《中国药典》,其性凉,味甘、淡,具有利湿退黄、清热解毒的功效[5]。临床上多用于治疗黄疸、急慢性肝炎和蛇伤烫伤等[6]。国内外研究表明垂盆草主要含有黄酮、三萜、甾醇、生物碱、氰苷、糖类等成分[7,8],其具有保护肝脏、抗肿瘤、免疫抑制和抑菌等药理作用[9-11]。目前,关于垂盆草提取物及其不同极性部位的抗氧化活性研究尚未见报道。因此,本文通过总还原能力、清除DPPH自由基、羟基自由基和ABTS自由基比较垂盆草醇提物及其不同极性部位之间的抗氧化活性能力,旨在为系统开发垂盆草植物资源在食品、药品和保健品等领域的应用提供一些理论参考。
1 材料与方法
1.1材料
1.1.1实验原料垂盆草购自宁波鄞州医药药材有限公司,并由中药专业王和平教授鉴定为景天科植物垂盆草(Sedum sarmentosum Bunge)。
1.1.2主要试剂1,1-二苯基-2-三硝基苯肼(DPPH,日本东京化成工业株式会社,批号:08110127);2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,Sigma公司,批号:A9941);抗坏血酸(Vc,上海国药集团,批号:20120902);无水乙醇(天津市科密欧化学试剂有限公司,批号:20151103);石油醚(天津博迪化工股份有限公司,批号:20150701);三氯甲烷(国药集团化学试剂有限公司,批号:20150703);乙酸乙酯(天津博迪化工股份有限公司,批号:20160110);正丁醇(天津市科密欧化学试剂有限公司,批号:20160113);铁氰化钾(国药集团化学试剂有限公司,批号:20150311);磷酸氢二钠(国药集团化学试剂有限公司,批号:20141119);磷酸二氢钠(天津市北辰方正试剂厂,批号:20150503);氯化钠(国药集团化学试剂有限公司,批号:20140312);三氯化铁(天津市化学试剂厂,20151114);硫酸亚铁(国药集团化学试剂有限公司,批号:20140729);水杨酸(国药集团化学试剂有限公司,批号:20141103);三氯乙酸(国药集团化学试剂有限公司,批号:F20050624);过硫酸钾(Sigma公司,批号:216224);30%过氧化氢(国药集团化学试剂有限公司,批号:20160104)。
1.1.3实验仪器JFSD-100粉碎机(北京环亚天元机械技术有限公司);RE-52旋转蒸发仪(上海亚荣生化仪器厂);DHG-9070A烘干箱(宁波江南仪器厂);UV-1240紫外可见分光光度计(日本岛津公司);DK-S26数显恒温水浴锅(金坛市维诚实验器材厂);JA26038电子天平(上海天美天平仪器有限公司);80-2B离心机(上海安亭科学仪器厂)。
1.2实验方法
1.2.1样品制备垂盆草干燥全草粉碎后过60目筛,得到垂盆草粉末。取500 g垂盆草粉末,按料液比1∶20,加入80%乙醇浸泡24 h,在室温条件下超声波辅助提取1 h,过滤,滤渣按上述条件重复提取2次,将3次得到的滤液在50℃条件下减压浓缩成浸膏。取部分浸膏进行冷冻干燥,得到粗提物的干样。将剩余浸膏用水打散,按极性由小到大顺序依次用石油醚、三氯甲烷、乙酸乙酯和正丁醇萃取,每个极性部位萃取3次,减压浓缩后冷冻干燥得到石油醚层、三氯甲烷层、乙酸乙酯层、正丁醇层和水层5个干样,干样称重后密封保存于4℃冰箱内待用。
1.2.2总还原能力测定[12]量取不同浓度的各样品溶液1.0 mL于各试管中,加入磷酸盐缓冲溶液(pH=6.6) 2.5 mL和铁氰化钾溶液(浓度1%)2.5 mL,在50℃条件下保温20 min,再加入三氯乙酸溶液(浓度10%)2.5 mL,随后在3000 rpm条件下离心10 min,量取上清液2.5 mL,加入三氯化铁溶液(浓度0.1%)0.5 mL和蒸馏水2.5 mL,于700 nm处测定吸光度值,以其吸光度值的大小反映还原能力的大小。以Vc溶液作为对照组,以上实验平行测定3次。
1.2.3清除DPPH自由基能力测定[13]取不同浓度的各样品溶液2.0 mL加入DPPH溶液(0.08 mg/mL)2 mL,摇匀,于室温避光条件下静置20 min,于517 nm波长处测定吸光度值。以Vc作为阳性对照,以上实验平行测定3次,求其平均值。DPPH自由基的清除率计算公式为:
DPPH自由基的清除率(%)=[1-(A1-A2)/A0]×100%
式中:A0为乙醇+DPPH溶液;A1为样品溶液+ DPPH溶液;A2为样品溶液+乙醇。
1.2.4清除羟基自由基能力的测定[14]水杨酸作为Fenton试剂反应产生的羟基自由基的捕剂,对垂盆草不同极性部位的抗氧化活性进行筛选。向试管中加入不同浓度的各样品溶液2.0 mL,再加入0.01 mol/L硫酸亚铁溶液2.0 mL和0.01 mol/L水杨酸-乙醇2.0 mL,最后再加0.1 mL 0.03%的H2O2启动反应,摇匀,37℃条件下保温30 min,于510 nm波长处测定吸光度值。用Vc作为阳性对照,以上实验平行测定3次,求其平均值。羟基自由基清除率计算公式为:
羟基自由基清除率(%)=[1-(A4-A5)/A3]×100%
式中:A3为蒸馏水代替样品溶液时的吸光度值;A4为加入样品后的吸光度值;A5为蒸馏水代替硫酸亚铁溶液的吸光度。
1.2.5清除ABTS自由基能力测定[14,15]配制7 mmol/L的ABTS溶液和2.45 mmol/L过硫酸钾溶液,取等体积的两种溶液混合,在室温条件下避光反应12~16 h,配制成ABTS·+的储备液。临用前用95%乙醇稀释,使其在734 nm波长处的吸光度值为(0.70±0.02),此时得到ABTS自由基工作液。在试管中加入100 μL不同浓度的各样品溶液,再加入3.9 mL的ABTS自由基工作液,摇匀,室温下反应10 min,于734 nm波长处测定吸光度值。用Vc作为阳性对照,以上实验平行测定3次,求其平均值。ABTS自由基清除率计算公式为:
ABTS自由基的清除率(%)=[1-(A7-A8)/A6]×100%
式中:A6为乙醇代替样品溶液测得吸光度值;A7为加入样品后的吸光度值;A8为乙醇溶液代替ABTS溶液测得吸光度值。
2 结果
2.1垂盆草不同极性部位得率比较
垂盆草正丁醇萃取部位得率最高,可达29.76%,剩余水层得率次之为26.80%,乙酸乙酯萃取部位的得率最低为9.83%。石油醚和三氯甲烷萃取部位的得率相对较低,分别是18.34%、15.27%。见表1。
2.2垂盆草不同极性部位总还原能力比较
抗氧化物质的活性与其还原能力有着紧密的联系,还原能力越强,其抗氧化能力就越强,还原能力的强弱与其浓度呈正相关,因此,样品浓度越大,吸光度值越大,则还原能力越强[16]。如图1和表1所示,垂盆草醇提物及其不同极性部位均表现出不同程度的还原能力,且还原能力在实验浓度范围内随着溶液浓度增加而增强,呈正相关性,但均小于Vc。当溶液浓度为0.5 mg/mL时,乙酸乙酯部分的还原能力明显高于其他极性部位,正丁醇部分次之,还原能力顺序为:Vc>乙酸乙酯部分>正丁醇部分>三氯甲烷部分>粗提物>石油醚部分>水提部分。
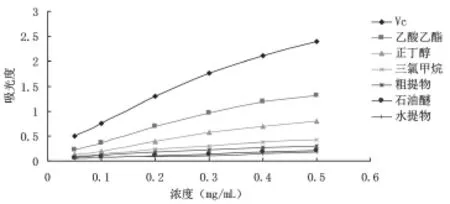
图1 垂盆草不同极性部位还原能力比较
2.3垂盆草不同极性部位对DPPH自由基清除作用比较
在体外抗氧化活性研究中,最常见的是DPPH自由基的清除,其原理是DPPH在溶液中生成一种稳定的以氮为中心的自由基,且溶液呈紫色,在517 nm波长处有特征吸收峰,当DPPH溶液中加入抗氧化物质时,抗氧化物质将电子和质子传递给DPPH自由基,生成稳定的分子态DPPH2,从而使DPPH溶液紫色消退,吸光谱强度随加入的抗氧化物质的量的增加而减小。因此,加入被测样品后,被测样品清除DPPH自由基而引起吸光度值的减少,通过计算自由基清除率,可评价其抗氧化能力的强弱[17]。由图2和表1可知,垂盆草醇提物及其不同极性部位对DPPH自由基均有较强的清除作用。当溶液浓度为0.5 mg/mL时,垂盆草各提取部分及Vc清除DPPH自由基能力的顺序依次为:乙酸乙酯部分>Vc>正丁醇部分>石油醚部分>三氯甲烷部分>粗提物>水提部分。乙酸乙酯部分和正丁醇部分均具有较强的体外抗氧化活性,且乙酸乙酯部分对DPPH自由基的清除作用强于Vc,而正丁醇部分的作用与Vc接近。
2.4垂盆草不同极性部位对羟基自由基(·OH)的清除作用比较
羟基自由基是目前已知对人体毒性最强、危害最大的一种自由基,几乎能与所有的生物大分子发生反应[18]。本实验以水杨酸作为Fenton试剂反应产生的羟基自由基的捕剂,对垂盆草各极性部位的抗氧化活性进行筛选。由图3和表1可知,随着垂盆草不同提取部分质量浓度的增加,清除OH能力逐步提高,但均弱于同质量浓度的Vc。当质量浓度为0.5 mg/mL时,水提部分对OH清除率达到43.10%,乙酸乙酯的清除率也达39.90%,其他极性部位则表现出较低的清除OH的能力,水提部分和乙酸乙酯部分的IC50值为0.7647、1.0730 mg/mL,垂盆草不同提取物清除OH的能力由强到弱依次为水提物>乙酸乙酯部分>粗提物>石油醚部分>正丁醇部分>三氯甲烷部分。
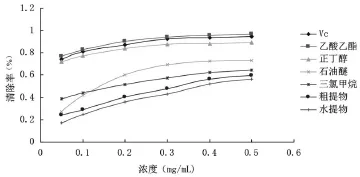
图2 垂盆草不同极性部位对DPPH自由基的清除率比较
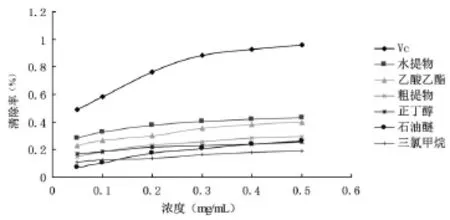
图3 垂盆草不同极性部位对羟基自由基的清除率比较
2.5垂盆草不同极性部位对ABTS自由基(ABTS·+)的清除作用比较
ABTS是一种自由基引发剂,经活性氧反应后生成一种稳定的蓝绿色阳离子自由基ABTS·+,当加入的物质中含有抗氧化物时,就会与ABTS·+发生反应使体系颜色褪去,其在734 nm波长处有最大吸收,吸光度值可反映物质的抗氧化活性[19]。由图4和表1可知,垂盆草醇提物及其不同极性部位对ABTS自由基均表现出良好的清除能力,且具有明显的量效关系。当溶液浓度为25 μg/mL时,垂盆草各部分与Vc清除ABTS·+的能力顺序为:Vc>乙酸乙酯部分>正丁醇部分>三氯甲烷部分>粗提物>水提部分>石油醚部分,其中乙酸乙酯部分对ABTS·+的清除率为78.10%,稍低于相同浓度下Vc对ABTS·+的清除率,表明乙酸乙酯部分体外抗氧化能力较强。
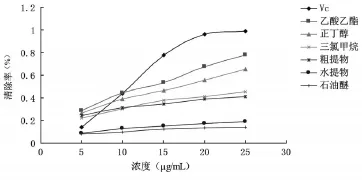
图4 垂盆草不同极性部位对ABTS自由基的清除率比较

表1 垂盆草不同溶剂提取物对自由基清除能力以及总还原能力的曲线方程、R2及IC50值
3 讨论
在正常生理情况下,人体维持新陈代谢只需要少量自由基,但是当自由基过量积累时就会对机体造成损害。自由基能与生物膜上的不饱和脂肪酸发生脂质过氧化反应,破坏生物膜结构;能直接作用于DNA,并造成DNA的永久损伤;能改变蛋白质结构与构象,使肽链断裂,产生聚合和交联,人体中DNA和蛋白质结构和功能的改变,会造成细胞功能紊乱,从而引发多种疾病,加速机体衰老[20]。当下与我们生活息息相关的食品和医疗领域中被广泛使用的是人工合成的抗氧化剂,虽然这些抗氧化剂具有化学性质稳定、价格优惠且效果好等特点,但其安全性受到怀疑,研究发现人工合成抗氧化剂(如BHA、BHT等)有潜在的肝损伤、致癌性等毒副作用[21,22]。
中药是中医预防和治疗疾病的独特药物,中药多方面的药理作用与其多种化学成分和能清除人体内活性氧自由基的作用密不可分。现代研究表明中药提取物或中药单体化合物可以通过调节免疫功能,抑制自由基的产生,或直接对抗自由基对细胞及组织的损伤作用。
因此,研究中药抗氧化具有重要意义,从中药中寻找清除体内自由基的抗氧化剂也将成为现代医药研发行业发展的潮流和趋势。垂盆草为现代研究较热门的一种中药,具有保肝降酶、免疫调节、抗肿瘤、增强肌力等作用[23,24],垂盆草所含的黄酮、三萜、生物碱、糖类等成分多数为中药中的抗氧化成分。本研究通过测定垂盆草总还原能力、DPPH自由基的清除率、羟基自由基的清除率以及ABTS自由基的清除率,综合评价了垂盆草醇提物不同极性萃取部位的抗氧化活性能力,并与抗氧化剂抗坏血酸进行比较,筛选了垂盆草醇提物有效抗氧化活性部位。体外抗氧化实验结果表明,垂盆草不同极性萃取物均具有抗氧化活性,其中乙酸乙酯部分的抗氧化能力最强,正丁醇部分次之,在一定范围内,随着浓度的增大,清除自由基的能力也随之增强。乙酸乙酯部分和正丁醇部分相对于其他极性部位表现出较强的还原能力和清除自由基的能力,表明垂盆草的乙酸乙酯部分和正丁醇部分很可能含有大量的黄酮、酚类、皂苷、多糖等抗氧化物质。另外,临床研究发现,垂盆草具有抑制炎性渗出、减少细胞损伤的作用[25],同时垂盆草提取液中的三萜和黄酮类等成分具有较强抗氧化和抗损伤的作用[26]。金京丽[27]腹腔注射垂盆草治疗D-氨基半乳糖与内毒素造成的小鼠急性肝损伤,证实垂盆草对小鼠肝细胞中核因子NF-κB的激活和DNA损伤有明显的抑制作用。垂盆草的这些药理作用,其机制主要是通过提高机体的抗氧化能力、降低组织细胞中的自由基、减轻脂质过氧化反应、调节免疫等途径。因此,研究垂盆草的抗氧化作用具有重要的意义,研究垂盆草不同极性部位的抗氧化活性,能为扩展垂盆草的应用范围,进一步研究其抗氧化活性成分和深入研究垂盆草药理作用机制提供了理论依据。
[1]李丽.中药抗氧化成分的现代分离和分析技术[M].北京:科学出版社,2011:1.
[2]徐燕,方朝晖,李韬.益气养阴活血药物对老龄鼠增龄自由基代谢变化的干预作用[J].中医药临床杂志,2010,22(6):522-524.
[3]李鸿飞,卿德刚,张娟,等.甘草渣中总黄酮清除·OH自由基能力的研究[J].新疆医科大学学报,2015,38(2):182-186.
[4]刘捷,王文,卢奎,等.皱皮木瓜多糖的提取及其抗氧化活性研究[J].河南工业大学学报(自然科学版),2011,32(1):48-52.
[5]国家药典委员会.中国药典[S].北京:中国医药科技出版社,2010:198.
[6]凌银禅,刘海燕,黄巨恩.急性肝损伤实验动物模型的研究进展[J].解剖学杂志,2012,35(3):389-391.
[7]张洪超,兰天,张晓辉,等.垂盆草化学成分与药理作用研究进展[J].中成药,2005,27(10):1201-1203.
[8]Panackel C,Thomas R,Sebastian B,et al.Recent advances in management of acute liver failure[J].Indian J Crit Care Med,2015,19(1):27-33.
[9]刘亮明,罗杰,张吉翔.内毒素诱导D-半乳糖胺致敏大鼠急化肝衰竭的研究[J].中华医学杂志,2006,(30):2122-2126.
[10]Song X,Bao M,Li D,et al.Advanced glycation in D-galactose induced mouse aging model[J].Mech Ageing Dev,1999,108(3):239-251.
[11]Wang HX,Liu M,Weng SY,et al.Immume mechanisms of concanavalialin a model of autoimmune hepatitis[J]. World J Gastroenterol,2012,108(3):119-125.
[12]孔令茜,梁晓霞,何敏,等.乌奴龙胆乙醇提取物不同极性部位体外抗氧化性研究[J].天然产物研究与开发,2015,(27):651-654.
[13]Saltarellir,Ceccarolip,Iottim,et al.Biochemical characterisation and antioxidant activity of mycelium of Ganoderma lucidum from Central Italy[J].Food Chemistry,2009,116(1):143-151.
[14]潘乔丹,唐海燕,黄元河,等.全缘栝楼多糖及提取物不同极性部位抗氧化研究[J].食品研究与开发,2015,36(10):1-4.
[15]景临林,马慧萍,范小飞,等.藏茜草不同溶剂提取物的抗氧化活性研究[J].食品工业科技,2015,36(1):91-96.[16]吴琼,陈丽娜,代永刚,等.松仁红衣中黄酮粗提物体外抗氧化作用的研究[J].食品工业科技,2011,32(12):110-112.
[17]李铉军,崔胜云.抗坏血酸清除DPPH自由基的作用机理[J].食品科学,2011,32(1):86-90.
[18]但飞君,鄢文芳,褚立军,等.红毛七乙醇提取物和不同极性部位抗氧化活性的研究[J].食品工业科技,2011,32(1):68-74.
[19]朱玉昌,焦必宁.ABTS法体外测定果蔬类总抗氧化能力的研究进展[J].食品与发酵工业,2005,31:77-80.
[20]申云翔.丁香提取物不同极性部位体外抗氧化活性研究[D].河南科技大学,2013.
[21]Saito M,Sakagami H,Fujisawa S.Cytotoxicity and apoptosis induction by butylated hydroxyanisole(BHA)and butylated hydroxytoluene(BHT)[J].Anticancer Research,2003,23(6C):4693.
[22]Grice HC.Safety evaluation of butylated hydroxytoluene(BHT)in the liver,lung and gastrointestinal tract[J]. Food and Chemical Toxicology,1986,24:1127-1130.
[23]李清,刘姣,曹秀莲,等.垂盆草不同提取物对小鼠移植性肿瘤抑制作用的初步研究[J].河北省科学院学报,2010,27(4):54-56.
[24]苏振阳.垂盆草对训练大鼠不同组织ATPase活性的影响[J].北京体育大学学报,2006,29(11):1505-1507.
[25]Lian LH,Jin X,Wu YL,et al.Hepatoprotective effects of Sedum sarmentosum on D-Galactosamine/Lipopoly-saccharide-Induced Murine Fulminant Hepatic Failure[J]. Journal of Pharmacological Sciences,2010,114(2):147-157.
[26]Adei A,Zaiton Z,Faizah O,et al.Aqueous extract of Piper sarmentosum decreases atherosclerotic lesions in high cholesterolemic experimental rabbits[J].Lipids Health Disease,2010,9:44.
[27]金京丽.垂盆草对D-氨基半乳糖与内毒素合用所致小鼠急性肝损伤的保护作用[D].延边大学,2006.
Study of antioxidant activity in vitro of parts with different polarity of sedum sarmentosum
CHEN Lei1,2YU Xuefeng2YAO Xiaomin2
1.Department of Pharmacology,Zhejiang Chinese Medical University,Hangzhou 310053,China;2.Department of Pharmacology,Zhejiang Pharmaceutical College,Ningbo 315100,China
R284
B
1673-9701(2016)24-0120-05
2016-04-28)
浙江省宁波市科技惠民计划项目(2015C50020)
