宫颈癌患者外周血淋巴细胞亚群分布的差异分析
2016-10-19张耿月金禹龙何春莹魏天雪都韧秋
于 鸿 张耿月 金禹龙 狄 娜 何春莹 魏天雪 都韧秋
1.吉林省肿瘤防治研究所细胞生物研究室,吉林长春130012;2.吉林省肿瘤医院病案室,吉林长春130012
宫颈癌患者外周血淋巴细胞亚群分布的差异分析
于鸿1张耿月1金禹龙1狄娜1何春莹1魏天雪1都韧秋2▲
1.吉林省肿瘤防治研究所细胞生物研究室,吉林长春130012;2.吉林省肿瘤医院病案室,吉林长春130012
目的检测分析宫颈癌患者外周血淋巴细胞亚群的差异分布及临床意义。方法采用流式细胞术检测宫颈癌患者和健康对照成人外周血中CD3+、CD3+CD4+、CD3+CD8+、NK、NKT、CD8+CD28+、CD8+CD28-、CD3+HLA-DR+、CD3-HLA-DR+、Treg细胞的百分比,同时结合宫颈癌患者的临床诊断分期做对比分析。结果与健康对照组比较,宫颈癌患者外周血中CD3+(P=0.0002)和CD3+CD4+T细胞百分比(P=0.0004)以及CD3+CD4+/CD3+CD8+比值(P=0.0256)显著降低;宫颈癌患者CD3+CD8+T细胞百分比与对照组比较无显著差异,但是随着患者临床分期的提高呈降低趋势(P=0.0480)。NK细胞(P<0.0001)、活化T细胞(CD3+HLA-DR+:P<0.0001)、活化B细胞(CD3-HLA-DR+:P=0.0021)百分比显著提高;细胞毒性T细胞(CD8+CD28+)细胞百分比降低(P=0.0006),抑制性T细胞(CD8+CD28-)百分比提高(P=0.0009);CD4+CD25brightT细胞(Treg)阳性细胞百分比与对照组比较没有显著差异,但CD4+CD25brightT细胞(Treg)在CD4+淋巴细胞中的百分比显著高于对照组(P=0.0335)。宫颈癌患者外周血中CD8+CD28-/CD8+CD28+之比与对照组比较显著提高(P<0.0001)。结论宫颈癌患者细胞免疫功能降低。精确分析宫颈癌患者的T淋巴细胞亚群变化对于临床诊断、治疗和预后评估具有重要的实际意义。
宫颈恶性肿瘤;淋巴细胞亚群;流式细胞术;肿瘤免疫
[Abstract]Objective To test and analyze the differences of distribution of lymphocyte subsets in peripheral blood in the patients with cervical cancer and its clinical significance.Methods Percentages of CD3+,CD3+CD4+,CD3+CD8+,NK,NKT,CD8+CD28+,CD8+CD28-,CD3+HLA-DR+,CD3-HLA-DR+,Treg cells were tested in adult peripheral blood in the patients with cervical cancer and health controls via flow cytometry.Comparative analysis was conducted in combination with the clinical diagnosis staging in the patients with cervical cancer.Results Compared with the healthy control group,the percentages of CD3+(P=0.0002)and CD3+CD4+T cells(P=0.0004)in the peripheral blood in the patients with cervical cancer and CD3+CD4+/CD3+CD8+ratio(P=0.0256)were significantly reduced;the percentages of CD3+CD8+T cells in the patients with cervical cancer were not statistically significant compared with that in the control group,but with the increase of clinical staging,the percentage was in a decreasing trend(P=0.0480).The percentages of NK cells(P<0.0001),activated T cells(CD3+HLA-DR+:P<0.0001),and activated B cells(CD3-HLADR+:P=0.0021)were significantly improved;the percentage of toxic T cells(CD8+CD28+)was reduced(P=0.0006),and the percentage of inhibitive T cells(CD8+CD28-)was increased(P=0.0009);the percentage of CD4+CD25bright(Treg)cells was not significantly different from that in the control group,but the percentage of CD4+CD25bright(Treg)cells in CD4+lymphocytes was significantly higher than that in the control group(P=0.0335).CD8+CD28-/CD8+CD28+ratio in the peripheral blood in the patients with cervical caner was significantly increased compared with that in the control group(P<0.0001).Conclusion Cell immunological function is reduced in the patients with cervical cancer.Accurate analysis of the changes of T lymphocyte subsets in the patients with cervical cancer has important and practical significance in clinical diagnosis,treatment and prognosis evaluation.
[Key words]Cervical malignant tumor;Lymphocyte subsets;Flow cytometry;Tumor immunology
宫颈癌是女性中最常见的肿瘤,也是导致女性癌症死亡的首要原因之一。其发生发展与免疫功能尤其是细胞免疫功能失调密切相关。此外,宫颈癌的预后也与肿瘤浸润淋巴细胞中存在的免疫细胞类型有关,如细胞毒性CD8+T细胞、CD4+T细胞、调节性T细胞等,具体涉及它们的数量、功能状态及肿瘤细胞表达的相关配体等等[1]。本研究采用流式细胞术检测宫颈癌患者和健康成人外周血中总T淋巴细胞(CD3+)、T辅助/诱导细胞(CD3+CD4+)、T抑制/细胞毒细胞(CD3+CD8+)百分比、自然杀伤细胞(nature killer cells,NK)、NK样T细胞(NKT)、细胞毒性T细胞(CD8+CD28+)、抑制性T细胞(CD8+CD28-)、调节性CD4+CD25brightT细胞(Treg)、活化T细胞(CD3+HLA-DR+)、静止T细胞(CD3+HLA-DR-)、活化B细胞(CD3-HLA-DR+)的百分比,计算并比较CD3+CD4+/CD3+CD8+比值,同时结合宫颈癌患者的临床诊断分期做对比分析,为临床诊断治疗提供实验依据。
1 资料与方法
1.1一般资料
选择吉林省肿瘤医院2014年1月~2015年12月期间经病理确诊为宫颈癌(鳞癌和腺鳞癌)且未经手术、放化疗的住院患者306例,排除严重感染或自身免疫病病例。患者平均年龄(51.62±6.88)岁(年龄范围21~75岁)。健康对照来自本院体检人群,共56例,均为女性,平均年龄(49.61±6.60)岁(年龄范围25~71岁)。两组年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。患者的临床基本信息见表1。
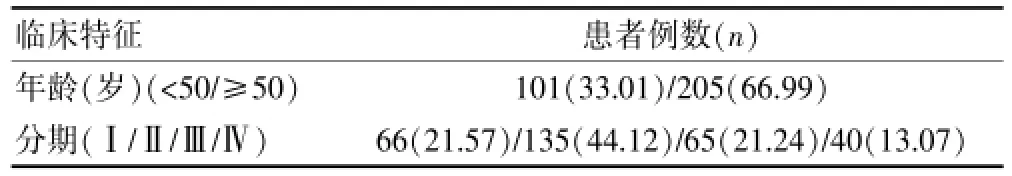
表1 宫颈癌患者的基本临床信息(n=306)
1.2方法
1.2.1试剂荧光标记的抗人抗体CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5(Catalog No:6607013),CD3-FITC/CD16+56-PE(Catalog No:A07735),CD3-FITC/ HLA-DR-PE(Catalog No:A07737),CD8-FITC(Catalog No:A07756),CD28-PE(Catalog No:IM2071U),CD4-FITC(CatalogNo:A07750),CD25-PE(CatalogNo:A07774),OptiLyse@C Lysis Solution(Catalog No:A11895)均为贝克曼公司产品。
1.2.2样本制备每个样本采集2 mL静脉血。按照试剂说明书操作。每100 μL外周血加5~10 μL抗体,避光室温孵育15~20 min后,OptiLyse@C Lysis Solution裂解红细胞,离心后PBS洗1次,加500 μL PBS,上机检测。采用Beckman Coulter Epics XL-MCL流式细胞仪,Expo32 ADC软件获取数据,收集10000个细胞,Expo32 V1.2软件分析数据。
1.3观察指标
检测宫颈癌患者和健康成人外周血中总T淋巴细胞(CD3+)、T辅助/诱导细胞(CD3+CD4+)、T抑制/细胞毒细胞(CD3+CD8+)百分比、自然杀伤细胞(nature killer cells,NK)、NK样T细胞(NKT)、细胞毒性T细胞(CD8+CD28+)、抑制性T细胞(CD8+CD28-)、调节性CD4+CD25brightT细胞(Treg)、活化T细胞(CD3+HLADR+)、静止T细胞(CD3+HLA-DR-)、活化B细胞(CD3-HLA-DR+)的百分比,计算并比较CD3+CD4+/CD3+CD8+比值,同时结合宫颈癌患者的临床诊断分期进行对比分析。
1.4统计学分析
使用SPSS 17.0和GraphPad Prism 5软件进行统计学分析。计量资料数据以(x±s)表示。组间比较采用方差分析和独立样本的t检验或Mann Whitney U检验,淋巴细胞亚群百分比与临床分期的相关性分析采用Spearman等级相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1两组外周血中总T淋巴细胞(CD3+)、T辅助/诱导细胞(CD3+CD4+)、T抑制/细胞毒细胞(CD3+CD8+)细胞百分比比较
见图1,与对照组比较,宫颈癌患者外周血中CD3+和CD3+CD4+细胞百分比、CD3+CD4+/CD3+CD8+比值显著降低[CD3+:(61.75±8.13)%vs(69.85±6.61)%;CD3+CD4+:(33.30±3.89)%vs(40.22±7.17)%;CD3+CD4+/CD3+CD8+:(1.59±0.54)vs(1.95±0.68)]。Ⅲ/Ⅳ期宫颈癌患者的CD3+细胞百分比均显著低于对照组;Ⅳ期宫颈癌患者的CD3+CD4+细胞百分比显著低于对照组,说明宫颈癌患者外周血中CD3+和CD3+CD4+细胞百分比的降低与临床分期的提高存在负相关趋势,虽然Spearman等级相关性分析结果表明差异无统计学意义(CD3+:r=-0.281,P=0.471;CD3+CD4+:r=0.023,P=0.871)。宫颈癌患者T抑制/细胞毒细胞[CD3+CD8+:(25.21± 5.28)%)]细胞百分比的均值与对照组的(22.28±5.65)%比较,差异无统计学意义(P=0.0872),但随着患者临床分期的提高呈降低趋势[Ⅰ/Ⅱ期:(27.00±4.07)%;Ⅲ/Ⅳ期:(22.04±4.06)%;对照组:(22.28±5.65)%)],Spearman等级相关性分析结果显示r=-0.281,P=0.0480,差异有统计学意义(P<0.05)。
2.2两组外周血中NK(CD3-CD16+56+)和NKT(CD3+CD16+56+)细胞百分比比较
见图2,与对照组比较,宫颈癌患者组NK细胞百分比[(17.64±3.81)%]显著高于对照组[(14.12±4.04)%],差异有高度统计学意义(P<0.0001);NK T细胞百分比[(4.30±1.39)%]显著低于对照组[(5.95±1.98)%],差异有高度统计学意义(P<0.0001)。
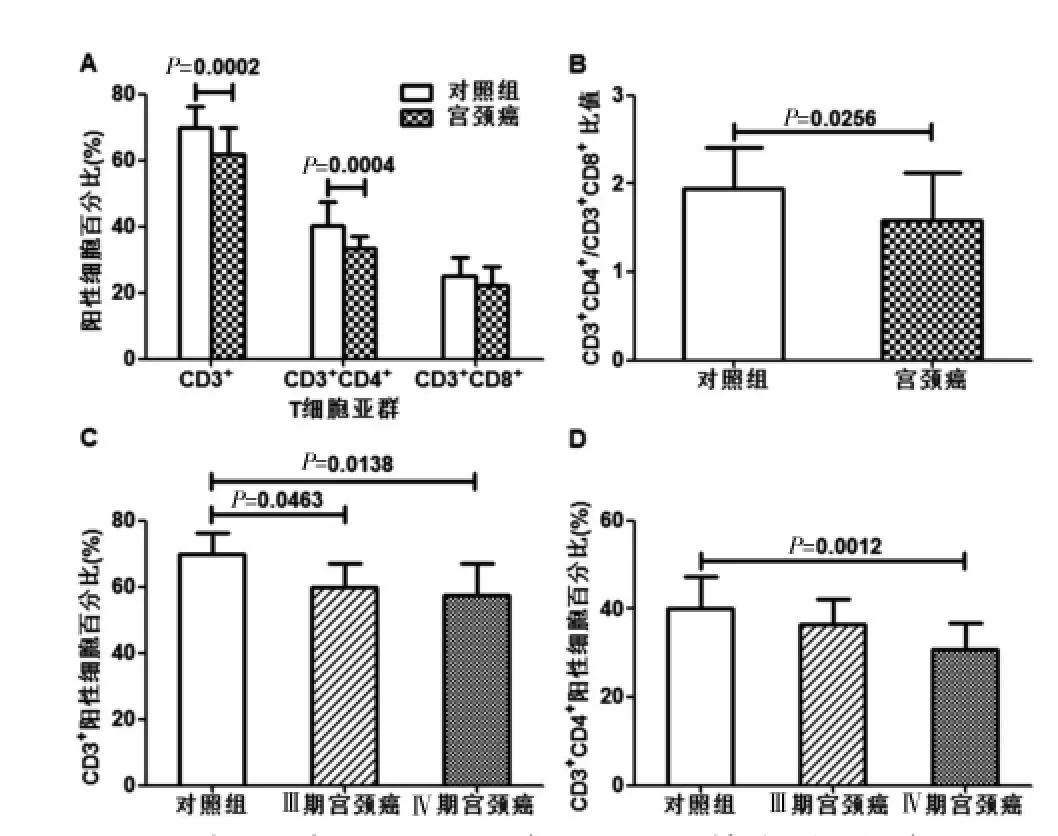
图1 两组外周血中总T淋巴细胞(CD3+)、T辅助/诱导细胞(CD3+CD4+)、T抑制/细胞毒细胞(CD3+CD8+)细胞百分比比较,A:CD3+、CD3+CD4+、CD3+CD8+细胞百分比;B:CD3+CD4+/CD3+CD8+比值;C:Ⅲ期和Ⅳ期患者CD3+细胞百分比;D:Ⅲ期和Ⅳ期患者CD3+CD4+细胞百分比
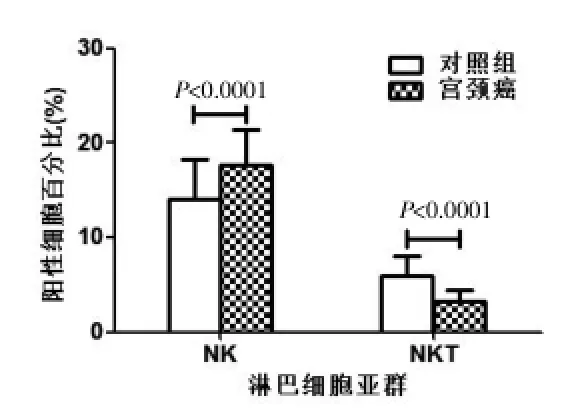
图2 两组外周血中NK(CD3-CD16+56+)和NKT(CD3+CD16+56+)细胞百分比比较
2.3两组外周血中活化T细胞(CD3+HLA-DR+)、静止T细胞(CD3+HLA-DR-)、活化B细胞(CD3-HLADR+)百分比比较
宫颈癌患者的活化T细胞(CD3+HLA-DR+)和活化B细胞(CD3-HLA-DR+)百分比显著高于健康对照组[CD3+HLA-DR+:(9.12±2.98)%vs(5.18±1.62)%,P<0.0001;CD3-HLA-DR+:(18.27±5.45)%vs(13.55± 3.15)%,P=0.0021],静止T细胞(CD3+HLA-DR-)百分比显著低于健康对照组[(50.52±6.87)%vs(63.68± 7.81)%,P<0.0001],且活化B细胞(CD3-HLA-DR+)水平的升高与临床分期存在正相关趋势,虽然Spearman等级相关性分析结果表明无统计学意义(r=0.221,P= 0.124);Ⅰ/Ⅱ期:(16.99±5.25)%;Ⅲ/Ⅳ期:(20.02± 7.05)%;对照组:(13.55±3.15)%,见图3。

图3 两组外周血中活化T细胞(CD3+HLA-DR+)、静止T细胞(CD3+HLA-DR-)、活化B细胞(CD3-HLA-DR+)百分比比较
2.4两组外周血中细胞毒性T细胞(CD8+CD28+)、抑制性T细胞(CD8+CD28-)、调节性CD4+CD25bright(Treg)细胞百分比比较
CD28是一个主要的共刺激受体,负责优化抗原介导的T细胞活化、增殖和存活。宫颈癌患者外周血中CD8+CD28+细胞阳性细胞百分比降低[(8.67±2.46)% vs(10.88±3.95)%,P=0.0006],CD8+CD28-细胞百分比提高[(17.85±4.28)%vs(12.13±4.01)%,P=0.0009],CD4+CD25brightT细胞(Treg)阳性细胞百分比与对照组比较无显著差异[(3.74±1.18)%vs(3.95±1.29)%,P=0.5514)],见图4。
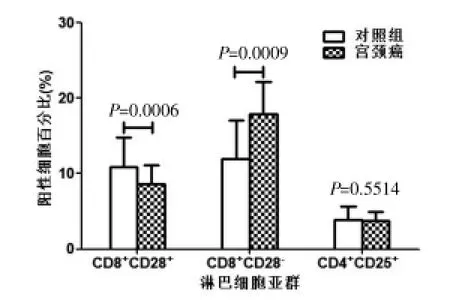
图4 两组外周血中细胞毒性T细胞(CD8+CD28+)、抑制性T细胞(CD8+CD28-)、调节性CD4+CD25brightT细胞(Treg)阳性细胞百分比比较
2.5两组外周血中CD8+CD28-/CD8+CD28+比值、CD4+CD25bright/CD4+细胞百分比比较
宫颈癌患者外周血中CD8+CD28-/CD8+CD28+之比与对照组比较显著提高[(1.99±0.58)vs(1.47±0.46),P<0.0001];CD4+CD25brightT细胞(Treg)在CD4+淋巴细胞中的百分比显著高于对照组[(11.45±4.28)%vs(9.57± 3.84)%,P=0.0335](图5)。
3 讨论
宫颈癌是女性中最常见的肿瘤,尤其在发展中国家,是导致女性死亡率最高的肿瘤之一。已知宫颈癌的形成是由于人类乳头瘤病毒(human papilloma virus,HPV)的持续感染造成的,因此与清除病毒密切相关的免疫反应在宫颈癌的发生、发展和治疗中起着更为重要的作用。大量的研究已表明癌症患者的肿瘤微环境中的淋巴细胞亚群分布与患者的临床分期和预后关系密切,然而在实际临床治疗中取材的困难限制了很多研究的深入进行[2]。外周血采集方便,能够直接分析淋巴细胞亚群和其他细胞的百分比,从而评估患者的免疫状态、临床预后状况并预测疗效。此外,随着临床检测技术的飞速进展,患者外周血中可检测到的各种指标越来越多,精确度也越来越高,因此分析癌症患者外周血淋巴细胞亚群分布具有重要的临床意义[5-8]。本研究采用流式细胞术检测宫颈癌患者外周血淋巴细胞亚群分布,分析其与患者临床分期的关系,为宫颈癌的诊断和治疗提供实验依据。
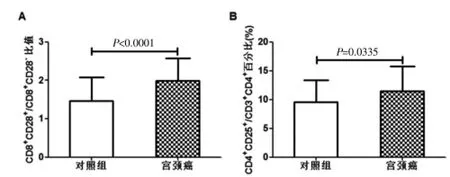
图5 宫颈癌患者和健康对照组外周血中CD8+CD28-/CD8+CD28+比值、CD4+CD25bright/CD4+细胞百分比比较,A:CD8+CD28-/CD8+CD28+比值;B:CD4+CD25brightT细胞(Treg)在CD4+淋巴细胞中的百分比
在T淋巴细胞中,CD3+细胞代表了T细胞的一般水平,反映宿主的细胞免疫状态。CD3+T细胞又包括CD4+辅助/诱导性T细胞和CD8+细胞毒/抑制性T细胞。后者识别MHC-I类抗原并通过前者分泌的细胞因子实现其调节免疫反应的功能。本研究中我们共检测分析了306例宫颈癌患者的外周血样本,结果表明,与健康对照组比较,宫颈癌患者的CD3+和CD3+CD4+细胞百分比,CD3+CD4+/CD3+CD8+比值显著降低,处于晚期的癌症患者又比早期患者更低。这说明宫颈癌患者的免疫功能,尤其是与抗肿瘤相关的细胞免疫功能降低[9]。
NK细胞是大颗粒淋巴细胞,在机体的天然免疫中发挥重要作用。NK细胞能直接破坏肿瘤细胞,其水平降低导致免疫功能下降。本研究中我们检测的宫颈癌患者均未经手术、放化疗治疗,其NK细胞百分比显著高于健康对照组,与文献报道一致[10]。说明宫颈癌患者在感染HPV病毒后机体的天然免疫防御机制发挥了抵抗作用。与此相呼应,宫颈癌患者外周血中活化T细胞(CD3+HLA-DR+)百分比也高于健康对照组,说明机体启动免疫防御机制抵抗病毒的侵害。有报道表明B淋巴细胞的慢性活化是有害的。我们检测到宫颈癌患者的活化B细胞(CD3-HLA-DR+)百分比高于健康对照组且活化B细胞水平的升高与临床分期的提高呈正相关,对这一结果的阐释尚需进行更深入的作用机制研究。
抗肿瘤免疫反应非常复杂,不同类型的细胞之间相互作用,彼此影响[11-14]。已知一些T淋巴细胞有调节功能,如分泌interleukin-10的T细胞、分泌TGF-β的T细胞、CD4-CD8-T细胞、NKT细胞、CD8+CD28-细胞、CD4+CD25+regulatory T细胞等。其中Treg细胞具有免疫抑制作用,可以阻止其它T细胞的激活或扩增,抑制树突状细胞的抗原提呈能力,抑制NK细胞活性,从而使肿瘤逃避免疫监视而进一步发展恶化。CD8+CD28-T细胞也是抑制性T细胞,抑制其他T淋巴细胞增殖和细胞毒性,其发挥免疫抑制作用主要通过分泌IL-10和TGF-β等细胞因子。本研究分析了是否CD8+CD28-、CD4+CD25+Treg细胞在宫颈癌患者和正常人之间存在差异。结果表明,CD8+CD28-细胞在宫颈癌患者中升高且宫颈癌患者外周血中CD8+CD28-/CD8+CD28+之比与对照组比较显著提高。虽然二者的CD4+CD25+Treg细胞水平没有显著差异,但宫颈癌患者的Treg细胞在CD4+淋巴细胞中的百分比显著高于健康对照组[15,16]。
综上所述,本研究结果显示,宫颈癌患者总体免疫功能下降且与临床分期关系密切。后续的研究需要增加入组患者数量,增加检测指标,如FoxP3、CD127、CD69、IFN-γ等[17],同时需要深入研究患者的免疫功能状态与肿瘤进展和预后的相关性,为临床诊断治疗提供实验依据。
[1]Nedergaard BS,Ladekarl M,Nyengaard JR,et al.A comparative study of the cellular immune response in patients with stage IB cervical squamous cell carcinoma.Low numbers of several immune cell subtypes are strongly associated with relapse of disease within 5 years[J].Gynecol Oncol,2008,108(1):106-111.
[2]Bordón E,Henríquez-Hernández LA,Lara PC,et al.Role of CD4 and CD8 T-lymphocytes,B-lymphocytes and Natural Killer cells in the prediction of radiation-induced late toxicity in cervical cancer patients[J].Int J Radiat Biol,2011,87(4):424-431.
[3]Jordanova ES,Gorter A,Ayachi O,et al.Human leukocyte antigen class I,MHC class I chain-related molecule A,and CD8+/regulatory T-cell ratio:Which variable determines survival of cervical cancer patients[J]?Clin Cancer Res,2008,14(7):2028-2035.
[4]Garcia-Chagollan M,Jave-Suarez LF,Haramati J,et al. An approach to the immunophenotypic features of circu-lating CD4+NKG2D+T cells in invasive cervical carcinoma[J]. J Biomed Sci,2015,22:91.
[5]Appay V,van Lier RA,Sallusto F,et al.Phenotype and function of human T lymphocyte subsets:Consensus and issues[J].Cytometry A,2008,73(11):975-983.
[6]Zhang W,Tian X,Mumtahana F,et al.The existence of Th22,pure Th17 and Th1 cells in CIN and Cervical Cancer along with their frequency variation in different stages of cervical cancer[J].BMC Cancer,2015,15:717.
[7]Kosmaczewska A,Bocko D,Ciszak L,et al.Dysregulated Expression of Both the Costimulatory CD28 and Inhibitory CTLA-4 Molecules in PB T Cells of Advanced Cervical Cancer Patients Suggests Systemic Immunosuppression Related to Disease Progression[J].Pathology Oncology Research,2012,18(2):479-489.
[8]Hu T,Yang P,Zhu H,et al.Accumulation of invariant NKT cells with increased IFN-γ production in persistent high-risk HPV-infected high-grade cervical intraepithelial neoplasia[J].Diagn Pathol,2015,10:20.
[9]Nedergaard BS,Ladekarl M,Thomsen HF,et al.Low density of CD3+,CD4+and CD8+cells is associated with increased risk of relapse in squamous cell cervical cancer[J]. Br J Cancer,2007,97(8):1135-1138.
[10]Jun L,Yi-Yu W,Rong Y,et al.The clinical value of T lymphocyte subsets and NK cells in peripheral blood of patients with high-risk HPV infection and different cervical lesions[J].Int J Clin Exp Med,2016,9(2):4521-4526.
[11]Das S,Karim S,Datta Ray C,et al.Peripheral blood lymphocyte subpopulations in patients with cervical cancer[J]. Int J Gynaecol Obstet,2007,98(2):143-146.
[12]Lee AJ,Lee HJ,Kim JD,et al.Changes of peripheral blood lymphocyte subtypes in patients with end stage canceradministeredlocalizedradiotherapyandbojungik-kitang[J].Evid Based Complement Alternat Med,2014,2014:207613.
[13]Prayitno A,Asnar E,Astirin OP,et al.The expression of CD8+and MHC-I in cervical cancer with HPV infection[J]. Journal of Cancer Therapy,2013,4(5A):15-18.
[14]Adurthi S,Mukherjee G,Krishnamurthy H,et al.Functional tumor infiltrating TH1 and TH2 effectors in large early-stage cervical cancer are suppressed by regulatory T cells[J].Int J Gynecol Cancer,2012,22(7):1130-1137.
[15]Visser J,Nijman HW,Hoogenboom BN,et al.Frequencies and role of regulatory T cells in patients with(pre)malignant cervical neoplasia[J].Clin Exp Immunol,2007,150(2):199-209.
[16]Pita-Lopez ML,Ortiz-Lazareno PC,Navarro-Meza M,et al. CD28-,CD45RA(null/dim)and natural killer-like CD8+T cells are increased in peripheral blood of women with low-grade cervical lesions[J].Cancer Cell Int,2014,14(1):97.
[17]Goncalves MA,Soares EG,Donadi EA.The influence of human papillomavirus type and HIV status on the lymphomononuclear cell profile in patients with cervical intraepithelial lesions of different severity[J].Infect Agent Cancer,2009,4:11.
Analysis of the differences of distribution of lymphocyte subsets in peripheral blood in the patients with cervical cancer
YU Hong1ZHANG Gengyue1JIN Yulong1DI Na1HE Chunying1WEI Tianxue1DU Renqiu2
1.Cell Biology Research Office,Jilin Research Center for Tumor Prevention and Control,Changchun130012,China;2.Disease Record Room,Jilin Tumor Hospital,Changchun130012,China
R737.3
A
1673-9701(2016)24-0020-05
2016-05-10)
吉林省科技发展计划应用基础研究项目(20130 102097JC)
