Slit/Robo信号通路在胰腺癌细胞中的表达及其对胰腺癌细胞生长的影响
2016-10-17梁刚何盟国马清涌
梁刚 何盟国 马清涌
1陕西核工业215医院肝胆外一科病区,陕西咸阳712000
2西安交通大学第一附属医院肝胆外科,陕西西安710000
Slit/Robo信号通路在胰腺癌细胞中的表达及其对胰腺癌细胞生长的影响
梁刚1何盟国1马清涌2#
1陕西核工业215医院肝胆外一科病区,陕西咸阳712000
2西安交通大学第一附属医院肝胆外科,陕西西安710000
目的探讨Slit/Robo信号通路在胰腺癌细胞中的表达情况,及其对胰腺癌细胞增殖的影响。方法分别采用RT-PCR、免疫细胞化学、免疫荧光方法检测胰腺癌细胞株BxPC-3、Panc-1中Slit和Robo的表达;通过Slit/Robo信号通路阻断剂RoboN阻断该通路,采用MTT法观察其对细胞生长的影响。结果胰腺癌细胞株Bx-PC-3、Panc-1中存在着Slit2、Robo1基因和蛋白表达;在RoboN的作用下,胰腺癌细胞体外生长受到抑制,增殖能力下降。结论胰腺癌细胞中可能存在着Slit2/Robo1信号通路,它能够负性调节胰腺癌细胞的生长,提示Slit/ Robo信号通路可能参与了胰腺癌的发生发展的过程。
Slit/Robo信号通路;胰腺癌细胞;细胞生长
1 材料与方法
1.1实验材料
人胰腺癌细胞株BxPC-3(中度分化)、Panc-1(低分化),由西安交通大学医学院肝胆外科实验室提供;兔抗人Slit2多克隆抗体(博士德生物工程有限公司);兔抗人Robo1多克隆抗体(Abcam公司);阻断剂Robo1(N-20)P(RoboN,Santa Cruz Biotechnology);MTT试剂(西唐生物科技有限公司);引物由北京三博志远生物工程技术服务有限公司合成:Slit2:P1 5-CTGTAACTGCTACCTGGCTTGG-3(2205-),P25-ACTCTGTGACATCTCTTGGAATACC-3(-2497);product:275 bp。
Robo1:P1 5-CCTACTCCTTACGCCACCACTC-(34054-),P25-GCCACTTCTTGTTTCTGCTGTCC-3(-4175);product:122 bp。
1.2实验方法
1.2.1细胞培养人胰腺癌细胞株BxPC-3、Panc-1用含10%新生牛血清的DMEM培养基,培养于含5%CO2、37℃恒温、饱和湿度培养箱中。
1.2.2RT-PCR法检测各组细胞中Slit、Robo基因表达分别提取胰腺癌细胞株BxPC-3、Panc-1中细胞总RNA,将其逆转录成cDNA,将Slit2、Robo1
引物稀释至工作浓度100 pmol/μl,按照PCR反应体系加入引物及cDNA合成DNA,最后通过琼脂糖凝胶电泳得到目的基因条带。
1.2.3免疫细胞化学法检测Slit2、Robo1蛋白在各组细胞中的表达取对数生长细胞,将其接种于铺有盖玻片的24孔培养板中,待细胞贴壁后,用4%多聚甲醛固定,中性树胶固定盖玻片,滴加0.5%Tritonx-100、3%H2O2,血清封闭,滴加一抗(PBS配制,湿盒)4℃孵育过夜,滴加生物素化的二抗孵育(湿盒),DAB显色,苏木素复染,脱水,固定,拍照。阴性对照组免去一抗滴加。阳性结果判断标准:光镜下观察到以细胞质内有棕褐色细颗粒染色为阳性信号。
1.2.4免疫荧光染色法检测Slit2、Robo1蛋白在各组细胞中的表达免疫荧光法步骤大体同免疫组化法,不同的是:在滴加一抗过夜后,滴加荧光标记的二抗工作液,脱水、透明、封片后于荧光显微镜下观察照相。阴性对照组免去一抗滴加。阳性结果判断标准:荧光显微镜下观察到细胞受激发出的绿色荧光。
1.2.5MTT法检测Slit/Robo信号通路阻断后对胰腺癌细胞增殖的影响取对数生长期的胰腺癌细胞,胰酶消化后,以5~10×103个细胞接种于96孔培养板中。设定1个对照组和3个实验组,对照组不加阻断剂,实验组加竞争性阻断剂Robo1(N-20)P(简写为RoboN)的浓度分别为5、10、20 μg/ml。胰腺癌细胞分别培养24、48、72 h后,加入20 μl MTT溶液(5 mg/ml),继续孵育5 h,吸弃培养孔上清液,每孔加入150 μl DMSO,振荡10 min,使甲瓒充分溶解,酶联免疫检测仪上测定各孔490 nm光吸收值(OD值),计算细胞生长抑制率绘制生长曲线。抑制率=1-实验孔OD值/对照孔OD值×100%。
1.3统计学方法
采用SPSS17.0软件进行数据录入和统计分析,实验所得数据以均数±标准差(x-±s)表示。采用t检验,比较各组间是否存在统计学差异,以P<0.05为差异具有统计学意义。
2 结果
2.1Slit2、Robo1基因在胰腺癌细胞中的表达
在胰腺癌细胞株BxPC-3(图1)、Panc-1(图2)中,通过RT-PCR法发现Slit2和Robo1均有基因表达。其中Slit2的退火温度为55℃,Robo1的退火温度为64℃,β-actin的退火温度为56℃。

图1 Slit2、Robo1基因在BxPC-3细胞中的表达

图2 Slit2、Robo1基因Panc-1细胞中的表达
2.2免疫细胞化学法检测出Slit2、Robo1蛋白在胰腺癌细胞中的表达
通过免疫细胞化学法,检测出Slit2、Robo1蛋白在胰腺癌细胞株BxPC-3(图3)、Panc-1(图4)中均有表达。
在BxPC-3中,图3中A图示为对照组,细胞质内未见棕褐色细颗粒,只见染成蓝紫色的细胞核;B图示为加了Slit2蛋白一抗组,细胞内可见棕色细颗粒,及染成蓝紫色的细胞核;C图示为Robo1蛋白一抗组,细胞内可见棕色细颗粒,及染成蓝紫色的细胞核。上述实验结果说明,Slit2、Robo1蛋白可以在胰腺癌BxPC-3中表达。
在Panc-1中,图4中A图示为对照组,细胞质内未见棕褐色细颗粒,只见染成蓝紫色的细胞核;B图示为加了Slit2蛋白一抗组,细胞内可见棕色细颗粒,及染成蓝紫色的细胞核;C图示为Robo1蛋白一抗组,细胞内可见棕色细颗粒,及染成蓝紫色的细胞核。上述实验结果说明,Slit2、Robo1蛋白可以在胰腺癌Panc-1中表达。

图3 Slit2、Robo1蛋白在BxPC-3细胞中的表达
2.3免疫荧光法检测出Slit2、Robo1蛋白在胰腺癌细胞中的表达
通过免疫荧光法,检测出Slit2、Robo1蛋白在胰腺癌细胞株BxPC-3(图5)、Panc-1(图6)中均有表达。
在BxPC-3中,图5中A图示为对照组,细胞上未见绿色荧光,只见发出蓝色荧光的细胞核;B图示为加了Slit2蛋白一抗组,细胞上可见绿色荧光,及发出蓝色荧光的细胞核;C图示为Robo1蛋白一抗组,细胞上可见绿色荧光,及发出蓝色荧光的细胞核。上述实验结果说明,Slit2、Robo1蛋白可以在胰腺癌BxPC-3中表达。
在Panc-1中,图6中A图示为对照组,细胞上未见绿色荧光,只见发出蓝色荧光的细胞核;B图示为加了Slit2蛋白一抗组,细胞上可见绿色荧光,及发出蓝色荧光的细胞核;C图示为Robo1蛋白一抗组,细胞上可见绿色荧光,及发出蓝色荧光的细胞核。上述实验结果说明,Slit2、Robo1蛋白可以在胰腺癌Panc-1中表达。
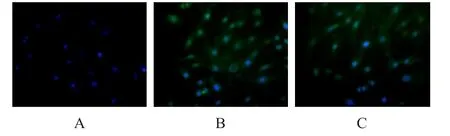
图5 Slit2、Robo1蛋白在BxPC-3细胞中的表达
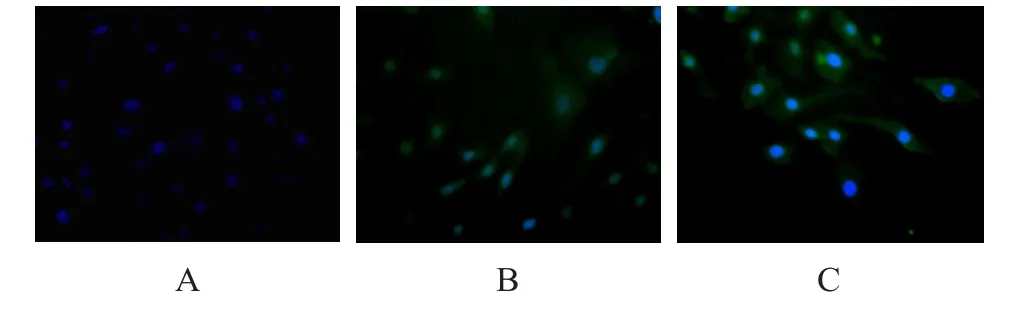
图6 Slit2、Robo1蛋白在Panc-1细胞中的表达
2.4胰腺癌细胞生长能力
2.4.1 MTT法绘测定各组胰腺癌细胞的OD值及抑制率表1为MTT法检测BxPC-3胰腺癌细胞在培养24、48、72 h后的OD值及抑制率。从表中可以看出:阻断Slit/Robo信号通路后,随着胰腺癌细胞培养时间的延长,胰腺癌细胞生长抑制率逐渐增高。

表1 BxPC-3细胞培养24、48、72 h各组的OD值及抑制率
表2为MTT法检测Panc-1胰腺癌细胞在培养24、48、72 h后的OD值及抑制率。从表中同样可以看出:阻断Slit/Robo信号通路后,随着胰腺癌细胞培养时间的延长,胰腺癌细胞生长抑制率也逐渐增高。

表2 Panc-1细胞培养24、48、72 h各组的OD值及抑制率
2.4.2细胞生长抑制率在胰腺癌BxPC-3细胞中,实验组对胰腺癌细胞生长的抑制率存在浓度依赖性,在24、48、72 h时,实验组20 μg/ml与10 μg/ml的抑制率存在统计学差异(P<0.05);在48、72 h时实验组10 μg/ml与5 μg/ml的抑制率也存在统计学差异(P<0.05),见图7。
和胰腺癌BxPC-3细胞类似,在Panc-1细胞中,在24、48、72 h时,实验组10 μg/ml与5 μg/ml间,实验组20 μg/ml与10 μg/ml间的抑制率均存在统计学差异(P<0.05),见图8。

图7 不同浓度RoboN对胰腺癌BxPC-3细胞的生长影响差异

图8 不同浓度RoboN对胰腺癌BxPC-3细胞的生长影响差异
3 讨论
胰腺癌是一种具有高度侵袭行为的消化道恶性肿瘤,在我国,发病率呈逐年增长趋势。胰腺癌的发生、发展、侵袭和转移是严重影响预后的因素,而有关上述方面的研究仍是目前研究的热点问题。
Slit/Robo信号通路较早是在中枢神经系统中进行研究的,其在中枢神经系统中有抑制神经细胞迁移,阻止合缝处神经轴突穿过神经管中线,控制神经轴突在神经系统中准确定位[14]的作用。Slit/Robo信号通路对感觉神经元的中枢突分支及延伸有抑制作用,而对其周围突分支及延伸有促进作用[15]。此外,Slit/Robo信号通路在外周自主神经系统的形成和发展中也具有一定作用[16]。
Slit/Robo信号通路对肿瘤发生发展也有作用,但各方面的研究报道结果尚不统一,主要表现在以下三个方面,第一,Slit/Robo信号通路在肿瘤中表达情况不同,表现在其是癌基因与抑癌基因方面的认识不同;第二,Slit/Robo信号通路对肿瘤新生血管形成的作用报道不一,来源于该信号通路可以通过诱导血管内皮细胞的迁移促进新生血管形成,还是抑制血管内皮细胞的迁移减少新生血管形成的结论不同;第三,Slit/Robo信号通路对肿瘤细胞迁移作用的报道也尚不一致,出现该信号通路可以抑制肿瘤细胞迁移,或者诱导肿瘤细胞迁移,从而促进肿瘤细胞的侵袭、扩散及转移。
目前尚无Slit/Robo信号通路在胰腺癌中的研究报道,由于胰腺癌具有神经浸润的特征性表现,其神经浸润机制可能与某些神经导向因子有关。Slit/Robo信号通路不仅能调节神经的生长及分支,且其已被发现存在于许多恶性肿瘤细胞中发挥一定作用。基于以上研究报道,本实验首先通过RTPCR、免疫细胞化学、免疫荧光两种方法证实胰腺癌细胞中存在Slit2、Robo1基因及蛋白的表达。表明在胰腺癌细胞中同样存在Slit/Robo信号通路,即Slit2/Robo1信号通路。与肝癌、直肠癌、乳腺癌、胃癌、宫颈癌等其他恶性肿瘤类似,Slit/Robo信号通路可能对胰腺癌的发生发展具有一定作用。
为了进一步探讨Slit/Robo信号通路对胰腺癌细胞的作用,本实验通过用不同浓度的Robo1胞外区阻断剂RoboN,它可以竞争性结合Robo第1个免疫球蛋白功能区,从而阻断Slit2/Robo1信号通路活性,通过检测细胞生长情况,发现添加阻断剂RoboN的实验组较正常对照组胰腺癌细胞的吸光度下降,细胞生长的抑制率上升,表明Slit2/Robo1信号通路对胰腺癌细胞的生长具有一定影响作用。通过统计学方法验证各组间细胞生长抑制率差异的显著性,发现在24、48、72 h时,各浓度组的抑制率存在显著性差异(P<0.05),并且随着实验组对Slit2/Robo1信号通路阻断时间的延长,这种抑制作用也越来越明显。
本实验研究发现,阻断Slit/Robo信号通路可以抑制胰腺癌细胞的生长,这和马宇光[17]用Slit/Robo信号阻断剂R5预处理人舌鳞状上皮癌细胞系Tb细胞后,Tb细胞的增殖率减弱,PCNA蛋白表达水平下降结果一致,表明Slit/Robo信号通路也参与了胰腺癌细胞生长的过程。
随着进一步的研究,Slit家族和Robo家族的其他成员可能在胰腺癌其他细胞株中将会被发现;Slit/Robo信号通路对胰腺癌生长、浸润、转移的生物学行为作用也将被揭示;此外通过研究,具有神经导向和促进肿瘤发生发展双重作用的Slit/Robo信号通路,可能为胰腺癌的神经浸润机制提供新的分子水平上的理论依据。
胰腺癌预后极差,本实验结果发现,通过添加Slit/Robo信号通路阻断剂RoboN可以抑制胰腺癌细胞的生长。因此,进一步深入研究Slit/Robo信号通路对胰腺癌的作用及机制,治疗方法提供新的理论支持。目前关于Slit/Robo信号通路在肿瘤中的作用报道不多,且现有的报道结果尚不统一,各种不明确的研究结果均揭示了Slit/Robo信号对肿瘤发生发展作用的复杂性,而这种不统一的研究结果可能与该信号通路中不同配、受体的相互作用有关,其机制也需要进一步深入研究。
[1]Brose K,Bland KS,Wang KH,et al.Slit proteins bind Robo receptors and have an evolutionarily conserved in repulsive axon guidance[J].Cell,1999,96(6):795-806.
[2]Wu W,Wong K,Chen J,et al.Directional guidance of neuronal migration in the olfactory system by the protein Slit[J].Nature,1999,400(6742):331-336.
[3]Dickson BJ,Gilestro GF.Regulation of commissural axon pathfinding by slit and Robo receptors[J].Annu Rev Cell Dev Biol,2006,22(6):651-675.
[4]Hohenester E.Structural insight into Slit-Robo signalling[J].Biochem Soc Trans,2008,36(2):251-256.
[5]Hussain SA,Piper M,Fukuhara N,et al.A molecular mechanism for the heparan sulfate dependence of slit-robo signaling[J].J Biol Chem,2006,281(51):39693-39698.
[6]Fukuhar N,Howwitt JA,Hussain SA,et al.Sturctual and functional analysis of Slit and heparin binding to immunoglobulin-like domains 1 and 2 of Drosophila Robo[J].J Biol Chem,2008,283(23):16226-16234.
[7]Wang B,Xiao Y,Ding BB,et al.Induction of tumor angiogenesis by Slit-Robo signaling and inhibition of cancer growth by blocking Robo activity[J].Cancer Cell,2003,4(1):19-29.
[8]Singh RH,Indra D,Mitra S,et al.Deletions in chromosome 4 differentially associated with the development of cervical cancer:evidence of slit2 as a candidate tumor suppressor gene[J].Hum Genet,2007,122(1):71-78.
[9]Wang LJ,Zhao Y,Han B,et al.Targeting Slit-Roundabout signaling inhibits tumor angiogensis in chemical-induced squamous cell squamous cell carcinogenesis[J].Cancer Sci, 2008,99(3):510-517.
[10]Legg JA,Herbert JM,Clissold P,et al.Slits and Roundabouts in cancer,tumour angiogenesis and endothelial cell migration[J].Angiogensis,2008,11(1):13-21.
[11]Schmid BC,Rezniczek GA,Fabjani G,et al.The neuronal guidance cue Slit2 induces targeted migration and may play a role in brain metastasis of breast cancer cells[J]. Breast Cancer Res Treat,2007,106(3):333-342.
[12]Yuasa-Kawada J,Kinoshita-Kawada M,Rao Y,et al.Deubiquitinating enzyme USP33/VDU1 is required for Slit sigmaling in inhibiting breast cancer cell migration[J]. Proc Nati Acad Sci USA,2009,106(34):14530-14535.
[13]Yiin JJ,Hu B,Jarzynka MJ,et al.Slit2 inhibits glioma cell invasion in the brain by suppression of Cdc42 activity[J]. Neuro Oncol,2009,22(6):779-789.
[14]Bagri A,Marin O,Plump AS,et al.Slit proteins prevent midline crossing and determine the dorsoventral position of major axonal pathways in the mammalian forebrain[J]. Neuron,2002,33(2):233-248.
[15]Le Ma,Marc Tessier-Lavigne M.Dual branch-promoting and branch-repelling Actions of Slit/Robo signaling on peripheral and central branches of developing sensory axons[J].J Neurosct,2007,27(25):6843-6851.
[16]Young HM,Anderson RB,Anderson CR.Guidance cues involved in the development of the peripheral autonomic nervous system[J].Auton Neurosci,2004,112(1-2):1-14.
[17]马宇光,王丽京,韩冰.信号对口腔癌Tb细胞增殖作用的影响[J].实用口腔医学杂志,2006,21(4):441-444.
Expression of Slit/Robo signaling pathway in pancreatic cancer cells and its effect on cell growth
LIANG Gang1HE Meng-guo1MAQing-yong2#1Department of Hepatobiliary Surgery,Xianyang 215 Hospital of the Nuclear Industry in Shaanxi Province,Xianyang 712000,Shaanxi,China2Department of Hepatobiliary Surgery,First Affiliated Hospital of Xi'an Jiaotong University,Xi'an 710000,Shaanxi,China
ObjectiveTo detect the expression of Slit/Robo signaling pathway in pancreatic cancer cells,and to analyze its impact on cell growth.MethodThe expression of Slit/Robo signaling pathway was detected in pancreatic cancer cell line BxPC-3 and Panc-1 by RT-PCR,immunohistochemistry,and immunofluorescence,respectively.Then the blocker RoboN was used to block the Slit/Robo signal pathway,and the cell proliferation was observed as per MTT method. ResultThe gene and protein expression of Slit2 and Robo1 was observed in pancreatic cancer cell line BxPC-3 and Panc-1.With the addition of inhibitor RoboN,the in-vitro cell growth and proliferation of pancreatic cancer cells was suppressed.ConclusionThere may be a Slit2/Robo1 signaling pathway in pancreatic cancer cells,which may negatively regulate the growth of pancreatic cancer cells,suggesting that the Slit/Robo signaling pathway is potentially engaged in the occurrence and development of pancreatic cancer.
Slit/Robo signaling pathway;pancreatic cancer;cell growth
R735.9
A
10.11877/j.issn.1672-1535.2016.14.02.15
Oncol Prog,2016,14(2)
(corresponding author),邮箱:qyma56@mail.xjtu.edu.cn作用。但Slit/Robo信号在胰腺癌细胞中是否也有表达,是否参与调控胰腺癌细胞的生长,国内外尚未见报道。本研究通过检测胰腺癌细胞中Slit、Robo的表达情况及阻断Slit/Robo信号通路,分析该通路对胰腺癌细胞生长的影响。
2015-06-30)
较早的研究发现,Slit/Robo信号通路作为神经导向因子在神经系统中具有轴突排斥[1]、轴突导向[2]、抑制神经元迁移[3]等作用。目前,已知Slit家族由Slit1、Slit2、Slit3组成,它们在神经系统、其他细胞中均有表达,如白细胞、肺脏、肾脏、黄体等。Slit蛋白含有4个亮氨酸富有区序列(LRRs,D1~D4)、7~9个EGF样的重复序列、一个半胱氨酸富有区C末端序列和一个层黏素G序列,其中LRRs参与和受体结合。Robo家族是一类保守跨膜受体蛋白,由4个成员组成:Robo1、Robo2、Robo3、Robo4,它们主要在神经系统中表达,也可表达于非神经系统,如血管内皮细胞、肌细胞等。Robo1、Robo2、Robo3由含有5个Ig样功能区及3个纤连蛋白Ⅲ组件(fibronectin typeⅢmodule,FN)的胞外区、跨膜区和一个胞内区组成,胞内区含有分别命名为:CC0、CC1、CC2、CC3的4个小区域。Robo4胞外区域只含两个Ig样功能区以及3个纤连蛋白Ⅲ组件,胞内区域只有CC0和CC2。研究表明,在硫酸类肝素(heparan sulfate,HS)蛋白多聚糖的参与下,Slit主要通过第2个LRR(D2)结合Robo胞外前两个Ig样功能区,激活Robo受体胞内区域,使其与一些重要信号分子,如srGAPs等相互作用,而产生相应的生物学作用[4-6]。现有的研究发现,Slit/Robo信号通路在多种肿瘤细胞中都有表达,不同肿瘤细胞中该信号通路基因表达亚型不同[7-8],并且其对肿瘤新生血管的形成[7,9-10]、细胞的迁移[11-13]都具有一定
