HPV16 E6对宫颈癌E-cadherin表达水平和基因甲基化的影响
2016-10-17李乐赛李梅花陈亦乐
李乐赛,李梅花,张 弦,陈亦乐
(中南大学湘雅医学院附属肿瘤医院妇瘤一科,长沙 410013)
HPV16 E6对宫颈癌E-cadherin表达水平和基因甲基化的影响
李乐赛,李梅花,张 弦,陈亦乐
(中南大学湘雅医学院附属肿瘤医院妇瘤一科,长沙 410013)
目的:探讨HPV 16 E6对宫颈癌组织和细胞中E-cadherin表达水平及基因甲基化状态的影响。方法:检测20例宫颈鳞癌组织及12例正常宫颈组织中HPV16 E6、 E-cadherin蛋白表达水平及E-cadherin甲基化率。采用Siha细胞构建HPV16 E6沉默细胞株,检测siRNA E6对细胞E-cadherin mRNA和蛋白表达影响,以及E-cadherin甲基化状态。结果:HPV16 E6蛋白在宫颈鳞癌组织中的表达高于正常宫颈组织,E-cadherin蛋白在宫颈鳞癌组织中的表达低于正常宫颈组织。正常宫颈组织均未扩增出E-cadherin基因甲基化条带;宫颈鳞癌组织中,E-cadherin基因甲基化检出率为65.0%。筛选得到HPV16 E6稳定下调的Siha细胞系。E-cadherin mRNA及蛋白表达在siRNA E6 组均显著高于空载体组和空白对照组。E-cadherin基因甲基化扩增条带在siRNA E6 组呈弱阳性,而在空载体组及空白对照组呈强阳性。结论:HPV 16 E6可引起宫颈癌组织和细胞中E-cadherin基因甲基化,并可导致E-cadherin mRNA及蛋白的表达水平下调。
子宫颈癌;人乳头状瘤病毒16 E6;E-钙黏蛋白;甲基化
宫颈癌是女性常见恶性生殖系统肿瘤,全世界每年约50万新发病例[1]。高危型人乳头瘤(human papillomavirus,HPV)病毒16型的持续感染可导致宫颈癌的发生,其中,致癌基因E6是病情进展的关键因素[2]。E-钙黏蛋白(E-cadherin)是鳞状上皮细胞所表达的钙依赖性黏附分子。E-cadherin启动子区甲基化与E-cadherin的表达下调或缺失相关[3],而E-cadherin的表达下调或缺失又与多种肿瘤的不良预后相关[4]。虽然有研究涉及E-cadherin与宫颈癌发病机制的关系,但缺乏HPV 16 E6对宫颈癌E-cadherin基因甲基化影响的研究,本研究旨在探索HPV 16 E6对宫颈癌组织和细胞中E-cadherin表达水平及基因甲基化状态的影响。
1 材料与方法
1.1 组织标本与细胞处理 宫颈组织标本选取2012年1月~2013年6月间湖南省肿瘤医院收治的HPV16阳性宫颈鳞癌患者20例,同期因子宫肌瘤行子宫全切术且宫颈正常的宫颈组织12例作为对照组,所有标本术前均未予以任何抗肿瘤治疗。标本经10%福尔马林固定,常规石蜡包埋,4 μm厚连续切片。
宫颈鳞癌Siha细胞系由湖南师范大学医学院中心实验室提供。用含10%的胎牛血清DMEM培养基(Hyclone公司),37℃、5%CO2饱和湿度培养箱培养。慢病毒载体购自上海吉凯生物公司,siRNA靶点序列选自GenBank(NC-001526),设计靶点为:5'-GTTATGCA CAGAGCTGCAA-3'。细胞分组为:siRNA E6组,空载体组及空白对照组。
1.2 试剂 兔抗人HPV16E6一抗购自BIOSS(bs-1719R),E-cadherin抗体购自英国Abcam公司,β-actin抗体购自长沙艾佳生物公司,HRP标记羊抗兔二抗购自长沙艾佳生物公司,甲基化PCR引物由上海生工生物公司合成。
1.3 Western Blot 组织及细胞分别提取总蛋白,计算样品浓度。取30ug蛋白在10%SDS-PAGE凝胶电泳,湿转至PVDF膜1h30min,5%脱脂牛奶室温封闭2h,一抗4℃孵育过夜,TBST洗膜3次,二抗孵育1h,TBST洗膜5次,ECL法(BioInd公司)处理后显影观察条带,GIS软件进行光密度值结果分析。以Beta-actin作为内参计算相对表达量。
1.4 甲基化特异PCR(methylation-specific PCR, MSP) 分别提取组织及细胞中DNA后,根据EZ DNA Methylation-Gold Kit试剂盒(ZYMO公司)说明,置于PCR仪(GeneAmp PCR System 9700)中反应进行DNA重亚硫酸盐修饰及纯化,所得产物随即进行甲基化PCR扩增。甲基化特异性上游引物为5’-ATTTTAGGTTAG AGGGTTATCGC-3’,下游引物为5’-ACAAATACTTTA CAATTCCGACG-3’,扩增片段为172bp。非甲基化上游引物为5’-TCACAAATACTTTACAATTCCAACA-3’,下游引物为5’-TAATTTTAGGTTAGAGGGTTATTGT-3’,扩增片段为172bp,反应体系预变性95°C 10min,变性94°C 30s,退火51°C 30s,延伸72°C 60s,经延伸72°C 5min,共35个循环。
1.5 统计学分析 本实验运用SPSS 16.0系统进行统计分析,定量数据以均数±标准差形式表示,P值<0.05具有统计学意义
2 结果
2.1 组织标本中HPV16E6、E-cadherin蛋白表达及E-cadherin基因甲基化 HPV16 E6蛋白在宫颈鳞癌组织中的表达高于正常宫颈组织(P<0.05)(图1 A)。E-cadherin蛋白在宫颈鳞癌组织中的表达低于正常宫颈组织(P<0.05)(图1 B)。12例正常宫颈组织均未扩增出E-cadherin基因甲基化条带;在20例宫颈鳞癌组织中,有13例检测到E-cadherin基因异常甲基化,检出率为65.0%(图1 C)。

图1 组织标本中HPV16E6、E-cadherin蛋白表达及E-cadherin甲基化
2.2 HPV16 E6沉默稳定细胞株的筛选和鉴定 筛选得到HPV16 E6稳定下调的Siha细胞系(图2 A),HPV16 E6 mRNA相对表达量siRNA E6组相较空载体组及空白对照组明显降低(P<0.05)(图2 B),抑制率约为75%。
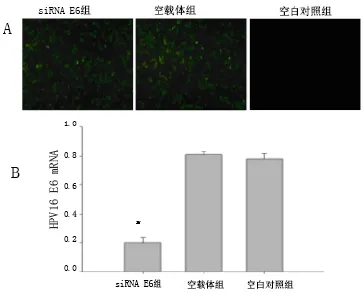
图2 HPV16 E6沉默稳定细胞株的筛选和鉴定
2.3 siRNA HPV16E6对Siha细胞E-cadherin 表达及基因甲基化的影响 E-cadherin mRNA表达在siRNA E6 组显著高于空载体组和空白对照组(P<0.05),空载体组和空白对照组无显著差异(P>0.05)(图3 A)。E-cadherin 蛋白表达水平在siRNA E6 组显著高于空载体组和空白对照组(P<0.05),空载体组和空白对照组无显著差异(P>0.05)(图3 B)。E-cadherin基因甲基化扩增条带在siRNA E6 组呈弱阳性,而在空载体组及空白对照组呈强阳性,即表明siRNA E6可导致Siha细胞中E-cadherin基因的甲基化(图3 C)。
3 讨论
大量的流行病学和分子病理学证据表明,宫颈癌患者HPV感染的亚型以HPV16型最为多见,约65.2%[5]。E6是高危型HPV病毒的重要编码蛋白之一,E6的持续表达可导致细胞恶变[6]。本研究显示,宫颈癌 HPV16 E6蛋白在宫颈鳞癌组织中的表达高于正常宫颈组织,符合上述观点。E-cadherin是一种与癌细胞浸润、转移和分化密切相关的细胞黏附分子,E-cadherin表达下调将使恶性肿瘤细胞极性丧失,呈现恶性细胞形态并具备侵袭性生长特征。研究发现多种肿瘤中均存在E-cadherin的表达降低或缺失,如胃癌、乳腺癌等[7],启动子5'端CpG岛甲基化是引起E-cadherin基因失活的重要途径[8]。我们的数据显示E-cadherin蛋白在宫颈鳞癌组织中的表达低于正常宫颈组织,提示E-cadherin蛋白的低表达可能与宫颈癌的发生及进展有关。在正常宫颈组织标本中均未扩增出E-cadherin基因甲基化条带;在20例宫颈鳞癌组织中,有13例检测到E-cadherin基因异常甲基化,检出率为65.0%。提示,在宫颈癌组织中,HPV16 E6高表达与E-cadherin蛋白的表达下降有关,而E-cadherin蛋白的表达下降可能与E-cadherin基因异常甲基化相关。
为探索HPV16 E6对宫颈癌细胞中E-cadherin表达及甲基化水平的影响,选择Siha细胞进行实验,该细胞是HPV16阳性表达的宫颈癌细胞。筛选得到HPV16 E6稳定下调的Siha细胞系,经验证HPV16 E6 mRNA抑制率约为75%。
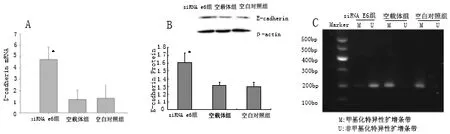
图3 siRNA HPV16E6对Siha细胞E-cadherin 表达及基因甲基化的影响
在Siha细胞中沉默HPV16 E6后,E-cadherin mRNA及蛋白表达水平均显著上调,提示HPV16 E6可以下调宫颈癌Siha细胞内E-cadherin mRNA及蛋白的表达。沉默HPV16 E6导致E-cadherin基因甲基化扩增条带呈弱阳性,而E-cadherin基因甲基化扩增条带在空载体组及空白对照组呈强阳性,表明HPV16 E6可导致Siha细胞中E-cadherin基因的甲基化,并降低宫颈癌细胞中E-cadherin mRNA及蛋白的表达水平。国外有研究表明,在Siha细胞中沉默E6可导致DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)蛋白表达水平下降60%[9]。DNA甲基转移酶是表观遗传学中催化并维持 DNA甲基化的重要酶家族。DNMT1是DNA进行复制修复并维持其正常甲基化的关键酶,与 DNA异常甲基化有关,并且二者与肿瘤的发生、发展也有密切关系。我们的研究与之相符,推测在Siha细胞中,有可能HPV16 E6通过诱导DNMT1表达水平上调,导致E-cadherin基因发生甲基化,进而E-cadherin mRNA及蛋白的表达水平下调,细胞间的黏附减弱,极性丧失,具备侵袭性生长特征。
另有研究显示,采用5-杂氮-2'-脱氧胞苷(5-aza-2'-deoxycytidine,5-Aza-dC)处理表达HPV16 E6的人永生化角质形成细胞,可导致E-cadherin的转录增加[10]。5-Aza-dC是一种甲基转移酶抑制剂,通过共价键与甲基转移酶形成不可逆的复合物从而抑制其活性,使甲基化随细胞分裂进行性丢失,能部分去除肿瘤细胞的甲基化,重新激活甲基化的基因。最早用于骨髓增生异常综合征等白血病的治疗,可以诱导或提高多种肿瘤抑癌基因的表达[11]。推测,对于宫颈癌细胞中HPV16 E6诱导的E-cadherin甲基化和蛋白水平下调,5-Aza-dC可能会是种有效的干预手段。
综上,本研究揭示:HPV 16 E6可引起宫颈癌组织和细胞中E-cadherin基因甲基化,并可导致E-cadherin mRNA及蛋白的表达水平下调。今后需要有进一步的基础研究来证实HPV 16 E6阳性宫颈癌细胞中组蛋白甲基化对E-cadherin转录的直接抑制作用,并通过体外、体内实验寻找有效的干预手段。
[1] Campbell LM, Pitta DR, De Assis AM, et al. Retrieval of HPV oncogenes E6 and E7 mRNA from cervical specimens using a manual open technology protocol[J]. Springerplus, 2012, 2(2): 473-473.
[2] Shen Y, Gong J, He Y, et al. Quantivirus® HPV E6/E7 RNA 3-0 assay(bDNA)is as sensitive, but lessspecific than Hybrid Capture 2 test[J]. J Virol Methods, 2013, 187(2): 288-293.
[3] Chan AO, Lam SK, Wong BC, et al. Promoter methylation of E-cadherin gene in gastric mucosa associated with Helicobacter pylori infection and in gastric cancer. [J]. Gut, 2003, 52(4): 502-506.
[4] Jiang WG, Sanders AJ, Katoh M, et al. Tissue invasion and metastasis: Molecular, biological and clinical perspectives[J]. Semin Cancer Biol,2015, 35(Suppl): S244-S275.
[5] Hong D, Ye F, Chen H, et al. Distribution of human papillomavirus genotypes in the patients with cervical carcinoma and its precursors in Zhejiang Province, China[J]. Int J Gynecol Cancer, 2008, 18(1): 104-109.
[6] zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. [J]. Nat Rev Cancer, 2002, 2(5): 342-350.
[7] Jiang WG, Sanders A J, Katoh M, et al. Tissue invasion and metastasis: Molecular, biological and clinical perspectives[J]. Semin Cancer Biol,2015, 35(Suppl): S244-275.
[8] Kim DS, Kim MJ, Lee JY, et al. Aberrant methylation of E-cadherin and H-cadherin genes in nonsmall cell lung cancer and its relation to clinicopathologic features[J]. Cancer, 2007, 110(12): 2785-2792.
[9] Au Yeung CL, Tsang WP, Tsang TY, et al. HPV-16 E6 upregulation of DNMT1 through repression of tumor suppressor p53[J]. Oncol Rep,2010, 24(6): 1599-1604. .
[10] Laurson J, Khan S, Chung R, et al. Epigenetic repression of E-cadherin by human papillomavirus 16 E7 protein[J]. Carcinogenesis, 2010,31(5): 918-926.
[11] Yan H, Yu N, Tong J. Effects of 5-Aza-2'-deoxycytidine on the methylation state and function of the WWOX gene in the HO-8910 ovarian cancer cell line[J]. Oncol Lett, 2013, 6(3): 845-849.
The Effect of the Humann Papillomavirus Type 16 E6 on the Expression and Methylation of E-cadherin in Cervical Cancer
Li Le-sai, Li Mei-hua, Zhang Xian, Chen Yi-lei
(Department of Gynecologic Oncology, Tumor Hospital Xiangya School of Medidine of Central South University, Changsha 410013, China)
Objective To explore the effect of papillomavirus type 16 E6 on gene expression and Methylation of E-cadherin in cervical cancer. Methods We examined protein expression of HPV 16 E6, E-cadherin and E-cadherin methylation rate in 20 cervical squamous cell carcinoma tissues and 12 normal cervical tissues. HPV16 E6 specific silenced Siha cells were constructed by virus transduction. We examined mRNA and protein expression of E-cadherin and E-cadherin methylation in Siha cells and HPV16 E6-siRNA-transfected Siha cells. Results We found that the expression of HPV16 E6 protein in cervical cancer tissues was higher than that in normal cervical tissues. The expression of E-cadherin protein in cervical cancer tissues was lower than that in normal cervical tissues. Hypermethylation of E-cadherin was not found in normal cervical tissues, while 65% in cervical cancer tissues. E6 siRNA cells showed significantly increased expression of E-cadherin mRNA and protein in comparison with the siRNA vector cells and control cells. E-cadherin gene methylation were weakly positive in E6 siRNA cells,while which were strongly positive in siRNA vector cells and control cells. Conclusion We concluded that perhaps HPV16 E6 down-regulate the expression of E-cadherin mRNA and protein and up-regulate the hypermethylation of E-cadherin in cervical cancer.
cervical cancer; HPV16 E6; E-cadherin; methylation
R711.74
A
1673-016X(2016)04-0001-04
2016-04-08
湖南省自然科学基金联合项目(14JJ7090);湖南省肿瘤医院院内青年基金
陈亦乐,E-mail:1658948099@qq.com
