Beclin1和LC3在胃癌组织中的表达水平和临床意义
2016-10-17罗小月彭美玲刘佳佳
罗小月,严 倩,彭美玲,刘佳佳,林 杨,厉 浩
(湖南师范大学医学院,长沙 410013)
Beclin1和LC3在胃癌组织中的表达水平和临床意义
罗小月,严 倩,彭美玲,刘佳佳,林 杨,厉 浩
(湖南师范大学医学院,长沙 410013)
目的:探讨胃癌相关组织中自噬相关基因Beclin1 和微管相关蛋白轻链LC3的表达及其临床意义。方法:采用免疫组化PV法检测61例胃癌组织及相应的癌旁组织中Beclin1 和LC3的表达水平,分析其与胃癌多种临床病理参数的关系。结果:免疫组化染色结果示,胃癌中Beclin1的阳性表达率为37.7%,LC3的阳性表达率为41.0%,癌旁组织的阳性表达率分别为98.4%、93.4%,癌组织明显低于癌旁组织;Beclin1 和LC3的表达水平与胃癌的淋巴结转移、浸润深度、分化程度、肿瘤TNM 分期有关,而与年龄、性别和肿瘤生长部位无相关性;胃癌组织中Beclin1 和LC3表达成正相关。结论:胃癌组织中Beclin1和LC3的表达率显著低于癌旁组织,两者之间的关系呈正相关,两者均与胃癌的发生发展有重要的关系。利用自噬调节药物对胃癌的治疗也许具有可行性。
胃癌;Beclin1;LC3;自噬
胃癌是全球最常见的消化道恶性肿瘤之一。我国是胃癌高发区,每年新发病例约40万例,占世界总发病例数的42%[1]。目前胃癌的主要治疗手段仍是手术并辅以放化疗,但多数胃癌在确诊时已到了肿瘤不可切除的阶段,此外,放、化疗对人体免疫系统有极大的副损伤,故这种方法并不能彻底缓解病人的痛苦,治愈疾病[2]。近几年,应用细胞自噬治疗恶性肿瘤已成为研究领域的一个热点问题。Beclin1和LC3 均是参与自噬体形成的重要基因,Beclin1是自噬特异性基因,在自噬的溶酶体降解过程中起到肿瘤抑制作用,而微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬标志性基因,是自噬特异的诊断指标之一[3]。该研究通过免疫组织化学方法检测胃癌中Beclin1和LC3蛋白的表达,分析其与临床病理因素之间的关系,探讨其在胃癌发生发展过程中的可能作用。
1 材料与方法
1.1 组织标本 收集湖南师范大学附属第一医院2013 年10月~2014年10月手术切除的61例胃癌石蜡标本和相应的癌旁组织及临床资料。根据WHO(2010)消化系统肿瘤分类标准[4],由两位高年资病理医师重新阅片诊断。所有病例均为首次发现,患者术前未行任何放、化疗。
1.2 主要试剂及方法 一抗为兔抗人Beclin1、LC3多克隆抗体,二抗为羊抗兔抗体,均来自北京博奥森生物技术有限公司;PV-9000 试剂盒,DAB显色液购自北京中杉金桥生物公司。按PV法行免疫组织化学染色,石蜡切片常规脱蜡水化,用pH6.0柠檬酸缓冲液进行微波抗原修复,滴加 3%H2O2去离子水(37℃孵育18min),第一抗体(稀释比例均为 1:200,4℃过夜),再滴加PV-9000试剂盒中Polymer Helper试剂(37℃孵育20min),加入辣根过氧化物酶标记的二抗(37℃孵育30min),DAB显色,苏木精复染,脱水,中性树胶封片。阳性对照由试剂公司提供,PBS代替一抗作为阴性对照。
1.3 结果判断 Beclin1、LC3阳性表达为棕黄色颗粒,LC3阳性表达见于细胞质,强阳性时细胞间质和细胞核中亦可见表达;Beclin1阳性见于细胞质,细胞间质及细胞核均不表达。每张切片采用双盲法随机观察5个高倍视野,计数100个细胞,依据阳性细胞比率及着色深度分别评估,最后综合评定。阳性细胞占总细胞数的比率<10%且呈浅黄色或不着色者为阴性。
1.4 统计学分析 应用SPSS19进行统计分析,非正态分布资料采用秩和检验,计数资料用X2检验。
2 结果
2.1 Beclin1 和LC3 在胃癌组织中的表达 Beclin1主要表达于细胞质,少量或微量表达于细胞膜,LC3 主要表达于细胞质与细胞核。Beclin1 在胃癌组织和癌旁组织中均有表达,胃癌组织中Beclin1 的表达率显著低于癌旁组织。61 例胃癌组织标本中Beclin1 阳性表达率为37. 7%(23/61),显著低于癌旁组织的98.4%(60/61),差异有统计学意义(P<0.05)。LC3 在胃癌组织和癌旁组织中亦有表达。胃癌组织中LC3 阳性表达率为41.0%(25/61),亦显著低于癌旁组织93.4%(57/61),差异有统计学意义(P<0.05)。见表1。

表1 Beclin1及LC3在癌组织、癌旁组织中的表达
2.2 Beclin1 和LC3 表达与胃癌临床病理因素的关系
Beclin1 和LC3在胃癌中的表达与淋巴结转移、浸润深度、分化程度、肿瘤TNM 分期有关(P<0.05),而与年龄、性别和肿瘤生长部位无相关性(P>0.05)。其中临床分期越高、病理分化程度越低、浸润深度越深、有淋巴结转移,Beclin1 和LC3表达量就越低。详见表2。
2.3 Beclin1 与LC3 相关性分析 Beclin1和LC3共同阳性患者18例,共同阴性者31例,Beclin1 阳性而LC3阴性表达者5例,Beclin1 阴性而LC3 阳性者7例,结果示:Beclin1阳性表达组中LC3 Ⅱ阳性表达率为78.2%,Beclin1阳性表达组中LC3 Ⅱ阴性表达率为21.7%,差异具有统计学意义(P<0.05)。Spearman 相关性分析显示,两者在胃癌中的表达呈正相关(P<0.01)。见表3。
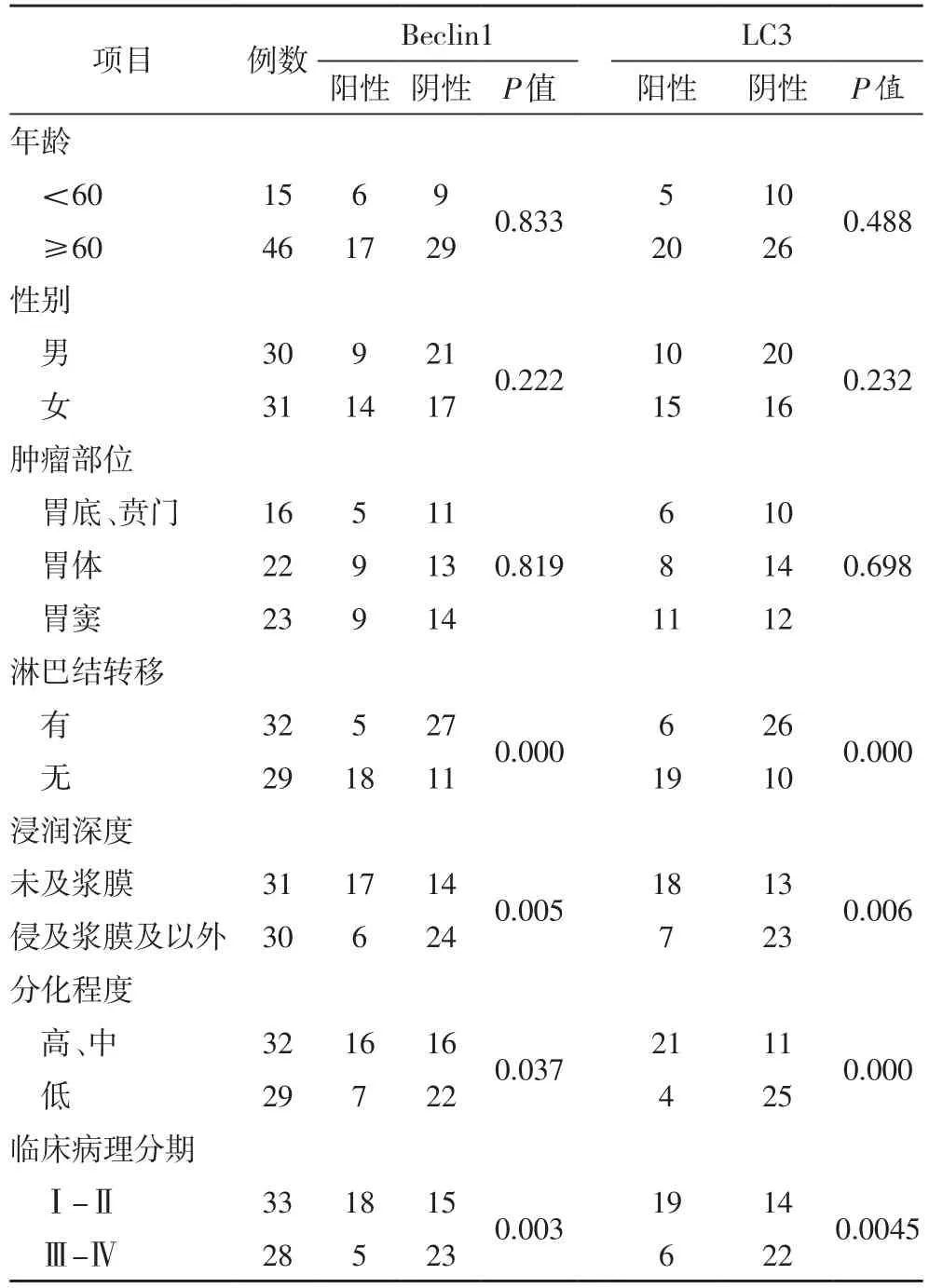
表2 Beclin1和LC3与临床病理特征的关系
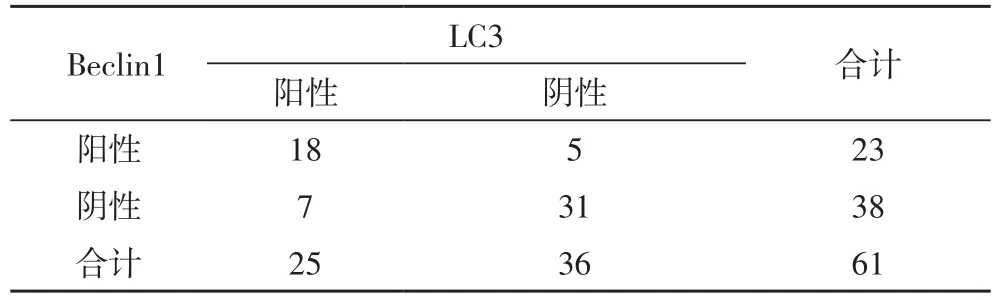
表3 胃癌组织中Beclin1和LC3蛋白的表达
3 讨论
自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程,是真核细胞特有的生命现象[5]。它不仅是细胞生长发育、分化成熟及死亡的重要调控机制,与肿瘤的发生、发展也有密切的关系[6,7]。
Beclin1是酵母自噬相关基因6(autophagy related gene 6,ATG6)在哺乳动物中的蛋白直系同源物,对于促进自噬起始囊泡的形成及细胞自噬具有关键作用[8]。Beclin1 作为一种自噬的调控因子,亦被认为是一种肿瘤相关因子,其在肿瘤方面,Beclin1介导的自噬作用可能有多重机制:其一,是可以调节细胞生长,降解必要的特定细胞器和长寿蛋白;其二是清除那些产生活性氧及增加遗传毒性的应激和诱导非凋亡形式程序性细胞死亡的细胞器[9]。故Beclin1既有杀伤肿瘤细胞,抑制肿瘤的产生与发展的可能,也有使细胞处于应激状态,让肿瘤细胞逃逸的可能。且已有相关研究表明,Beclin1在不同的肿瘤以及同一肿瘤的不同阶段起不同的作用[10]。在人类的乳腺癌、卵巢癌和前列腺癌等细胞中,Beclin1可存在缺失[11],而动物实验证明,在Beclin 1 单等位基因敲除的小鼠中,发现有多种癌症的发病率明显高于正常小鼠[12],提示,Beclin1参与了癌症的发生,且可能是癌症发生的一个早期事件之一。本实验结果显示:在61例胃癌组织标本中Beclin1的阳性表达率为37.7%,癌旁组织的阳性表达率为98.4%,癌组织明显低于癌旁组,差异具有统计学意义,提示Beclin1参与了胃癌的发生。而且,Beclin1的低表达与胃癌的临床分期、淋巴结转移、浸润深度、分化程度有密切关系。而与患者的年龄、性别、肿瘤部位无明显相关。在分期较晚、分化程度较低、有淋巴结转移、侵及浆膜及浆膜外的胃癌组织中,Beclin1表达显著降低,提示Beclin1在胃癌的发生发展以及转移中起着重要作用,其在胃癌组织的低表达可能与胃癌的演进和不良预后有关。
LC3是哺乳动物细胞中酵母ATG8(Ant7/ Apg8)基因的同源基因,其有Ⅰ型与Ⅱ型两种形式存在,当自噬发生时,LC3Ⅰ经泛素样加工修饰过程生成其蛋白水解衍生物LC3Ⅱ(分子量分别为18 kD 和16 kD)。LC3Ⅰ被定位于细胞质,而LC3Ⅱ结合自噬体[13]。LC3作为一种自噬相关基因,其表达强度与自噬泡的数量呈正相关,被作为自噬表达的特异性方法之一,且LC3Ⅱ的测定比LC3Ⅰ更有意义[14]。本实验测定的为LC3Ⅱ的表达强度,其结果如下:在61例胃癌组织标本中LC3Ⅱ的阳性表达率为41.0%,癌旁组织的阳性表达率为93.4%,癌组织明显低于癌旁组,差异具有统计学意义,类似Beclin1。同时,LC3Ⅱ的低表达与胃癌的临床分期、淋巴结转移、浸润深度、分化程度有密切关系。而与患者的年龄、性别、分化程度、肿瘤部位无明显相关。在分期较晚,有淋巴结转移、分化程度较低、侵及浆膜及浆膜外的胃癌组织中,LC3Ⅱ表达显著降低,因为LC3Ⅱ是自噬测定的特异性因子之一,其表达的降低,提示自噬活性的降低,这可能与胃癌恶性程度的增高及侵袭转移密切相关。此外,Spearman等级相关分析示Beclin1与LC3 Ⅱ在胃癌中的表达呈正相关,提示两者在胃癌的淋巴结转移中起协调作用,在两者的共同低表达作用下,癌细胞的侵袭力及其向淋巴管及远处组织的渗透能力加强,使得癌细胞更易转移至局部淋巴结并形成转移灶。两者的联合检测可能对胃癌的治疗效果评价及预后具有一定的参考意义。
综上所述,细胞自噬在胃癌的发生发展中占有重要地位。胃癌细胞自噬活性明显上升,并且主要集中在胃癌的早期阶段,表明自噬对于胃癌的早期发生和进展可能具有推动作用。且肿瘤的难治性在于其易复发及转移,从而影响患者的生存期,而淋巴结转移、浸润深度、分化程度、及临床分期与胃癌预后明显相关,本实验提示胃癌治疗过程中,出现局部肿瘤未完全控制、向远处转移、复发等可能与自噬的作用相关。以此为基础,自噬可以作为新的靶点设计新的药物或者联合治疗方案[15],且本实验的结果提示在胃癌的治疗中,调节自噬的药物具有应用前景,因此,联合自噬调节药物和化疗药物[16],甚至结合放疗[17]可能会成为治疗胃癌的一种新手段。目前,已有不少以自噬为靶点促进胃癌细胞死亡的相关研究。如姜黄素[18]已有相关的证据能促进胃癌细胞死亡,其具体机制目前正在探索当中。尽管对自噬与肿瘤关系的研究已取得重大的进展,但考虑到自噬在肿瘤发生发展中的复杂作用,深入识别及探讨其机制,将有助于找到抑制肿瘤生长的有效途径,这对肿瘤发病机制的研究及临床治疗均有一定的意义。
内科杂志, 2014, 34(4): 408-415.
[2] 吕潇童. 进展期胃癌的治疗进展[J]. 医学综述, 2013, 19(19): 3513-3515.
[3] Jiang H, Cheng D, Liu W, et al. Protein kinase C inhibits autophagy and phosphorylates L[J]. Biochem Biopys Res Commun, 2010, 395(4): 471-476.
[4] Bosman FT, Carneire F, Hruban R H, et al. World Health Organization classification of tumours of the digestive system[M]. Lyon: IARC Press,2010.1-155.
[5] 王宠, 张萍, 朱卫国, 等. 细胞自噬与肿瘤发生的关系[J]. 中国生物化学与分子生物学报, 2010, 26(11): 988-997.
[6] 周欢欢, 姜涛. 自噬在肿瘤发生发展及治疗中的作用[J]. 肿瘤学杂志, 2010, 16(6): 482-486.
[7] Pavlides S, Tsirigos A, Migneco G, et al. The autophagic tumor stroma model of cancer: Role of oxidative stress and ketone production in fueling tumor cell metabolism[J]. Cell Cycle, 2010, 9(17): 3485-3505.
[8] Djavaheri-Mergny M, Maiuri MC, Kroemer G. Cross talk between apoptosis and autophagy by caspase-mediated cleavage of Beclin 1[J]. Oncogene, 2010, 29(12): 171-176.
[9] Baspinar S, Bircan S, Yavuz G, et al. Beclin 1 and bcl-2 expressions in bladder urothelial tumors and their association with clini-copathological parameters[J]. Pathol Res Pract, 2013, 209(7): 418-423
[10] White E. DiPaola RS[J]. The Double—Edged sword of autophagy modulation in cancer. Clin Cancer Res, 2009, 15: 5308-5316.
[11] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451(7182): 1069-1075.
[12] Brech A, Ahlquist T, Lothe RA, et al. Autophagy in tumour suppression and promotion[J]. Mol Oncol, 2009, 3(4): 366-375.
[13] Yoshioka A, Miyata H, Doki Y, et al. LC3, an autophagosome marker, is highly expressed in gastrointestinal cancers[J]. Int J Oncol, 2008, 33(3): 461-468.
[14] Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for theuse and interpretation of assays for monitoring autophagy[J]. Autophagy, 2012,8(4): 445-544.
[15] Janku F, Mcconkey DJ, Hong DS, et al. Autophagy as a target for anticancer therapy[J]. Nat Rev Clin Oncol, 2011, 8(9): 528-539.
[16] Liu D, Yang Y, Liu Q, et a1. Inhibition of autophagy by 3-MA potentiates cisplatin—induced apoptosis in esophageal squamous cell carcinoma cells[J]. Med Oncol, 2011, 28(1): 105-111.
[17] Kuwahara Y, Oikawa T, Ochiai Y, et a1. Enhancement of autophagy is a potential modality for tumors refractory to radiotherapy[J]. Cell Death Dis, 2011, 2: 177-175.
[18] 邓淑文, 殷清华, 苏琦, 等. 姜黄素诱导人胃癌SGC7901细胞自噬性凋亡的研究[J]. 中国现代医学杂志, 2012, 22(31): 30-35.
[1] 邹文斌, 李兆申. 中国胃癌发病率及死亡率研究进展[J]. 中国实用
Expression and clinical significance of MAPLC3 and autophagy-related gene Beclinl in gastric cancer
Luo Xiao-yue, Yan Qian, Peng Mei-ling, Liu Jia-jia, Lin Yang, Li Hao
(Medical College of Hunan Normal University, Changsha 410013, China)
Objective To investigate the expression and significance of autophagy-related gene Beclinl and MAP LC3 in gastric cancer. Methods Immunohistochemical staining was used to detect the protein expressions of Beclinl and LC3 in 61 gastric carcinoma tissues and their adjacent noncancerous specimens. Results The express of Beclinl and LC3 was both decreased in carcinoma tissues(37.7%, 41.0%), which were significantly lower than those in noncancerous tissues. The expression of Beclinl and LC3 was correlated with depth of invasion, lymph node metastasis, TNM classification and the degree of differentiation. There was positive correlation between the expression of Beclinl and LC3. Conclusion Autophagy gene Beclinl and LC3 expression is down-regulated in gastric cancer, which may relate to tumorigenesis and development of gastric cancer. Gene therapy targeting to autophagy gene Beclinl and LC3 may be feasible in treatment of gastric cancer.
gastric cancer; Beclinl; LC3; autophagy
R735.2
A
1673-016X(2016)04-0004-04
2016-03-04
湖南师范大学创新性实验项目(NO.043-0094)通讯作者:厉浩,E-mail:lihao1234567@sina.com
