扫描探针显微技术测量血管内皮细胞的弹性
2016-10-13徐峥段俊丽钱梦騄程茜
徐峥,段俊丽,钱梦騄,程茜
扫描探针显微技术测量血管内皮细胞的弹性
徐峥1,段俊丽2,钱梦騄1,程茜1
(1. 同济大学物理科学与工程学院,上海200092; 2. 上海交通大学附属医学院新华医院老年科,上海 200092 )
血管内皮细胞的功能与许多疾病间存在关联,但现在对其功能好坏的定量描述仍十分少见。该文以内皮细胞的弹性作为衡量其功能的一个标准。通过理论建立压痕测量杨氏模量的计算方法,并利用扫描探针显微镜从实验上得到了正常及过氧化氢处理过的人脐静脉内皮细胞的杨氏模量。发现过氧化氢处理后细胞的杨氏模量升高,表明通过杨氏模量来表征细胞活性是可行的。
内皮细胞;扫描探针显微镜;杨氏模量;活性
0 引言
血管内皮细胞是铺在血管内壁的细胞,它位于血液和血管组织基底膜之间,厚度在微米数量级。在血管中,内皮细胞主动传输小分子、大分子和激素,并在调节血压、凝血、血管新生里起到至关重要的作用[1]。G. Favero 等研究发现内皮功能紊乱与心血管疾病及糖尿病有着紧密的联系[2]。也有研究表明内皮细胞功能异常会导致动脉粥样硬化[3]、出血性疾病、免疫功能紊乱、移植排斥,甚至造成死胎等[1]。内皮细胞的研究对预防和治疗这些疾病起着至关重要的作用。现在,越来越多的研究从生理和病理上研究其功能并建立了一系列的离体模型,已有研究者研究了内皮细胞功能对血管舒张性,凝血、新生、淋巴细胞黏附、迁移,以及血管信号和传输通路等的影响。然而,从细胞出发,以内皮细胞的力学特性来对其定量描述的研究仍十分少见。
近年来随着纳米技术的发展,纳米生物力学和纳米生物医学是迅速兴起的生物医学研究前沿。在细胞尺度上开展生理和病理学的研究,可以更深刻地揭示疾病的起因,为相关严重疾病的诊疗和康复提供更有效的途径[4-5]。扫描探针显微镜如今正迅速发展为新型的表面结构成像的有力工具,相对电子显微镜技术,扫描探针显微技术不但可对绝缘体和导体进行成像,更可以对浸润在液体(如生理盐水)中的样品进行成像,使生物样品在扫描中仍可维持生命。现在,扫描探针显微镜已被广泛用以得到生物体材料的形貌及表面弹性[6-8]。
当用针尖产生纳米压痕时,扫描探针显微镜可逐点测量微小区域、弹性较小且表面弹性不均匀材料的力曲线。样品由于探针微压痕产生压缩,通过分析施加力与位移间的关系,可以得到样品的杨氏模量,其横向分辨率仅几个纳米。如今,扫描探针显微镜已经用来测量细菌[6]、关节软骨[7]、骨组织[8]的弹性,也用来测量单个分子间的结合力[9]。
本文推导了探针表面施加力、探针纵向位移与细胞杨氏模量间的关系。测量了正常内皮细胞及使用过氧化氢处理过的内皮细胞的表面弹性模量。并分析了误差的来源。
1 理论基础与实验方法
1.1 理论计算方法
对于针尖与试样间的相互作用,其等效杨氏模量可以表示为

式中:和分别是材料的杨氏模量和泊松比,下标代表是探针压头,代表试样。这样由实验测得的減去来确定探针压头的。如果已知探针材料的弹性参数,也可通过比较理论与实验测定的来验证相应的赫兹模型理论。
假设样品在探针压痕处平整且与界面间无摩擦力,则其正应力符合赫兹接触模型,其边界条件可写为

在方程(2)中,

正位移u(0,0) 即压痕深度可表示为[10]

(4)
如果假设压痕深度与接触半径之间的关系为[11]
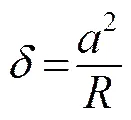
则可以得到力与等效杨氏模量间的关系:
(6)
1.2 实验方法
试样为人脐静脉内皮细胞,扫描方式为接触模式。扫描探针显微镜工作示意图如图1所示。通过下压或抬针过程,可得到下针位移以及由光探测器得到探针偏转量的关系。其中偏转量为探针受力的反馈,将两者转换为压痕深度与探针受力的关系即为力曲线。随后代入公式(6),计算可得到等效杨氏模量。
2 结果与讨论
探针弹性由原子力显微镜的热调谐功能测得为0.14 N/m。假设探针针头半径为10 nm,细胞杨氏模量为0.47。得到曲线如图2所示。图2中,横轴为轴位移,纵轴为偏转量。虚线为进针曲线,实线为退针曲线。在非接触区域,随着轴位置的增加,偏移量几乎不变,表明探针没有受到力的作用。随后探针接触到细胞,受到细胞的弹性力作用,探针产生偏转。在退针时,在接触区域,退针与进针曲线几乎重合。当探针退出与试样接触区域时,由于粘滞力的存在,使探针产生负向偏移,随后才进入非接触区。
如果将接触区与非接触区的交界取为新的零点,则可将横轴转变为压痕深度,同时纵轴反应的是受力后的偏转量,与相乘即为探针受力。由这两个参数通过公式(6)可得到等效杨氏模量。
2.1 正常内皮细胞的杨氏模量
正常内皮细胞杨氏模量如图3所示。其中横轴代表单个细胞同一部位不同深度上的采样点,纵轴代表杨氏模量,不同颜色代表不同细胞不同部位。由于细胞各点处高度不同,而有效数据在探针接触到细胞后产生,因此采样点长度略不同。从图3中发现,在刚进入细胞时,采样点计算得到的杨氏模量较大,这主要是因为在压痕深度较小时,近场引力及静电力对探针的影响。另一方面也可能是由于在计算中较小时绝对误差较大造成的。因此在实际计算时,我们忽略刚进入细胞段的数据,只取相对稳定区域的杨氏模量作计算。
对平稳区域的数值进行平均,得到正常内皮细胞的杨氏模量为(0.84±0.14)×105Pa。
2.2 过氧化氢处理后细胞的杨氏模量
由于过氧化氢生成的自由基,与生物大分子如蛋白质、核酸、生物膜上不饱和脂肪酸等发生反应,导致大分子变性、脂质过氧化、生物膜损伤等[12]。高浓度>300 μmol/L的过氧化氢会迅速导致细胞不可逆损伤甚至死亡,低浓度过氧化氢能通过激活细胞内各种信号传导机制,造成对细胞的损伤,但其机制比较复杂[13]。
分别用100 μmol/L和200 μmol/L过氧化氢对内皮细胞进行处理。得到杨氏模量分布如图4和5所示。对用100 μmol/L和200 μmol/L过氧化氢处理过的内皮细胞,计算得到其杨氏模量分别为(5.47±1.02)×105Pa和(4.02±0.75)×105Pa。与未处理过的内皮细胞相比,其杨氏模量增加约5倍。因此,处理过的细胞更硬且不易形变。这可能是由于该浓度的过氧化氢可使细胞功能损伤。内皮细胞杨氏模量的增加可能与内皮细胞的功能障碍有关,内皮细胞变硬可能是细胞衰老的一个标志,而杨氏模量可能成为简单的内皮细胞功能评价指标。
从结果可以发现实验及计算过程中存在误差,误差可能来源于以下几个方面:
(1) 细胞培养在盖玻片上,当探针下压细胞时,压痕深度与细胞本身的高度大致相当,此时细胞下方的盖玻片相当于刚性界面,使得在相同载荷力的作用下,探针的压痕深度变浅,因此会影响到杨氏模量的计算,更严格的计算将在以后的工作中进行探讨。
(2) 细胞是非常柔软的物质,细胞压痕主要是细胞膜和细胞骨架弹性的反映。因此,过氧化氢对内皮细胞的影响很可能是由于过氧化氢使得细胞骨架构型发生改变。而力曲线也依赖于测量细胞的部位,比如当压痕在细胞核及细胞核仁上进行时,反映的杨氏模量应当偏大,而对细胞骨架进行测量时,其值相对较小。因此,需要在先得到细胞形貌的情况下才能使每次测量的细胞位置相同,但是在液相下得到细胞形貌现在仍然是难题,这将在以后的课题中进行研究。
(3) 在计算中,我们假设探针针尖的半径为10 nm。而实际情况下,该半径为标称值,与实际探针半径大小存在偏差,这样的偏差将导致计算得到的杨氏模量与实际细胞的杨氏模量有所差别。
(4) 实际细胞的泊松比很难测量。一般细胞的泊松比在0.45~0.49之间。统一假设其值为0.47,实际泊松比可能与假设存在差别。当然,对于同种细胞,我们认为其泊松比的变化量不会太大。
3 结论
本文通过实验及计算得到了人脐静脉内皮细胞的杨氏模量,发现用过氧化氢处理的内皮细胞其弹性要高于未经处理的,并分析了误差的来源。为将细胞弹性作为评价细胞功能的手段提供了依据。
[1] Cines D, Pollak E, Buck C, et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders[J], Blood, 1998, 91(10): 3527-3561.
[2] Favero G, Paganelli C, Buffoli B, et al. Endothelium and its alterations in cardiovascular diseases: life style intervention[J]. Biomed Res. Int., 2014, 2014(1): 1-28.
[3] Pinkney J H, Stehouwer C, Coppack S, et al. Endothelial dysfunction: Cause of the insulin resistance syndrome[J]. Diabetes, 1997, 46(2): S9-S13.
[4] Ghormade V, Deshpande M, Paknikar K. Perspectives for nano-biotechnology enabled protection and nutrition of plants[J]. Biotechnol. Adv., 2011, 29(6): 792-803.
[5] Lahann J. Recent progress in nano-biotechnology: compartmentalized micro- and nanoparticles via electrohydrodynamic co-jetting [J]. Small, 2011, 7(9): 1149-1156.
[6] Schaer-Zammaretti P, Ubbink J. Imaging of lactic acid bacteria with AFM—elasticity and adhesion maps and their relationship to biological and structural data[J]. Ultramicroscopy, 2003, 97(1-4): 199-208.
[7] Stolz M, Raiteri R, Daniels A. VanLandingham M et al. Dynamic elastic modulus of porcine articular cartilage determined at two different levels of tissue organization by indentation-type atomic force microscopy[J]. Biophys. J., 2004, 86(5): 3269-3283.
[8] Tao N J, Lindsay S, Lees S. Measuring the microelastic properties of biological material[J]. Biophys. J., 1992, 63(4): 1165-1169.
[9] Florin E L, Moy V, Gaub H. Adhesion forces between individual ligand-receptor pairs[J]. Science, 1994, 264(5157): 415-417.
[10] Herbert E, Pharr G, Oliver W, et al. On the measurement of stress-stain curves by spherical indentation[J]. Thin Solid Films, 2001, 398(1): 331-335.
[11] Radmacher M. Measuring the elastic properties of biological samples with the AFM[J]. IEEE Eng. Med. Biol. Mag., 1997, 16(2): 47-57.
[12] 曹纯章, 杨同书. 过氧化氢对培养心肌细胞损伤作用的研究[J]. 生物化学与生物物理进展, 2000, 27(6): 628-632.
CAO Chunzhang, YANG Tongshu. The injured effect of hydrogen peroxide on cultured cardiac myocytes[J]. Prog. Biochem. Biophys., 2000, 27(6): 628-632(in chinese).
[13] Goldhaber J, Weiss J. Oxygen free radicals and cardiac reperfusion abnormalities[J]. Hypertension, 1992, 20(1): 118-127.
Elasticity measurement of endothelial cells by scanning probe microscopy
XU Zheng1, DUAN Jun-Li2, QIAN Meng-Lu1, CHENG Qian1
(1. School of Physics Science and Engineering, Tongji University, Shanghai 200092,China;2. Department of Gerontology, Xinhua Hospital, Shanghai Jiaotong University, Shanghai 200092,China)
It is known that the function of endothelial cells is associated with the presence of many diseases. However, so far the quantitativedescriptions of their function have been seldom investigated. In this paper, the function of endothelial cells is evaluated by the elastic modulus. The theoretical calculation for detecting their Young’s modulus based on indentation theory is established. The Young’s moduli of the normal endothelial cells and the endothelial cells after hydrogen peroxide treatment are investigated by the scanning probe microscopy. It is found that after hydrogen peroxide treatmentthe Young’s modulus of the endothelial cells will be increased. Thus, it is proved that the activity of the cell can be characterized by its elasticity. Finally, errors in the measurement are discussed.
endothelial cells; scanning probe microscope; Young’s modulus; activity
Q2-33
A
1000-3630(2016)-03-0239-04
10.16300/j.cnki.1000-3630.2016.03.011
2016-01-10;
2016-03-10
国家自然科学基金资助项目(11404245,11174223, 11374231)
徐峥(1984-), 男, 江苏苏州人, 博士, 研究方向为生物医学超声。
程茜, E-mail: q.cheng@tongji.edu.cn
