粒径对麸皮多酚及其抗氧化活性的影响
2016-10-13王小平张广峰雷激刘刚叶丹孙曼兮陈丽娟
王小平,张广峰,雷激*,刘刚,叶丹,孙曼兮,陈丽娟
1(西华大学 食品与生物工程学院,四川 成都,610039)2(四川省食品药品检验检测院(东区食品中心),四川 成都,610000)
粒径对麸皮多酚及其抗氧化活性的影响
王小平1,张广峰1,雷激1*,刘刚2,叶丹1,孙曼兮1,陈丽娟1
1(西华大学 食品与生物工程学院,四川 成都,610039)2(四川省食品药品检验检测院(东区食品中心),四川 成都,610000)
为比较不同粒径麸皮的多酚含量及抗氧化活性,该实验采用不同有机溶剂分别对麸皮的游离多酚和结合多酚进行提取,并测定最佳提取条件下不同粒径麸皮的多酚含量、抗氧化活性及阿魏酸含量。结果表明:游离多酚和结合多酚提取的最佳溶剂分别为体积分数80%丙酮和乙酸乙酯,其提取液的多酚含量及对DPPH·清除能力都是最高的。不同粒径麸皮其多酚含量和黄酮含量都有显著差异,结合多酚、结合黄酮、总多酚和总黄酮的含量都随粒径减小而显著降低,而游离多酚、游离黄酮含量显著增加(P<0.05),不同粒径麸皮的抗氧化活性强弱与相应的多酚含量变化一致;麸皮中的阿魏酸主要存在于结合多酚中,且随粒径的减小其含量呈极显著降低(P<0.01)。综上可知,粒径对麸皮中的多酚及抗氧化活性有显著影响。
麸皮;多酚;抗氧化活性;阿魏酸
小麦是世界各国主要粮食作物之一,年消费量巨大,麸皮是小麦加工过程中产生的主要副产物,麸皮产量占小麦消费量的20%以上。据不完全统计,2014年我国小麦的年产量超过1.2亿t,麸皮的产量可达3 000万t[1]。由于麸皮口感粗糙,难以食用等问题,绝大部分被当作饲料来使用,目前食品领域对麸皮的综合利用还远远不足,利用率不到20%[2]。研究发现,麸皮中含大量的多酚类物质,它被证实具有抗氧化活性,能有效预防高血脂、高血糖、心脑血管疾病、肿瘤等慢性疾病[3]。关于麸皮多酚的研究, 主要涉及提取方法和性质,其中提取方法主要有溶剂法、超临界流体法、超声波辅助提取法等,溶剂法常用的提取溶剂包括水、甲醇、乙醇、丙酮、乙酸乙酯等。根据多酚的存在形态将其分为游离态多酚和结合态多酚,游离态多酚可通过选择合适的溶剂直接萃取后进行定量(比色法或色谱法)分析,而结合态多酚由于被细胞壁物质束缚而无法被溶剂直接萃取,故结合态多酚只有先采用合适的水解方式(碱、酸、酶)使其释放为游离态再进行萃取分析[4]。
本实验选择小麦麸皮作为原材料,选择多酚化合物为研究对象,对多酚化合物的提取溶剂进行优化,确定最佳提取溶剂;并对不同粒径麸皮的多酚性质进行研究。本实验的目的旨在进一步开发利用麸皮资源,为研制和生产新型的高品质麸皮食品提供理论依据,进而提高麸皮综合利用率。
1 材料与方法
1.1材料与仪器
麸皮,四川巴中龙头食品有限公司;阿魏酸标准品、芦丁标准品,中国食品药品检定研究院;乙腈(HPLC级),西陇化工股份有限公司;焦性没食子酸、VC、冰乙酸、丙酮、甲醇和乙醇(分析纯),成都市科龙化工试剂厂;其他试剂都为分析纯。
HK-02A万能粉碎机,厦门旭朗机械设备有限公司;BS-1E恒温振荡器,苏州威尔实验用品有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;TDZ5-WSTDZ5-WS离心机,湖南长沙湘仪离心机仪器有限公司;1220液相色谱仪,安捷伦科技(中国)有限公司;UV2800紫外可见光分光光度计,上海舜宇恒平科学仪器有限公司。
1.2实验方法
1.2.1麸皮分级处理
麸皮除杂质→干燥(50℃、2 h)→粉碎(1 min,25 000 r/min)→物料依次过筛(200目→120目→80目→30目)
麸皮经过粉碎后,首先将其过200目分样筛,取筛下物记为200目麸皮,筛上物再过120目分样筛,取筛下物记为120目麸皮,以同样方法再依次过80目、30目分样筛,得80目、30目麸皮。
1.2.2提取多酚的溶剂筛选
游离多酚:分别称取3份2 g粉碎后麸皮于离心管中,分别加入30 mL体积分数80%甲醇、80%乙醇、80%丙酮,振摇30 min后离心(2 800×g,10 min),取上清液,重复提取3次,合并上清液用旋转蒸发仪浓缩至有机溶剂挥发完全,并用甲醇溶液定容至50 mL,即得游离多酚提取液。
结合多酚:取2份80%丙酮提取游离多酚后的残渣烘干(40 ℃),滴入20 mL 2 mol/L NaOH水解2 h,接着用浓HCl调整pH值为2~3,离心(4 390×g,15 min),取上清液,分别加入50 mL乙醚和乙酸乙酯萃取,重复萃取3次,合并溶液后,用旋转蒸发蒸干,用70%甲醇溶解残渣并定容至50 mL,即得结合多酚提取液[5]。
1.2.3不同粒径麸皮多酚含量测定
分别称取2 g 粒径为30、80、120、200目的麸皮,于离心管中,用最佳提取溶剂对它们的游离多酚和结合多酚进行提取,提取方法同1.2.2。
1.2.4多酚含量测定
对1.2.2和1.2.3的提取液采用Folin-Ciocalteu比色法[6]测定多酚含量,以焦性没食子酸为参照标准品,样品总多酚等于游离多酚和结合多酚之和。
1.2.5黄酮含量测定
1.2.3的提取液采用采用NaNO2-Al(NO3)3法[6]测定黄酮含量。取1 mL提取液,用体积分数30%乙醇溶液补充至约12.5 mL,加入0.7 mL质量分数5%NaNO2,摇匀,放置5 min后加入0.7 mL质量分数10%Al(NO3)3,6 min后再加入5mL 1 mol/L NaOH溶液及30%乙醇补足体积至25 mL,混匀后置于室温下避光反应10 min,于510 nm波长处测定吸光度。以芦丁为标准品,样品的黄酮含量以100 g干基中所含芦丁的毫克数表示(mg/100 g),样品总多黄酮等于游离黄酮和结合黄酮之和。
1.2.6淀粉含量测定
不同粒径麸皮的淀粉含量测定参照GB5006进行测定。
1.2.7抗氧化活性测定
对1.2.3的提取液采用以下方法进行抗氧化能力的测定。样品的抗氧化活性以VC为标准品,即样品抗氧化活性以1 g干基中相当于VC的毫克数表示(mg/g)。
DPPH·清除能力:取1.0 mL提取液置10 mL离心管中,加入3.0 mL的DPPH·溶液,室温避光反应30 min,同时以无水乙醇为空白,于517 nm波长处测定吸光值;OH·清除能力:参照文献[7]进行测定;ABTS+清除能力:ABTS+工作液配制,取 7.4 mmol/L ABTS溶液2 mL和 2.6 mmol/L K2S2O8溶液2 mL进行混合,室温、避光条件下放置12 h后,用无水乙醇稀释40~50倍(A734 nm=0.7±0.02),得ABTS+工作液。取1.0 mL提取液于离心管中,加入ABTS+工作液4mL,摇匀静置6 min后,于734 nm波长测定吸光度;总还原力:参照文献[8]进行测定。
1.2.8阿魏酸测定
对1.2.3的提取液采用高效液相色谱法测定阿魏酸含量,色谱条件:Kromasil C18色谱柱(250 mm×4.6 mm,5 μm);检测温度42 ℃;检测波长280 nm;进样量10 μL;流动相:乙腈,3%乙酸水溶液,梯度洗脱程序见文献[9]。
1.2.9数据分析
2 结果与分析
2.1多酚提取试剂筛选
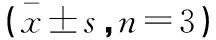
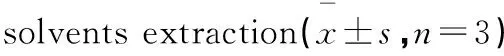
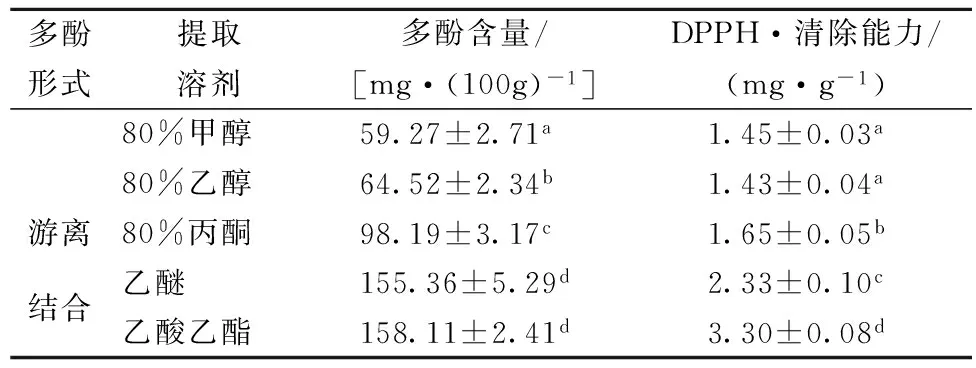
多酚形式提取溶剂多酚含量/[mg·(100g)-1]DPPH·清除能力/(mg·g-1)80%甲醇59.27±2.71a1.45±0.03a80%乙醇64.52±2.34b1.43±0.04a游离80%丙酮98.19±3.17c1.65±0.05b结合乙醚155.36±5.29d2.33±0.10c乙酸乙酯158.11±2.41d3.30±0.08d
注:不同字母表示同列参数之间有显著差异(P<0.05),表2、表3同。
多酚是广泛存在于可食性植物组织中的一类植物化学物质,它被证实具有抗氧化活性,能有效预防高血脂、高血糖、心脑血管疾病、肿瘤等慢性疾病[10]。从表1可得,用不同溶剂提取麸皮的游离和结合多酚时,其多酚含量及对DPPH·清除能力都有显著差异, 以80%丙酮为提取游离多酚时,多酚含量最高为98.19 mg/100 g,80 %乙醇次之,80 %甲醇最低为59.27 mg/100g,并且多酚含量与对DPPH·清除能力呈显著正相关(r=0.893,P<0.05),这表明酚类化合物是麸皮中主要的抗氧化物质之一;以乙醚和乙酸乙酯分别提取麸皮结合多酚时,其多酚含量没有显著差异,但是乙酸乙酯的提取液对DPPH·清除能力显著高于乙醚的提取液,这可能因为乙酸乙酯提取出来的多酚较纯[11]。结果表明,以80%丙酮、乙酸乙酯分别提取麸皮游离多酚、结合多酚较合适。
2.2不同粒径麸皮多酚和黄酮含量
目前对粉碎后麸皮的多酚研究大多集中于超微粉碎[12],但由于超微粉碎成本高不能应用于中小型工厂的生产中,本实验应用普通粉碎机对麸皮进行粉碎并将其依次通过不同目径的分样筛,对其筛下物进行研究,这样更切合工厂的实际生产。

图1 不同粒径麸皮淀粉的含量Fig.1 Starch content from different particle size of wheat bran
由表2可知,通过普通粉碎过筛后的不同粒径麸皮多酚含量和黄酮含量都有显著差异,说明不同粒径麸皮其功能成分含量是有差异的。多酚含量随粒径的变化趋势与黄酮一样,特别是结合多酚和结合黄酮,其相关系数为0.993(n=4,P<0.01)这与文献报道一致[13],这是因为大部分黄酮属于多酚类,它们在麸皮中存在的形式及性质差异不大。游离多酚和游离黄酮随麸皮粒径的减小含量显著增加;而结合多酚和结合黄酮随粒径的减小含量显著降低,这是因为游离多酚可以直接被有机溶剂提取出来,其含量取决于被提取物的表面积大小,因此粒径越小提取出的游离多酚越多;麸皮中的结合多酚主要以化学键结合在其中的膳食纤维上,而淀粉中结合多酚含量很少[14-15];麸皮中的淀粉含量较高,为51%~63%[16],且粉碎还能使包埋在膳食纤维中的淀粉颗粒释放出来[17],造成如图1所示的结果,即粒径越小的麸皮其淀粉含量越多,因而结合多酚含量越少,黄酮同理。由表2还可知,在一定粒径范围类,游离的多酚和黄酮明显低于结合的多酚和黄酮,特别是结合黄酮高于游离黄酮的1~2倍;结合多酚和结合黄酮分别与总多酚、总黄酮呈显著正相关,其相关系数分别为0.988、0.973(n=4,P<0.05),说明结合态的多酚和黄酮决定了总多酚、总黄酮的含量,这与文献报道的粮食类结合态多酚占有较大比例的观点一致[18-19]。

表2 不同粒径麸皮多酚及黄酮的含量±s,n=3)
2.3不同粒径麸皮抗氧化活性
多酚化合物是自然界中存在的一种非常重要的天然抗氧化剂,可以通过清除自由基,络合金属离子,作用于体内抗氧化酶,再生及协同增效体内抗氧化剂和提高机体免疫力等多种方式直接和间接实现抗氧化作用。由表3可知,粒径对麸皮抗氧化活性有显著影响,随粒径变化对3种自由基(DPPH·、ABTS+、OH·)清除能力和总还原力的变化趋势是一致的。游离多酚抗氧化活性随粒径的减小而增加,结合多酚抗氧化活性随粒径的减小而降低,相同粒径麸皮的结合多酚抗氧化活性显著高于游离多酚,这个变化趋势与多酚含量的变化一致,再次证明多酚是一种强抗氧剂。麸皮多酚对3种自由基清除能力存在差异,对自由基清除能力由大到小为ABTS+>DPPH·>·OH,这与多酚性质和对不同自由基清除的机理相关;总还原力最高的是30目结合多酚的4.05 mg/g,最低的是200目结合多酚的1.44 mg/g,这与多酚含量有明显关系,总还原力的测定,实质上是检测物质是否为良好的电子供应者的过程,还原力强的物质供应的电子除可以还原氧化性物质外,也可与自由基反应,使自由基成为稳定的物质,因此还原能力能够反映被测物抗氧化活性高低。

表3 不同粒径麸皮的抗氧化活性±s,n=3)
2.4不同粒径麸皮阿魏酸含量

本实验对游离多酚中的阿魏酸进行了测定,但是都没有检测出,这是因为小麦麸皮中的阿魏酸主要通过酯键或醚键与多糖、木质素交联在一起,或自身酯化成二阿魏酸,一般很少以游离形式存在[20],所以在游离多酚中未检测出阿魏酸。一般要利用碱或酶打断酯键使细胞壁中酯化了的阿魏酸释放出来,本实验结果证实通过碱水解麸皮能使结合在细胞壁中的阿魏酸得以释放,即在结合多酚中检测出阿魏酸。
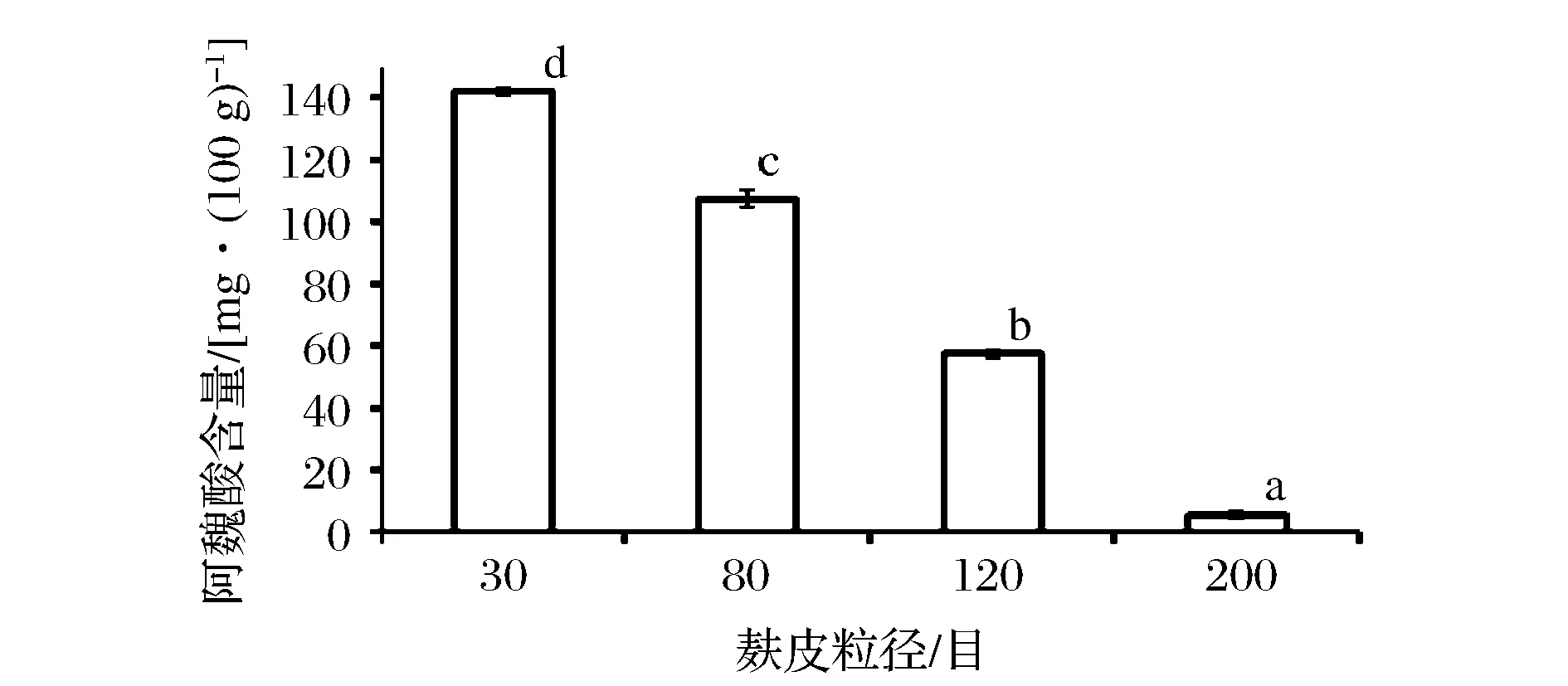
图2 不同粒径麸皮阿魏酸含量Fig.2 Ferulic acid content from different particle size of wheat bran注:不同字母表示不同粒径麸皮阿魏酸有极显著差异(P<0.01)。
由图2可知,随粒径的减小阿魏酸含量呈现极显著的降低,200目的麸皮其阿魏酸含量仅为5.50 mg/100 g,仅为30目的142.17 mg/100 g的1/26,这原因与结合多酚一样,粒径越小含有的膳食纤维少,所结合的阿魏酸也越少。阿魏酸与结合多酚、总多酚呈显著的正相关,其相关系数分别为0.993、0.957(n=4、P<0.05),由此说明阿魏酸是麸皮多酚最重要的化合物之一。
3 结论
(1)选用不同的有机溶剂分别对游离多酚和结合多酚进行提取结果发现:以体积分数80%丙酮提取麸皮游离多酚,以乙酸乙酯提取麸皮结合多酚效果最好。
(2)不同粒径麸皮的多酚含量及黄酮含量有显著差异,粒径越小两者的结合态含量越低,而游离态越多,且两者的结合态含量高于游离态;多酚提取液的抗氧化活性与多酚含量呈显著正相关。
(3)在麸皮游离多酚中未检测出阿魏酸,而在结合多酚中检测出较高含量的阿魏酸,且随麸皮粒径的减小,其含量呈现极显著降低,含量最高的是30目麸皮,为142.17 mg/100 g。
[1]曾凯宏, 曾凯芳. 麦麸的深度加工与利用 [J]. 食品工业, 2001(3): 18-19.
[2]安艳霞, 李水莲, 王亚平. 小麦麸皮的功能成分及加工利用现状 [J]. 粮食流通技术, 2011(2): 41-43.
[3]HAMAUZU Y, INNO T, KUME C, et al. Antioxidant and antiulcerative properties of phenolics from Chinese quince, quince, and apple fruits [J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 765-772.
[4]颜才植, 叶发银, 赵国华. 食品中多酚形态的研究进展 [J]. 食品科学, 2015, 36(15): 249-54.
[5]翟玮玮, 侯会绒, 孙兆远. 四种谷物中多酚含量的测定及抗氧化特性研究 [J]. 食品工业科技, 2012, 33(24): 150-153.
[6]李秀信, 张院民. 香椿叶总黄酮含量测定方法研究 [J]. 中国食品学报, 2010, 10(5): 243-248.
[7]何小解, 易著文, 田云,等.儿茶素清除O2-·与·OH的能力 [J]. 中南大学学报:医学版, 2006, 31(1): 138-140.
[8]黄仁术, 胡晓梦, 何惠利. 大别山野葛根异黄酮超声辅助提取工艺的响应面优化与还原力测定 [J]. 中国药学杂志, 2015, 50(1): 51-57.
[9]陈磊, 黄雪松. 高效液相色谱法同时检测黄酒中的5-羟甲基糠醛和9种多酚 [J]. 分析化学, 2010,38(1): 133-137.
[10]GIARDI M T, REA G, BERRA B. Bio-Farms for Nutraceuticals: Functional Food And Safety Control by Biosensors[M]. New York:Springer,2010: 36-51.
[11]王立峰. 薏米中多酚类物质对抗氧化、抗肿瘤和降血脂作用的评价研究 [D].无锡:江南大学, 2012.
[12]ROSA N N, BARRON C, GAIANI C, et al. Ultra-fine grinding increases the antioxidant capacity of wheat bran [J]. Journal of Cereal Science, 2013, 57(1): 84-90.
[13]张亮亮, 汪咏梅, 徐曼,等. 不同品种桑叶多酚和黄酮含量变化规律研究 [J]. 时珍国医国药, 2013,24(5): 1 064-1 066.
[14]MATEO ANSON N, HEMERY Y M, BAST A, et al. Optimizing the bioactive potential of wheat bran by processing [J]. Food Funct, 2012, 3(4): 362-375.
[15]APPRICH S, TIRPANALAN Ö, HELL J, et al. Wheat bran-based biorefinery 2: Valorization of products [J]. LWT-Food Science and Technology, 2014, 56(2): 222-231.
[16]程丽娟,袁静. 发酵食品工艺学 [M].杨凌:西北农林科技大学出版社,2002:200-201.
[17]孙颖. 小麦麸皮膳食纤维的脱色及超微粉碎加工 [D].无锡:江南大学, 2008.
[18]MIN B, GU L, MCCLUNG A M, et al. Free and bound total phenolic concentrations, antioxidant capacities, and profiles of proanthocyanidins and anthocyanins in whole grain rice (OryzasativaL.) of different bran colours [J]. Food Chemistry, 2012, 133(3): 715-722.
[19]KIM K, TSAO R, YANG R, et al. Phenolic acid profiles and antioxidant activities of wheat bran extracts and the effect of hydrolysis conditions [J]. Food Chemistry, 2006, 95(3): 466-473.
[20]MAURYA D K, DEVASAGAYAM T P A. Antioxidant and prooxidant nature of hydroxycinnamic acid derivatives ferulic and caffeic acids [J]. Food And Chemical Toxicology, 2010, 48(12): 3 369-3 373.
Effect of particle size on phenols and antioxidant activities of wheat bran
WANG Xiao-ping1, ZHANG Guang-feng1,LEI Ji1*, LIU Gang2,YE Dan1, SUN Man-xi1, CHEN Li-juan1
1(Food and Bioengineering College,Xihua University,Chengdu 610039,China)2(Sichuan Institute for Food and Drug Control (East Food Center),Chengdu 610000,China)
Several organic solvents were used to extract polyphenol in wheat bran, and antioxidant activities among different particle size of wheat bran were studied. The results showed that the best extraction solvent for free phenolic acid and bound phenolic were 80% acetone and andethyl acetate, the polyphenol content and DPPH· scavenging ability were the highest. Different particle size of wheat bran had significant influence in polyphenol and flavonoid levels. The content of compound phenolic acid, bound flavonoid, total phenolic acid and total flavonoid decreased obviously with wheat bran particle size decreased, while free phenolic acid and free flavonoid increased obviously, and the trend in antioxidant property was similar with that of polyphenol content. Ferulic acid mainly existed in bound phenolic, and its content reduced significantly with the reduction of particle size in wheat bran. In conclusion, particle size of wheat bran had remarkable influences on its phenol level and antioxidant activity.
wheat bran;phenolic acid;antioxidant activity;ferulic acid
10.13995/j.cnki.11-1802/ts.201609028
硕士研究生(雷激教授为通讯作者,E-mail:121175698@qq.com)。
四川省科技厅(2014NZ0078,2015ZYZF0107);四川省经信委(2015ZYZF0107);西华大学人才基金(R0910507);西华大学食品生物技术省级重点实验室开放基金,西华大学创新基金资助项目(ycjj2015022)
2016-01-20,改回日期:2016-02-29
