液态发酵条件对红曲菌菌体形态及产物Monacolin K的影响
2016-10-13叶昌亚张薄博许赣荣
叶昌亚,张薄博,许赣荣
(江南大学,工业与生物技术教育部重点实验室,江苏 无锡,214122)
液态发酵条件对红曲菌菌体形态及产物Monacolin K的影响
叶昌亚,张薄博,许赣荣*
(江南大学,工业与生物技术教育部重点实验室,江苏 无锡,214122)
红曲菌是一种重要的食药双用丝状真菌,红曲菌9901种子扩大培养及液态发酵过程中,发酵条件、菌体形态与代谢产物Monacolin K(MK)之间有着紧密的联系。研究发现,斜面菌种的种龄和孢子接种量对红曲菌种子液的菌球直径、菌球外菌丝长度和菌体量等有明显的影响;在30 L机械搅拌发酵罐培养过程中,搅拌转速对红曲菌菌体形态、生物量和代谢产物MK的产量有较明显的影响。当搅拌转速较低时(150~350 r/min),红曲菌菌球直径和菌球比例随着转速的加大而逐渐增加,当搅拌转速为350 r/min时,发酵液的中菌体为均匀的、较大的、表面光滑的菌丝球,其液态发酵合成MK 产量较高;当搅拌转速为400 r/min,初始直径为1 500 μm的菌球减小至最终大小稳定为900 μm的菌丝球,这些分散的、较小的、表面有较长菌丝的菌丝球,液态发酵合成MK产量较低。最后选择种子液初始菌球大小为1 500 μm,设搅拌转速为350 r/min时,30 L发酵罐分批发酵384 h时MK的产量为1 308 mg/L,进而为更大规模的发酵罐以至工业化生产的实现奠定基础。
红曲菌;液态发酵罐发酵;菌体形态;菌丝球;Monacolin K
莫纳可林K(Monacolin K,简称为MK)[1]也称为洛伐他汀(lovastatin),是一种能够抑制胆固醇生物合成途径中的限速酶(HMG-CoA还原酶)的竞争性抑制剂,可有效降低体内总胆固醇以及甘油三酯、低密度脂蛋白水平,从而有效降低冠心病和心肌梗塞的病发率和死亡率[2-5]。MK主要用土曲霉(Aspergillusterreus)和红曲霉(Monascusruber)经发酵制取。红曲菌液态生产得到的MK多为酸式,其空间结构与人体内HMG-CoA更为接近,其活性较内酯式高约1倍,无需水解直接发挥抑制体内胆固醇合成的作用[6-9]。采用红曲菌液态发酵代替固态发酵,可实现大罐发酵,因而生产规模大,可节省大量人力,发酵水平较为稳定,因而发展前景十分可观[10-11]。
大罐液态发酵高产MK的关键之一是如何在大容积的通风机械搅拌或气升式发酵罐中保持正常的、有活力的丝状菌菌体形态。通常来说,丝状真菌的形态可以分为絮状菌丝(Dispersed mycelia)、团块状成簇(Clumps)、结实的菌球(Dense pellets) 3类[12-14]。丝状真菌的液体发酵过程中,菌体形态会不断发生变化,其中菌体形态的变化不仅仅较难检测及控制,并且会伴随着搅拌器类型、转速、发酵液流变特性、传质特性及混合特性而发生变化[15]。微生物代谢产物产量的高低,与发酵液中的菌体形态有密切关系[16-17]。CHEN[18]等研究发现阿魏蘑液体发酵过程中,漆酶产量在球状菌体条件下高于丝状、絮状菌丝,直径分布在0.2~0.4 mm范围的菌球对漆酶的合成具有明显的促进作用。江洁[19]研究发现在5 L通风搅拌发酵罐中进行里氏木霉306生产组织型纤溶酶原激活剂,斜面孢子接种量越小,菌球个数越少,菌球越大,接入的种子液以菌丝球为主时,发酵液中菌体将以菌丝球形态继续生长。王莉衡[20]研究发现Aspergillusterreus液态发酵罐发酵产洛伐他汀时,菌球直径越小,游离菌丝越短,菌球外毛发长度在短区域分度越均匀,洛伐他汀的产量越高。作者在研究摇瓶发酵和5 L发酵罐发酵时发现,在红曲菌的斜面菌种培养、种子培养、摇瓶发酵及发酵罐发酵的不同阶段,菌体形态有大变化,有初始接种孢子、丝状菌丝、絮状菌丝、菌球等各种形态。且当发酵液中出现较多菌球时,红曲菌产MK的能力大大提高。而采用机械搅拌发酵罐发酵,因为搅拌一方面可以充分地使营养物质与菌体接触,加快传质,提高发酵液中溶解氧,另一方面机械搅拌也会产生剪切力,剪切力会减弱菌丝球生长,甚至切断菌丝体,从而间接地影响代谢产物MK的合成。故研究发酵罐发酵时各种条件与菌体形态及MK产量的关系非常有必要。
本课题在前人[21]研究的基础上,经过多次实验发现红曲菌菌体形态的变化对产MK有很大影响,在摇瓶发酵中,形成较大菌球的实验组比不形成菌球的实验组,其菌体量比后者少1倍的时候,但是其产MK的量还比后者高,故进一步研究如何通过优化培养条件控制摇瓶培养种子液中的菌球大小以及摇瓶种子接种发酵罐后,菌球大小和比例对红曲菌液态发酵罐发酵的影响,为红曲菌液态发酵的工程放大提供更为扎实的基础。
1 材料与方法
1.1菌株
红色红曲菌(Monascusruber9901),由江南大学生物工程学院固态发酵实验室保存。
1.2培养基
PDA琼脂斜面培养基:200 g土豆去皮,切成块,加水煮沸30 min,经纱布过滤后的滤液中加入20 g葡萄糖,20 g琼脂,融化后加水定容到1 000 mL。115 ℃灭菌15 min,灭菌后放置斜面。
一级种子培养基:葡萄糖60 g/L,蛋白胨25 g/L,NaNO32 g/L,MgSO4·7H2O 1 g/L,K2HPO4·3H2O 1 g/L,玉米浆 10 mL/L,pH 5.0。115 ℃灭菌15 min。
二级种子培养基:葡萄糖25 g/L,大豆水解液50 mL/L,NaNO32 g/L,MgSO4·7H2O 1 g/L,K2HPO4·3H2O 1 g/L,玉米浆 10 mL/L,pH 5.0。115 ℃灭菌15 min。
液态发酵培养基:甘油100 g/L,大豆水解液200 mL/L,NaNO32 g/L,MgSO4·7H2O 1 g/L,K2HPO4·3H2O 1 g/L,ZnSO4·7H2O 2 g/L,玉米浆 10 mL/L,pH 4.5。121 ℃灭菌20 min。
大豆水解液的制备:称取100 g大豆加水浸泡24 h,然后用豆浆机粉碎磨浆定容到1 000 mL,再加0.1%的中性蛋白酶,50 ℃水浴水解4 h。
1.3培养方法
1.3.1斜面菌种培养
在30 ℃的恒温箱中培养8~12 d,作为实验用种子。
1.3.2摇瓶种子培养
在无菌室中,把无菌水注入培养成熟的试管斜面中,将孢子从斜面洗脱下来,制成一定浓度的孢子悬液,然后接种到装有100 mL种子培养基的500 mL的三角瓶中,在30 ℃,170 r/min的旋转式摇床中培养3 d。
1.3.3二级种子培养
在无菌室中将培养好的一级种子液以10%的接种量,接种到装有100 mL二级种子液培养基的500 mL的三角瓶中,然后放入30 ℃,170 r/min的旋转式摇床中培养24~48 h。
1.3.4发酵罐发酵
30 L发酵罐装液量20 L,罐体高度(H)42 cm,内部直径(D)21 cm,高径比(H/D)为2,搅拌桨直径(d)9 cm,搅拌桨高度(h)2.5 cm,d/D为0.47,h/d为0.28。将培养好的二级种子以5%~10%的接种量接入30 L发酵罐中,设置通风量为1.0 v/v/m,转速为150 r/min,30 ℃培养48 h,然后降温为25 ℃继续培养14~16 d。
1.4分析检测方法
1.4.1菌体形态的观察[14]
取一定量发酵液,稀释5倍,混匀,取5 mL较纯净的菌球样品加入平皿中。然后对整个平皿拍照或者用具有拍照功能的倒置显微镜拍摄,最后使用Image Pro Plus V 6.0软件分析,得出菌球直径D和菌球外菌丝长度。而菌球比例是菌球面积的总和占整个视野总面积的百分数。
其中,D为菌丝球直径,μm;A为菌丝球平均面积,μm2。
1.4.2菌体量的测定(干重法)
取发酵液30 mL用已经烘干至恒重的滤纸过滤,滤渣用蒸馏水充分洗涤3次后,置于80 ℃烘箱中烘干至恒重。
1.4.3Monacolin K的检测[20]
液态发酵样品的处理:取匀浆后发酵液10 mL置于50 mL的比色管中,用体积分数为70%的乙醇定容至50 mL,55 ℃水浴1 h,冷却至室温后取上清液经0.22 μm的滤膜微滤,用HPLC仪器对滤液进行Monacolin K含量分析检测。
HPLC检测条件:仪器:Waters;色谱柱:ZORBAX SB-C18,150 mm×4.6 mm×5 μm;流动相:V(乙腈)∶V(水)=55∶45,用磷酸调pH至2.5;柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL;检测器:紫外检测器;检测波长:238 μm。
2 结果与分析
2.1斜面菌种培养与摇瓶液态种子菌球形态的关系
通过优化斜面种子培养条件控制摇瓶种子液的菌体形态,以期获得生产活力较好的菌球种子液。
2.1.1斜面种子种龄对摇瓶液态种子液菌体形态、生物量的影响
用于接种的斜面菌种的种龄是影响微生物生长重要参数,对摇瓶种子的菌体形态及生物量的变化有重要的影响。红曲菌9901液态摇瓶培养的菌体形态和生物量的变化随着孢子种龄的增加而呈一定的变化(如表1)。
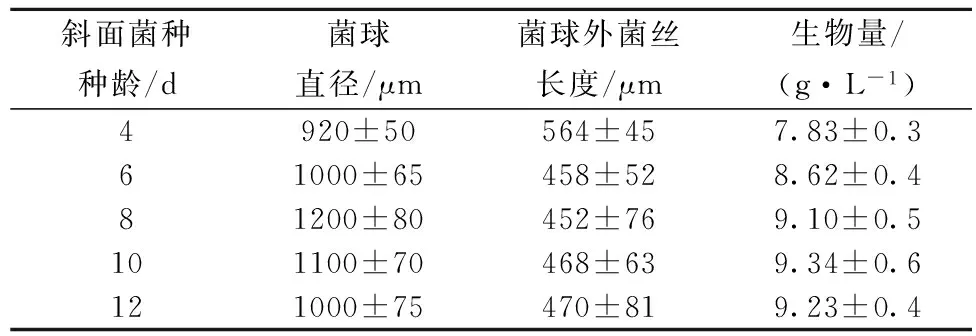
表1 红曲菌斜面种子种龄对种子液菌体形态、生物量的影响
注:培养条件:选择不同种龄的斜面种子(PDA培养基),用无菌水制成孢子悬浮液,然后每100 mL种子培养基中接种3.0×107个孢子,放置在30 ℃,170 r/min旋转式恒温摇床培养72 h。
由表1可以看出,随着斜面种子种龄的增加,菌球直径先增大后减小,当种龄为8 d时,菌球直径达到最大,最大值为1 200 μm,菌球外菌丝长度较小,生物量达到9.10 mg/L。当斜面种子种龄为10 d或以上时,形成菌球直径变小,菌球外菌丝长度加长,可能斜面菌种菌丝和孢子活力下降,不利于菌球的形成。因此选择斜面种子培养第8 d用于接种。
2.1.2种子液初始孢子浓度对种子液菌体形态、生物量的影响
为了进一步研究初始孢子浓度对种子液菌体形态、生物量的影响,其实验结果如表2。

表2 种子液初始孢子浓度对种子液菌体形态、生物量的影响
注:培养条件:选择不同种龄的斜面种子(PDA培养基),用无菌水制成孢子悬浮液,然后每100 mL种子液接种一定数量的孢子,在30 ℃,170 r/min旋转式恒温摇床培养3 d。
由表2可知,摇瓶种子液初始孢子浓度与菌球直径大小、菌球外菌丝长度成负相关,当孢子浓度较低时,种子液形成的菌球较大,菌球外菌丝长度较长。同时,初始孢子浓度与生物量成正相关,孢子浓度越高,种子液中菌体量越大,可能较高的孢子浓度形成菌球能力更强,更早形成菌球,最终形成菌球数更多。为了获得更多、较大的菌球,且菌球外菌丝长度较短,最终选择种子培养液中初始孢子浓度为3.0×107个/100 mL。
2.2红曲菌液态摇瓶发酵过程中菌体形态、生物量、MK的变化
红曲菌液态发酵过程中菌体形态的变化主要表现在菌球形成与否、直径大小、数目、菌球所占比例和菌球外菌丝长度等方面。红曲菌液态揺瓶发酵过程中,红曲菌菌球直径、生物量和MK产量的变化如图1。
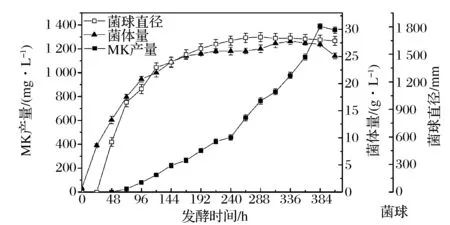
图1 红曲菌液态发酵过程中菌体形态、生物量和MK产量的变化Fig.1 Time course of mycelial morphology,biomass and total MK yield in submerged fermentation of M. ruber 9901
由图1中菌体形态变化曲线可以发现,在整个发酵过程,0~144 h菌体快速生长,而在48 h左右出现小菌球,随着发酵时间的增加,菌球直径持续加大,到第336 h左右达到最大,其最大值为1 910 μm,随后菌体进入稳定器后期开始出现菌体破碎、pH升高等自溶现象,而使菌球直径变小。MK的变化规律表明,MK的合成与菌体生长、菌体形态有很大的关联性,在生长的对数期第72 h开始合成,在72~240 h合成速度较慢,随着发酵的继续,当菌体生长到达稳定期以后MK开始快速合成,直到第384 h达到产量的最大值1 381 mg/L。
对该批红曲菌液态发酵过程菌体形态分析的结果如图2。由图2可以看出,以菌丝接种后在前48 h 主要是以菌丝体生长,自48 h 以后菌球开始形成,数目逐渐增多,在192 h菌球比例可到65%,以后趋于稳定;菌球形成后,随着发酵时间推移,菌球外菌丝长度也不断加长,在144 h 左右达到最大值654 μm,以后逐渐减少;菌球直径随着发酵的进行渐渐增大,到288 h 左右趋向稳定,其最大值可达1 910 μm。在发酵的中后期,随着菌体浓度的升高,菌球总量增加,同时MK 增加量较大,中后期MK合成速率较快。

图2 红曲菌摇瓶发酵菌球直径、菌球外菌丝长度和菌球所占比例的变化Fig.2 Time course of average pellet diameter, filamentous length and pellet ratio in submerged fermentation of M. ruber 9901
2.3液态种子菌体形态对红曲菌30 L发酵罐发酵产MK的影响
在30 L发酵罐中,通过研究搅拌转速、菌体形态、菌体量及MK产量之间的关系,最终实现高产MK的目的。
通过控制斜面孢子种龄、初始孢子浓度等条件,可以有效地控制种子液菌丝球直径大小,又由于种子液的质量对红曲菌发酵罐培养的菌体形态影响很大,故研究了种子液菌体形态对发酵罐中菌体形态、生物量和产MK的影响,结果如图3。

图3 种子液初始菌球大小的对红曲菌30 L罐发酵菌体形态、生物量和产MK的影响Fig.3 Effects of seed culture pellets diameter on mycelial morphology, biomass and MK yield in 30 L submerged fermentation of M. ruber 9901
图3在30 L机械搅拌发酵罐中,搅拌速度恒定为150 r/min,通气量为1.5 v/v/m,接种量为5%,前48 h设置培养温度30 ℃,48 h以后设置培养温度25 ℃,继续培养360 h。测红曲菌发酵液菌球直径大小、生物量和MK含量。
由图3可得,红曲菌发酵过程中,随着种子液中菌丝球直径逐渐增大,发酵液中菌丝球直径也是逐渐增大,同时可以发现发酵液中菌丝球直径比种子液的菌丝球直径大,发酵液中红曲菌生物量和MK产量也逐渐增加。这一现象与MARIA等[22]研究发现当初始种子液的菌球直径较大时,种子液中可能会有新的“菌核”,会更有利于发酵液中形成新的菌球一致,且熊强等[23]认为当发酵液中有较多菌球时,发酵液黏性会下降,溶解氧会增加,更有利于红曲菌的生长。当种子液菌丝球直径达到1 500 μm时,发酵液中菌体量达到最大,最大值为28.1 g/L,红曲菌产MK也达到最大,最高值为350 mg/L。且当种子液菌丝球直径超过1 500 μm时,红曲菌发酵液中菌体量和MK产量都出现明显下降。CASAS等[24]发现当菌球过大时,会导致菌球内部营养物质传输受限,氧气不能自由通过,造成内部细胞自溶形成菌球中空,从而限制了丝状真菌生长与代谢产物的累积。
2.4搅拌转速对红曲菌机械搅拌罐发酵时菌体形态和产MK的影响
2.4.1搅拌转速对红曲菌机械搅拌罐发酵菌体量和MK产量的影响
由图4可知,红曲菌机械搅拌罐发酵产MK其发酵水平远低于摇瓶发酵水平,且观察发酵罐中红曲菌的发酵过程时,发现发酵液中的菌丝球数量、菌丝球所占比例明显低于液态摇瓶。这说明,当采用机械搅拌罐发酵时,培养条件对红曲菌的菌体形态产生了显著的影响。其中菌丝球的形态与种子液、搅拌转速、培养基组成、供氧状况及温度和pH等多种因素有关,而且不同生产MK的丝状菌、不同类型的搅拌桨、不同的搅拌直径下结果也会有差异。在这些影响因素中,搅拌转速是影响红曲菌液态发酵罐发酵的菌体形态和MK产量的一个非常重要的因素,因此,对不同搅拌转速对红曲菌液态发酵菌体量和MK产量的影响进行进一步的研究。其实验结果如图4。
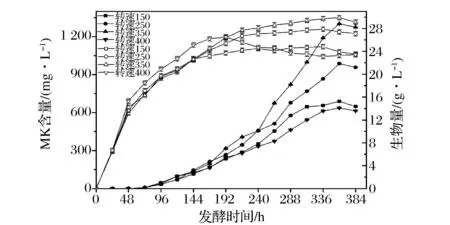
图4 搅拌转速对红曲菌液态发酵生物量和MK产量的影响Fig.4 Effects of agitation speed on biomass and the production of MK in submerged fermentation of M. ruber 9901 in 30 L bioreactor(注:实心图例代表MK产量,空心图例代表菌体量)
搅拌转速大小会影响红曲菌菌体形态的变化,同时菌体形态的变化与红曲菌生物量和MK产量又有紧密的关系。观察菌体量的变化曲线可以发现,在一定的转速范围(150~350 r/min时),随着搅拌转速的增加,菌体量逐渐增加。当转速为350 r/min时,发酵培养360 h菌体量达到最大值为29.7 g/L, 比当转速为150 r/min时的最大值24.8 g/L高出19.7%。这可能是由于搅拌转速的增加,提高了发酵液中的溶解氧,加快了营养物质的传递。但当转速为400 r/min时,培养前期菌体生长正常,到168 h时菌体量达到最大值为26.5 g/L,之后菌体量有明显的减少,这可能是菌体进入稳定期时,搅拌转速产生的剪切力较大,阻碍菌丝体生长,打破稳定期的平衡,导致菌体量下降[25]。
观察红曲菌液态发酵代谢产物MK的变化曲线可以发现,当搅拌转速较低时(150~350 r/min时),红曲菌液态发酵合成MK量随着转速的加大而逐渐增加,当搅拌转速为350 r/min时,发酵培养到216 h时,MK合成速率逐渐加快,发酵到360 h其MK合成量达到最大值1 308 mg/L。这可能由于搅拌转速增加,有利于生物量增加,且发酵中期有大量的菌球的形成,有利于MK的合成与分泌。当搅拌转速为400 r/min时,整个发酵过程中MK的合成量均低于当搅拌转速为150 r/min时,这可能是由于搅拌转速较大,红曲菌菌丝体不能正常生长形成较理想的菌球形态,从而影响MK的合成。
2.4.2搅拌转速对红曲菌菌体形态及菌球比例的影响
为进一步阐明搅拌转速对红曲菌液态发酵生物量和MK产量的影响,在30 L发酵罐发酵过程中,观察不同的搅拌水平的菌球形态分布情况(图5)。通过对大量的菌球样本分析,可以看到菌丝球形态与搅拌转速有明显的相关性。在较低搅拌转速条件下(150~350 r/min时),菌丝球在48 h左右形成,之后随着发酵时间加长而逐渐增大,菌丝球直径随着转速增大而增大,当转速为350 r/min时,培养时间为360 h左右达到最大,最大值为2 347 μm左右,并且菌球外菌丝长度这时较短387 μm左右,呈现较大的、光滑的菌丝球。当搅拌转速继续增大到400 r/min时,发酵液中的菌丝球初始在48 h左右开始形成,之后逐渐增大,但是到144 h左右时,菌丝球开始减小,同时菌丝球外菌丝长度也达到最短310 μm左右,说明搅拌转速过大,菌丝无法继续生长,不能保持正常生长繁殖。
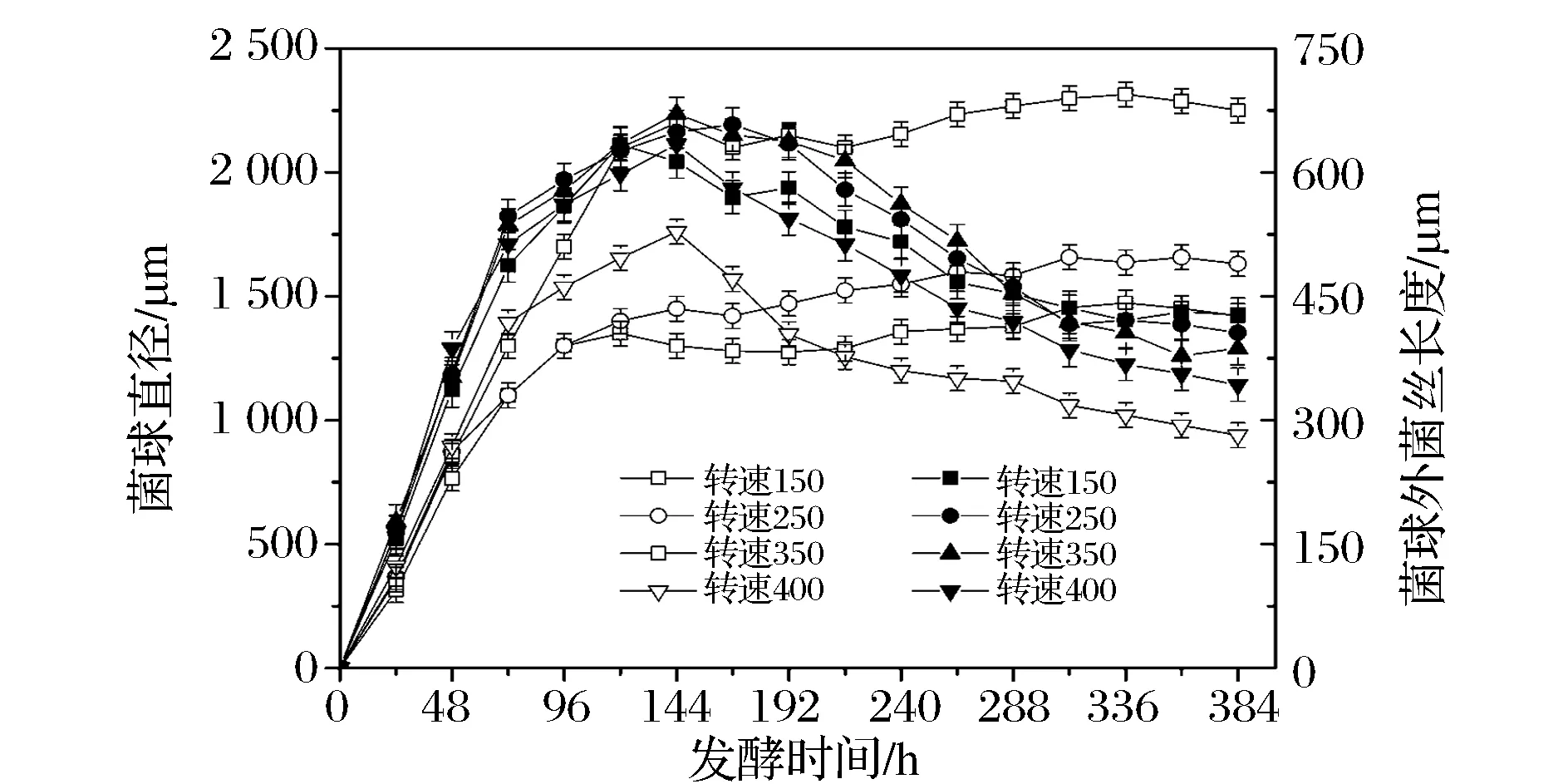
图5 搅拌转速对红曲菌30 L发酵罐发酵菌球大小和菌球外菌丝长度的影响Fig.5 Effects of agitation speed on pellets diameter and filamentous length in submerged fermentation of M. ruber 9901 in 30 L bioreactor(注:空心图例代表菌球直径,实心图例代表菌球外菌丝长度)

图6 搅拌转速对红曲菌30 L发酵罐发酵菌球比例的影响Fig.6 Effects of agitation speed on pellets ratio in submerged fermentation of M. ruber 9901 in 30 L bioreactor
在发酵罐中,由于搅拌转速影响了菌体形态,从而对菌球比例有很大的影响。比较不同时间点红曲菌菌丝球数量(图6),可以发现菌球比例与转速大小成正相关的关系。随着搅拌转速的增加,菌球比例逐渐增大。当转速为350~400 r/min时,菌丝球比例最高可达81%,比摇瓶发酵时61%的菌球所占比例高出34%。但从图6可发现,当转速为400 r/min时,菌丝直径在144 h后逐渐减小,而菌球比例却逐渐变大,可能因为搅拌转速较大时,较小的菌丝球无法继续形成较大的菌球,但是可以促进发酵液中絮状菌丝形成新的菌核,从而形成新的菌球,也可能是菌丝球外菌丝被切断以后,可以形成新的菌核,从而形成新的球,增加菌丝球的比例。在不同转速条件下发酵液中菌球数量都有较高的比例,说明一定的搅拌对红曲菌液态发酵菌球的形成有促进作用。
比较菌体形态的变化与MK产量变化的曲线,当搅拌转速较低时(150~350 r/min时),随着搅拌转速的增加,发酵液中的菌球数量和菌球直径也逐渐增大,其发酵合成MK的产量随着转速的加大而逐渐增加。当搅拌转速为350 r/min时,发酵液的中菌体为均匀的、较大的、表面光滑的菌丝球(图7),其液态发酵合成MK产量最高;当搅拌转速为400 r/min时,初始直径为1 500 μm的菌球减小至最终大小稳定为900 μm的菌丝球,这些分散的、较小的、表面有较长菌丝的菌丝球(图8),液态发酵合成MK产量较低。

(a)表观形态;(b)显微镜照片(40×)图7 均匀的较大的表面光滑的菌球形态Fig.7 The uniform, larger and smoother pellets
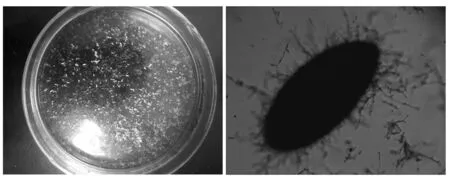
(a)表观形态;(b)显微镜照片(40×)图8 分散的较小的表面有较长菌丝菌球形态Fig.8 The scattered, smaller and rougher pellets
3 结论
液态发酵过程中,菌体形态会直接影响丝状真菌代谢产物的形成和积累,因此可以通过改变液态发酵条件控制菌体形态的变化获得较高产的目的代谢产物。其中斜面菌种的培养时间和种子液中的初始孢子浓度对种子液的菌体形态影响显著,继而影响合成MK的产量。在一定培养条件作用下,适当增加搅拌转速有利于菌球的形成,且随着发酵时间的延长,菌球直径逐渐加大,菌球所占比例也不断加大,发酵合成MK产量提高。比较不同搅拌转速条件下红曲菌菌体形态与MK产量的关系,得出均匀的、较大的、表面光滑的菌丝球液态发酵合成MK的产量更高,分散的、较小的、表面有较长菌丝的菌球液态发酵合成MK的产量较低的结论。由于不同的发酵条件改变了红曲菌的菌体形态,从而使发酵合成代谢产物能力发生了变化,但菌体形态对红曲菌产物合成的作用机制还需后续工作继续研究。
[1]ENDO A. Monacolin K: a new hypocholesterolemic agent Produced by aMonascusspecies[J]. The Journal of Antibioties, 1979, 329(8): 552-854.
[2]ALBERTS A W, CHEN J, KURON G,et al.Mevinolin: A highly protein competitive inhibitor of hydroxymethylglutaryl-coenzyme A reductase and a cholesterol-lowering agent [J]. Proceedings of the National Academy of Sciences, 1980, 77(7): 3 957-3 961
[3]ZHAO X J, HAO F H, HUANG C Y, et al. Systems responses of rats tomequindox revealed by metabolic and transcriptomic profiling [J]. Journal of proteome research, 2012, 11(9): 4 712-4 721.
[4]MARON D J, FAZIO S, LINTON M R F. Current perspectives on statins[J]. Circulation, 2000, 101(2): 207-213.
[5]傅剑云,夏勇,孟佳,等. 红曲对实验性高脂血症大鼠体重及血脂水平的影响[J]. 中国临床康复,2002,6 (1):57-59.
[6]陈运中,陈春艳,张声华,等. 红曲有效成分洛伐他汀对高脂小鼠血脂代谢及脂蛋白脂酶 mRNA 表达的作用[J]. 中草药,2005,36 (5):713-717.
[7]朱华,许赣荣,陈蕴,等. HPLC 法测定红曲中酸型与内酯型Monacolin K[J].无锡轻工大学学报,2003,22(3):46-52.
[8]陈运中,陈春艳,张声华,等. 红曲有效成分洛伐他汀对高脂小鼠血脂代谢及脂蛋白脂酶 mRNA 表达的作用[J]. 中草药,2005,36(5):713-717.
[9]黄颖颖,杨成龙,陈源. 液态培养红曲霉产洛伐他汀开闭环组分的研究[J].福建农业学报,2013.8(8):817-822.
[10]陈蕴,夏永军,许赣荣,等. 红曲液态发酵高产色素低产桔霉素的工艺条件[J].食品与发酵工业,2007,33(10)10-13.
[11]朱华. 红曲菌液态发酵法生产Monacolin K的研究[D]. 无锡: 江南大学, 2003.
[12]KAMAKSHI G, MISHRA P K, PRADEEP S, et al. Enhanced continuous production of Lovastatin using pellets and siran supported growth ofAspergillusterreusin all airlift reactor[J]. Biotechnology Bioprocess Engineering, 2009(14): 207-212
[13]METZ B, KOSSEN NWF. The growth of molds in the form of pellets-a literature review[J]. Biotechnology Bioengineering, 1977, 19(6): 781-799.
[14]CASAS LJ L, SANCHEZ P J A, FERNANDEZ S J M, et al. Pellet morphology, culture rheology and lovastatin production incultures ofAspergillusterreus[J]. Journal of Biotechnology, 2005(116):61-67.
[15]YU L, CHAO Y, WENSEL P, et al. Hydrodynamic andkinetic study of cellulase production byTrichodermareeseiwith pellet morphology[J].Biotechnology Bioengineering, 2012, 109(7): 1 755-1 768.
[16]SAYYAD S A, PANDA B P, JAVED S, et al. Optimization of nutrient parameters for lovastatin production byMonascuspurpureusMTCC 369 under submerged fermentation using response surface methodology [J].Applied Microbiology Biotechnology, 2007, 73: 1 054-1 058.
[17]吴波, 陈长华, 杨琳, 等. 洛伐他汀发酵培养基配方优化及15L罐放大[J]. 中国抗生素杂志, 2007, 32(7): 409-413.
[18]陈友枝,王璐,彭林,等. 阿魏蘑液体发酵过程菌体形态变化对产漆酶的影响[J]. 生物工程学报,2013, 29(11): 1 701-1 705.
[19]江洁,杜连祥,路福平,等.培养条件对里氏木霉 306 菌体形态和 t-PA 生物合成的影响[J].工业微生物,2005,35(4):9-14.
[20]王莉衡. 土曲霉发酵条件对菌体形态与产物产量影响的研究[D].西安:西北大学生命科学学院,2004.
[21]ZHANG J, WANG Y L, XU G R, et al. Enhanced production of Monacolin K by addition of precursors and surfactants in submerged fermentation ofMonascuspurpureus9901[J].Biotechnology and Applied Biochemistry,2014,61(2):202-207.
[22]MARIA P,MURRAY M Y. Protease secretion in glucoamylase producerAspergillusnigercultures fungal morphology and inoculum effects[J]. Process Biochemistry,2002(37):1 271-1 278.
[23]熊强,徐晴,李霜,等. 丝状真菌形态控制及其在发酵过程优化中的运用[J]. 生物工程学报,2012,28(2):178-190.
[24]CASAS L J L,SANCHEZ P J A,Fernandez S J M,et al. Pellet morphology, culture rheology and lovastatin production in cultures ofAspergillusterreus[J]. Journal of Biotechnology, 2005(116):61-77.
[25]GIBBS P A,SEVIOUR R J,SCHMID F. Growth of filamentous fungi in submerged culture: problems and possible solutions[J]. Critical Reviews in Biotechnology, 2000, 20(1):17-48.
Effects of the fermentation conditions on mycelial morphology ofMonascusruber9901 and production of Monacolin K through its submerged fermentation
YE Chang-ya, ZHANG Bo-bo, XU Gan-rong*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University, Wuxi 214122, China)
Monascusspecies are important medicinal and edible fungi, the effects of the fermentation conditions on its mycelial morphology and the production of MK through submerged fermentation ofMonascusruber9901 were investigated in 30 L stirred bioreactors. The results indicated that the average diameter of pellet, the length of filamentous and the biomass of seed culture were significantly influenced by the spore age and the concentration of spore suspension. Moreover, the pellet diameter of the mycelia and the ratio of pellet were affected by the rotation speed in 30 L stirred bioreactors. The rotation speed could significantly affect the mycelial morphology, the biomass and the production of MK in submerged fermentation ofM.ruber9901 in 30 L stirred bioreactors. The pellet diameter and the ratio of pellet were gradually increased along with the increase of rotation speed of the bioreactor. When rotation speed was 350 r/min, the pellets were uniform, larger and smoother, and MK yield of fermentation broth was higher. When rotation speed was 400 r/min, the pellets were scattered, smaller and rougher, and MK yield of fermentation broth was lower. Finally,the production of MK reached 1 308 mg/L after 384 h of fermentation when the mycelial pellet diameter was 1 500 μm, rotation speed was 350 r/min in 30 L stirred bioreactors. This study laid a good foundation for the subsequent large scale production of MK.
Monascus; submerged of fermentation; mycelium morphology; pellet; Monacolin K
10.13995/j.cnki.11-1802/ts.201609005
硕士研究生(许赣荣教授为通讯作者,E-mail:grxu123@126.com)。
国家“十二五”科学技术支撑项目(2011BAD23B02);“863”项目(2012AA021302);中央高校基本科研业务费专项资金(JUSRP11219)资助
2016-04-05,改回日期:2016-05-11
