慢性低氧对大鼠肺内腱蛋白mRNA表达的影响
2016-10-13李晓岩
李晓岩
(广州市第一人民医院呼吸内科,广东 广州 510180)
·论著·
慢性低氧对大鼠肺内腱蛋白mRNA表达的影响
李晓岩*
(广州市第一人民医院呼吸内科,广东 广州 510180)
目的:观察慢性低氧对大鼠肺组织、肺动脉组织及大鼠远端肺动脉平滑肌细胞(PASMCs)中骨形态发生蛋白4(BMP4)的内源性拮抗蛋白基因Chordin mRNA表达的影响。方法:12只雄性SD大鼠完全随机分为2组(n=6):即常氧对照组和低氧21 d组;原代培养大鼠远端PASMCs,分为2组(n=6):即常氧对照组和低氧60 h组,采用实时定量PCR检测Chordin mRNA表达水平。结果:①低氧21 d大鼠与常氧状态下的大鼠相比较,在肺组织、肺动脉组织及肺动脉平滑肌内的Chordin的mRNA的表达均有增加,分别是增加1.36倍、1.24倍、1.58倍(P<0.05);②低氧60 h的大鼠远端PASMCs,与对照组细胞比较,BMP内源性拮抗蛋白Chordin的mRNA的表达增加1.79倍(P<0.05)。结论:BMP4内源性拮抗蛋白Chordind mRNA表达在慢性低氧初期对抗增加的BMP4表达增加,对于CHPH发病可能具有保护作用。
BMPs内源性拮抗蛋白;Chordind;慢性低氧
慢性低氧性肺动脉高压(chronic hypoxic pulmomary artery hypertension,CHPH),是包括慢性阻塞性肺疾病在内的多种慢性缺氧性心肺疾病。CHPH的形成包括低氧性肺血管收缩反应和低氧性肺血管重塑两个主要发病机制[1]。肺动脉平滑肌细胞的增殖肥大是肺血管重塑的主要原因[2]。近年,具有调节多种细胞增殖、分化、凋亡的转化生长因子超家族成员BMPs引起了众多的基础研究[3-5]。其中,在慢性低氧的小鼠肺组织内,BMP4 mRNA和蛋白的表达上调,BMP4在加速低氧引起的肺血管重塑中起重要作用[3-5]。在细胞外BMP的活性由一些分泌蛋白(如Gremlin、Chordin等)调节[6]。Chordind等分泌蛋白通过与BMP结合发挥抑制BMP功能的作用,而且有数据表明BMP能够诱导Chordin的表达[7]。最近,部分与低氧有关的BMPs的拮抗蛋白被描述,其中Chordin在人类的视网膜周皮细胞可由低氧诱导因子(HIF-1α)诱导表达[8],但是,Chordin在CHPH发病中到底有怎样的作用,尚未有研究,因此本研究使用SD大鼠为动物模型,应用Q-PCR技术分别检测慢性低氧大鼠远端肺组织、肺动脉组织及肺动脉平滑肌的Chordin的mRNA表达的情况,并且原代培养大鼠远端肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs),检测低氧60 h后PASMCs的Chordin的mRNA表达是否有变化。可望能够在BMP4参与的CHPH发病机制上得到初步的了解。
1 材料和方法
1.1大鼠肺组织的制备
将12只300 g左右成熟的雄性SD大鼠完全随机分为2组(n=6):即常氧对照组和低氧21 d组。将低氧组大鼠置于低氧装置内,调节箱内氧浓度为10%,每天24 h持续低氧。对照组大鼠除吸入空气外,其它饲养条件与实验组相同。大鼠模型制备后将大鼠腹腔注射肝素0.5 mL,3~5 min后腹腔注射130 mg/kg戊巴比妥钠;打开胸腔将心脏及肺脏一起拿出放入冰的HBSS液中(1.5 mmol/L Ca2+)。取出右肺上叶作为肺组织标本,左肺上叶分离出的动脉组织作为肺动脉组织标本。
1.2大鼠肺动脉组织制备及肺动脉平滑肌细胞原代培养
分离后的右肺下叶动脉纵向剖开暴露内腔,用棉签轻轻擦除内皮,将动脉翻转去除外膜,沿着动脉长轴将动脉剪成小块并放在含Ca2+1.5 mmol/L冰的HBSS液30 min使动脉恢复;再将组织放入没有Ca2+的HBSS液中室温下20 min,将动脉放入酶溶液中37 ℃,20 min。酶溶液由含有1750 U/mL的I型胶原酶(美国BD Transduction LaboratoriesTM)、9.5 U/mL的木瓜酶(美国 Sigma)、2 g/mL的牛血清白蛋白和 1 mmol/L二硫苏糖醇(美国Sigma)的不含Ca2+的HBSS液组成。20 min后将组织从酶溶液中取出,用无Ca2+的HBSS液冲洗组织3次,将组织放入1~2 mL的无 Ca2+的HBSS液;用吸管吹打溶液分散细胞;细胞被铺在玻璃盖玻片上或者在悬浮液中保存在冰箱中2 h后加入适量培养基,37 ℃、体积分数5% CO2培养箱中培养。细胞免疫化学法检测细胞纯度,肺动脉平滑肌细胞纯度平均达98%以上。细胞培养至第三天,细胞密度达到50%,用1%低氧处理PASMCs 60 h(n=6)。
1.3提取肺组织及肺动脉组织总RNA
将100 mg肺组织或肺动脉组织加入1 mL TRIzol(美国Promega)利用匀浆仪将组织彻底打碎25 ℃放置5 min;加0.2 mL氯仿剧烈震荡离心管15 s后放置3 min。4 ℃下≥10 000 r/min(离心半径6 cm)离心15 min;转移水相到新的离心管中,加入0.5 mL的异丙醇沉淀RNA,25 ℃放置10 min后4 ℃下≥10 000 r/min离心10 min;RNA在管底和侧面形成胶样片状沉淀移去上清,75%酒精1 mL洗涤RNA涡旋混合混合物,4 ℃下≥7 500 r/min离心5 min;短暂干燥RNA胶样片状沉淀(空气干燥或者真空干燥10 min)后RNase-free水溶解RNA,吹打3次,放置在60 ℃10 min备用。
1.4提取细胞总RNA(RNeasy Mini kit:QIAGEN)
35 mm细胞培养皿加入350 μL的RLT缓冲液,通过晃动培养皿使细胞脱落;将含有细胞的缓冲液移入离心管中,全速离心2 min;加70%酒精1 mL到裂解液,用移液枪充分混匀后移入RNeasy spin column收集管内,轻轻盖紧盖子,≥10 000 r/min离心15 s,弃滤液;加700 μL RW1缓冲液到RNeasy spin column轻轻盖紧盖子,≥10 000 r/min离心15 s洗涤spin column膜,弃滤液;加500 μL RPE缓冲液到RNeasy spin column轻轻盖紧盖子,≥10 000 r/min离心15 s洗涤spin column膜,弃滤液;加500 μL RPE缓冲液到RNeasy spin column轻轻盖紧盖子,≥10 000 r/min离心2 min洗涤spin column膜,弃滤液;将RNeasy spin column放入新的收集管中,轻轻盖紧盖子,全速离心1 min;将RNeasy spin column放入新的1.5 mL收集管中,加入30 μL RNase-free水,轻轻盖紧盖子,≥10 000 r/min离心1 min洗脱RNA;分装放入-80 ℃冰箱保存。
1.5实时荧光定量PCR(FQ-PCR)检测
先清除总RNA中的DNA污染(美国DNA-freeTMkit:Applied Biosystems)加入5.5 μL 10×TURBODNase 缓冲液和10 μL TURBO DNase到RNA,轻轻混匀;37 ℃孵育30 min后加入重悬的DNase灭活剂2 μL,混匀;室温孵育2 min,期间间断混匀2~3次;≥10 000 g离心1.5 min;将RNA转入新的离心管内,放入-80 ℃冰箱保存。利用M-MLV RT合成第一条(cDNAiScript cDNA Synthesis Kit:BIO-RAD);5 μg总RNA用于20 μL反应体系;将以下成分加入一个无核酸酶的微量离心管内:1 μL oligo (DT) 12~18 (500 μg/mL);5 μg总RNA;1 μL 10 mmol/L dNTP混合物;无菌蒸馏水加到12 μL。65 ℃加热混合物5 min,然后快速在冰上冷却。短时离心收集管内成分并且加入4 μL 5X的第一链缓冲液;2μL 0.1 mol/L二硫苏糖醇;1 μL RNaseOUT 重组核糖核酸分解酶抑制剂轻轻地混合管内的成分并且37 ℃孵育2 min;加1μL(200 U) 的M-MLV RT并且轻轻地上下吹吸。将管在25 ℃孵育10 min;37 ℃孵育50 min;70 ℃15 min灭活。 Primer3软件设计Chordin的引物序列(见表1),利用(iQ SYBR Green Supermix:Bio-Rad Laboratories)FQ-PCR 25 μL反应体系进行实时荧光定量:2×master mix液12.5 μL;CDNA 5 μL;RNase-free water 5 μL。反应程序:95 ℃ 30 s,2个循环;95 ℃ 15 min;45个循环: 94 ℃ 15 s;57.5 ℃ 20 s;72 ℃ 20 s。目的基因的拷贝数通过iCycler软件(Bio-Rad Laboratories)进行计算[9]。

表1 Chordin及CyclophilinB引物序列
1.6统计学方法
2 结 果
2.1不同组织内Chordin mRNA的表达
大鼠肺组织,肺动脉组织及肺远端PASMCs的PCR扩增产物通过琼脂糖电泳,显示可以扩增出相应大小(120 bp)的Chordin特异性产物,提示在大鼠肺组织,肺动脉组织及肺远端PASMCs中均存在BMP内源性拮抗蛋白Chordin的mRNA的表达。见图1。

100bpM123M
注:M:marker;1:肺组织;2:肺动脉组织;3:PASMCs
图1PCR扩增Chordin特异性产物琼脂糖电泳
2.2低氧大鼠不同组织内Chordin mRNA表达的情况
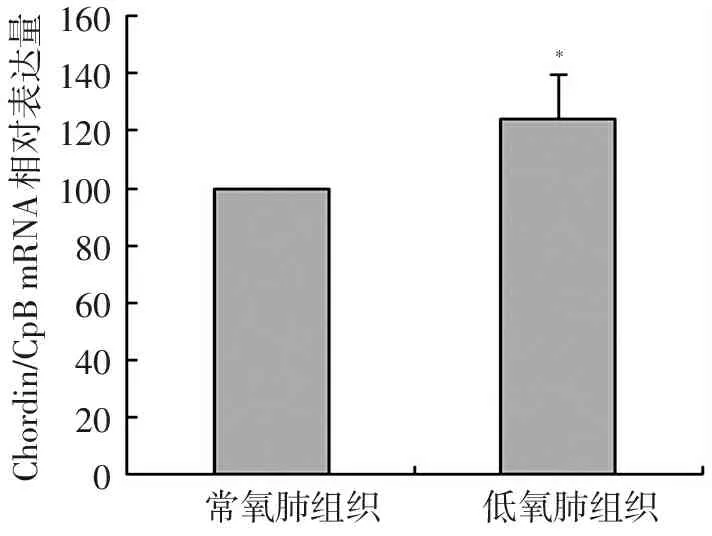
低氧21 d大鼠与常氧状态下的大鼠相比较,在肺组织、肺动脉组织及肺动脉平滑肌内的Chordin的mRNA的表达均有增加,分别是增加1.36倍、1.24倍、1.58倍(P<0.05),见图2,图3,图4。
2.3大鼠远端PASMCs低氧状态下Chordin mRNA表达的情况
大鼠远端PASMCs低氧状态下60 h,与正常氧状态下细胞相比较,BMP内源性拮抗蛋白Chordin的mRNA的表达增加1.79倍(P<0.05),见图5。
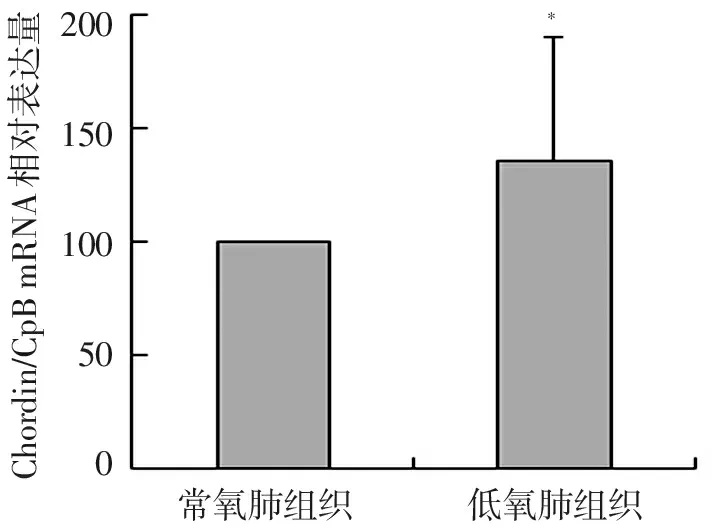
Chordin/CpBmRNA相对表达量200150100500*常氧肺组织低氧肺组织
注:与常氧肺组织比较,*P<0.05

注:与常氧肺动脉组织比较,*P<0.05
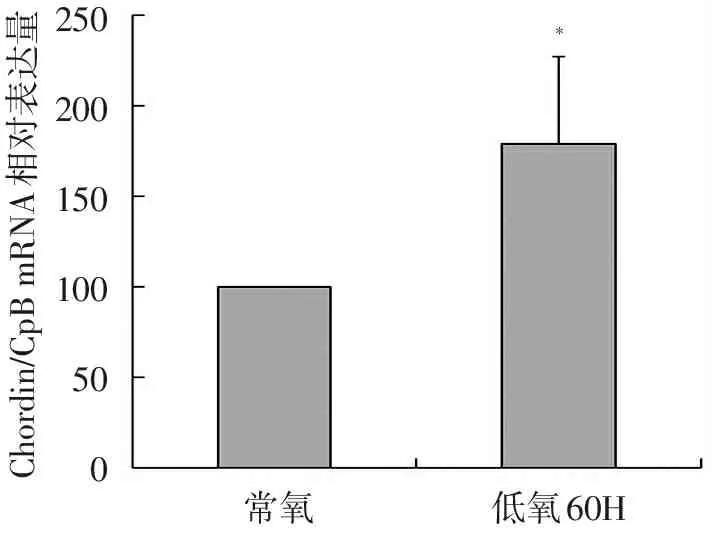
注:与常氧肺动脉平滑肌比较,*P<0.05
注:与常氧组比较,*P<0.05
图5大鼠远端PASMCs低氧状态下Chordin mRNA的表达
3 讨 论
CHPH是众多心肺疾病发生、发展过程中重要的病理生理环节,具有相似的临床和病理生理改变过程,以肺动脉血管壁重塑为主要特征,并最终导致右心衰竭。在CHPH动物模型中发现在肺动脉平滑肌细胞的增殖和迁移促进了肺动脉高压的发生。Frank等[10]证实大鼠肺组织BMP4主要表达于内皮细胞及平滑肌细胞,低氧可使BMP4表达上调,促进血管平滑肌细胞增殖和迁移,BMP4在加速低氧引起的肺血管重塑中起重要作用,低氧条件下BMP4基因突变的小鼠,肺组织中BMP4mRNA的表达水平没有改变,且杂合无效的BMP4lacZ/+大鼠能够避免血管平滑肌细胞增殖以及血管重构从而阻止HPH的发展。细胞外调节BMP4的结合蛋白通过直接与BMPs结合,阻止BMPs与其相应受体结合[11-12]。在胚胎和生后发育方面BMPs的功能被时间和空间调节,BMPs和他们的受体的表达没有严格地限制在一定的区域,但是BMP拮抗蛋白的表达能够被精确地调节,能够准确地限定BMP的功能。换句话说,BMP拮抗蛋白就是BMP功能的开关键[13]。最近,部分与低氧有关的BMPs的拮抗蛋白被描述,包括Noggin、Chordin 和 Gremlin 。其中Chordin在人类的视网膜周皮细胞可由低氧诱导因子(HIF-1α)诱导表达,但是在慢性低氧性肺动脉高压发病机制中BMP拮抗蛋白Chordin是否具有一定的作用,尚无研究。在本研究中本组发现Chordin mRNA在大鼠肺组织、肺动脉及PASMCs均有表达,慢性缺氧大鼠肺组织、肺动脉及PASMCs中Chordin mRNA的表达较常氧大鼠均有增加,同时检测到低氧对原代培养的大鼠远端PASMCs内Chordin mRNA的表达有促进作用,这说明在慢性低氧初期随着BMP4 mRNA表达增加的同时内源性拮抗蛋白Chordind mRNA的表达也有所增加,BMP4内源性拮抗蛋白Chordind mRNA表达在慢性低氧初期对抗增加的BMP4表达的增加,对于CHPH发病具有保护作用,这只是初步研究,为明确具体机制尚需进一步的研究。
[1] Stenmark KR,McMurtry IF. Vascular remodeling verus vasoconstriction in chronic hypoxic pulmonary hypertension: A time for reappraisal[J].Circ Res,2005,97(2) :95-102.
[2] Mandegar M,Fung YCB,Huang W,et al. Cellular and molecular mechanisms of pulmonary vascular remodeling: role in the development of pulmonary hypertension[J].Microvas Res,2004,12(3):68 -75.
[3] Fantozzi I,Huang W,Zhang J,et al. Divergent effect s of BMP-2 on gene expression in pulmonary artery smoot h muscle cells from normal subject s and patient s wit h idiopat hic pulmonary arterial hypertension[J].Exp Lung Res,2005,31(3) :783-806.
[4] Yang X,Long L,Sout hwood M,et al . Dysfunctional Smad signaling contributes to abnormal smoot h muscle cell proliferation in familial pulmonary arterial hypertension[J].Circ Res,2005,96 (5) :1053-1063.
[5] Long L,Scott L,Stephens R,et al . Induction of gene expression in human pulmonary artery smoot h muscle cells by bone morphogenetic proteins24[J].Thorax,2001,56 (S 3) : 76-81.
[6] Christian JL,Nakayama T. Can’t get no SMAD is faction : Smad proteins as positive and negative regulators of TGF family signals[J].Bio Essays,1990,21(2) :382-390.
[7] Moreno M,Munoz R,Aroca F,et al.Biglycan is a new extracellular component of the Chordin-BMP4 signaling pathway[J].EMBO J,2005,24(3) :1397-1405.
[8] Kane R,Godson C,O'Brien C.Chordin-like 1,a bone morphogenetic protein-4 antagonist,is upregulated by hypoxia in human retinal pericytes and plays a role in regulating angiogenesis[J].Mol Vis,2008,20(14):1138-1148.
[9] Pfaf MW.A new mathematical model for relative quanti cation in real-time RT-PCR[J].Nucleic Acids Res,2001,29(1) :45-47.
[10] Frank D,Johnson J,de Caestecker M. Bone morphogenetic protein 4 promotes vascular remodeling in hypoxic pulmonary hypertension[J].Chest,2005,128(3):590S-591S,
[11] Troilo H,Zuk AV,Tunnicliffe RB,et al.Nanoscale structure of the BMP antagonist chordin supports cooperative BMP binding[J].Proc Natl Acad Sci USA,2014,111(36):13063-13068.
[12] Plouhinec JL,Zakin L,Moriyama Y,et al .Chordin forms a self-organizing morphogen gradient in the extracellular space between ectoderm and mesoderm in the Xenopus embryo[J].Proc Natl Acad Sci USA,2013,110(51):20372-20379.
[13] Troilo H,Barrett AL,Wohl AP,et al .The role of chordin fragments generated by partial tolloid cleavage in regulating BMP activity[J].Biochem Soc Trans,2015,43(5):795-800.
(本文编辑:郑颖)
Effect of chronic hypoxia on Chordin mRNA expression in rat lungs
LiXiaoyan*
(DepartmentofRespiratoryMedicine,GuangzhouFirstMunicipalPeople'sHospital,Guangzhou510180,China)
*Correspondingauthor:Email:andylixy@163.com
Objective:To investigate the effect of chronic hypoxia on mRNA expression of Chordin,an endogenous antagonist of bone morphogenetic protein 4 (BMP4) in lung tissues,pulmonary artery tissues and pulmonary artery smooth muscle cells (PASMCs) of rats. Methods: Twelve male SD rats were randomly divided into 2 groups (n=6 each): the normoxic control group and the 21d hypoxic group. Primary cultured rat distal PASMCs were divided into two groups (n=6 each): the normoxic control group and 60h hypoxic group. Real-time quantitative PCR was used to measure the Chordin mRNA expression in the specimens. Results: ①Compared with normoxic rat controls,the 21 d hypoxic group showed increased expression levels of mRNA chordin in the lung tissue,pulmonary artery and distal PASMCs by 1.36,1.24,and 1.58 folds,respectively(P<0.05). ②Compared with normoxic control cells,60 h hypoxic distal PASMCs showed a 1.79-fold increase in mRNA expression of the endogenous BMP antagonist chordin (P<0.05). Conclusion: The increase in mRNA expression of the endogenous BMP4 antagonist Chordin along with the increasing expression of BMP4 during the early phase of chronic hypoxia may be protective against incidence of CHPH.
endogenous BMPs antagonist; Chordin; chronic hypoxia
10.3969/j.issn.1008-1836.2016.01.001
国家自然科学基金(81200037)
Email:andylixy@163.com
R332
A
2095-9664(2016)01-0001-05
2015-08-21)
