2型糖尿病患者体内的氧化应激水平研究
2016-10-13杨群峰徐伟良曹绮雯
杨群峰 徐伟良 曹绮雯
(东莞市第五人民医院内分泌科,广东 东莞 523905)
·临床实践·
2型糖尿病患者体内的氧化应激水平研究
杨群峰徐伟良曹绮雯
(东莞市第五人民医院内分泌科,广东 东莞 523905)
目的:探讨2型糖尿病患者体内的氧化应激水平。方法:选取200例2型糖尿病患者(试验组)和200例健康者(对照组),通过检测两组受试者血清中超氧化物歧化酶的活性(SOD)、总抗氧化能力、总酚含量、蛋白羰基的含量以及丙二醛(MDA)的含量,比较两组受试对象的体内的氧化应激水平是否存在差异。结果:与对照组相比,试验组患者体内SOD活性、总抗氧化能力明显降低(P<0.05),总酚含量、蛋白羰基含量以及MDA含量显著升高(P<0.05)。试验组中低血糖水平组(6.1~7.0 mmol/L)的氧化应激水平低于高血糖水平组(≥7.0 mmol/L)(P<0.05)。结论:2型糖尿病患者体内氧化应激水平较高,且随着血糖的水平的升高而逐渐升高。
2型糖尿病; 氧化应激; 血糖水平
糖尿病是一种由遗传和环境因素的相互作用引起,以高血糖为主要特征的慢性代谢障碍性疾病[1]。较高的血糖水平可导致机体出现一系列的并发症,包括心脑血管疾病、癌症、神经病变、视网膜病变、肾病和胆结石等,从而严重影响患者的生命质量[2]。生理条件下,体内的葡萄糖经多种途径最终代谢为山梨醇和晚期糖基化终末产物。2型糖尿病患者体内血糖水平较高,这一代谢途径尤为活跃,一定程度上可能损伤体内的抗氧化系统,引起线粒体的功能障碍,进而导致NADPH氧化酶的激活[3,4]和活性氧(ROS)的产生[5],使机体出现氧化应激。本研究旨在评价糖尿病患者体内的氧化应激水平,以期在血糖的代谢途径上找到治疗糖尿病的新的靶点,降低2型糖尿病及其并发症的发病率,提高糖尿病患者的生命质量。
1 资料与方法
1.1研究对象
选取2013年12月至2014年12月在我科收治的200例2型糖尿病患者作为试验组,其中男115例,女85例,平均年龄(50.9±9.58)岁。
根据1∶1比例选取同期在我院健康体检科进行健康检查的普通人群200例作为对照组。其中男109例,女91例;平均年龄(49.9±9.72)岁。两组一般资料比较,差异统计学意义(P>0.05),具有可比性。
纳入标准:①糖尿病病史≥5年;②40岁≤年龄<70岁;③24 kg/m2≤BMI<35 kg/m2;④血清胆固醇>200 mg/dL或甘油三酯>150 mg/dL;⑤糖化血红蛋白(HbA1c)6.5%~9%;⑥规律性口服降压药。排除标准:①接受胰岛素治疗;②治疗药物能够改变体内脂代谢过程;③患者未进行规律性血糖控制治疗,或患有严重的心脑血管疾病、肝病、肾病和胃肠疾病。
1.2检测方法
于清晨抽取研究对象的空腹静脉全血5 mL,所得样本以5 000 r/min离心10 min后分离血清待测。
1.2.1血清SOD活性检测血清SOD活性用邻苯三酚比色法进行测定,严格按照SOD试剂检测盒的方法步骤准确进行,然后使用Hitachi 7600全自动生化分析仪检测各个标本的SOD活性。
1.2.2血浆MDA含量测定血清MDA含量采用高效液相色谱法进行分析。在待检测的血浆中加入TBAR并在95 ℃的条件下孵育3 min。加合物采用Varian C18柱子进行分离,激发光的波长为515 nm,发射光波长为553 nm。
1.2.3血浆蛋白羰基含量的测定血浆中蛋白羰基含量采用2,4-DNPH分光光度法进行测定。避光条件下,血浆中加入DNPH并孵育1 h。加入三氯乙酸后进行离心,沉淀用乙醇/乙酸乙酯洗涤三次。沉淀溶于6 M盐酸胍后,波长设定为370 nm,检测吸光度。试剂的检测盒为Bio-Rad 蛋白检测试剂盒(Bio-Rad,Hercules,CA,USA)。
1.2.4总酚含量的测定血浆中总酚含量的测定采用福林-乔卡梯奥试剂的方法测定。结合型的酚类物质用HCl和NaOH溶解后,使用偏磷酸和丙酮进行蛋白提取后,检测酚类物质。
1.2.5血浆总抗氧化能力的测定血浆中总抗氧化能力的测定采用三价铁还原抗氧化能力测定(FRAP)法进行检测。此方法基于还原剂在氧化-还原比色法中Fe3+转化为蓝色的Fe2+病在593 nm进行测定。FRAP的结果表示为抗氧化剂当量(TE/L)。
1.3试验组亚组
将试验组的患者按照血糖水平分为低血糖水平组(6.1~<7.0)和高血糖水平组(≥7.0 mmol/L)。
1.4统计学分析
应用SPSS 17.0统计软件进行分析,计量资料以均数±标准差表示,两组比较,采用t检验计数资料的比较采用χ2检验,P<0.05认为差异有统计学意义。
2 结 果
2.1两组体内氧化应激水平比较
试验组体内SOD活性、总抗氧化能力均低于对照组(P<0.05);而总酚含量,蛋白羰基含量、MOA含量均高于对照组(P<0.05),见表1。
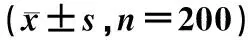
表1 两组氧化应激水平
2.2试验组不同血糖水平亚组间氧化应激的水平比较
与低血糖值水平组相比,高血糖值水平组体内SOD值、总抗氧化能力明显降低(P<0.05)。总酚含量、蛋白羰基含量、MDA含量明显升高(P<0.05),见表2。
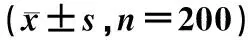
表2 不同血糖水平糖尿病患者氧化应激水平的比较
3 讨 论
糖尿病患者的动脉粥样硬化和心脑血管的发病率是健康人群的2~4倍[6,7],严重威胁着患者的健康。目前,临床上针对2型糖尿病的发病机制的治疗药物多种多样,但这些药物都不能有效地遏制2型糖尿病患者β细胞功能衰退及病情的进展[8]。深入研究2型糖尿病的发病机制,对于开发新药物,缓解病情的进展及防治并发症具有重要的意义。持续性较高的血糖水平,导致2型糖尿病患者的体内葡萄糖的代谢通路发生异常,氧化系统与抗氧化系统之间的失衡,进而导致患者出现氧化应激状态。随着患者血糖的升高,氧化应激状态也越发严重。
2型糖尿病患者体内的高血糖水平可导致氧化应激的出现,其与糖尿病患者的胰岛素抵抗有一定的关系。体内的SOD为主要的抗氧化酶,主要用于清除体内的氧自由基,从而减轻对机体的损伤,对于人体的抗氧化系统具有重要的意义。本研究证明,与健康人群相比,糖尿病患者体内的SOD的活性明显降低,机体的抗氧化系统发生异常。氧化应激的状态下,细胞内产生较多的活性氧,主要为超氧化物阴离子(O2-)、过氧化氢(H2O2)和氢氧根(OH-)[9],引起脂质过氧化效应[10-12]。研究表明,脂质过氧化效应、脂质过氧化过程是细胞氧化损伤的主要机制,与细胞的超微结构损伤有重要的联系,引起细胞的生物膜结构发生异常,导致机体多系统出现损伤反应。氧化应激所引起的又一重要的变化是蛋白羰基衍生物和DNA加合物的形成。在此种状态下,膜蛋白以及与细胞生命活动相关的酶类的结构和功能会受到严重的影响。ROS(活性氧)将会损伤DNA的正常结构与功能[13,14]。在此种影响之下,蛋白质可通过氧化应激产生的自由基与DNA直接产生交联,形成蛋白-DNA交联物。这种结构的存在能够明显影响DNA复制、修复、重组、转录和染色体重塑等过程[15],细胞的分裂及分化活动均受到一定的影响。此外,氧化应激导致细胞内谷胱甘肽转移酶的活性升高,其与早期自由基的产生有关,而自由基的产生又在一定程度上加重了脂质过氧化反应,进而加重对细胞损伤反应。由此可见,体内氧化应激状态的出现,对机体的损伤效应是多方面的。所以,对2型糖尿病患者进行积极的抗氧化应激的治疗,能够从根本上减轻或缓解较高的血糖水平对机体的损伤反应,从而能够避免糖尿病并发生的发生或降低糖尿并发症发病率或死亡率,其具有重大的临床意义。
本研究比较2型糖尿病患者和健康人群的体内的氧化应激水平,结果显示2型糖尿病患者体内抗氧化系统的水平明显下降,氧化反应的水平显著升高,引起氧化系统与抗氧化系统严重失衡,进而导致机体出现氧化应激状态。
[1] 王红菊. 糖尿病患者的护理健康教育[J]. 健康医学研究与实践,2014,11(6):65-68.
[2] de Winter CF,Hermans H,Evenhuis HM,et al.Associations of symptoms of anxiety and depression with diabetes and cardiovascular risk factors in older people with intellectual disability[J]. J Intellect Disabil Res,2015,59(2):176-185.
[3] Sun Q,Yin Y,Zhu Z,et al.Association of the C242T polymorphism in the NAD(P)H oxidase P22 phox gene with type 2 diabetes mellitus risk:a meta-analysis[J]. Curr Med Res Opin,2014,30(3):415-422.
[4] Sukumar P,Kearney MT.Response to Comment on:Sukumar et al. Nox2 NADPH oxidase has a critical role in insulin resistance-related endothelial cell dysfunction[J]. Diabetes,2013,62(12)e31.
[5] Chen GQ,Ren L,Zhang J,et al. Cryopreservation affects ROS-induced oxidative stress and antioxidant response in Arabidopsis seedlings[J]. Cryobiology,2015,70(1):38-47.
[6] Qiu S,Cai X,Schumann U,et al.Impact of walking on glycemic control and other cardiovascular risk factors in type 2 diabetes:a meta-analysis[J]. PLoS One,2014,9(10):e109767.
[7] Ginter E,Simko V.Recent data on Mediterranean diet,cardiovascular disease,cancer,diabetes and life expectancy[J]. Bratisl Lek Listy,2015,116(6):346-348.
[8] 甘立霞. 2型糖尿病基础研究中的难题与突破[J]. 第三军医大学学报,2014,15(36):1543-1547
[9] Hossain MA,Bhattacharjee S,Armin SM,et al.Hydrogen peroxide priming modulates abiotic oxidative stress tolerance:insights from ROS detoxification and scavenging[J]. Front Plant Sci,2015,6:420.
[10] Fukui H,Endoh S,Shichiri M,Ishida N,Hagihara Y,et al. The induction of lipid peroxidation during the acute oxidative stress response induced by intratracheal instillation of fine crystalline silica particles in rats[J]. Toxicol Ind Health,2014[Epub adead of print].
[11] Wang P,Xie K,Wang C,et al.Oxidative stress induced by lipid peroxidation is related with inflammation of demyelination and neurodegeneration in multiple sclerosis[J]. Eur Neurol,2014,72(3-4):249-254.
[12] Solhi H,Malekirad A,Kazemifar AM,Oxidative stress and lipid peroxidation in prolonged users of methamphetamine[J]. Drug Metab Lett,2014,7(2):79-82.
[13] Wang C,Yang J,Lu D,et al.Oxidative stress-related DNA damage and homologous recombination repairing induced by N,N-dimethylformamide[J]. J Appl Toxicol,2015,36(7):936-945.
[14] Hubackova S,Kucerova A,Michlits G,et al.IFNy induces oxidative stress,DNA damage and tumor cell senescence via TGFbeta/SMAD signaling-dependent induction of Nox4 and suppression of ANT2[J]. Oncogene,2016,35(10):1236-1249.
[15] Ye X,Ji Z,Wei C,et al.Inhaled formaldehyde induces DNA-protein crosslinks and oxidative stress in bone marrow and other distant organs of exposed mice[J]. Environ Mol Mutagen,2013,54(9):705-718.
The level of oxidative stress in type 2 diabetes patients
YangQunfeng*,XuWeiliang,CaoQiwen
(Departmentofendocrinology,TheFifthPeoplesHospitalofDongguan,Donggang523905)
*Correspondingauthor:Email:btyw2015@sina.com
Objective:To study the level of oxidative stress in type 2 diabetes patients,which may be a new target of clinical treatments.Methods:Selected 200 patients and 200 health people and evaluate the activity of SOD、total antioxidant capacity、total phenolic content、malondialdehyde、protein carbonyl,and determine the difference between two groups.Results:Compared with the control group,there is significant low level of activity of SOD and total antioxidant capacity in patient group (P<0.05),while there is significant high level of total phenolic content、malondialdehyde and protein carbonyl in patient group (P<0.05). Furthermore,there is a significant difference between the groups of blood glucose concentrations in 6.1~7.0 mmol/L and ≥7.0 mmol/L.Conclusion:Compared with the control group,patients with the type 2 diabetes has a higher level of oxidative stress,and is associated with the blood glucose concentrations
type 2 diabetes,oxidative stress, blood glucose concentrations
10.3969/j.issn.1008-1836.2016.02.026
Email:btyw2015@sina.com
R587.1
A
2095-9664(2016)02-0098-03
2016-03-18)
