鞘内β-七叶皂甙钠对神经病理性疼痛大鼠脊髓背角细胞因子的影响
2016-10-13尧新华肖珍科卿朝辉
王 保 尧新华 肖珍科 鲁 义 周 朴 卿朝辉 谭 花
(广州市中医医院麻醉科,广东 广州 510130)
·论著·
鞘内β-七叶皂甙钠对神经病理性疼痛大鼠脊髓背角细胞因子的影响
王保*尧新华肖珍科鲁义周朴卿朝辉谭花
(广州市中医医院麻醉科,广东 广州 510130)
目的:观察鞘内β-七叶皂甙钠对神经病理性疼痛大鼠脊髓背角细胞因子的影响。方法:于健康雄性SD大鼠(体质量180~200 g)鞘内留置PE-10 导管,置管1周后制作神经病理性疼痛模型。将18只神经病理性疼痛大鼠随机分成3组(每组6只):生理盐水组、β-七叶皂甙钠20 μg组和β-七叶皂甙钠40 μg组。测定3组鞘内给药前、给药后20、40、60 min大鼠机械性阈值,计算最大效应百分比(MPE)。采用RT-PCR法检测脊髓背角内TNF-a、IL-1β、IL-6的mRNA水平。结果:β-七叶皂甙钠20 μg组、40 μg组MPE均明显高于生理盐水组(P<0.05),TNF-a、IL-1β、IL-6 mRNA表达水平则明显低于生理盐水组(P<0.05)。结论:鞘内注射β-七叶皂甙钠可产生抗神经病理性疼痛作用,其作用可能与其抑制脊髓背角内TNF-a、IL-1β、IL-6的mRNA表达有关。
β-七叶皂甙钠;神经病理性疼痛;脊髓背角;细胞因子
神经病理性疼痛是由各种原因(如外伤、手术、肿瘤、病毒感染、糖尿病和化疗药物)引起的神经损伤所致,主要表现为痛超敏(即痛阈显著下降)、痛敏(即痛反应增强)和自发性疼痛[1]。目前,临床上尚无特效的治疗药物和治疗方法,属于难治性疼痛[2]。有研究结果表明,大鼠鞘内注射β-七叶皂甙钠可产生剂量依赖性抗神经病理性疼痛作用[3],但其机制较为复杂。本研究拟建立神经病理性疼痛大鼠模型,观察鞘内注射β-七叶皂甙钠对神经病理性疼痛大鼠脊髓背角细胞因子的影响,探讨可能的作用机制。
1 材料与方法
1.1实验动物建模和分组
将体质量180~200 g的雄性SD大鼠(中山大学实验动物中心提供),腹腔内注入咪唑安定(2 mg/kg)和氯胺酮(40 mg/kg)麻醉后,将PE-10导管从大鼠枕骨大孔入蛛网膜下腔向尾侧插入7.0~7.5 cm 至脊髓腰骶段,另一端固定在颈外以供注射实验药物;1周后,无运动功能障碍大鼠者,在同样的麻醉方法下,结扎大鼠腰5、6神经,制作神经病理性疼痛模型。随机抽取18只模型大鼠,随机分成3组:生理盐水组、β-七叶皂甙钠20 μg组和β-七叶皂甙钠40 μg组,每组6只。将含20 μg β-七叶皂甙钠的生理盐水20 μL、40 μg β-七叶皂甙钠的生理盐水20 μL和生理盐水20 μL分别从PE-10导管注入蛛网膜下腔。7 d后,用于下一步实验。
1.2试剂
β-七叶皂甙钠购自山东绿叶制药有限公司;RT-PCR试剂盒购自美国Promega公司;PBS缓冲液:NaCl 8 g、KCl 0.2 g、Na2HPO41.56 g、KH2PO40.2 g加超纯水至900 mL,调pH值至7.4,高压灭菌备用。PCR引物及序列[4,5]见表1,由英潍捷基(上海)贸易有限公司合成。
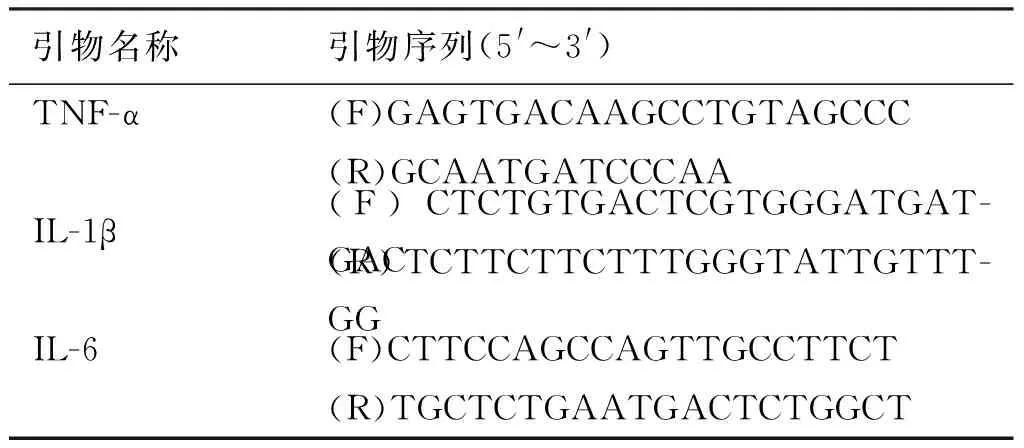
表1 PCR引物及序列
1.3机械性阈值的测定
将SD大鼠置于实验容器中适应20 min后,使用vonFrey 纤维丝垂直于大鼠神经结扎侧肢足底中间部位,然后给予一定刺激,持续刺激时间≤6 s,当大鼠出现舔足、抬脚反应时,则认为是阳性反应。从2 g刺激开始进行测试,若该力度的刺激不能诱导阳性反应,则用相邻大一级的力度进行刺激,若阳性反应被诱导出,需要换成级别小一级的力度进行刺激。在经过数次连续的伤害刺激以后,当出现第一次阳性反应和阴性反应的骑跨,再连续测定4 次,记录该值,最大力度限制为15 g,刺激力度>15 g时记为15 g,每次刺激的间隔时间为30 s[6]。对抗伤害效果的评定:抗伤害最大效应百分比(MPE%)=(给药后压力阈值-基础压力阈值)/(15-基础压力阈值)×100%。
1.4脊髓背角细胞因子的测定
将完成机械性阈值测定的大鼠处死,取腰段脊髓,采用RT-PCR法检测TNF-a、IL-1β、IL-6 mRNA水平。
1.5统计学分析
2 结 果
2.1鞘内β-七叶皂甙钠对大鼠机械性阈值的影响
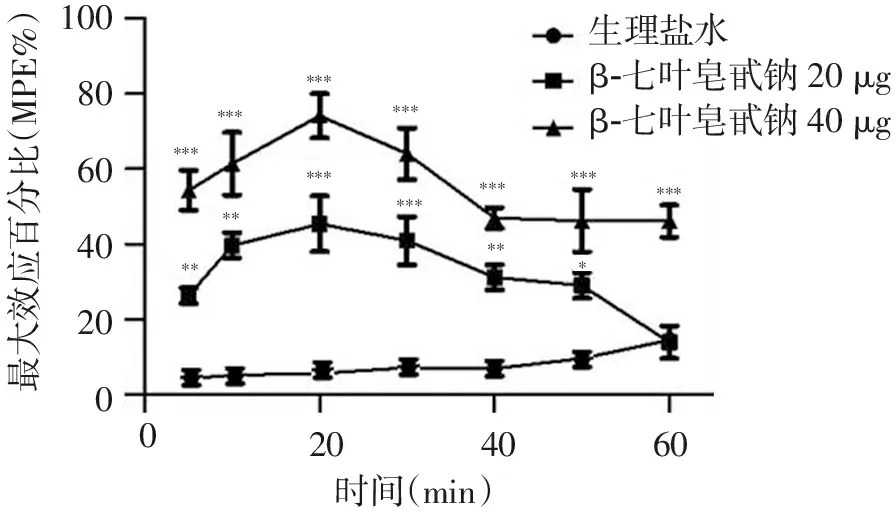
鞘内分别注射20、40 μg β-七叶皂甙钠可产生较强的抗神经病理性疼痛作用,在注药后20 min抗神经病理性疼痛作用达到最大,其作用可持续至给药后1 h,且与生理盐水组比较,差异有统计学意义(P<0.05),见图1。
100806040200最大效应百分比(MPE%)**********************************生理盐水β-七叶皂甙钠20μgβ-七叶皂甙钠40μg2040600时间(min)
注:*P<0.05,**P<0.01,***P<0.001
图1鞘内注入β-七叶皂甙钠各时间点的最大效应百分比
2.2β-七叶皂甙钠对脊髓背角TNF-α、IL-1β和IL-6表达的影响
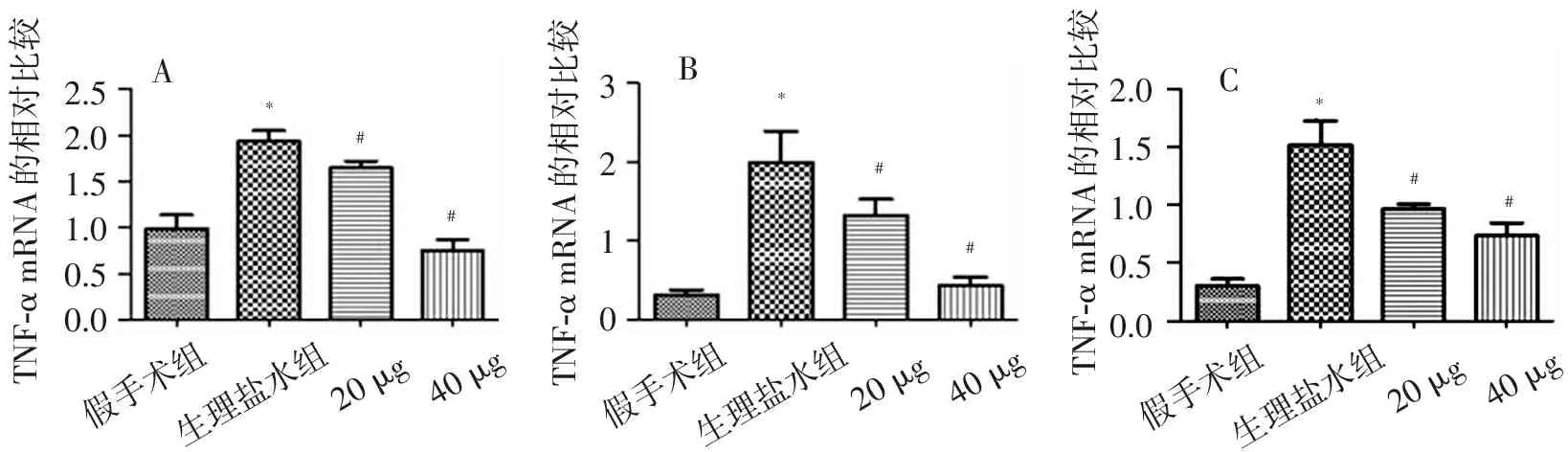
鞘内分别注入β-七叶皂甙钠20 μg和40 μg后,脊髓背角细胞因子TNF-α、IL-1β、IL-6 mRNA表达水平均明显下降,与生理盐水组比较,差异均有统计学意义(P<0.05),见图2。
TNF-αmRNA的相对比较2.52.01.51.00.50.03210TNF-αmRNA的相对比较TNF-αmRNA的相对比较2.01.51.00.50.0假手术组生理盐水组20μg40μg假手术组生理盐水组20μg40μg假手术组生理盐水组20μg40μgABC##*##*##*
注:A TNF-α;B IL-1β;C IL-6;与假手术组比较,*P<0.05;与生理盐水组比较,*P<0.05
图2实时荧光定量RT-PCR检测脊髓背角TNF-α、IL-1β、IL-6 mRNA水平
3 讨 论
神经病理性疼痛是一种常见的由神经系统损伤引发的难以根治的慢性病理状态,主要表现有痛阈降低、痛反应增强和自发性疼痛等,国际疼痛研究协会将其称之为“源于或由神经系统功能紊乱所引起”[7]。神经病理性疼痛发病机制复杂,与组织损伤所引起的急性疼痛不一样,治疗比较困难。
β-七叶皂甙钠可通过下列途径发挥抗神经病理性疼痛作用:刺激肾上腺皮质及刺激细胞产生脂质调节素,对抗炎性介质,抗渗出、消肿;抑制TXA2的表达,通过促进分泌前列腺素PGF2a,提高血液中的皮质酮浓度,阻滞腺苷三磷酸酯酶的作用而促进钾离子外排,并使钠离子交换变慢,从而消肿抗炎;其化学分子结构包含酚羟基,可通过捕捉清除游离的氧自由基,降低脂质过氧化,从而稳定血管内皮细胞,扩张动脉,增强耐缺氧能力[8]。
本研究结果表明,鞘内注射20、40 μg β-七叶皂甙钠可产生较强的抗神经病理性疼痛作用,且在注药后20 min作用达到最大,其作用可持续1 h,这与尧新华等[3]的研究结果一致。有研究结果表明,促炎细胞因子TNF-α、IL-1β、IL-6可使伤害性感受神经元活化或致敏,具有增强疼痛的作用[9],本研究结果证实,鞘内β-七叶皂甙钠具有抑制TNF-α、IL-1β、IL-6的mRNA表达的作用,可使脊髓背角细胞因子TNF-α、IL-1β、IL-6的mRNA表达水平明显下降。我们据此推测,鞘内注射β-七叶皂甙钠抗神经病理性疼痛作用可能与其抑制脊髓背角TNF-α、IL-1β、IL-6等炎症因子的释放有关。
综上所述,大鼠鞘内β-七叶皂甙钠可产生抗神经病理性疼痛作用,其机制可能与其降低脊髓背角内TNF-α、IL-1β和IL-6等细胞因子的表达有关。
[1] Woolf CJ,Salter MW. Neuronal plasticity:increasing the gain in pain[J]. Science,2000,288(5472):1765-1769.
[2] 樊碧发. 神经病理性疼痛的诊疗[J]. 现代实用医学,2010,22(2):126-129.
[3] 尧新华,周朴,黄瑛,等. 鞘内七叶皂苷钠和可乐定治疗神经病理性疼痛[J].南方医科大学学报,2009,29(9):1840-1842.
[4] Tal M,Bennett GJ . Extra-territorial pain in rats with a peripheral mononeuropathy:mechano-hyperalgesia and mechano-allodynia in the territory of an uninjured nerve [J]. Pain,1994,57(3):375-382 .
[5] Choi Y,Yoon YW,Na HS,et al. Behavioral signs of ongoing pain and cold allodynia in a rat model of neuropathic pain[J]. Pain,1994,59(3):369-376.
[6] 贾子普,罗芳. 脉冲射频治疗外周神经病理性疼痛模型的研究进展[J].中国疼痛医学杂志,2015,21(4):293-296.
[7] de Novellis V,Siniscalco D,Galderisi U,et al. Blockade of glutamate mGlu5 receptors in a rat model of neuropathic pain prevents early over-expression of pro-apoptotic genes and morphological changes in dorsal horn lamina Ⅱ [J]. Neuropharmacology,2004,46(4):468-479.
[8] Taylor HR,Livingston PM,Stanislavsky YL,et al . Visual impairment in Australia:distance visual acuity,near vision,and visual field findings of the Melbourne Visual Impairment Project [J]. Am J Ophthalmol,1997,123(3):328-337.
[9] 奚正德,胡峻熊. 趋化因子和神经病理性疼痛[J]. 中国神经免疫学和神经病学杂志,2004,15(4):297-300.
(本文编辑:张辉)
Effects of intrathecal β-Aescin sodium on cytokines in spinal dorsal horn of rats with neuropathic pain
WangBao*,YaoXinhua,XiaoZhenke,LuYi,ZhouPu,QingChaohui,TanHua
(DepartmentofAnesthesiology,GuangzhouMunicipalHospitalofTraditionalChineseMedicine,Guangzhou510130,China)
*Correspondingauthor:Email:78wb@163.com
Objective:To investigate the effects of intrathecal β-Aescin sodium on cytokines in spinal dorsal horn of rats with neuropathic pain. Methods:Healthy male SD rats (body weight 180~200 g) received intrathecal indwelling of PE-10 catheters. One week later,model of neuropathic pain was established in these rats by spinal nerve ligation (SNL). Eighteen SNL rats were randomly selected and divided into 3 groups (n=6 each):normal saline group,20 μg β-Aescin sodium group and 40 μg β-Aescin sodium group. Before intrathecal administration and at 20,40 and 60 min after administration,we determined the mechanical threshold of rats,and thereby calculated the maximum percent effect (MPE). RT-PCR was used to detected the mRNA levels of TNF-a,IL-1β and IL-6 in the dorsal horn of spinal cord. Results:Compared with normal saline group,20 μg and 40 μg β-Aescin groups showed significantly higher MPE values (P<0.05),and significantly lower mRNA expression levels of TNF-a,IL-1β and IL-6(P<0.05).Conclusion:Intrathecal injection of β-Aescin may result in anti-neuropathic pain effect,which may be related to inhibition of TNF-a,IL-1β,and IL-6 mRNA expression in the dorsal horn of spinal cord.
β-Aescin; neuropathic pain; spinal dorsal horn; cytokine
10.3969/j.issn.1008-1836.2016.02.002
广州市医药卫生科技项目(20131A 011034)
Email:78wb@163.com
R575.2
A
2095-9664(2016)02-0006-03
2016-03-17)
