RBBP4对前列腺癌细胞生长和侵袭能力的影响
2016-10-13黄亚强黄红星丘少鹏黎卫郑轶群袁润强
黄亚强 黄红星 丘少鹏 黎卫 郑轶群 袁润强
·实验研究·
RBBP4对前列腺癌细胞生长和侵袭能力的影响
黄亚强黄红星丘少鹏黎卫郑轶群袁润强
目的研究视网膜母细胞瘤结合蛋白4(retinoblastoma binding protein4,RBBP4)对前列腺癌细胞侵袭、迁移、增殖及肿瘤生长等生物学行为的影响。方法构建RBBP4过表达慢病毒载体转染及未转染LNCaP、DU145细胞株,分别通过Transwell实验、Wound healing实验、CCK8及流式细胞技术检测前列腺癌细胞的侵袭、迁移、增殖和凋亡, 异体肿瘤种植模型研究RBBP4 对前列腺癌细胞成瘤能力的影响。结果RBBP4上调表达明显促进前列腺癌细胞的迁移(LNCaP: RBBP4 vs Ctrl =133.8±14.1 vs 48.6±11.9;DU145: RBBP4 vs Ctrl =118.2±10.5 vs 62.3±13.0,P<0.001)和侵袭(LNCaP: RBBP4 vs Ctrl =252.0±16.3 vs 82.5±12.6; DU145: RBBP4 vs Ctrl =232.8±9.2 vs 61.0±8.3,P<0.001)能力;RBBP4高表达可以刺激DU145前列腺癌细胞的增殖并显著加快DU145细胞移植瘤的生长速度(P<0.01)。结论RBBP4能刺激前列腺癌细胞的侵袭、迁移,促进前列腺癌的形成及生长。
前列腺癌;RBBP4;侵袭;肿瘤生长
前列腺癌是老年男性常见恶性肿瘤,随着我国人口的老龄化,前列腺癌已成为威胁我国老年男性生命的重要疾病[1]。前列腺癌细胞的侵袭力影响前列腺癌的进展及预后。前期基于蛋白组学的研究发现视网膜母细胞瘤结合蛋白4(retinoblastoma binding protein 4,RBBP4)在前列腺癌组织中的表达明显上调[2],本研究拟进一步探讨RBBP4对前列腺癌细胞侵袭、增殖及肿瘤生长能力的影响。
材料与方法
一、材料
本研究所用的LNCaP和DU145前列腺癌细胞株均取自广东省临床分子医学及分子诊断重点实验室,所有细胞株均在10%FBS、5%CO2、37℃条件下培养。CCK8试剂购自碧云天生物技术研究所。RBBP4慢病毒载体由美国SBI公司设计及构建。nu/nu裸鼠购自广东省动物实验中心。
二、方法
1.构建稳定传代的RBBP4过表达慢病毒载体转染细胞株和未转染细胞株:RBBP4过表达慢病毒载体(货号: PMIRHRBBP4PA-1/MZIPRBBP4-PA-1),用包装质粒混合液转染RBBP4到293T细胞株,3 d后根据SBI说明书用Lenti-Concentin病毒沉淀溶液提取收集病毒颗粒。然后,用TransDux 病毒转染试剂转染DU145 和LNCaP 细胞株。 流式分选RBBP4过表达及空白对照细胞株并经RT-PCR和Western blot验证。
2.CCK8:取生长状态良好的转染细胞配成单细胞悬液,以每孔3 000个细胞接种到96孔板,每孔体积200 μl,设3个复孔。 培养24、48、72 h后,每孔加CCK8溶液20 μl,继续孵育4 h,终止培养,离心后再吸弃孔内培养上清液。用酶标仪测定细胞在 450 nm处的吸光度,检测 OD 值,记录结果,以时间为横坐标,OD 值为纵坐标绘制细胞生长曲线。实验重复3次。
3.细胞划痕实验(Wound healing):取对数生长期的细胞,置于24孔板,细胞密度8×104/孔,每组设3个复孔,待细胞呈现单层贴壁生长时,用消毒枪头在24孔板垂直划痕,用无血清培养液洗2~3次后继续培养,于0、48 h在相差显微镜下随机选择5个40倍视野测量划痕面垂直距离。实验重复3次。
4.侵袭实验(Transwell):按照Chemicon公司的ECM550系列说明书要求制备有基质胶的Transwell小室。用含BSA的无血清培养液制备细胞悬液并调整细胞密度至5×105/ml,取细胞悬液100~200 μl加入Transwell小室,小室加入500 μl完全培养液常规培养12~48 h。取出Transwell小室,PBS淋洗后用4%PFA固定,姬姆萨染色。Leica DC 300F正置显微镜进行观察和拍照,计数移至微孔膜下层的细胞,每个样本计数10个视野,取均数。
5.裸鼠皮下成瘤实验:购买6周龄雄性裸鼠,动物房饲养1周。取RBBP4过表达慢病毒载体转染和未转染的DU145细胞悬液与等体积Matrigel(货号: 356234, BD Biosciences)充分混合,接种到裸鼠两侧协腹皮下,每组3只裸鼠,每侧接种细胞数为2×106个。每4 d测量1次肿瘤的长度和宽度并计算肿瘤体积[肿瘤体积(mm3)=宽2(mm2) ×长(mm)/2]。接种后第32天处死裸鼠获取移植瘤组织,并绘制肿瘤生长曲线图。
三、统计学方法
实验所得数据釆用SPSS 18.0软件进行统计学分析。组间计量资料比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、 RBBP4过表达病毒转染DU145 和LNCaP 细胞株验证
为了验证RBBP4过表达DU145 和LNCaP前列腺癌细胞株构建成功,分别经RT-PCR和Western blot检测各细胞株中RBBP4表达情况。结果显示RBBP4在转染组DU145 和LNCaP 细胞株中的表达量均高于对照组(P<0.001)。见图1。

A:RT-PCR;B:Western blot
二、RBBP4对前列腺癌细胞侵袭和迁移能力的影响
通过RBBP4过表达慢病毒载体转染和未转染的DU145、LNCaP细胞株研究RBBP4对前列腺癌细胞侵袭、迁移能力的影响。Tanswell实验发现转染组细胞侵袭力明显增强(LNCaP: RBBP4 vs Ctrl =252.0±16.3 vs 82.5±12.6; DU145: RBBP4 vs Ctrl =232.8±9.2 vs 61.0±8.3,P<0.001)。见图2。Wound healing实验结果表明转染组细胞迁移能力也明显增强(LNCaP: RBBP4 vs Ctrl=133.8±14.1 vs 48.6±11.9;DU145: RBBP4 vs Ctrl =118.2±10.5 vs 62.3±13.0,P<0.001)。见图3。说明RBBP4表达上调可明显促进DU145、LNCaP细胞的侵袭能力,增加前列腺癌细胞的迁移能力。
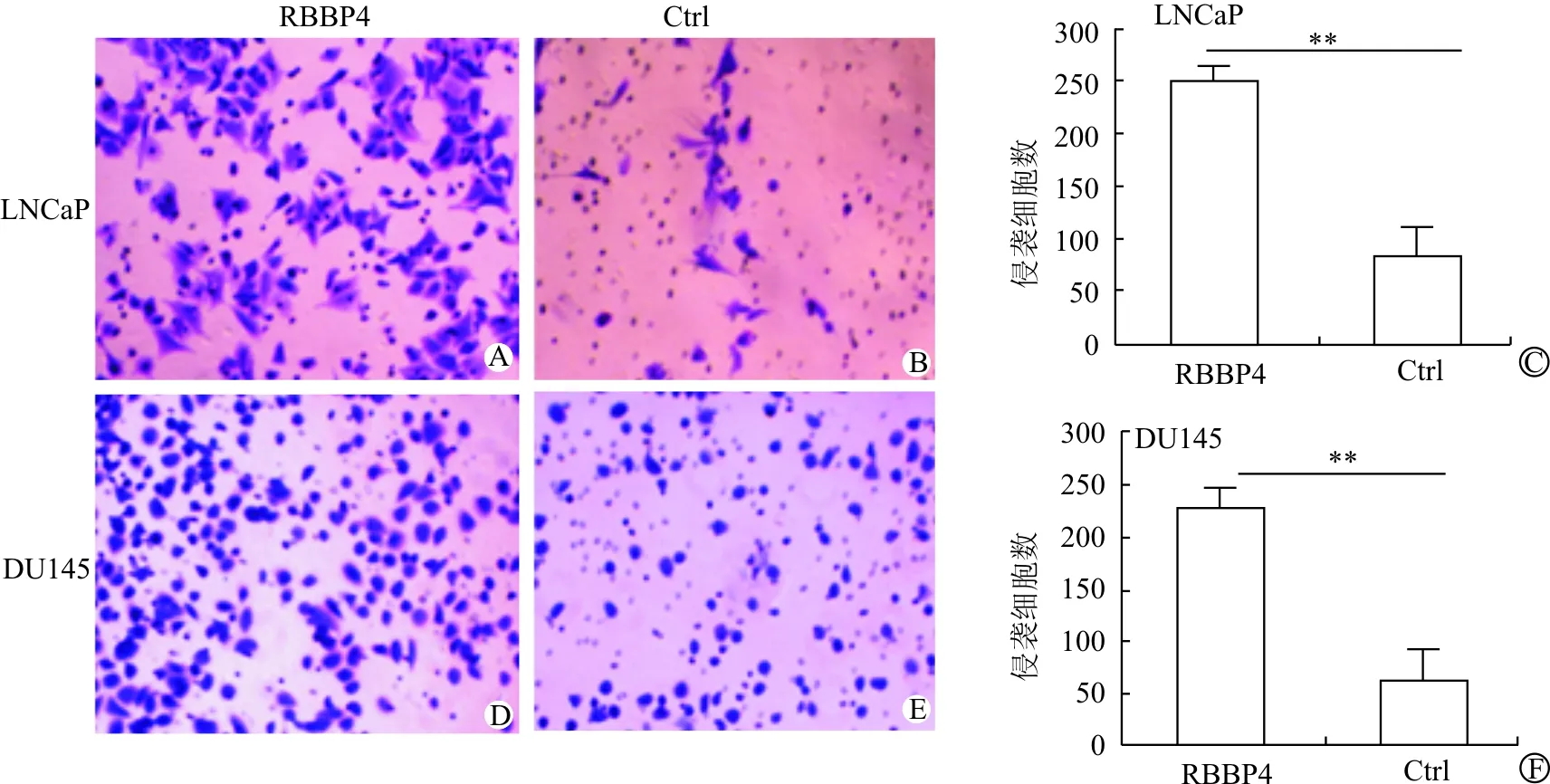
A:LNCaP转染组;B:LNCaP未转染组;C:LNCaP:RBBP4 vs Ctrl;D:DU145转染组;E:DU145未转染组;F:DU145:RBBP4 vs Ctrl
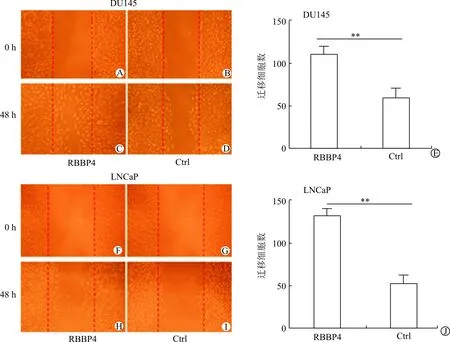
A:DU145转染组(0 h);B:DU145未转染组(0 h);C:DU145转染组(48 h);D:DU145未转染组(48 h);E:DU145: RBBP4 vs Ctrl;F:LNCaP转染组(0 h);G:LNCaP未转染组(0 h);H:LNCaP转染组(48 h);I:LNCaP未转染组(48 h);J:LNCaP: RBBP4 vs Ctrl
三、RBBP4表达对前列腺癌细胞增殖和凋亡的影响
细胞凋亡实验发现转染组DU145前列腺癌细胞凋亡率明显低于未转染组(P<0.001),提示RBBP4抑制前列腺癌细胞凋亡。见图4A~4C。CCK8细胞增殖实验检测RBBP4表达对DU145前列腺癌细胞株增殖的影响,观察转染细胞培养24、48、72 h后的OD值,发现48、72 h后RBBP4过表达的前列腺癌细胞生长明显增快(P<0.001)。见图4D。
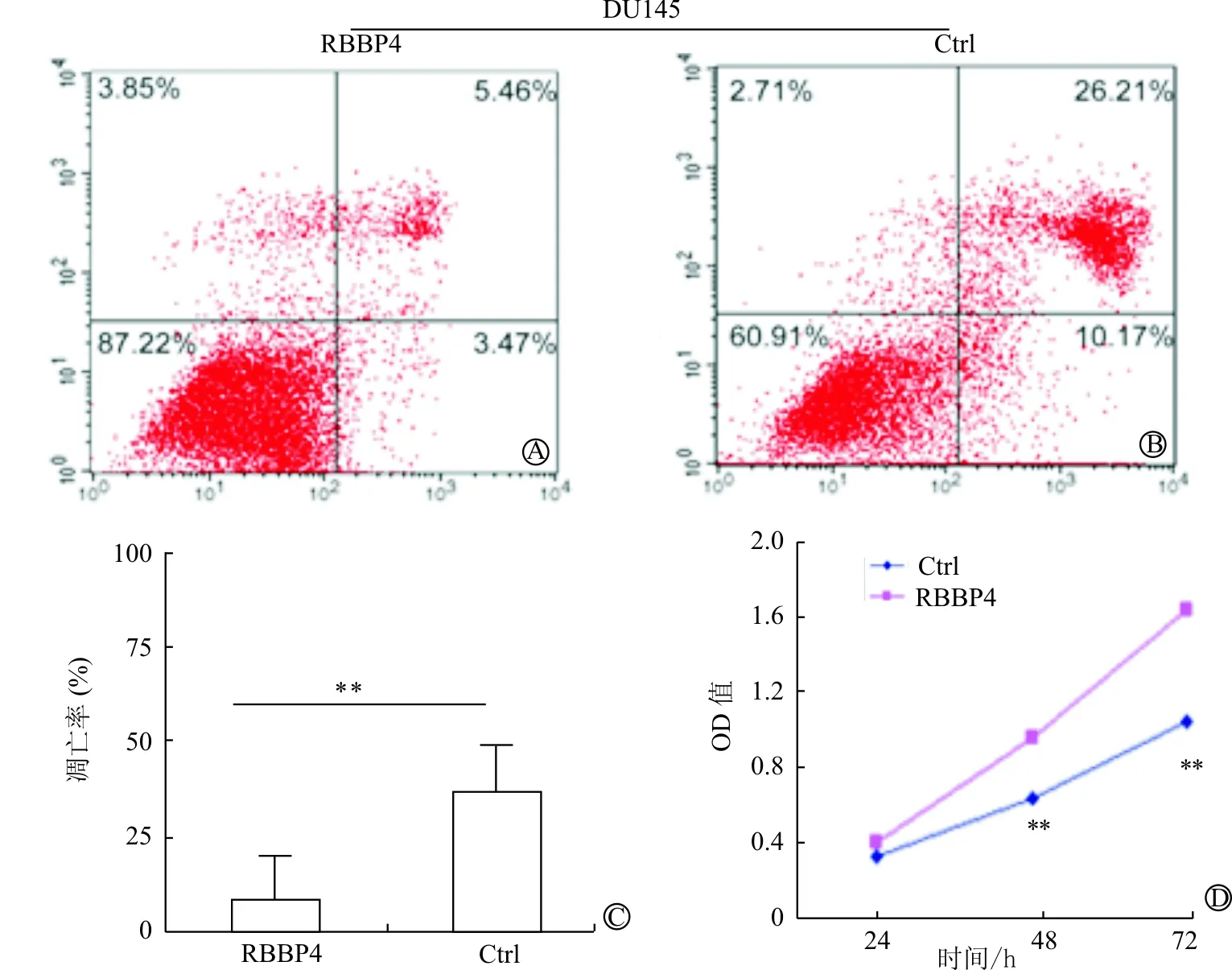
A:DU145转染组;B:DU145未转染组;C:DU145:RBBP4 vs Ctrl 凋亡率;D:DU145:RBBP4 vs Ctrl OD值
四、RBBP4对裸鼠皮下移植瘤形成及生长的影响
为进一步了解RBBP4对前列腺癌细胞在体内成瘤能力的影响,分别将转染和未转染RBBP4过表达慢病毒载体的DU145细胞株注射到裸鼠双侧皮下,形成异体移植瘤模型(3只裸鼠)。发现在细胞接种7 d后开始成瘤,转染组DU145细胞形成肿瘤的体积明显大于对照组,而且肿瘤的生长速度明显加快。见图5。

A:皮下种植32 d后肿瘤生长情况;B:肿瘤生长曲线图
讨 论
前列腺癌是男性生殖系统最常见的恶性肿瘤,肿瘤转移是患者治疗失败及死亡的主要原因。肿瘤转移是多步骤、多基因参与的一个复杂生物过程,其中肿瘤细胞向邻近组织侵袭、迁移是肿瘤实现远处转移的关键[3]。RBBP4属于WD-40蛋白家族,参与组蛋白乙酰化、染色体重构、核小体修饰、细胞周期进展及肿瘤干细胞分化等功能[4-5],并通过一系列中间环节,影响细胞因子的转录及细胞增殖[6]。RBBP4在肝癌、结肠癌等肿瘤组织中表达升高并加快肿瘤的进展[7]。本研究发现RBBP4能促进前列腺癌细胞的迁移、侵袭、增殖、成瘤能力并抑制细胞凋亡。
侵袭、迁移是肿瘤细胞相对独立的功能特征,侵袭是指肿瘤细胞脱离原发瘤,穿越基底膜并向周围间质浸润生长。钟晶晶等[8]研究认为RBBP4能促进宫颈癌细胞株MS751的上皮间质转化,增加细胞的迁移与侵袭活动,其作用机制与Snail、Twist的表达上调有关。RBBP4与雌激素受体相互作用调节MCF-7乳腺癌细胞雌激素受体的活性,并影响乳腺癌的预后[9]。本研究通过Transwell和Wound healing实验发现RBBP4过表达可明显促进前列腺癌DU145、LNCaP细胞的侵袭、迁移能力, 加快裸鼠移植瘤模型肿瘤的形成及生长,提示RBBP4为前列腺癌的促癌基因,参与前列腺癌的局部浸润及转移。
恶性增殖是肿瘤细胞区别于正常细胞的特点,肿瘤细胞失去了正常细胞所具有的细胞分裂反馈抑制及接触抑制。RBBP4参与染色体重构、核小体修饰等有丝分裂过程,在细胞增殖中扮演着重要的角色[10]。Pacifico等[11]通过蛋白组学及细胞实验发现NF-kappaB和RBBP4在甲状腺癌中表达上调,NF-kappaB靶向RBBP4调节甲状腺肿瘤细胞的增殖和凋亡。本研究的CCK8细胞增殖实验及细胞凋亡实验结果显示,RBBP4能抑制DU145前列腺癌细胞凋亡并加快前列腺癌细胞增殖,意味着RBBP4在促进前列腺癌生长和恶性进展中同样发挥着重要作用。
综上所述,RBBP4促进前列腺癌细胞的迁移、侵袭、增殖及成瘤能力,并能抑制细胞凋亡,在前列腺癌的进展中可能扮演着重要角色。RBBP4在前列腺癌中具体的作用机制还有待进一步研究,以期为前列腺癌的诊断治疗提供新的方法。
[1]韩苏军,张思维,陈万青,等. 中国前列腺癌死亡现状及流行趋势分析[J]. 中华泌尿外科杂志,2012,33(11):836-839.
[2]Han ZD, Zhang YQ, He HC, et al. Identification of novel serological tumor markers for human prostate cancer using integrative transcriptome and proteome analysis[J]. Med Oncol,2012,29(4):2877-2888.
[3]Bidard FC, Pierga JY, Soria JC, et al. Translating metastasis-related biomarker to the clinic-progress and pitfalls[J]. Nat Rev Clin Oncol,2013,10(3):169-179.
[4]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell,2011,144(5):646-674.
[5]Krüger AV, Jelier R, Dzyubachyk O, et al. Comprehensive single cell -resolution analysis of the role of chromatin regulators in early C.elegans embryogenesis[J]. Dev Biol,2015,398(2):153-162.
[6]Pazin MJ, Kadonaga JT. What's up and down with histone deacetylation and transcription?[J]. Cell,1997,89(3):325-328.
[7]Song H, Xia SL, Liao C, et al. Genes encoding Pir51, Beclin 1, RbAp48 and aldolase b are up or down-regulated in human primary hepatocellular carcinoma[J]. World J Gastroenterol,2004,10(4):509-513.
[8]钟晶晶,杨旭锐,麦梅清,等. 下调RbAp48表达可抑制人宫颈癌MS751细胞株的迁移侵袭能力[J]. 南方医科大学学报,2015,35(11):1564-1569.
[9]Creekmore AL, Walt KA, Schultz-Norton JR, et al. The role of retinoblastoma associated proteins 46 and 48 in estrogen receptor alpha mediated gene expression[J]. Mol Cell Endocrinol,2008,291(1-2):79-86.
[10]Satrimafitrah P, Barman HK, Ahmad A, et al. RbAp48 is essential for viability of vertebrate cells and plays a role in chromosome stability[J]. Chromosome Res,2016,24(2):161-173.
[11]Pacifico F, Paolillo M, Chiappetta G, et al. RbAp48 is a target of nuclear factor-kappaB activity in thyroid cancer[J]. J Clin Endocrinol Metab,2007,92(4):1458-1466.
(本文编辑:徐汉玲)
The effects of RBBP4 on invasion and tumorigenesis of prostate cancer cells
HUANGYa-qiang*,HUANGHong-xing,QIUShao-peng,LIWei,ZHENGYi-qun,YUANRun-qiang.*DepartmentofUrology,FirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China
Correspondingauthor:HUANGHong-xing,E-mail:hhxzs@21cn.com
ObjectiveTo investigate the effects of RBBP4 on the migration, invasion, proliferation and tumorigenesis of prostate cancer cells. MethodsThe over-expression and blank control of RBBP4 of prostate cancer cells were constructed by lentivirus vector. The abilities of cell migration, invasion, proliferation and apoptosis were evaluated by using wound healing, transwell, CCK-8 and flow cytometry assasy, respectively. Tumor xenografts growth was applied to confirm the role of RBBP4 in carcinogenesis. ResultsThe up-regulation of RBBP4 promoted migration (LNCaP: RBBP4 vs Ctrl =133.8±14.1 vs 48.6±11.9; DU145: RBBP4 vs Ctrl=118.2±10.5 vs 62.3±13.0,P<0.001)and invasion (LNCaP: RBBP4 vs Ctrl=252.0±16.3 vs 82.5±12.6; DU145: RBBP4 vs Ctrl=232.8±9.2 vs 61.0±8.3,P<0.001) of DU145 and LNCaP cells significantly. Furthermore, RBBP4 stimulated proliferation and promoted tumor xenografts growth of DU145 cell (P<0.01). ConclusionsIncreased expression of RBBP4 can significantly enhance the invasive and carcinogenic abilities of prostate cancer cell.
Prostate cancer;RBBP4;Invasion;Tumor growth
中国博士后科学基金(2016M590842);广东省医学科学技术研究基金(A2016052)
510080广州,中山大学附属第一医院泌尿外科(黄亚强、黄红星、丘少鹏);中山大学附属中山医院泌尿外科(黎卫、郑轶群、袁润强)
黄红星,E-mail:hhxzs@21cn.com
10.3870/j.issn.1674-4624.2016.03.009
2016-04-22)
