急性药物性肝损伤的临床研究
2016-10-11齐芬任晓非许建明
齐芬,任晓非,许建明
(安徽医科大学第一附属医院消化科,安徽 合肥 230022)
急性药物性肝损伤的临床研究
齐芬,任晓非,许建明
(安徽医科大学第一附属医院消化科,安徽 合肥230022)
目的对305例住院诊断急性药物性肝损伤病例进行分型判断和关联性评价,探讨病因,为临床医生提供参考。方法诊断急性药物性肝损伤305例,根据药物性肝损伤因果关系评价表(RUCAM)对病例进行分型和量化评分,列出可疑用药,评价其与肝损伤的关联程度。结果305例急性药物性肝损伤病例,肝细胞型221例(72.5%),胆汁淤积型36例(11.8%),混合型48例(15.7%);RUCAM评分大于8分(非常可能)29例(9.5%),6~8分(很可能)181例(59.9%),3~5分(可能)86例(28.2%),1~2分(不大可能)8例(2.6%),小于1分(无关)1例(0.3%);中草药占肝损伤可疑用药的首位(47.5%),其中何首乌是导致肝毒性的可疑用药(6.9%)。结论RUCAM评分有助于可疑药物与肝损伤的关联性评价,但仍有不足,中草药致肝损伤比例增加,何首乌药物肝毒性问题需要重视。
药物性肝损伤;中草药/副作用;回顾性研究
急性药物性肝损伤是药物治疗过程中常见的不良反应,近年来,随着临床用药种类增加,药物性肝损伤的发病率逐渐增加。药物性肝损伤为排除性诊断,临床医生缺乏足够的认识。本文回顾性收集2012年1月至2015年3月在本院诊断为急性药物性肝损伤病例,采用药物性肝损伤因果关系评价表(RUCAM)评分系统判断可疑药物与肝损伤之间的关联程度,判断肝损伤类型,研究肝损伤病因。
1 资料与方法
1.1临床资料回顾性收集安徽医科大学第一附属医院2012年1月至2015年3月诊断急性药物性肝损伤住院病历,详细记录患者的基线信息、住院时间、可疑用药史、相关既往史、肝脏生化指标、肝炎病毒血清学检查、影像学检查及其他辅助检查、治疗经过及转归,剔除信息不全者。
1.2药物性肝损伤的分型根据美国胃肠病学会 (ACG)临床指南[1],将药物性肝损伤分为3 型:(1) 肝细胞型:血清谷丙转氨酶(ALT)升高的倍数/碱性磷酸酶 (ALP) 升高倍数≥5;(2)胆汁淤积型:血清ALP 升高倍数超过2 倍正常值上限,ALT 升高倍数/ALP 升高倍数≤2;(3)混合型:血清ALT 和ALP 水平同时升高,ALT/ALP 升高倍数介于2~5之间。
1.3可疑用药与肝损伤关联程度的评价根据2015年Danan等更新的RUCAM评分系统[2]进行评分,按照评分大小可分为5级:(1)>8分者,非常可能;(2)6~8分者,很可能;(3)3~5分者,可能;(4)1~2分者,不大可能;(5)≤0 分者,无关。
1.4统计学方法采用SPSS 16.0进行数据分析。
2 结果
2.1病例筛选和一般临床资料分析共收集急性药物性肝损伤住院病例369例,剔除资料不完整及诊断不达标者64例,可供实际分析的病例305例。305例临床诊断急性药物性肝损伤的病例中,男性139例,女性166例,年龄10~87岁(49.4±16.2岁),>55岁122例(40.0%),其中男性60例(19.7%),女性62例(20.3%)。2012年106例,2013年78例,2014年104例,2015年1~3月17例。与往年相比,急性药物性肝损伤的发病率有所上升[3]。
2.2急性药物性肝损伤的分型和量化评分在305例急性药物性肝损伤患者中,以肝细胞型急性药物性肝损伤最多见,胆汁淤积型和混合型少见。与胆汁淤积型和混合型相比,肝细胞型的RUCAM评分为“非常可能 ”和“很可能”两个级别的诊断例数较多,具体见表1。

表1 305例急性药物性肝损伤的分型与量化评分比较/例
2.3急性药物性肝损伤可疑用药分类统计305例急性药物性肝损伤可疑用药,发现中草药导致急性药物性肝损伤的比例接近50% ,其次为抗结核药、抗生素、抗肿瘤药,具体见表2。
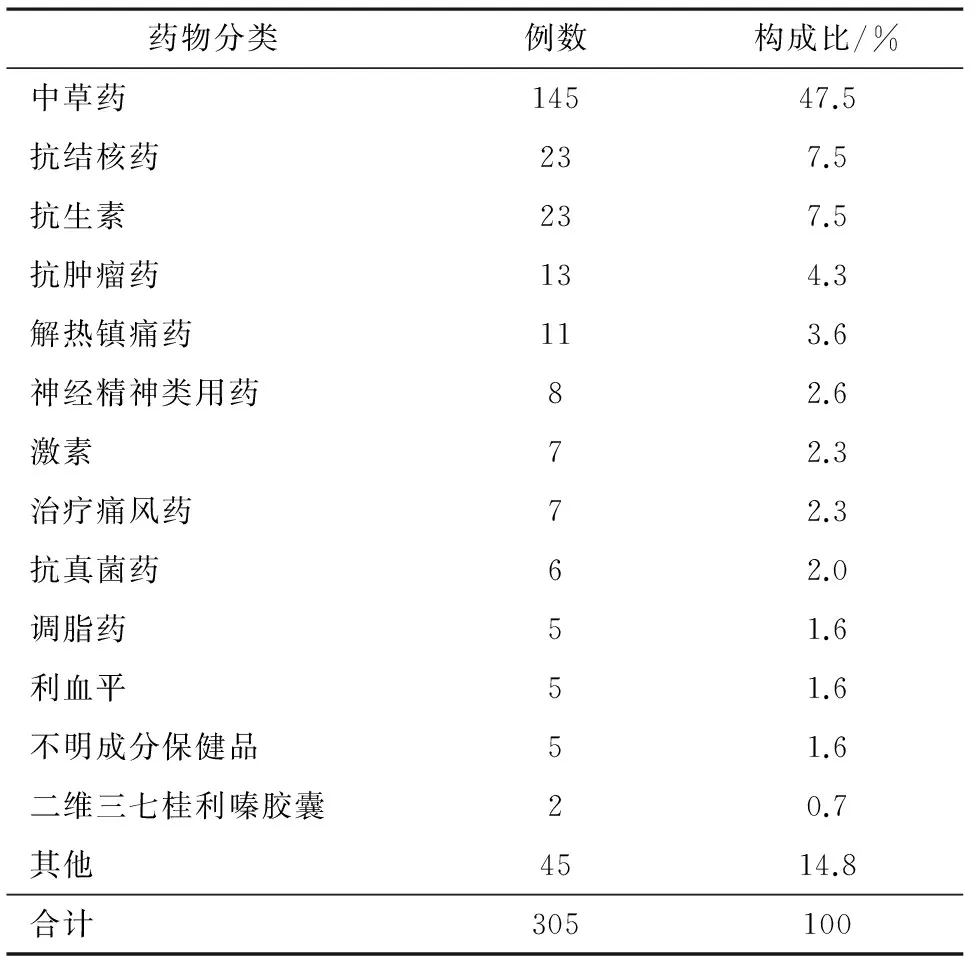
表2 305例急性肝损伤可疑用药的种类和占比
2.4导致急性药物性肝损伤的中草药种类在145例中草药导致急性药物性肝损伤的病例中,104例(71.7%)为具体药物成分不详的中草药、中成药、药酒等,41例(28.3%)已知名称或成分中药,其中,导致肝损伤为单一中药何首乌或以何首乌为主要成分的病例10例(6.9%)、仙灵骨葆胶囊5例、灵芝益寿胶囊4例、养血生发胶囊3例、土三七2例、润燥止痒胶囊2例、尿毒清颗粒2例。
3 讨论
急性药物性肝损伤是临床诊治中常见的不良反应,临床医生在用药过程中需严密监测,近年来由于临床用药种类的增加以及临床医生对药物性肝损伤的诊断敏感性和规范性增加,我院2012年、2013年和2014年的急性药物性肝损伤的发病例数都较既往有所增加[3]。其中55岁以上患者占四成,这可能与年龄大者的服药种类多、服药依从性差和自身机体生理状态不佳有关系。此外,在305例急性药物性肝损伤患者中,以肝细胞型最多见(72.5%),胆汁淤积型(11.8%)和混合型(15.7%)少见,这与国内既往统计数据相似[4]。
急性药物性肝损伤由于临床和病理表现无特殊,缺乏特异的生物标志物,因此药物性肝损伤的诊断需要临床专业知识、直觉、和适当的标准[5]。本次研究采用国际共识意见的RUCAM量化评分系统,该评分系统较客观全面,是药物性肝损伤诊治指南推荐使用的评价因果关系的方案[6]。 在这个评分系统中,包括服药至出现症状的时间、停药反应、危险因素(年龄、饮酒、妊娠)、伴随用药、非药物性肝损伤因素、药物不良反应史、再次用药反应等7个方面,根据评分大小,将药物性肝损伤的关联性评价分为5个等级。在本次调研中,评分高于8分的病例为29例(9.5%),可认为是肯定的药物性肝损伤,而评分低于3分者9例,占3.0%,可基本排除药物与肝损伤存在关联性[7]。87.5%的患者处于很可能和可能的可疑水平,这与既往的文献报道相近,说明RUCAM量化评分系统对药物与急性肝损伤的关联性评价具有较好的一致性,对临床中急性药物性肝损伤的规范化诊断有一定帮助。但RUCAM评分将HBV、HCV感染作为减分项目,事实上,HBV、HCV感染可能使机体肝脏的功能不佳,服用可疑药物后,易致肝损伤,因此,RUCAM评分仍需进一步完善。
导致急性药物性肝损伤的药物种类繁多,本次研究中,中草药最常见(47.5%),其次为抗结核药物、抗生素和抗肿瘤药。中草药的应用在我国有着悠久的历史,但大多数人对中草药的认识不足,缺乏规范化应用,它可能带来的肝毒性不可忽视。与我院既往资料相比,导致急性肝损伤的药物中中草药比例有所增加(47.5%),已超过抗结核药物,成为我院急性药物性肝损伤的首位病因[3]。其中,何首乌导致肝损伤达10例,占中草药导致肝损伤6.9%,值得关注研究。何首乌是蓼科植物何首乌的干燥块根,性苦、甘、涩、微温,其作为中药有生、制之分,生首乌有解毒、消痛、润肠通便的功效,制首乌可补肝肾、益精血、降血脂[8]。蒽醌类、二苯乙烯苷类、磷脂类是何首乌的主要化学成分,整体看,何首乌所含化学成分较为简单,且容易辨识[9]。近年来随着何首乌及其相关制剂(首乌片、首乌丸、首乌汁、首乌粉等)的广泛研发,何首乌不仅在临床上可以用于高血脂、高血压、斑秃、老年性疾病等的治疗,同时也在保健品和美容产品上有着广泛的应用,故而近年来有关何首乌的不良反应和毒性的报道也日益增多,尤其是它的肝毒性,包括肝功能异常、黄疸、药源性肝炎[9-11]。本文进一步提示,何首乌致肝损伤不良事件的发生情况和危险因素需要深入细致地分析。
[1]Chalasani NP,Hayashi PH,Bonkovsky HL,et al.ACG Clinical Guideline:the diagnosis and management of idiosyncratic drug-induced liver injury[J].Am J Gastroenterol,2014,109(7):950-966.
[2]Danan G,Teschke R.RUCAM in drug and herb induced liver injury:the update[J].International Journal of Molecular Sciences,2016,17(1):14.
[3]任晓非,许建明.急性药物性肝损伤住院病例调研分析[J].安徽医科大学学报,2007,42(4):458-460.
[4]任晓非,许建明.中药导致急性肝损伤临床研究[J].安徽医药,2015,19(10):1997-2000.
[5]Teschke R,Andrade RJ.Drug-induced liver injury:Expanding our knowledge by enlarging population analysis with prospective and scoring causality assessment[J].Gastroenterology,2015,148(7):1271-1273.
[6]中华医学会肝病学分会药物性肝病学组.药物性肝损伤诊治指南[J].中华肝脏病杂志,2015,23(11):810-820.
[7]Sierra F,Torres D.A concise and structured review of drug-induced toxic hepatic disease[J].Ann Hepatol,2004,3(1):18-25.
[8]楼招欢,吕圭源,俞静静.何首乌成分、药理和毒副作用相关的研究进展[J].浙江中医药大学学报,2014,38(4):495-500.
[9]李奇,赵奎君.何首乌的肝毒性研究进展[J].国际中医中药杂志,2012,34(8):747-750.
[10] Subramaniam A,Shanmugam MK,Ong TH,et al.Emodin inhibits growth and induces apoptosis in an orthotopic hepatocellular carcinoma model by blocking activation of STAT3[J].Br J Pharmacol,2013,170(4):807-821.
[11] 张瑞晨,张超,孙震晓,等.何首乌不同分离部位对人正常肝L02细胞和肝癌HepG2细胞的杀伤作用[J].中国中药杂志,2012,37(12):1830-1834.
A clinical research and analysis of acute drug-induced liver injury
QI Fen,REN Xiaofei,XU Jianming
(DepartmentofGastroenterology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230022,China)
ObjectiveTo judge classification and evaluate relevance of 305 cases of acute drug-induced liver injury,to discuss the cause and to provide reference for clinical doctors.MethodsThe 305 cases of drug-induced liver injury were recounted.According to the international consensus criteria to judge classification and quantitative evaluation ,we listed the suspicious drugs and evaluated their association with liver injury.ResultsAmong 305 cases with acute drug-induced liver injury,there were 221 liver cell types(72.5%),36 cholestasis types(11.8%) and 48 mixed(15.7%).According to RUCAM(Rousssel Uclaf causality assessment method) score,there were 29 cases more than 8 points(highly possible) ,181 cases 6~8 points(very possible) ,86 cases 3~5 points(possible) ,8 cases 1~2 points(unlikely) and 1 case less than 1 point(unrelated).Chinese herbal medicine is at the maximum among liver damage suspected drugs(47.5%),of which Polygonum multiflorum was the suspected drug of liver toxicity(6.9%).ConclusionsRUCAM score helps in correlative evaluation between suspicious drugs and liver injury,but there is insufficient proof.Chinese herbal medicine increases the rates of liver damage,and the liver toxicity caused by Polygonum multiflorum need further study.
Drug-induced liver injury;Drugs,chinese herbal/adverse effects;Retrospective studies
许建明,男,教授,博士生导师,研究方向:药物性肝病,E-mail:xujm1017@163.com
10.3969/j.issn.1009-6469.2016.08.054
2016-03-01,
2016-06-30)
