血友病A家系的单体型基因连锁分析
2016-10-09黄蓉曹颖郑天津赵胜科窦瑞艳洪淑贞陈靖李红智
黄蓉,曹颖,郑天津,赵胜科,窦瑞艳,洪淑贞,陈靖,李红智
1.温州医科大学 生命科学学院 浙江省医学遗传学重点实验室,浙江 温州 325035;2.温州市计划生育宣传技术指导站,浙江 温州 325000;3.温州市人口和计划生育委员会,浙江 温州 325000)
血友病A家系的单体型基因连锁分析
黄蓉1,曹颖1,郑天津2,赵胜科1,窦瑞艳1,洪淑贞2,陈靖3,李红智1
1.温州医科大学生命科学学院浙江省医学遗传学重点实验室,浙江温州325035;2.温州市计划生育宣传技术指导站,浙江 温州 325000;3.温州市人口和计划生育委员会,浙江温州325000)
目的:该研究开展温州地区血友病A(HA)家系的可变数目串联重复序列(VNTR)多态性、短串联重复序列(STR)多态性和限制性片段长度多态性(RFLP)单体型基因连锁分析,为HA遗传咨询和生育指导提供症状前、携带者基因诊断方面的依据。方法:针对HA先证者及其有关家系成员,进行单体型基因连锁分析。采用PCR检测凝血因子VI(FVI)基因外的DXS52(St14)位点的VNTR多态性,检测FVI基因外的DXS15(CA)n、DXS9901(GT)n、DXS1073(GT)n位点和内含子1(GT)n、13(CA)n、22(GT)n(AG)n、24(GT)位点的STR多态性并经毛细管电泳确证。另外采用PCR产物限制酶切检测FⅧ基因的内含子18、19、22位点的RFLP。结果:以2个HA家系为例报道研究结果。家系一先证者年幼弟弟肯定为正常人,先证者母亲、外祖母为携带者,先证者小姨肯定为携带者而其年幼儿子肯定为正常人。家系二先证者外祖母肯定不是携带者,先证者的X染色体来自外祖父,但已知外祖父不是患者,那么按照最大风险估计,母亲的那条来自外祖父的X染色体在外祖父生殖细胞中FVI基因发生了突变,因此母亲是携带者。家系二先证者年幼妹妹是携带者,将来有生育患儿的风险,但先证者大姨及其年幼女儿不是携带者。结论:该研究的HA家系的VNTR-PCR、TR-PCR和PCR/RFLP单体型基因连锁分析,特别是对症状前男孩的诊断、对未曾有患病后代的女性携带者的检出,具有非常重要的实际意义,可以为遗传咨询和生育指导提供可靠依据。
血友病A;多态性;单体型;基因连锁分析
甲型血友病(hemophilia A,HA)是由于凝血因子VI(FVI)基因缺陷引起的一种X连锁隐性遗传病,发病率约占男性的1/5 000[1]。患者常常发生自发性或外伤后出血不止,以关节出血最为多见,可能致残甚至危及生命。目前患者主要以输注FVI制品来预防和治疗出血,尚无有效的根治方法[2]。FVI基因定位于Xq28,全长186 kb,包含26个外显子和25个内含子,是一个比较庞大的基因。虽然约20%的HA是由FVI基因第22内含子的倒位引起,可通过长距离PCR直接检测,但是有近80%的HA的基因突变呈现高度异质性,迄今已发现一千多种基因突变,且散布于基因内,给直接基因诊断带来了一定的困难[3]。因此利用FVI基因内、外与之紧密连锁的多态性位点进行间接连锁分析,已成为检测携带者主要途径之一。HA携带者基因诊断是减少HA患者出生的最有效的途径之一。本研究开展温州地区HA家系的单体型连锁基因诊断,并因此开展基于HA症状前、携带者基因诊断结果的遗传咨询和生育指导。
1 材料和方法
1.1材料
1.1.1先证者家系资料:以近年由温州市计划生育宣传技术指导站登记的温州地区的2例HA先证者为例。家系一、二的HA先证者均经三甲医院鉴定,均为男性,年龄分别为12、4周岁,均有典型病史、出血症状,并经血清酶学检查(血浆凝血因子VI活性极低、活化部分凝血活酶时间很长等)证实。该2个HA家系中家系一有家族史。该2个家系均拟再育,特别希望得到足够的先证者及其母亲的基因诊断信息。
1.1.2连锁标记位点的引物:本研究采用凝血因子VI(FVI)基因外的DXS52(St14)位点的引物[4]进行可变数目串联重复序列(variable number tandem repeat,VNTR)的PCR,表示为VNTR-PCR。分别采用位于FVI基因外的DXS15(CA)n、DXS9901 (GT)n、DXS1073(GT)n和FVI基因的内含子1(GT)n、 13(CA)n、22(GT)n(AG)n、24(GT)n位点的引物[1,5-7]进行短串联重复序列(short tandem repeat,STR)的PCR,表示为STR-PCR。分别采用FVI基因的内含子18、19、22位点的引物进行PCR产物的限制性片段长度多态性(restriction fragment length polymorphism,RFLP)检测,表示为PCR/ RFLP。以上11个FVI基因连锁标记位点在X染色体上的相对位置见图1,图中F8C区域为FVI基因位置范围。以上11对引物均由上海Invitrogen公司合成。

图1 11个FVIII基因连锁标记位点在X染色体上的相对位置
1.2方法
1.2.1血液标本采集及DNA提取:采集2例HA先证者及其有关家系成员的抗凝外周血各2~4 mL,分装冻存。按照试剂盒说明书提取DNA。
1.2.2VNTR-PCR:针对DXS52位点的PCR扩增体系为25 μL:PCR mix 12.5 μL,10 μmoL/μL正向、反向引物各1 μL,DNA 2 μL(约100 ng),加水8.5 μL。扩增条件为:95 ℃变性40 s,60 ℃退火40 s,72 ℃延伸90 s,循环26次。采用1%琼脂糖凝胶电泳,5 V/cm,40 min。DXS52位点重复以约60 bp为单位,采用本研究引物在重复1、17、24、29次时的PCR产物大小分别为700、1 690、2 100、2 400 bp,PCR产物大小多态性常见范围700~3 000 bp[8]。
1.2.3STR-PCR:针对1(GT)n、13(CA)n、22(GT)n(AG)n、24(GT)n、DXS15(CA)n、DXS9901(GT)n和DXS1073(GT)n位点的PCR扩增体系均与上述VNTR-PCR体系相同。扩增条件为:95 ℃变性45 s,1(GT)n位点55 ℃/13(CA)n位点45 ℃/22(GT)n AG)n位点50 ℃/24(GT)n位点58 ℃/DXS15(CA)n位点60 ℃/DXS9901(GT)n位点62 ℃/DXS1073(GT)n位点60 ℃,退火45 s,72 ℃延伸45 s,循环35次。
1.2.4聚丙烯酰胺凝胶电泳、银染:取STR扩增产物5 μL经6%聚丙烯酰胺凝胶电泳,600 V,1 h,银染。若某女性的两条带之一与先证者的带位置相同,则该女性为携带者;若某男性的带与先证者的带位置相同,则该男性为患者。
1.2.5STR毛细管电泳测序:7个STR位点下游引物的5’端用6-FAM进行荧光标记,由杭州擎科生物技术有限公司完成STR毛细管电泳测序,检测STR扩增片段的准确大小。据报道在中国人群中该7个STR位点的重复次数范围及采用本研究引物的PCR产物大小多态性范围:1(GT)n为14~20次[7],120~132 bp;13(CA)n为14、17~27次[7,9],146~172 bp;22(GT)n(AG)n为23~29次[7],207~219 bp;24 GT)n为14~22次[7],182~198 bp;DXS15(CA)n 为15~25次[6],148~168 bp;DXS9901(GT)n为9~23次[6],186~214 bp;DXS1073(GT)n为14~24次[6],122~142 bp。
1.2.6PCR/RFLP:针对18、19、22位点的PCR扩增体系均与上述VNTR-PCR体系相同。扩增条件为:95 ℃变性45 s,18位点58 ℃/19位点55 ℃/22位点60 ℃,退火45 s,72 ℃延伸45 s,循环35次。对18、19、22位点的PCR扩增产物分别采用限制酶BclI、HindI、XbaI进行酶切。19位点酶切产物采用2%琼脂糖凝胶电泳,5 V/cm,30 min。18位点、22位点酶切产物采用6%聚丙烯酰胺凝胶在600 V电压下电泳1 h,银染。18位点PCR扩增片段长度为374 bp,经BclI酶切后长度为211 bp和163 bp,如不含BclI酶切位点则仍为374 bp。19位点PCR扩增片段长度为702 bp,内部含有2个HindI酶切位点,第一个酶切位点没有多态性,将其切成467 bp 和235 bp,第二个酶切位点有多态性,在235 bp片段的内部,将235 bp片段切成154 bp和81 bp,如不含第二个酶切位点则仍为235 bp。22位点PCR扩增片段长度为96 bp,经XbaI酶切后长度为68 bp 和28 bp,28 bp条带由于跑得太远而舍去,如不含XbaI酶切位点则仍为96 bp。
2 结果
2.1HA家系一的结果
2.1.1采用VNTR连锁分析的间接基因诊断结果:DXS52位点结果得出先证者(I1)700 bp带与先证者母亲(I3)杂合子的700 bp带一致,说明该X染色体为致病X染色体,母亲为携带者。先证者弟弟(I2)2 400 bp带与母亲杂合子的2 400 bp带一致,表明弟弟的X染色体正常。先证者小姨(I5)、母亲的两条X染色体中,致病X染色体来自先证者外祖母(I2),正常X染色体来自先证者外祖父(I1),外祖母、小姨均为携带者,外祖父正常。先证者姨表弟(I3)2 400 bp带与小姨杂合子的2 400 bp带一致,表明姨表弟的X染色体正常。见图2。

图2 HA家系一的VNTR多态性位点DXS52的PCR产物,经琼脂糖凝胶电泳后结果
2.1.2采用STR单体型连锁分析的间接基因诊断结果:a13(CA)n位点结果和DXS9901(GT)n位点结果得出先证者(I1)的带与先证者母亲(I3)两条带中下面(或上面)那条带处于同一位置,说明该X染色体为致病X染色体,母亲为携带者。先证者弟弟(I2)的带与母亲两条带中上面(或下面)那条带处于同一位置,表明弟弟的X染色体正常。先证者小姨(I5)、母亲的2条X染色体中,致病X染色体来自先证者外祖母(I2),正常X染色体来自先证者外祖父(I1),外祖母、小姨均为携带者,外祖父正常。先证者姨表弟(I3)的带与小姨的上面(或下面)那条带处于同一位置,表明姨表弟的X染色体正常。见图3。
2个位点13(CA)n、DXS9901(GT)n的毛细管电泳图,见图4。因13(CA)n位点PCR产物聚丙烯酰胺凝胶电泳带型I2、I1相同,I3、I5相同,I1、I2、I3相同,故仅示I2、I3、I2毛细管电泳结果图。13(CA)n位点I2、I1相同,片段长度为156 bp,CA重复19次; I3、I5相同,片段长度为156 bp/ 162 bp,CA重复19次/22次;I1、I2、I3相同,片段长度为162 bp,CA重复22次。因DXS9901(GT)n位点PCR产物聚丙烯酰胺凝胶电泳带型I2、I1相同,I3、I5相同,I1、I2、I3相同,故仅示I1、I3、I2毛细管电泳结果图。DXS9901(GT)n位点I2、I1相同,片段长度为198 bp,GT重复15次; I3、I5相同,片段长度为194 bp/198 bp,GT重复13次/15次;I1、I2、I3相同,片段长度为194 bp,GT重复13次。

图3 HA家系一的STR多态性位点PCR产物,经聚丙烯酰胺凝胶电泳后银染结果
2.1.3采用RFLP单体型连锁分析的间接基因诊断结果:从18位点结果、22位点结果得出先证者(I1)X染色体含有酶切位点,母亲(I3)2条X染色体中一条含有酶切位点,另一条没有酶切位点,因此可以诊断含有酶切位点的那条X染色体为致病X染色体,表明母亲是携带者。先证者弟弟(I2)的没有酶切位点,表明弟弟正常。先证者外祖母(I2)2条X染色体中一条含有酶切位点,另一条没有,先证者外祖父(I1)的没有酶切位点,表明母亲的致病X染色体来自外祖母,正常X染色体来自外祖父,可以诊断外祖母为携带者,外祖父正常。先证者小姨(I5)的2条X染色体中一条含有酶切位点的来自外祖母的致病X染色体,另一条没有酶切位点的来自外祖父的正常X染色体,小姨为携带者。先证者姨表弟(I3)的没有酶切位点,因此可以诊断为正常见图5a和图5c。
从19位点结果得出先证者(I1)X染色体含有一个酶切位点,母亲(I3)2条X染色体中一条含有一个酶切位点,另一条含有2个酶切位点,因此可以诊断含有一个酶切位点的那条X染色体为致病染色体,表明母亲是携带者。先证者弟弟(I2)的含有2个酶切位点,表明弟弟正常。先证者外祖母(I2)2条X染色体中一条含有2个酶切位点,另一条含有一个酶切位点,先证者外祖父(I1)的含有个酶切位点,表明母亲的致病X染色体来自外祖母正常X染色体来自外祖父,可以诊断外祖母为携带者,外祖父正常。先证者小姨(I5)的2条X染色体中一条含有一个酶切位点的来自外祖母的致病X染色体,另一条含有2个酶切位点的来自外祖父的正常X染色体,小姨为携带者。先证者姨表弟(I3)的含有2个酶切位点,因此可以诊断为正常。见图5b。

图4 HA家系一的2个位点13(CA)n、DXS9901(GT)n的毛细管电泳图

图5 HA家系一的RFLP位点PCR产物酶切片段,经琼脂糖凝胶电泳(b)或聚丙烯酰胺凝胶电泳后银染(a、c)
2.1.4家系一间接基因诊断结论:家系一7个成员11个位点多态性检测结果,VNTR的DXS52位点,STR 的13(CA)n、DXS9901(GT)n位点,RFLP的18、19、22位点均能提供有意义的连锁分析信息,见图6。先证者的致病X染色体来自其母亲,其母亲为携带者,年幼弟弟肯定为正常人(肯定将来没有出血风险)。先证者外祖母为携带者,先证者外祖父正常。先证者小姨肯定为携带者(尽管后代未曾有患者),先证者小姨年幼儿子肯定为正常人(肯定将来没有出血风险)。
2.2HA家系二的结果

图6 HA家系一的系谱图及1个VNTR、2个STR、3个RFLP位点单体型连锁分析
2.2.1采用VNTR连锁分析的间接基因诊断结果:单独从DXS52位点结果得出先证者(I3)1 390 bp带与先证者母亲(I5)杂合子的1 390 bp带一致,表明该X染色体为致病X染色体,母亲为携带者。母亲致病X染色体来自于先证者外祖母(I2)杂合子的1 390 bp带,外祖母也为携带者。先证者妹妹(I4)杂合子的1 390 bp带来自母亲(即致病X染色体),700 bp带来自先证者父亲(I4),表明妹妹为携带者。先证者大姨(I1)杂合子与母亲的2条带分别一致,表明大姨为携带者。先证者大姨女儿(I2)杂合子的1 390 bp带为致病X染色体,说明大姨女儿也为携带者。见图7。
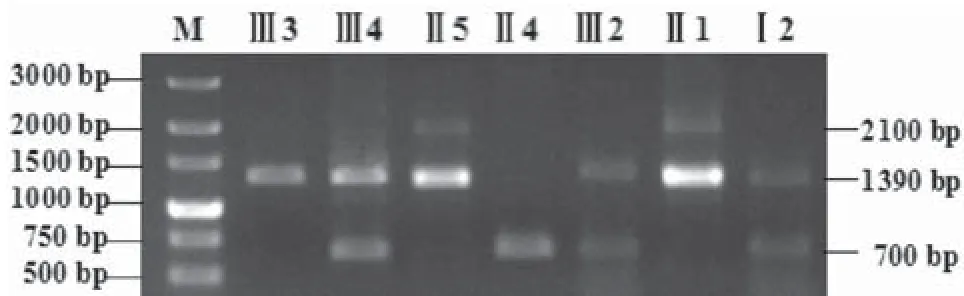
图7 HA家系二的VNTR多态性位点DXS52的PCR产物,经琼脂糖凝胶电泳后结果
2.2.2采用STR单体型连锁分析的间接基因诊断结果:从DXS9901(GT)n位点结果得出先证者(I3)的带与先证者母亲(I5)2条带中的下面那条带处于同一位置,表明该X染色体为致病X染色体,母亲为携带者。先证者妹妹(I4)的2条带中下面那条带来自母亲(即来自母亲的为致病X染色体),上面那条带来自先证者父亲(I4),表明妹妹为携带者。先证者外祖母(I2)仅一条带,与先证者大姨(I1)和母亲上面那条正常X染色体的带处于同一位置(即外祖母没有致病X染色体)。见图8。

图8 HA家系二的DXS9901(GT)n STR多态性位点PCR产物,经聚丙烯酰胺凝胶电泳后银染
DXS9901(GT)n位点的毛细管电泳图见图9。因DXS9901(GT)n位点PCR产物聚丙烯酰胺凝胶电泳带型I2、I4相同,I1、I5、I4相同,I2、I3相同,故仅示I4、I5、I3毛细管电泳结果图。DXS9901(GT)n位点I2、I4相同,片段长度为202 bp,GT重复17次;I1、I5、I4相同,片段长度为194 bp/202 bp,GT重复13次/17次;I2、I3相同,片段长度为194 bp,GT重复13次。
2.2.3采用RFLP单体型连锁分析的间接基因诊断结果:采用与2.1.3类似的酶切位点分析,从18位点结果、19位点结果、22位点结果得出先证者母亲(I5)、先证者妹妹(I4)均为携带者,先证者外祖母(I2)没有致病X染色体,先证者大姨(I1)与母亲酶切位点一致。见图10。
2.2.4家系二间接基因诊断结论:家系二7个成员11个位点多态性检测结果,VNTR的DXS52位点,STR 的DXS9901(GT)n位点,RFLP的18、19、22位点均能提供有意义的连锁分析信息,见图11。

图9 HA家系二的DXS9901(GT)n位点的毛细管电泳图
将DXS52位点与其它位点结果对照可以看出,先证者外祖父(I1)的X染色体,经先证者母亲(I5)传给先证者(I3)和先证者妹妹(I4),另外经先证者大姨(I1)传给大姨女儿(I2)。但第二代母亲、大姨在产生配子时2条同源X染色体在DXS52位点与DXS9901(GT)n位点间发生了交换,使DXS52位点与致病基因的连锁关系改变了,所以第三代DXS52位点结果不能用于致病基因连锁分析了。因为DXS52位点在本家系遗传过程中与致病基因间发生了交换,故该位点连锁分析信息不考虑。
从STR的DXS9901(GT)n位点和RFLP的18、19、22位点得出的家系二间接基因诊断结论:先证者外祖母肯定不是携带者,先证者的X染色体来自外祖父,但已知外祖父不是患者,那么按照最大风险估计,母亲的那条来自外祖父的X染色体在外祖父生殖细胞中FVI基因发生了突变,母亲是携带者,先证者年幼妹妹是携带者,将来有生育患儿的风险。但先证者舅舅、阿姨的那条来自外祖父的X染色体FVI基因一般未同样发生突变,大姨及其女儿不是携带者,二姨也不是携带者,舅舅正常。
3 讨论
针对HA的FVI基因突变,虽然一些直接基因诊断是有效准确的方法,但较繁琐费时、花费大,难以推广[10]。目前HA直接基因诊断主要是针对FVI基因第22内含子倒位采用长距离PCR(long distance PCR,LD-PCR),该方法虽方便快速敏感,但仍存在反应体系复杂、PCR扩增难度大等缺点[10]。
由于FVI基因具有显著的遗传异质性,加之其结构庞大,分子病理学改变复杂,而以现有的分子生物学手段尚不能完全查明其分子缺陷的全部类型,故对HA(除约占20%的第22内含子倒位外)直接基因诊断尚存在一定困难,因此利用FVI基因内或其旁侧与之紧密连锁的多态性位点作为遗传标志,来进行家系成员的间接基因诊断,成为HA基因诊断的主要途径之一。

图10 HA家系二的RFLP位点PCR产物酶切片段,经琼脂糖凝胶电泳(b)或聚丙烯酰胺凝胶电泳后银染(a、c)

图11 HA家系二的系谱图及1个VNTR、1个STR、3个RFLP位点单体型连锁分析
HA间接基因诊断常采用RFLP、STR、VNTR等多态性片段与致病突变位置连锁的关系及其向后代传递的规律来进行连锁分析,进而检出携带者和产前诊断。常采用的有,基因内的4个RFLP位点:BclI/内含子18[11-12]、HindI/内含子19[11-12]、XbalI/内含子22[11]、BglI/内含子25[13];基因内的2个STR多态性标记:内含子13(CA)n[7,14-15]、内含子22(GT)n(AG)n[14-15];基因外的2个VNTR或STR多态性标记:
DXS52(Stl4)[13,16]、DXS15(CA)n[13,17]。
据报道在北印度人群中内含子18(BclI)、19 (HindI)、22(XbaI)RFLP位点的杂合率分别为57%、38%、43%[11]。据报道在中国人群中内含子1(GT)n、13(CA)n、22(GT)n(AG)n和24(GT)n STR位点的杂合率分别为34.6%[7]/37.9%[15]、60.9%[18]/61.0%[15]、43.6%[7]和38.2%[7]。据报道在中国人群中基因外DXS15(CA)n、DXS9901(GT)n和DXS1073(GT)n STR位点的杂合率分别为88.24%[6]、82.35%[6]和62.0%[18]。连锁分析时需要遗传标记有一定的杂合率,在人群中提供足够的多态信息量,一般根据当地群族杂合率情况选取杂合率较高的遗传标记,联用几个遗传标记,可提高检出率。DXS52位点虽然杂合率高,信息量大,可诊断率达66.7%~81.3%[4],但在本研究涉及的11个位点中距离FVI基因最远(2厘摩),理论上与FVI基因有2%~5%的重组率,实际上我们发现在家系二中DXS52位点与FVI基因间发生了重组。由于HA基因较大,在减数分裂中基因内发生重组的可能性约为3%[6],因此应该采用多个杂合位点的结果进行单体型连锁分析,可发现HA基因内是否发生了交换及其交换发生的位置,就可能极大限度地避免因基因内交换而致错误的连锁基因诊断。
我们体会到有关HA连锁分析的关键问题的解决办法。首先是多态性位点的设计问题,尽管有的位点据文献报道很好,但应该依据实际结果情况(杂合率、重组率)决定是否调整位点设计。其次是非变性聚丙烯酰胺凝胶对片段大小微小差异的鉴别问题,理论上很好,实际上要摸索最佳条件,包括凝胶浓度、电泳的电压与时间搭配及减弱银染胶背景显色等。我们经过反复摸索,最终采用6%聚丙烯酰胺凝胶、600 V、电泳1 h。该最佳条件较一般报道的独特,使片段大小区分度达到2 bp且银染胶背景显色很浅。
本研究报道以2个HA先证者家系为例,采用1 个VNTR、7个STR和3个RFLP共11个多态性位点的单体型连锁分析,进行间接基因诊断。连锁分析可以诊断先证者家系中的其他患者,特别是早期诊断发现那些尚未有严重出血症状但在外伤后有严重出血风险的男性婴幼儿。连锁分析可以诊断哪些可能的女性携带者为肯定的女性携带者。在此基础上,对肯定的女性携带者(不仅仅是患者的母亲)的男胎进行连锁分析可以用于产前诊断。
∶
[1]HARRAWAY J R, SMITH M P, GEORGE P M. A highly informative, multiplexed assay for the indirect detection of hemophilia A using fi ve-linked microsatellites[J]. J Thromb Haemost, 2006, 4(3): 587-590.
[2]朱淼勇, 陈李, 黄瑛, 等. 血友病患者血液传播性疾病调查[J]. 温州医学院学报, 2006, 36(3): 280-282.
[3]LI W, HU X, GAO B D, et al. Mutation screening of the FVIII gene in 10 hemophilia A families[J]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi, 2011, 28(2): 127-132.
[4]YAN M, LIANG Y, CHEN X, et al. Improvement and application of DXS52(St14) in gene diagnosis of hemo-philia A[J]. Zhonghua Yi Xue Yi Chuan Xue Za Zhi, 2011, 28(1):19-22.
[5]褚玉新, 胡朝晖, 王晓春, 等. 广东地区正常人群DXS15, CA13, CA22位点多态性研究[J]. 中国实验血液学杂志, 2009, 17(6): 1569-1572.
[6]FANG Y, WANG X F, DAI J, et al. A rapid multifl uorescent polymerase chain reaction for genetic counselling in Chinese haemophilia A families[J]. Haemophilia, 2006, 12(1):62-67.
[7]LIANG Y, ZHAO Y, YAN M, et al. Prenatal diagnosis of haemophilia A in China[J]. Prenat Diagn, 2009, 29(7): 664-667.
[8]RICHARDS B, HEILIG R, OBERLE I, et al. Rapid PCR analysis of the St14 (DXS52) VNTR[J]. Nucleic Acids Res,1991, 19(8): 1944.
[9]吴朝阳, 刘木根, 盛瑞兰, 等. 中国汉族人群FVIII基因内微卫星序列的多态性研究[J]. 江苏医药杂志, 2001, 27(4): 249-250.
[10]陈淑芬, 蒋玮莹. 甲型血友病基因诊断及产前诊断的研究进展[J]. 国际遗传学杂志, 2009, 32(3): 195-198.
[11]TASLEEM R S, HUSAIN N, KUMAR A. Screening for hemophilia A carriers: utility of PCR-RFLP-based polymorphism analysis[J]. Clin Appl Thromb Hemost, 2009, 15(1):73-83.
[12]MOHARRAMI T, DERAKHSHAN S M, POURFEIZI A A,et al. Detection of hemophilia A carriers in Azeri Turkish population of Iran: Usefulness of HindIII and BclI markers [J]. Clin Appl Thromb Hemost, 2015, 21(8): 755-759.
[13]LALLOZ M R, SCHWAAB R, MCVEY J H, et al. Haemophilia A diagnosis by simultaneous analysis of two variable dinucleotide tandem repeats within the factor VIII gene[J]. Bri J Haematol, 1994, 86(4), 804-809.
[14]MACHADO F B, MEDINA-ACOSTA E. High-resolution combined linkage physical map of short tandem repeat loci on human chromosome band Xq28 for indirect haemophilia A carrier detection[J]. Haemophilia, 2009, 15(1): 297-308.
[15]MASSARO J D, WIEZEL C E, MUNIZ Y C, et al. Analysis of fi ve polymorphic DNA markers for indirect genetic diagnosis of haemophilia A in the Brazilian population[J]. Haemophilia, 2011, 17(5): e936-e943.
[16]LIU Y, WANG X, CHU H, et al. Carrier detection and prenatal diagnosis of hemophilia Alpha[J]. Chin Med J, 2002,115(7), 991-994.
[17]HE Z, CHEN J, XU S, et al. A strategy for the molecular diagnosis in hemophilia a in Chinese population[J]. Cell Biochem Biophys, 2013, 65(3): 463-472.
[18]DING Q L, LU Y L, DAI J, et al. Characterisation and validation of a novel panel of the six short tandem repeats for genetic counselling in Chinese haemophilia A pedigrees[J]. Haemophilia, 2012, 18(4): 621-625.
(本文编辑:吴彬)
Heplotype gene linkage analysis for hemophilia A families
HUANG Rong1, CAO Ying1, ZHENG Tianjin2, HAO Shengke1, DOU Ruiyan1, HONG Shuzhen2, CHEN Jing3, LI Hongzhi1. 1.School of Life Science/Zhejiang Provincial Key Laboratory of Medical Genetics, Wenzhou Medical University, Wenzhou, 325035; 2.Family Planing Publicity and Technical Guidance Station of Wenzhou City, Wenzhou, 325000; 3.Population and Family Planning Commission of Wenzhou City, Wenzhou, 325000
Objective: To develop variable number tandem repeat (VNTR) polymorphism, short tandem epeat (STR) polymorphism and restriction fragment length polymorphism (RFLP) heplotype gene linkage analyis for hemophilia A (HA) pedigrees in Wenzhou, further to provide evidences of gene prognosis of males and emale carriers for HA genetic counseling and family planning guidance. Methods: For the HA probands and elated family members, haplotype gene linkage analysis was processed. PCR was used to analyze the VNTR olymorphism in extragenic site DXS52 (St14) of clotting factor VIII (FVIII) gene, to analyze the STR polymorhism in extragenic sites DXS15 (CA)n, DXS9901 (GT)n, DXS1073 (GT)n and in intragenic sites intron 1 (GT), 13 (CA)n, 22 (GT)n (AG)n, 24 (GT)n of FVIII gene, and the STR polymorphism was identifi ed by capillary lectrophoresis. Also PCR/RFLP was used to analyze the RFLP in intragenic sites intron 18, 19 and 22 of FVIII ene. Results: The results of two HA pedigrees were taken as examples. In pedigree 1, the very young brother of roband was normal, the mother and grandmother of proband were carriers, the young aunt of proband was carier and her very young son was normal. In pedigree 2, the grandmother of proband was not carrier, the X chromosome of proband was interited from his grandfather. Since the grandfather was not HA patient, supposing the most serious situation, it was deduced that a mutation of FVIII gene had happened to the X chromosome of the mother which interited from the grandfather when it was in germ cell of grandfather, thus the mother of probandwas carrier. In pedigree 2, the very young sister of proband is carrier, and there will be risk for her sons, but the eldest aunt of proband and her very young daughter are not carriers. Conclusion: The VNTR-PCR, STR-PCR and PCR/RFLP haplotype gene linkage analysis of HA pedigrees of this study, especially the presymptomatic gene diagnosis of males, the gene diagnosis of female carriers without HA offspring, will have their very important clinical implications, can provide reliable evidences for genetic counseling and family planning guidance.
hemophilia A; polymorphism; heplotype; gene linkage analysis
R554.1
A DOI: 10.3969/j.issn.2095-9400.2016.07.003
2015-09-03
浙江省人口和计划生育科技项目(201107);温州市科技计划项目(Y20140403);温州医科大学横向
科研项目(HX1202,KJHX1318)。
黄蓉(1989-),女,湖北荆州人,硕士生。
李红智,教授,Email:lhz@wmu.edu.cn。
