糖化白蛋白酶法测定试剂研制与评价
2016-10-09连国军潘利琴李宝青陈青松
连国军,潘利琴,李宝青,陈青松
(1.温州医科大学 环境与公共卫生学院,浙江 温州 325035;2.温州市人民医院 检验科,浙江 温州325000;3.温州医科大学附属第二医院 检验科,浙江 温州 325027;4.浙江夸克生物科技有限公司,浙江 绍兴 312500)
·技术与方法·
糖化白蛋白酶法测定试剂研制与评价
连国军1,潘利琴2,李宝青3,陈青松4
(1.温州医科大学环境与公共卫生学院,浙江温州325035;2.温州市人民医院检验科,浙江温州325000;3.温州医科大学附属第二医院检验科,浙江温州325027;4.浙江夸克生物科技有限公司,浙江绍兴312500)
目的:研发糖化白蛋白(GA)酶法测定试剂并进行方法学评价。方法:利用特异性的蛋白酶(PR)在3 min内裂解GA并释放出糖化氨基酸,然后利用酮胺氧化酶进行氧化并释放出过氧化氢,过氧化氢经Trinder’s反应显色后,与同样处理的标准溶液比较求得GA含量。结果:该试剂批内、批间不精密度(CV)分别为0.84%~1.88%和1.14%~2.35%;线性范围为1.3~1 200 μmol/L,血清样本2~16倍稀释范围与原倍血清的百分偏差在99.3%~108.6%之间,平均回收率为101.8%;血清中胆红素<35 mg/dL,甘油三酯(TG)<750 mg/dL,血红蛋白<200 mg/dL,胆汁酸<8 mg/dL,尿酸<33 mg/dL,葡萄糖<1 800 mg・dL-1,维生素C 15 mg/dL,EDTA・K22.5 mg/dL,肝素钠80 U/L,枸橼酸钠8.0 mg/dL,对550 μmol/L GA的检测干扰<±5%。与日本ASAHI公司提供的GA测定试剂方法进行比较,回归方程及相关系数分别为Y=0.9991X+ 0.0809,r=0.9958;试剂置4 ℃开盖储存至少稳定30 d,置4 ℃加盖储存至少稳定12个月。结论:GA酶法测定试剂精密度良好,线性范围宽,稀释准确性满足临床需要,回收率较高,抗干扰能力较强,与进口试剂相关性好,具有推广应用价值。
糖化白蛋白;酶法检测;试剂
糖化白蛋白(glycated albumin,GA)是血清白蛋白被葡萄糖糖化之后的产物,即血清白蛋白的赖氨酸残基上的ε-氨基基团被糖化。GA半衰期较短,测定GA的浓度可有效反映患者过去2~3周内平均血糖的水平,并不受临时血糖浓度波动的影响,因此,测定GA可更灵敏、更确切地反映较短期内糖尿病的控制程度[1-4]。目前国内临床主要应用日本ASAHI公司推出的酮胺氧化酶法检测试剂进行GA含量测定,该测定试剂无需调配即可直接使用,置2~8 ℃保存可稳定12个月,但该检测试剂依赖进口、价格昂贵,限制了其在临床的进一步推广应用。本研究参考有关文献[5-7],在国内率先建立了酮胺氧化酶法测定GA的新方法,该法首选利用特异性的蛋白酶(PR)在3 min内裂解GA并释放出糖化氨基酸,然后利用酮胺氧化酶进行氧化并释放出过氧化氢,过氧化氢经Trinder’s反应显色后,与同样处理的标准溶液比较求得GA含量。依据该方法研发的液体即用型GA检测试剂,可应用于目前广泛使用的各类型全自动生化分析仪,方法快速、准确,具有临床推广应用价值,报告如下。
1 材料和方法
1.1材料 收集温州医科大学附属第二医院检验科40份健康体检者临床血液标本每份5 mL作为检测对象,并另选男女各90名体检合格成年人,年龄18~60岁,空腹静脉采血5 mL,共采集180份血清标本用于参考值测定;GA校准品:同时期收集肝功能正常,HBsAg阴性,无脂浊、黄疸、溶血的健康体检者的新鲜血清200份,混匀,3 000 r/min离心30 min,取上清,每瓶1 mL分装,冻干,使用时每瓶加去离子水1 mL复溶,用HPLC法定值[8]。试剂I:含pH 7.5 Tris-HCl 50 mmol/L缓冲液、20 KU/L PR (XXVI I)、1.0 mL/L TritonX-100、5 mmol/L CaCl2、2 g/L聚乙二醇6 000、2.0 mmol/L 4-氨基安替比林、球蛋白组分选择性蛋白酶抑制剂、适量稳定剂;试剂I I:含pH 7.5 Tris-HCl 50 mmol/L缓冲液、30 KU/L酮胺氧化酶、50 KU/L过氧化物酶、2.0 mmol/L TOOS、1.0 mL/L TritonX-100、适量稳定剂。所用试剂从上海国药采购,纯度为分析纯,水为去离子水。UV-2201紫外可见分光光度计(日本岛津株式会社),OLYMPUS AU5400全自动生化分析仪(日本OLYMPUS光学株式会社),pHS-3C酸度计(上海雷磁分析仪器厂)。
1.2方法
1.2.1全自动生化分析仪参数:反应类型:双波长终点法;波长:(主)550 nm/(次)700 nm;反应温度:37 ℃;样品5 μL加试剂I 200 μL,反应3~5 min后读取第1点吸光度A1,然后加试剂II 50 μL继续反应5 min读取第2点吸光度A2,计算ΔA=A2-A1,与标准比较后定量。计算过程由仪器自动计算完成。
1.2.2精密度评价:依据美国临床和实验室标准协会(CLSI)EP15-A2[9]文件所提供方案,用本法试剂分别测定低、中、高3份混合血清样本,1 d内连续测定20次用于计算批内不精密度(CV),每天测定1次、连续测定12 d用于计算批间CV。
1.2.3线性范围评价:用0.9%氯化钠溶液(B)和一份高浓度混合血清(H),按0.9B∶0.1H、0.8B∶0.2H、0.7B∶0.3H、0.6B∶0.4H、0.5B∶0.5H、0.4B∶0.6H、0.3B∶0.7H、0.2B∶0.8H、0.1B∶0.9H、1.0H的比例,配成10个浓度梯度的混合血清,其预期浓度按公式X=(CH×VH)/(VB+VH)进行计算。测试时按照低浓度到高浓度的顺序对每个标本各测定5次,按照CLSI EP6-A文件[10]提供的方案检查数据,以测定值为Y、预期浓度为X,绘制校准曲线,求得线性方程和相关系数r。
1.2.4最低检出限(LOD)和最低定量限(LOQ)验证:通过重复10次检测空白溶液获得的空白值和标准差s来估计LOD和LOQ。计算公式为:LOD=+3s,LOQ=+10s。
1.2.5稀释验证试验:取1份混合血清用0.9%氯化钠溶液进行1∶2、1∶4、1∶8、1∶16倍比稀释,稀释后的样本各测定5次,计算测定均值乘以稀释倍数的结果与原倍血清测定结果的Diff%。
1.2.6回收率验证:在1份已测得GA浓度的混合血清样本中分别加入低、中、高GA标准液,得到标准品混合血清工作液;另取混合血清样本和校准品加0.9%氯化钠溶液至标准品混合血清工作液同样体积,测试回收率。回收率=[(标准品混合血清工作液实测浓度-混合血清实测浓度)/校准品实测浓度]×100%。
1.2.7干扰实验:根据CLSI EP7-A2文件[11]提供的方案,将胆红素、甘油三酯(TG)、血红蛋白、胆汁酸、尿酸、葡萄糖、维生素C、EDTA・K2、肝素钠、枸橼酸钠干扰物按要求进行配制,制成含特定量干扰物的血清,含有的胆红素终浓度为35 mg/dL,TG为750 mg/dL、血红蛋白为200 mg/dL、胆汁酸为8 mg/dL、尿酸为33 mg/dL、葡萄糖为1 800 mg/ dL、维生素C 15 mg/dL、EDTA・K22.5 mg/mL、肝素钠80 U/L、枸橼酸钠8.0 mg/mL,同时以样品中加入相同体积的0.9%氯化钠溶液作基础样品,用本法试剂测定每个混合血清各3次,求均值,计算添加各干扰物后血清GA测定值与干扰物浓度为0时的Diff%,以±5%为标准判断是否存在干扰。
1.2.8方法比对试验:参考CLSI EP9-A2文件[12]提供的方案,用本法试剂和日本ASAHI公司提供的GA测定试剂分别测定100例血清标本,以本法测得的结果为X,ASAHI公司测定的结果为Y,进行线性回归,求得线性方程和相关系数r。
1.2.9试剂稳定性验证:将新配的GA测定试剂分成A、B 2组,A组在全自动生化分析仪4 ℃试剂仓中开盖储存30 d,B组在4 ℃冰箱加盖储存12个月,测定2组试剂空白管及浓度为800 μmol/L的GA标准管吸光度值、含量为(855±90.5)μmol/L的GA质控品测定值,每个样本重复测定3次,求均值,用于判断试剂稳定性。
1.3统计学处理方法 采用Excel 2003和SPSS13.0软件对数据进行统计分析。相关分析采用线性相关。P<0.05为差异有统计学意义。
2 结果
2.1精密度评价 按本法测定3份不同GA含量的混合血清标本,批内CV(每个样品用本法平行测定20次)在0.84%~1.88%之间,批间CV(每个样品用本法连续测定12 d)在1.14%~2.35%之间,精密度良好,可满足临床应用,见表1。
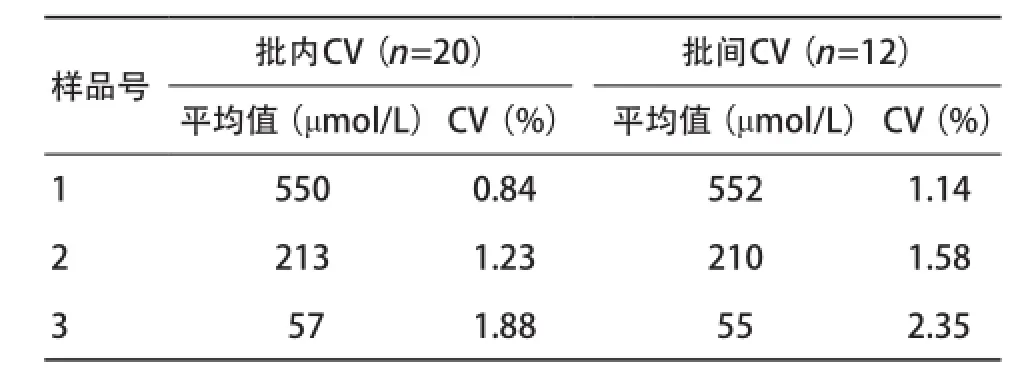
表1 血清GA检测精密度
2.2线性范围、LOD和LOQ评价结果 取浓度1 200μmol/L的标准溶液1份,按本研究所述方法进行校准曲线绘制,所得线性回归方程为Y(理论值)= 1.014X(测量值)-5.54,r=0.9999,表明线性可达1 200 μmol/L。按本研究所述LOD和LOQ评价方法,测定试剂的LOD为1.3 μmol/L,LOQ为3.8 μmol/L。2.3 稀释验证试验 取一份浓度为1 025 μmol/L的混合血清,用本研究所述方法进行稀释验证,用去离子水在2~16倍稀释范围与原倍血清的百分偏差在99.3%~108.6%之间,满足临床需要。
2.4回收率验证 取1份浓度为275 μmol/L的混合血清,加入不同量的GA标准液进行回收试验,见表2。GA检测平均回收率为101.8%。

表2 血清GA检测回收率
2.5干扰实验 用本法试剂测定含不同浓度干扰物的混合血清,以±5%为标准判断是否存在干扰,对于GA浓度为550 μmol/L的血清检测,各干扰物质的最大允许浓度为:胆红素35 mg/dL,TG 750 mg/dL、血红蛋白200 mg/dL、胆汁酸8 mg/dL、尿酸33 mg/dL、葡萄糖1 800 mg/dL、维生素C 15 mg/dL、EDTA・K22.5 mg/dL、肝素钠80 U/L、枸橼酸钠8.0 mg/dL。
2.6方法比对实验 取100例血清标本,用本法试剂和日本ASAHI公司提供的GA测定试剂分别测定,本法(X)测得的GA平均值为104.2 μmol/L(6.93 g/L),日本ASAHI公司试剂(Y)测定的GA平均值105.3 μmol/L(7.00 g/L),回归方程为Y=0.9991X+ 0.0809,r=0.9958,经t检验,两者差异无统计学意义(P>0.05)。
2.7试剂稳定性验证 按本研究所述方法进行试剂稳定性验证,见表3。2组试剂到达储存时间后,空白管及标准管吸光度值基本恒定,质控品测定值相对偏差<10%,说明本法GA测定试剂具有良好的稳定性。

表3 GA测定试剂稳定性试验
2.8 参考值 用本研究所述方法测定180名体检合格成年人(男90名,女90名,年龄18~60岁)血清GA浓度,测得结果血清GA(±s)为(85.5±14.6)μmol/L,参考范围(±2s):56.3~114.7 μmol/L。
3 讨论
糖尿病是现代疾病中的第二杀手,其对人体的危害仅次于癌症。临床诊断糖尿病的常用指标有血清(浆)葡萄糖和糖化血红蛋白A1c(HbA1c)。血清(浆)葡萄糖受饮食影响较大,很难准确反映糖尿病的控制程度,HbA1c虽受饮食影响较小,但日变化幅度小,反映过去2~3个月的总血糖水平,不能及时反映糖尿病的控制程度。GA半衰期较短,测定GA的浓度可有效反映患者过去2~3周内平均血糖的水平,并不受临时血糖浓度波动的影响。因此,GA可更灵敏、更确切地反映较短期内糖尿病的控制程度[1-4]。
在建立酶法测定GA方法学及试剂前,临床通常采用NBT法测定GSP(果糖胺)代替GA反应过去2~3周内平均血糖的水平,存在易受血清还原性物质干扰、特异性差的缺点。本研究在有关文献[5-7]的基础上,通过特异性PR和球蛋白抑制剂的使用,研发了液体型GA酶法检测试剂,该试剂精密度良好,线性范围宽,稀释准确性满足临床需要,回收率较高,抗胆红素、TG等内源性干扰物和维生素C、EDTA・K2等外源性干扰物干扰能力较强,与日本ASAHI公司提供的GA测定试剂方法进行比对,两者检测结果无显著性差异,但试剂成本仅为进口试剂销售价格的1/8左右,具有实际推广应用价值。
本研究在全自动生化分析仪上的对所研发的GA测定试剂分析性能进行了验证,测试结果表明,方法的批内CV和批间CV分别在0.84%~1.88%和1.14%~2.35%之间,GA浓度在5~1 200 μmol/L之间线性良好,用去离子水在2~16倍稀释范围与原倍血清的百分偏差在99.3%~108.6%之间,方法平均回收率为101.8%,试剂抗胆红素等物质干扰的能力较强,与ASAHI公司提供的GA测定试剂进行对比相关性好,测定试剂置4 ℃加盖保存至少稳定12个月,各项方法学指标均能满足临床需求。限于实验条件,本研究仅在全自动生化分析仪上进行了各项方法学指标测试,在不同实验室、不同分析仪上的性能与本研究结果是否相同,尚有待进一步工作确认。
[1]WARWAS M, ŻURAWSKA-PŁAKSEJ E, CIĘŻKA D, et al. Glycated albumin as a marker of glycemia in diabetes and its vascular complications[J]. Postepy Hig Med Dosw (Online), 2015, 69: 638-648.
[2]LEE J W, KIM H J, KWON Y S, et al. Serum glycated albumin as a new glycemic marker in pediatric diabetes[J]. Ann Pediatr Endocrinol Metab, 2013, 18(4): 208-213.
[3]金先富, 沈波, 王静, 等. 评价糖化白蛋白在糖尿病患者短期血糖监测中的价值[J]. 中国临床药理学杂志, 2011, 27 (4): 302-305.
[4]刘延苏, 郭红梅, 黄婉. 3 628例非糖尿病人群糖化白蛋白的检测与分析[J]. 中国卫生检验杂志, 2011, 21(3): 555-558.
[5]PARONI R, CERIOTTI F, GALANELLO R, et al. Performance characteristics and clinical utility of an enzymatic method for the measurement of glycated albumin in plasma [J]. Clin Biochem, 2007, 40(18): 1398-1405.
[6]KOUZUMA T, USAMI T, YAMAKOSHI M, et al. An enzymatic method for the measurement of glycated albumin in biological samples[J]. Clin Chim Acta, 2002, 324(1-2): 61-71.
[7]KOUZUMA T, UEMASTU Y, USAMI T, el al. Study of glycated amino acid elimination reaction for an improved enzymatic glycated albumin measurement method[J]. Clin Chim Acta, 2004, 346(2): 135-143.
[8]SHIMA K, ITO N, ABE F, et al. High-performance liquid chromatographic assay of serum glycated albumin[J]. Diabetologia, 1988, 31(8): 627-631.
[9]CLSI. User demonstration of performance for precision and trueness, Approved Guideline-Second Editon[S]. CLSI document EP15-A2. Wayne, PA: CLSI, 2008.
[10]CLSI. Evaluation of the linearity of quantitative measurement procedures[S]. CLSI document EP6-A. Wayne, PA:CLSI, 2003.
[11]CLSI. Interference testing in clinical chemistry, Approved-Guideline[S]. CLSI document EP7-A2. Wayne, PA: CLSI,2005.
[12]CLSI. Method comparison and bias estimation using patient samples[S]. CLSI document EP9-A2. Wayne, PA: CLSI,2002.
(本文编辑:赵翠翠,丁敏娇)
The development and evaluation of glycated albumin enzymatic determination reagent
LIAN GuojunPAN Liqin2, LI Baoqing3, CHEN Qingsong4.1, 1.School of Environmental Science and Public Health, Wenzhou Medical University, Wenzhou, 325035; 2.Department of Laboratory Tests, the Wenzhou People’s Hospitol, Wenzhou, 325000; 3.Department of Laboratory Tests, the Second Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325027; 4.Zhejiang Kuake Bioscience Co.Ltd, Shaoxing, 312500
Objective: To develop and evaluate the serum glycated albumin enzymatic determination reagent. Methods: The analysis was based on the fact that the glycated albumin glycated albumin was hydrolyzed to glycated amino acids by special proteinase digestion, and glycated amino acids were oxidized to produce hydrogen peroxide, which was quantitatively measured through the Trinder's chromogenic reaction, compared with the same treatment of the standard solution. Results: The within-run and between-run CVs of this reagent were 0.84%~1.88% and 1.14%~2.35%, respectively; the method was liner in the range of 1.3~1 200 μmol·L-1, percent deviation of the measured results of diluted serum samples diluted by 2 to 16 times compared to the results of the original samples ranged from 99.3%~108.6%, the average rate of recovery was 101.8%; No signifi cant interference (bias%≤±5%) was found in the test of 550 μmol·L-1GA analysis when bilirubin <35 mg·dL-1, triglyceride<750 mg·dL-1, hemoglobin <200 mg·dL-1, bile acid <8 mg·dL-1, uric acid <33 mg·dL-1,glucose <1800 mg·dL-1, Vitamin C <15 mg·dL-1, EDTA·K2<2.5 mg·mL-1, Heparin Sodium <80 U·L-1, Sodium citrate <8.0 mg·mL-1. Comparing this methods (Y) with the ASAHI method (X), the regression equations is Y=0.9991X+0.0809, r=0.9958. The reagent was stable at least 30 days when it was open cover stored and at least 12 months when it was sealed stored at 4 ℃. Conclusion: This reagent shows high precision, wide linear range,and the dilution accuracy can meet the clinical needs. It also shows high recovery, good anti-interference capability, good correlation with imported reagent, and suitable for clinical application.
glycated albumin; enzymatic determination; reagent
R446
B DOI: 10.3969/j.issn.2095-9400.2016.07.011
2015-05-12
浙江省科技厅公益技术研究社会发展项目(2013C33240)。
连国军(1976-),男,浙江上虞人,副教授。
