2019新型冠状病毒S蛋白可能存在Furin蛋白酶切位点
2020-07-09段广有施劲松陈嘉源陈舜梅阮吉寿
李 鑫,段广有,张 伟,施劲松,陈嘉源,陈舜梅,高 山**,阮吉寿**
(1.南开大学 数学科学学院, 天津 300071;2.南开大学 生命科学学院, 天津 300071;3.齐鲁师范学院 生命科学学院,济南 250200;4.东部战区总医院, 南京 210016;5.昆明医科大学 分子临床医学研究院,昆明 650500)
2019年12月,中国武汉报道了2019新型冠状病毒(2019 novel Coronavirus,2019-nCoV)引起的肺炎。基于2019-nCoV的基因组信息和公开的临床数据,我们发现[1]:(1)2019-nCoV与严重急性呼吸综合征(Severe Acute Respiratory Syndrome, SARS)冠状病毒(SARS Coronavirus, SARS-CoV)同属Beta冠状病毒B亚群(BB冠状病毒),但两种病毒差异较大,这一结果与两者临床症状差异一致;(2)与SARS冠状病毒相比,2019-nCoV虽然毒力较弱,但传播力更强;(3)溯源分析的结果支持2019-nCoV源自蝙蝠;(4)BB冠状病毒存在大量的可变翻译,而且具有变异快、多样性高的特点。
已知多种RNA病毒都要通过自身的膜融合蛋白与靶细胞结合(膜融合)从而进入细胞。其中,SARS冠状病毒S蛋白(Spike protein)、HIV包膜糖蛋白(Envelope glycoprotein, Env)、埃博拉病毒糖蛋白(Glycoprotein,GP)和流感病毒血凝素(Hemagglutinin,HA)等属于I类膜融合蛋白[2]。比较HIV病毒与SARS冠状病毒,相同之处有:都是包膜病毒,都可以通过膜融合途径(各自的其它途径不做进一步讨论)进入细胞,都需要其膜融合蛋白被细胞蛋白酶切割,分割为受体结合结构域和膜融合结构域。两种病毒的不同之处在于:HIV病毒的gp160在细胞内包装过程中被Furin蛋白酶切割,分泌出的病毒颗粒表面的gp120(负责与受体结合)和gp41(负责膜融合)是分开的两个亚基;而SARS冠状病毒分泌出的病毒颗粒表面的S蛋白(Spike Protein)中的S1(负责与受体结合)和S2(负责膜融合)仍是融合状态。SARS冠状病毒通过两种方式侵染宿主细胞,在细胞表面有蛋白酶(如胰蛋白酶Trypsin)时,S蛋白被切割成为S1和S2两个亚基,进而与宿主细胞膜融合进入细胞;否则,SARS冠状病毒通过胞吞途径进入宿主细胞,而后S蛋白被溶酶体内的组织蛋白酶切割(不再进一步讨论)。研究显示前一种方式(直接膜融合)的侵染效率是后者的约100到1 000倍[3]。除了鼠肝炎冠状病毒(The Mouse Hepatitis coronavirus, MHV)等少数外,SARS等其它大部分Beta冠状病毒的S1与S2之间的交界区(Junctional region)没有被Furin蛋白酶切割的位点(Cleavage site),即Furin蛋白酶切位点。
有关SARS冠状病毒感染过程中的很多机制尚不明确,因此不能为药物、疫苗和抗体开发等应用提供更多信息。基于大量基因组数据的比较研究,特别是针对S蛋白区域的变异研究,不仅可以有助于深入了解BB冠状病毒的感染机制,而且有助于揭示2019-nCoV感染的特点,为病毒防控以及治疗奠定基础。本研究在前期工作基础上,无意间发现了2019-nCoV的S蛋白可能存在Furin蛋白酶切位点。这一发现暗示了2019-nCoV可能在感染机制上与SARS冠状病毒有较大差异,转而与HIV等其它病毒的感染机制更相似。不同病毒采取相同的感染机制,提示了治疗相关病毒(例如HIV)的大量药物都可以考虑以“老药新用”的方式进行组合,与免疫抑制剂等联合用药,以提高治疗效果。
1 数据与方法
在前期研究中,我们共使用13条BB冠状病毒基因组序列,(GenBank: JX993987、JX993988、GQ153539、GQ153540、GQ153542、DQ071615、DQ412042、DQ412043、AY515512、AY572034、AY274119、MN908947和MG772934)。在本研究中,13条序列根据其宿主分为五组,用于进一步研究,这五组命名为SARS(AY274119)、果子狸(AY515512和AY572034)、2019-nCoV(MN908947)、来自浙江舟山的蝙蝠群体(MG772934)和其它蝙蝠群体(MG772934之外8条来自蝙蝠的序列)。在本研究中,序列多重比对使用在线软件ClustalW2,数据处理、统计与作图使用软件R v2.15.3[4],蛋白质二级结构预测使用软件PSIPRED v4.0[5],所有参数采用默认值。密码子偏好性分析使用NCBI GenBank数据库(截止2019年12月12日)中符合物种(灵长类、脊椎动物、哺乳动物和啮齿动物任何一个)的数据,去除密码子数少于5 000的物种,再加上2019-nCoV和蝙蝠冠状病毒两大类数据。密码子偏好性分析中,密码子相对使用频率(以下简称相对频率)指的是一个密码子使用次数占其对应氨基酸所有密码子使用次数和的百分比。
2 结果与分析
使用NCBI工具Blast,比对2019-nCoV(MN908947)与SARS冠状病毒(AY274119)之间S1和S2核酸序列之间同一度(Identity),结果显示S1在两种病毒之间同一度是66.4%,而S2是80.1%,两个同一度差异很大。于是观察S1与S2之间的交界区的氨基酸序列,无意间发现了“RRAR”序列(见图1A),该序列符合Furin酶切位点的识别模式“RXXR”[6]。比对2019-nCoV与SARS之间交界区的核酸序列,发现变异来源是插入了12个碱基,最重要的插入是“CGGCGG”(见图1B)。将以“CGGCGG”为中心向5'和3'端各扩展15 bp得到的序列比对到NCBI NT数据库,发现“CGGCGG”也有可能来自细菌。因此,必须通过以下方式排除“CGGCGG”来自测序或拼接错误:(1)检索NCBI Genbank数据库,找到三条以上已提交的2019-nCoV基因组序列支持“CGGCGG”;(2)检索NCBI Genbank数据库,从所有的Beta冠状病毒(2019-nCoV除外)的S蛋白的交界区中搜索“RRAR”模式,发现只有在鼠肝炎等少数冠状病毒中存在Furin酶切位点,而在所有SARS和SARS样冠状病毒中都不存在Furin酶切位点;(3)通过蛋白质二级结构预测确定“RRAR”未参与折叠配对。最后,使用华大基因公开的148条2019-nCoV基因组序列确定了所有2019-nCoV的S蛋白都包括完全一样的Furin酶切位点。
基于以上结果,2019-nCoV的S蛋白可能因为突变引入了Furin蛋白酶切位点,其感染机制可能与鼠肝炎冠状病毒的感染机制更相似,而不同于SARS等其它大部分Beta冠状病毒。前期实验结果表明,鼠肝炎冠状病毒的S蛋白在细胞内包装过程中可被Furin样(Furin-like)蛋白酶切割,从而分泌出S1和S2呈非融合状态的病毒颗粒[7]。另一方面,2019-nCoV的S蛋白中新增的“RRAR”中最后一个R恰好对应SARS冠状病毒S蛋白中的一个胰蛋白酶切位点R667(图1A),而SARS冠状病毒S蛋白中的另外一个胰蛋白酶切位点R797(相比R667更主要)在2019-nCoV的S蛋白中对应R815。另外,R667恰好对应鼠肝炎冠状病毒S蛋白中的Furin酶切位点。有实验表明如果在SARS冠状病毒S蛋白的交界区的R667或R797[8]人为加入Furin酶切位点,可以增强S蛋白的膜融合能力。2019-nCoV同时具备Furin(R685)和胰蛋白酶切位点(R815),分别对应SARS冠状病毒的胰蛋白酶切位点(R667和R797)。这种改变将使2019-nCoV更多地通过直接膜融合的方式侵染细胞,故进入细胞的效率更高。
在第I类膜融合蛋白中,HIV(GenBank: NC_001802.1)的gp160和埃博拉病毒(GenBank: NC_002549.1)GP的Furin酶切位点分别是“REKR”和“RKIR”,而鼠肝炎冠状病毒的Furin酶切位点是“RRARR”。总体上,SARS等Beta冠状病毒与具有Furin酶切位点的其它病毒的感染机制不同。作为一个意外发现,一些流感病毒的HA也可以通过突变获得一个Furin蛋白酶切位点,而且这些流感病毒大部分是禽流感(见表1)。综合分析NCBI GenBank全库的Beta冠状病毒、HIV、埃博拉病毒和流感病毒中的Furin酶切位点后,我们推断Furin酶切位点对病毒感染等生物学功能产生较大影响,后续研究将有助于我们提高对这几类病毒的膜融合蛋白功能以及病毒膜融合机制的认识,也有助于我们对Beta冠状病毒的感染机制的深入研究。

图1 2019新型冠状病毒S蛋白可能存在Furin蛋白酶切位点Fig.1 A furin cleavage site is discovered in the S protein of the 2019 novel coronavirus
注:13条序列根据其宿主分为五组用于进一步研究,这五组命名为SARS(AY274119)、果子狸(AY515512和AY572034)、2019-nCoV(MN908947)、来自浙江舟山的蝙蝠群体(MG772934)和其它蝙蝠群体(MG772934之外8条来自蝙蝠的序列).(a) 这里显示的是S1(上游)与S2(下游)之间的交界区的部分氨基酸序列:“RRAR”序列(红色方框内)符合Furin酶切位点的识别模式“RXXR”;蛋白质二级结构预测使用MN908947,H代表螺旋结构helix,E代表折叠结构strand,C代表无规卷曲结构coil.(b)插入的一段核酸序列(红色方框内)与“RRAR”序列对应.
Notes:13 virus genomes were clustered into 5 groups according to their hosts. These 5 groups were named SARS (AY274119), civet (AY515512 and AY572034), 2019-nCoV (MN908947), Zhejiang bat (MG772934) and other bat (the other 8 virus genomes). A. The amino acid sequences of junctional regions between S1 (upstream) and S2 (downstream), the “RRAR” sequence (in red box) was recognized as a furin recognition sequence “RXXR”, MN908947 was used to predict the protein secondary structure, where H stands for the helix, E stands for the strand, and C stands for the coil. B. The nucleotide sequence of the insertion (in red box) corresponds to “RRAR”.
由于“CGGCGG”含有两个精氨酸R的密码子“CGG”,我们重点关注“CGG”在精氨酸R的六个密码子(CGG、CGA、CGC、CGT、AGA和AGG)中的相对频率(见数据与方法)。人的“CGG”相对频率(1.94%)远远低于蝙蝠(21.55%),因此,可以肯定的是“CGGCGG”是传播到人之前形成的;又发现“CGG”相对频率从云南蝙蝠(自然宿主)携带的冠装病毒(2.59%)到2019-nCoV(3.14%)有升高趋势,因此推断中间宿主应该来自一个“CGG”相对频率更高(起码高于蝙蝠)的动物。我们计算了大量哺乳动物的“CGG”相对频率(可通过Email索取附表1),使用我们提供的“CGG”相对频率表结合2019-nCoV检测阳性的动物样品信息或华南海鲜市场进货名单可以准确地确定2019-nCoV的中间宿主。在“CGG”相对频率表中,排名前十位动物印度花豹(Panthera pardus fusca)、黑麂(Muntiacus crinifrons)、林麝(Moschus berezovskii)、小麂(Muntiacus reevesi)、纹鼠(Rhabdomys pumilio)、大山雀(Parus major)、下袍鼠(Delomys sublineatus)、敏狐(Vulpes macrotis),小嘴乌鸦(Corvus corone orientalis)和地中海雅鳕(Lepidion lepidion)的“CGG”相对频率分别是58.64%、57.02%、50.21%、47.03%、46.44%、45.81%、45.22%、44.40%,43.33%和43.05%。总体来说,鹿、狐和鼠成为中间宿主的可能性最大。另外,水貂(Mustela vison)[9]、果子狸(Paguma larvata),穿山甲(Manis pentadactyla)和蛇(Bungarus multicinctus)[10]的“CGG”相对频率分别是17.95%、17.09%,13.89%和11.28%,这些动物成为中间宿主的可能性依次越来越小。我们的研究还发现,在鼠肝炎冠状病毒的Furin酶切位点“RRARR”中,四个精氨酸R的密码子(“CGA”、“CGC”,“CGT”和“AGA”)的相对频率无显著差异,显然没有受到选择压力;而禽流感病毒Furin酶切位点(见表1)中精氨酸R偏好使用密码子“AGA”,这恰好与禽类宿主“AGA”相对频率高对应。因此,我们提出中间宿主必须满足的条件是从该动物提取的病毒的S蛋白应该含有Furin酶切位点和密码子“CGG”。
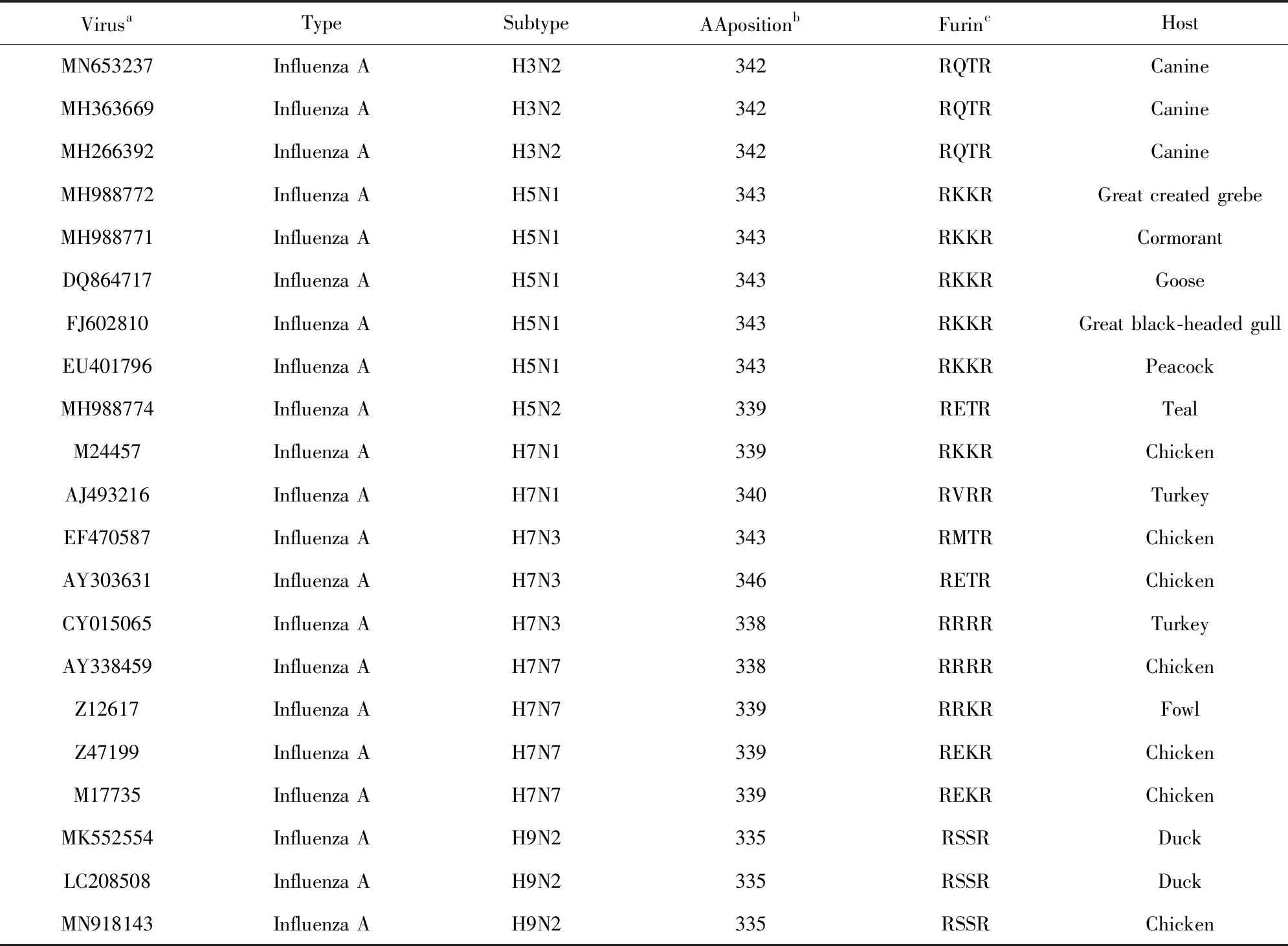
表1 流感病毒获得Furin酶切位点Table 1 Furin cleavage sites in influenza viruses
注:第1列使用NCBI GenBank数据库的Accession Number;第4列是Furin酶切位点在氨基酸序列中的位置;第5列是Furin酶切位点的序列.
Notes: (a)The Accession Numbers in the NCBI GenBank database.(b)The positions of cleavage sites for furin enzyme. (c)The sequences of cleavage sites for furin enzyme.
3 结 论
1)2019-nCoV的S蛋白可能存在Furin蛋白酶切位点,从而导致2019-nCoV的感染机制不同于SARS等大部分Beta冠状病毒,而与鼠肝炎冠状病毒、HIV、埃博拉病毒和一些禽流感病毒的感染机制更相似;
2)由于感染机制的改变,2019-nCoV获得了更高的进入细胞的效率,这可能是其传播能力大于SARS冠状病毒的一个原因;
3)一些禽流感病毒也可以通过突变获得一个Furin蛋白酶切位点,这说明自然突变可以引入Furin酶切位点;
4)包含“CGGCGG”的插入突变是传播到人之前形成的,2019-nCoV的中间宿主应该来自一个“CGG”相对频率更高的动物,特别是鹿、狐和鼠;
5)我们提出中间宿主必须满足的条件是从该动物提取的病毒的S蛋白应该含有Furin酶切位点和密码子“CGG”;
6)使用我们提供的“CGG”相对频率表结合2019-nCoV检测阳性的动物样品信息可以准确地确定2019-nCoV的中间宿主。
4 讨 论
不同病毒采取相同的感染机制,提示了现有的大量抗病毒药物(特别是抗鼠肝炎冠状病毒、HIV、埃博拉病毒和禽流感的)都可以考虑以“老药新用”的方式进行组合,与免疫抑制剂等联合用药,以提高治疗效果。在已有抗病毒药物中,有以病毒蛋白(如RNA合成酶)为靶点的药物,也有以宿主(人)蛋白为靶点(如Furin蛋白酶)的药物。根据BB冠状病毒变异快的特点,南开大学阮吉寿等提出同时考虑以宿主(人)蛋白为靶点进行药物筛选或设计,这样可以有效规避病毒变异的影响。我们根据天津中医药大学第一附属医院的心衰治疗数据,选定了一组治疗心衰的药物组合,可以很好地抑制Furin蛋白酶活性,同时副作用较小。下一步的研究还应该考虑从病毒和宿主细胞膜融合角度对2019-nCoV、鼠肝炎冠状病毒、流感、HIV和埃博拉病毒进行比较研究,找到膜融合的共性与差异,从干扰膜融合角度进行药物设计。
致谢:感谢南开大学生命科学学院陈佺、孔德领、卜文俊、张涛、黄大卫、刘燕强、赵强和贺秉军等各位老师对我们生物信息学研究的长期支持。感谢河北师范大学宣益波等同学为本文章所做的公益性劳动。感谢深圳华大基因科技有限公司公开2019-nCoV基因组序列用于验证我们结果的可靠性。
此论文于2020年1月24日提交到https://www.researchgate.net/publication/338804501_A_furin_cleavage_site_was_discovered_in_the_S_protein_of_the_2019_novel_coronavirus。同时,此论文于1月27日通过了中科院预印本平台的审核http://www.chinaxiv.org/abs/202002.00004v1。