粤北地区规模化猪场蓝耳病抗体水平及其与病毒血症关系的初步研究
2016-10-08吴静波黄健强南文金胡鸿惠彭国良韶关学院广东省粤北生猪生产及疫病防控协同创新发展中心广东韶关512005
吴静波,黄健强,南文金,胡鸿惠,彭国良(韶关学院/广东省粤北生猪生产及疫病防控协同创新发展中心,广东 韶关 512005)
粤北地区规模化猪场蓝耳病抗体水平及其与病毒血症关系的初步研究
吴静波,黄健强,南文金,胡鸿惠,彭国良
(韶关学院/广东省粤北生猪生产及疫病防控协同创新发展中心,广东 韶关 512005)
蓝耳病是全球生猪规模化养殖场所面临的共同难题,现仍缺少有效的治疗药物,而疫苗免疫是控制该病最为有效的手段。为了解粤北地区规模化猪场的蓝耳病抗体水平,对该地区4家猪场382份血清样品进行ELISA检测,并设计荧光定量RT-PCR方法对血清中的病毒RNA进行检测,以初步探讨猪群抗体水平与病毒血症的关系。结果显示:粤北地区规模化猪场的蓝耳病抗体阳性率为82.9%,平均S/P值为1.59;但抗体水平离散度较大,4家猪场抗体水平的变异系数均高于25%。经灵敏度为10-1.5TCID50/mL的荧光定量RT-PCR方法检测显示,猪群病毒血症发生率为12.4%,其中抗体水平不稳定群中病毒血症发生率为16.7%,明显高于抗体稳定群的7.3%。研究表明,粤北地区地区抗体阳性率和抗体效价较高,但均一性差,蓝耳病发病的可能性较大;同时抗体不稳定猪群出现病毒血症的概率更高。
蓝耳病;PRRSV;抗体水平;病毒血症
吴静波,黄健强,南文金,等. 粤北地区规模化猪场蓝耳病抗体水平及其与病毒血症关系的初步研究[J].广东农业科学,2016,43(8):143-150.
猪呼吸道与繁殖综合征(PRRS)又称蓝耳病,是由猪呼吸道与繁殖综合征病毒(PRRSV)引起的一种严重危害生猪养殖业的急性、高度传染性疾病,主要引起发热、母猪繁殖障碍、早产、流产、死胎、木乃伊胎及仔猪呼吸综合征等临床症状,母猪流产率可达40%,仔猪病死率高达50%以上,是目前造成生猪生产损失最严重的疾病之一[1-3]。
由于PRRS缺少有效的治疗药物,并且存在高度变异、免疫逃避和持续感染等因素,使得猪场一旦感染PRRSV就很难完全清除[4-7]。目前控制PRRS发生的方法主要有优化管理、扑杀感染猪、生物隔离和接种疫苗,其中定期对猪群进行疫苗免疫仍然是控制该病传播最有效的手段。当前我国市场上商品化的蓝耳病疫苗包括灭活疫苗和弱毒疫苗两类,灭活疫苗安全但是抗体产生慢,免疫效率低;弱毒疫苗虽有毒力并可引起流产等症状,但抗体产生快,效价高且持续时间持久,能有效降低疾病的严重性、缩短毒血症时间、减低继发感染几率。因此大部分猪场偏好免疫弱毒苗用于蓝耳病防控[8-9]。但是随着近年弱毒疫苗的大量使用和混用,使得蓝耳病疫情越来越复杂[10]。从我们近几年对蓝耳抗体的检测数据来看,虽然猪场抗体阳性率和抗体水平不断上升,但抗体的整齐性却越来越差,异常的抗体水平越来越多。其中,低水平抗体可能因抗体依赖增强作用(ADE)反而有利于病毒生长[11],而异常高的抗体水平有可能是疫苗引起的病毒血症或者野毒感染,因此异常抗体水平给猪群带来的保护力并不明确。
最近几年,粤北地区蓝耳病的防控形势也越来越严峻,多种弱毒疫苗的混用和不规范引种导致部分猪场病毒株群越来越复杂。为进一步了解目前形势下粤北地区蓝耳病抗体水平,本研究对该地区的4个猪场328份样品进行蓝耳病抗体ELISA检测,并构建高灵敏度的荧光定量RT-PCR方法对其中121份样品进行蓝耳病病原RNA的定量检测,初步分析蓝耳病抗体水平与病毒血症的关系。
1 材料与方法
1.1血清样品的采集及处理
2014年12月至2015年12月,我们在对猪场抗体水平的常规监测中,采集了粤北地区4家规模化猪场共328头猪的上腔静脉血,包括208头种猪和120头仔猪,具体采集情况如表1所示。静脉血采集后室温静置1 h释出血清,然后冷藏运输回实验室,10 000 r/min离心分离血清。将血清分为两部分,一部分进行ELISA检测,一部分进行病毒RNA提取,用于病原RTPCR检测。在检测抗体的同时,我们还对猪场的疫苗免疫、生产和发病情况进行调查,具体情况如表1所示。
1.2抗体水平的ELISA检测
使用PRRSV抗体检测试剂盒(美国IEDXX公司)对抗体水平进行ELISA检测,该试剂盒只检测针对PRRSV核衣壳蛋白(N蛋白)的抗体。实验操作严格按照说明书进行。在阴阳性对照成立的前提下,如果S/P值<0.4,样品判定为PRRSV抗体阴性;如果S/P值≥0.4,样品判定为PRRS抗体阳性。
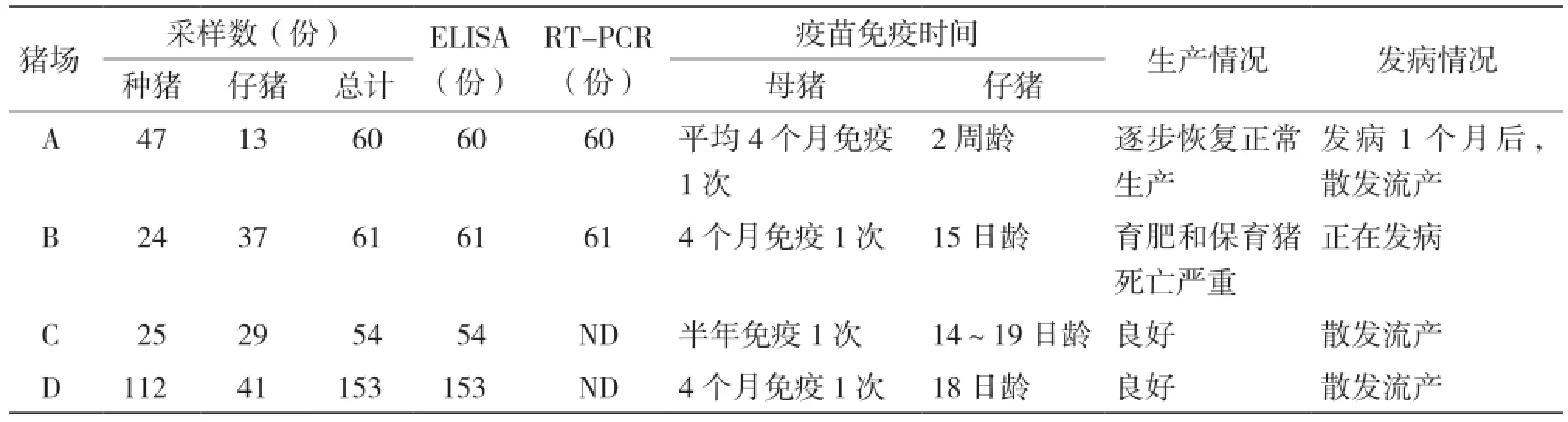
表1 4个规模化猪场基本情况和采样信息
1.3RNA提取
采用RNAiso Plus试剂〔Code No.:9108Q,宝生物工程(大连)有限公司〕进行病毒RNA提取,实验操作要按照说明书进行。所提取的RNA于-70℃下保存备用。
1.4荧光定量RT-PCR的引物探针设计及扩增条件
PRRSV的膜基质蛋白(M蛋白)基因序列在所有毒株中呈高度保守。我们对10株经典株和10株高致病株的M蛋白基因进行多重比对,以高致病株JXA1的基因组序列(GenBank登录号:EF112445)为参考序列在M蛋白基因的保守区内设计引物和探针,引物和探针序列信息如表2所示,使用FAM发光基团和BHQ1淬灭基团标记探针两端。使用MAGA 5.1和Oligo 7进行多重比对和引物探针设计,引物探针由宝生物工程(大连)有限公司合成。
荧光定量RT-PCR扩增使用ABI 7 500荧光定量RT-PCR系统进行扩增和分析,以One Step PrimeScript™ RT -PCR Kit (Perfect Real Time)〔Code No.:RR064A,宝生物工程(大连)有限公司〕作为检测试剂。扩增体系20 μL,包括10 μL One Step RT-RT-PCR Buffer (2×)、0.4 μL Ex Taq HS(5 U/μL),0.4 μL PrimeScript RT Enzyme Mix,0.5 μL引物(10 μmol/L)和探针(5μmol/L)、2 μL RNA模板、0.4 μL ROX Reference Dye(50×),无RNA酶水补至25 μL。扩增条件:42℃逆转录30 min,94℃灭活逆转录酶和预变性2 min;94℃变性5 s、60℃退火和延伸35 s,40个循环,并收集荧光。
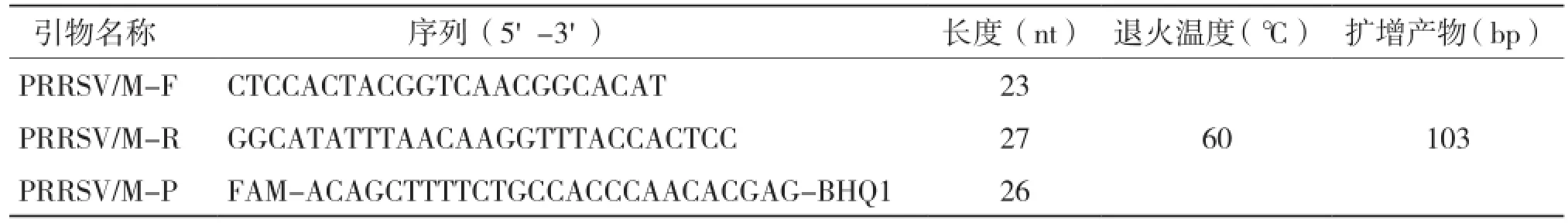
表2 引物探针序列
1.5荧光定量RT-PCR的特异性和灵敏度检测
用我们建立的方法对多个病毒(HPPRRSV、经典PRRSV、JEV、CSFV、PCV、PRV、TGEV、PEDV、ProV)的RNA/DNA进行检测,以验证本方法的特异性。病毒来源:猪圆环病毒为本实验室分离保存;高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)购自广东大华农动物保健品股份有限公司;猪乙型脑炎活疫苗(SA-14-14-2株)、猪瘟活疫苗(CVCC AV1412)、猪伪狂犬活疫苗(HB-98株)购自武汉科前生物制品有限公司;猪繁殖与呼吸综合征疫苗(CH-1R株)和猪传染性胃肠炎、猪流行性腹泻、猪轮状病毒三联活疫苗(弱毒华毒株+弱毒CV777株+NX株)购自哈尔滨维科生物技术开发公司。
将提取的HP-PRRSV JXA1-R株的RNA进行10倍梯度稀释作为标准品,根据病毒的原始滴度计算,梯度稀释后的浓度为1×105.5~1× 10-1.5TCID50/mL。使用我们建立的方法对稀释好的标准品进行扩增,每个梯度3个复孔,检测方法的灵敏度并绘制标准曲线,计算相关系数和扩增效率。
1.6抗体水平与病毒血症关系分析
提取A和B猪场121份血清的病毒RNA作为模板,用我们建立的荧光定量RT-PCR方法进行检测,记录样品携带PRRSV的情况,并根据标准曲线计算阳性样品中含有的PRRSV滴度。结合样品的ELISA和病原RT-PCR结果,分析不同S/P值区间内样品RT-PCR阳性率、RT-PCR阳性样品的S/P值大小分布及样品携带病毒量对S/P值大小的影响,初步探讨抗体水平与病毒血症的相关性。
2 结果与分析
2.1抗体水平检测结果
4个猪场328份血清的抗体S/P值情况如图1所示。从图1可以看见,4个猪场样品S/P值的离散度较大,表明抗体水平的均一性较差。从表3可知,4个猪场总的抗体阳性率为82.9%,各猪场的总体抗体阳性率都达到80%以上,但A猪场仔猪群的抗体阳性率只有38.5%。4个猪场的平均S/P值均大于0.8,总体平均S/P值达到1.59,处于一个较高的水平;25.4%的抗体阳性样品的S/P值>2.5,其中A猪场种猪群的平均值达到2.82,63.8%的样品S/P值>2.5,最高S/P值甚至达到4.243。检测显示4个猪场抗体水平的变异系数均高于25%,最低和最高值均出现在A猪场,分别是种猪群的32.1%和仔猪群的109.0%。

图1 4个猪场的血清样品S/P值情况
2.2荧光定量RT-PCR的特异性
所建立的荧光定量RT-PCR方法对HPPRRSV、经典PRRSV、JEV、CSFV、PCV、PRV、TGEV、PEDV、ProV的检测结果如图2所示,显示本方法可特异性检测出HP-PRRSV和经典PRRSV,而对JEV、CSFV等其他阴性对照病毒没有非特异性反应,具有良好的特异性。
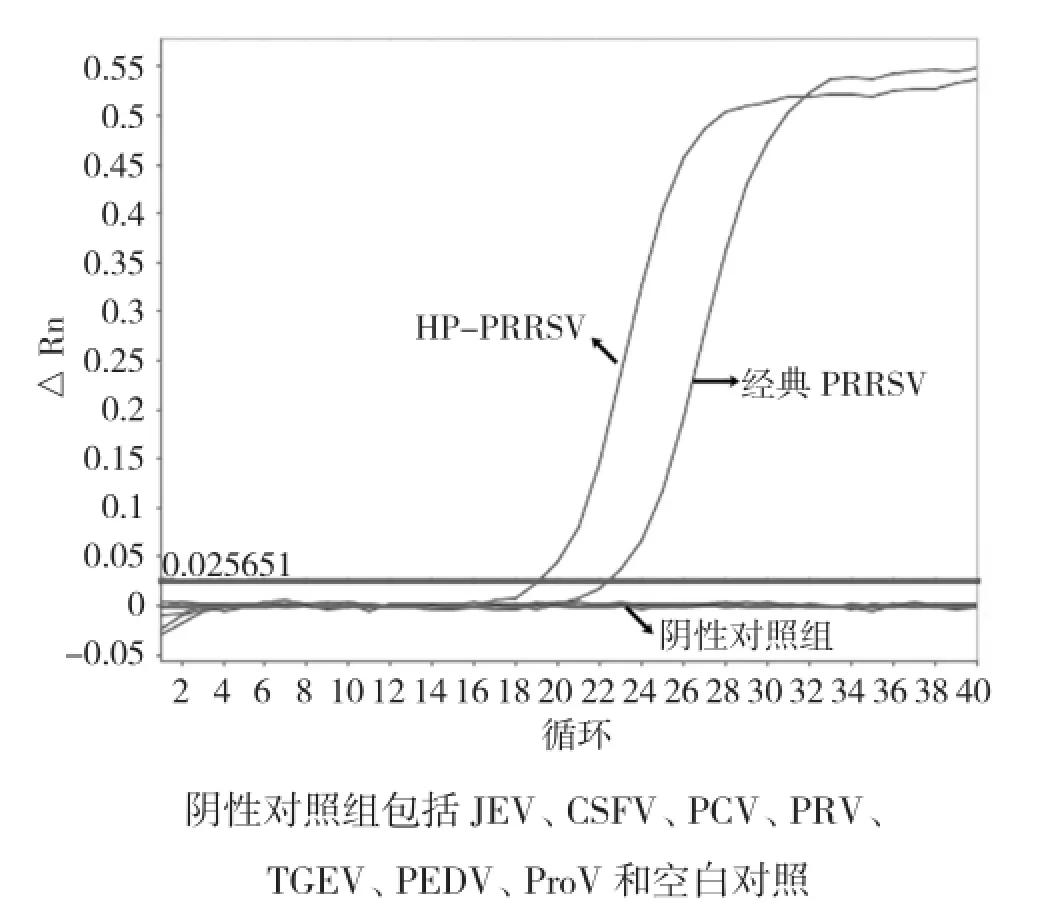
图2 荧光定量RT-PCR特异性检测扩增曲线
2.3荧光定量RT-PCR的标准曲线及灵敏度
荧光定量RT-PCR对浓度梯度为1× 105.5~1×10-1.5TCID50/mL的标准品的检测结果如图3A所示,显示1×10-1.5TCID50/mL以上的标准品均出现荧光增长曲线,检测为阳性,即本方法的检测极限达到1×10-1.5TCID50/mL。对所有标准品检测结果进行分析并绘制标准曲线(图3B),显示8个浓度梯度标准品的检测CT值与对应滴度的Log10值呈线性关系,且线性范围极宽;线性方程为y =-3.077x+33.42(y为CT值,x为原始滴度的Log10值),相关系数(R2)为0.9959,扩增效率为111.345%。
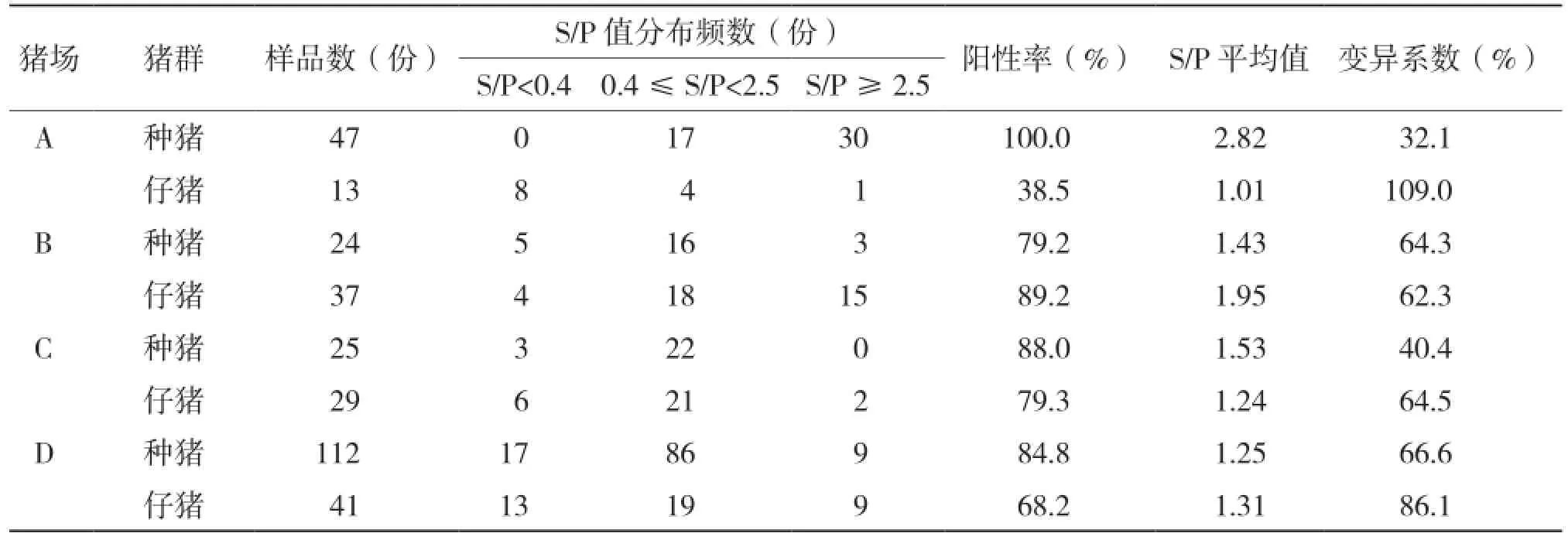
表3 4个猪场的抗体检测结果
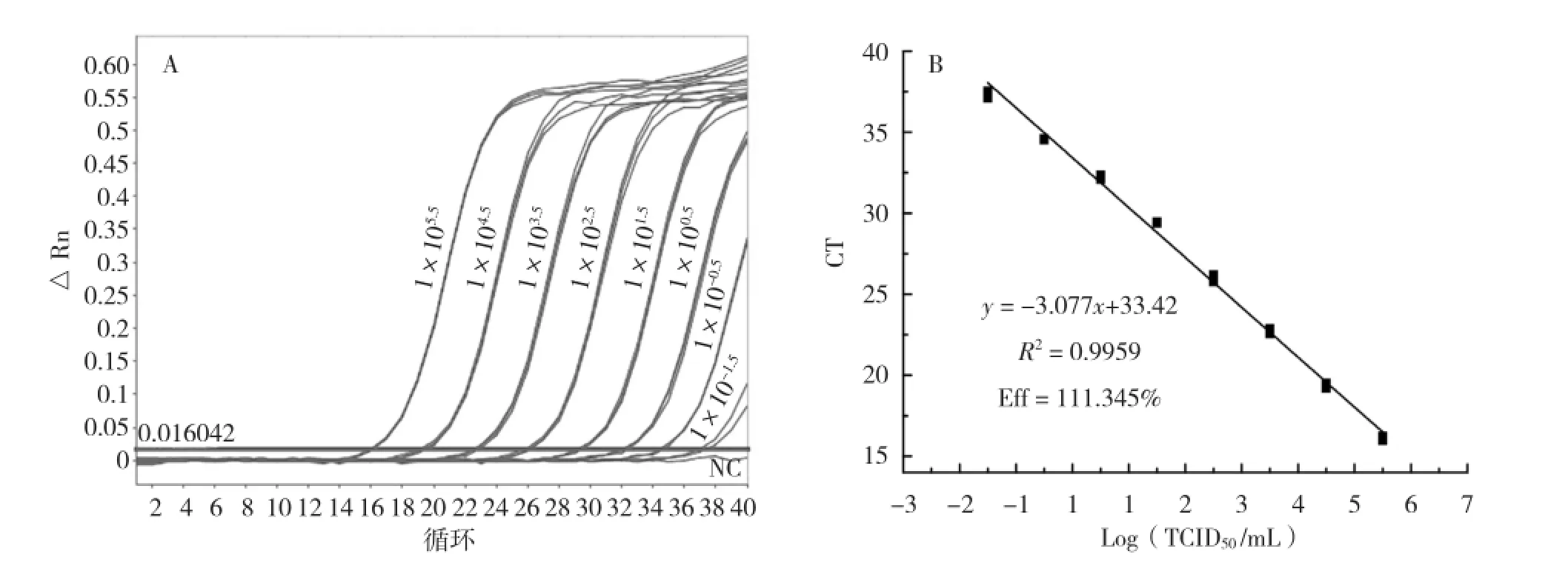
图3 荧光定量RT-PCR对标准品检测的扩增曲线(A)及标准曲线(B)
2.4血清样品的RT-PCR检测结果
应用建立的荧光定量RT-PCR方法对A 和B两猪场的所有血清样品的病毒RNA进行检测,部分样品的扩增结果如图4所示,两猪场121份样品中有15份样品荧光定量RTPCR检测为阳性,阳性率为12.4%,其中仔猪占66.7%、种猪占33.3%。由表4可知,A猪场阳性样品4份,占该猪场检测样品数的6.7%;B猪场阳性样品11份,占该猪场检测样品数的18.0%。另外A猪场种猪阳性样品3份、仔猪1份,分别占各自猪群的6.4%和7.7%;B猪场种猪阳性样品3份、仔猪9份,分别占各自猪群的12.5%和24.3%。根据标准曲线计算获得各阳性样品的原始PRRSV滴度,A猪场阳性样品病毒滴度较低,含量在1×10-1.16~1×101.9TCID50/mL之间,B猪场病毒滴度含量范围较大,在1 ×10-1.3~1×105.3TCID50/mL之间,最高与最低相差106.6倍。

图4 部分样品的荧光定量RT-PCR检测扩增曲线
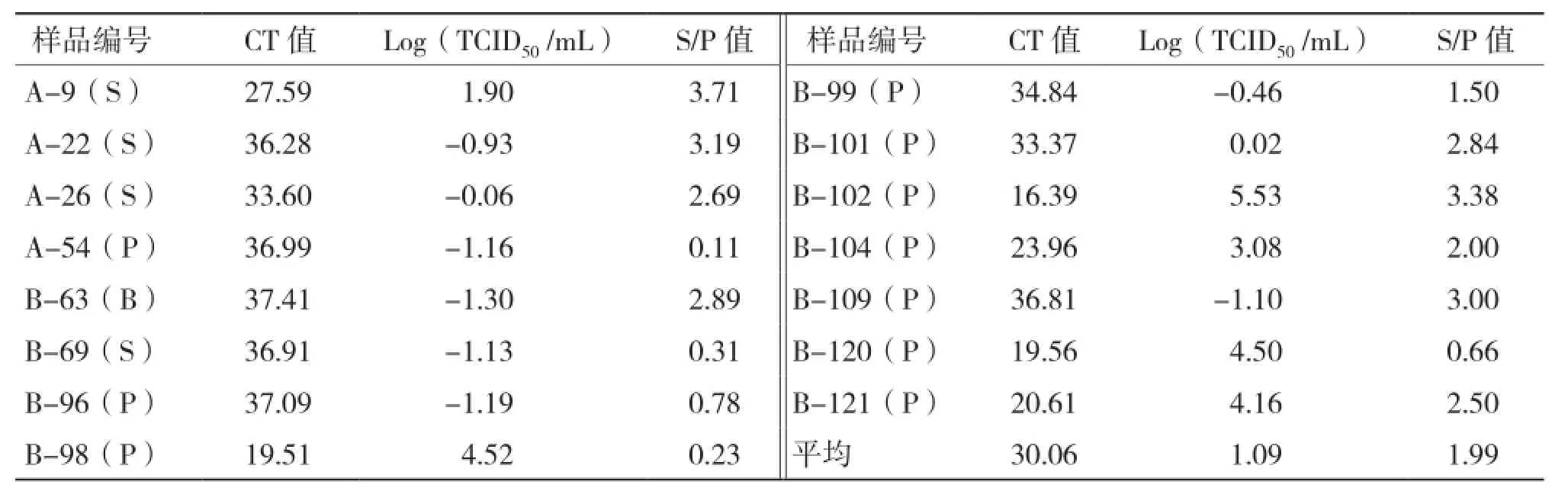
表4 15份阳性样品荧光定量RT-PCR检测结果
2.5抗体水平与病毒血症的关系
结合表3的ELISA检测结果和表4的荧光定量RT-PCR检测结果发现,S/P值<0.4和S/P值>2.5的猪群中病毒血症发生率为16.7%,其中S/P值<0.4的猪群病毒血症发生率为17.6%;S/P值>2.5的猪群中病毒血症发生率为16.3%,并且B场仔猪S/P值>2.5的猪群中病毒血症发生率达到33.3%;S/P值在0.4~2.5之间的猪群中病毒血症发生率为7.3%,其中S/P值在0.8~1.2之间的猪群病毒血症发生率为0。分析RT-PCR阳性样品的S/P值还发现,73.3%的RT-PCR阳性样品的S/P值处在异常范围(<0.4或>2.5),其中A场的RT-PCR阳性样品的S/P值均在异常范围;但血清中的病毒滴度与S/P值没有明显的相关性,滴度较高的几份样品的S/P值分别为0.23、3.38、0.66、2.5,在抗体水平的3个区间内均有分布。
3 讨论
由于免疫效果不明显、病毒不断变异及其他免疫逃逸机制等因素的存在,PRRSV急性发病后一般会出现一个慢性、持续性的感染过程[4-7,12]。持续感染是PRRSV流行中的一个重要特征,同时也是病毒在猪群内成功长期存在的关键,而这些带毒猪正是蓝耳病最主要的传染源。为对抗PRRSV的持续感染,防治疾病的再次暴发,接种疫苗是最为有效的方法。研究显示,一定的抗体水平,尤其是中和抗体,有利于减轻PRRSV阳性猪的临床症状,降低猪群发病率和死亡率[13-15],因此蓝耳病疫苗一直是农业部强制免疫的范围。良好的猪场蓝耳病抗体阳性率为70%~80%,离散度在25%左右,S/P值在0.8~1.2之间,并且保证S/P值>2.5的猪只占猪群5%以下。但最近几年出现部分猪场为追求高的抗体阳性率和效价,超份额、频繁甚至混用蓝耳病疫苗,造成猪场的抗体水平越来越不稳定,疫情也越来越复杂。从我们的调查可看到,粤北地区规模化猪场蓝耳病的平均抗体阳性率达到82.9%,平均S/P值达到1.59,各猪场的平均阳性率和S/P值均能到达70%和0.8的合格线,发病1个月后的A猪场种猪抗体阳性率甚至达到100%,平均S/P达到2.82。调查显示此地区的蓝耳病抗体水平保持在一个较高的水平,但抗体水平的均一性较差,各猪场种猪和仔猪的变异系数均高于25%,25.4%的抗体阳性样品的S/P值>2.5;A猪场的同一批免疫的仔猪甚至出现明显的抗体强阳性群和抗体阴性群。结合各猪场疫病情况,可初步说明高抗体水平并不能完全阻挡PRRSV的侵袭,反而抗体水平不稳定的猪场面临蓝耳病暴发的风险更大。
PRRSV感染的第一阶段一般持续2周或以上,此时所有年龄段的猪群均可发病,发病率为5%~75%,主要表现为急性病毒血症,PRRSV能够使感染猪在12 h即出现病毒血症,24 h时病毒遍布所有淋巴组织和肺脏,7~14 d时血清、淋巴结和肺脏中的病毒滴度达到最高峰,大概为102~105TCID50/mL。急性病例第一阶段后进入以繁殖障碍为主要特征的第二阶段,此阶段一般持续1~4个月,同样会伴随病毒血症,断奶前仔猪死亡也主要发生在这一阶段。经历完这一阶段后,大部分猪群会进入持续感染阶段,此阶段血液中病毒与抗体长期共存[16]。因此病毒血症伴随着PRRSV流行的每一个阶段,有研究表明,PRRSV引起的病毒血症在猪群中可持续6~7周,甚至可长达210 d[17]。而这些都是使用普通RT-PCR方法检测所获得的数据,为更准确检测病毒血症,我们建立了针对PRRSV膜基质蛋白基因的荧光定量RTRT-PCR检测技术,该方法灵敏度达到10-1.5TCID50/mL,并且具有良好的特异性。从我们检测的数据可看到,A、B两猪场的病毒血症发生率为12.4%,处在第一阶段的B猪场和处在第二阶段后期的A猪场都仍有病毒血症的存在,发生率分别为18.0%和6.7%,第一阶段稍高于第二阶段。分析还发现A、B两猪场仔猪病毒血症发生率为7.7%和24.3%,而种猪的发生率为6.4%和12.5%,即无论是疾病的第一阶段还是第二阶段,出现病毒血症的主要是免疫力较低的仔猪(占病毒血症样品的66.7%),与相应群体的抗体阳性率无明显相关性。说明病毒血症发生率与猪群的抗体阳性率没有直接关系,另外定量结果也显示病毒血症样品的病毒滴度与其抗体水平同样没有直接关系。
按照蓝耳病抗体水平的高低,我们将蓝耳病阳性猪场的猪群分为抗体水平稳定群(0.4≤S/P值<2.5)和抗体水平不稳定群(S/P值<0.4 或S/P值≥2.5)。其中,抗体水平稳定群因有抗体的保护受PRRSV感染的压力最小,但随着抗体依赖增强作用机制的发现,低浓度的抗体或许更有利于病毒的传播;抗体水平不稳定群的阴性群(S/P值<0.4)没有抗体保护,面临PRRSV感染的压力最大,只能依靠自身免疫机制抵抗野毒入侵;抗体水平不稳定群中的高抗体群(S/P值≥2.5)现在对病毒的抵御能力还比较模糊,一般认为高抗体效价是由于野毒或者毒力较强的疫苗株感染导致,即异常高的抗体水平预示着猪只正在发病。为进一步探究猪只抗体水平与病毒血症的关系,我们对A、B两猪场的121份样品进行ELISA和荧光定量RTPCR检测,结果发现抗体水平不稳定群的阴性群和阳性群病毒血症发生率分别为17.6%和16.3%,合计为16.7%,均明显高于抗体水平稳定群的7.3%,抗体水平良好的猪群(S/P值在0.8~1.2之间)甚至为0;另一方面,73.3%的RT-PCR阳性样品为抗体水平不稳定群样品。以上结果说明抗体不稳定猪群与病毒血症的关系较为密切,抗体不稳定猪群中发生病毒血症的概率更高,而病毒血症样品中抗体异常的样品也占主要部分,但两者之间并没有绝对的对应关系。至于到底是病毒血症引起抗体异常,还是抗体异常导致抵抗力下降引起病毒血症,我们的实验结果并不能体现,需要后续动物实验作进一步研究探索。
综上所述,经过初步调查,粤北地区规模化猪场的抗体阳性率和抗体效价较高,但离散度大,均一性差,蓝耳病发病的可能性较大;同时研究发现,抗体不稳定猪群中出现病毒血症的概率更高,两者之间关系密切但不是绝对的对应关系。
[1] Zhou L,Yang H. Porcine reproductive and respiratory syndrome in China[J]. Virus Res,2010,154(1-2):31-37.
[2] Karniychuk U U,Nauwynck H J. Pathogenesis and prevention of placental and transplacental porcine reproductive and respiratory syndrome virus infection[J]. Vet Res,2013,44:95.
[3] Zhu L,Zhou Y,Tong G. Mechanisms of suppression of interferon production by porcine reproductive and respiratory syndrome virus[J]. Acta Virol,2012,56(1):3-9.
[4] Lunney J K,Fang Y,Ladinig A,et al. Porcine reproductive and respiratory syndrome virus (PRRSV):pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci,2016,4:129-154.
[5] Drew T W. A review of evidence for immunosuppression due to porcine reproductive and respiratory syndrome virus[J]. Vet Res,2000,31(1):27-39.
[6] Liu C,Ning Y,Xu B,et al. Analysis of genetic variation of porcine reproductive and respiratory syndrome virus(PRRSV) isolates in Central China[J]. J Vet Med Sci,2016,78(4):641-648.
[7] Xie J,Cui T,Cui J,et al. Epidemiological and evolutionary characteristics of the PRRSV in Southern China from 2010 to 2013[J]. Microb Pathog,2014,75:7-15.
[8] Hu J,Zhang C. Porcine reproductive and respiratory syndrome virus vaccines:current status and strategies to a universal vaccine[J]. Transbound Emerg Dis,2014,61(2):109-120.
[9] 李儒曙,冷和平,伍时达,等. 高致病性猪蓝耳病弱毒疫苗与灭活疫苗体液免疫效果对比研究[J]. 广东农业科学,2012,39(12):127-129.
[10] 林太明. 警惕猪蓝耳病疫苗使用不当的危害[J]. 养猪,2007(4):41.
[11] Yoon K J,Wu L L,Zimmerman J J,et al. Antibody-dependent enhancement (ADE) of porcine reproductive and respiratory syndrome virus (PRRSV) infection in pigs[J]. Viral Immunol,1996,9(1):51-63.
[12] Christopher-Hennings J,Nelson E A,Hines R J,et al. Persistence of porcine reproductive and respiratory syndrome virus in serum and semen of adult boars[J]. J Vet Diagn Invest,1995,7 (4):456-464.
[13] 周志平,陈火光,田同军,等. 猪蓝耳病活疫苗免疫效果试验观察[J]. 猪业科学,2011,28 (4):96-101.
[14] Lee J A,Lee N H,Lee J B,et al. Augmented immune responses in pigs immunized with an inactivated porcine reproductive and respiratory syndrome virus containing the deglycosylated glycoprotein 5 under field conditions[J]. Clin Exp Vaccine Res,2016,5(1):70-74.
[15] Loving C L,Osorio F A,Murtaugh M P,et al. Innate and adaptive immunity against Porcine Reproductive and Respiratory Syndrome Virus [J]. Vet Immunol Immunopathol,2015,167 (1-2):1-14.
[16] Barbara E S,Jeffery J Z,et al. Taylor. Diseases of Swine[M]. 赵德明,张仲秋,沈建忠(译). 第9版. 北京:中国农业大学出版社,2008:423-463.
[17] Rossow K D. Porcine reproductive and respiratory syndrome[J]. Vet Pathol,1998,35(1):1-20.
(责任编辑 崔建勋)
Preliminary research on PRRSV antibody level of scale pig farms in northern Guangdong and its relationship with viremia
WU Jing-bo,HUANG Jian-qiang,NAN Wen-jin,HU Hong-hui,PENG Guo-liang
(Shaoguan University/North Guangdong Collaborative Innovation Development Center for Swine Farming and Disease Control,Shaoguan 512005,China)
Porcine reproductive and respiratory syndrome (PRRS) is a serious problem common to the swine industry worldwide. Because it is lack of effective drug for treatment,vaccination is still the most effective means for preventing and controlling PRRS. In order to monitor the PRRSV antibody level of the scale pig farms in northern Guangdong,this study conducted ELISA of the PRRSV antibody of 382 serum samples from 4 pig farms in northern Guangdong. For explorating the relationship of PRRS antibody level and viremia,this study detected PRRSV RNA by fluorescence quantitative reverse-transcriptase PCR assay which was established in this study. Results showed that the positive rate of PRRS antibody of 4 pig farms was 82.9%. Mean value of S/P was 1.59. But the degree of dispersion was large,variable coefficient of S/P value was over 25% in all farms. This study found that the incidence of viremia of 4 pig farms was 12.4%,using the fluorescence quantitative RT-PCR whose detection limit was 10-1.5TCID50/mL,and the incidence of viremia of antibody unstable group was 16.7%,significantly higher than antibody stable group,whose incidence was 7.3%. The positive rate and antibody titer in northern Guangdong were high,but consistencywas poor,leading to high incidence of PRRS. Besides,this study also found that the incidence of viremia in antibody unstable groups was higher than that in stable groups.
PRRS;PRRSV;antibody level;viremia
S852.65+9;S858. 28
A
1004-874X(2016)08-0143-08
2016-04-11
广东省现代农业产业技术体系建设专项(生猪产业创新团队);韶关市科技计划项目(2013CX/NO9,2014CX/N319);韶关学院科研项目(314-140694)
吴静波(1988-),男,硕士,助教,E-mail:xiaobo.maple@163.com
彭国良(1965-),男,硕士,研究员,E-mail:pengguoliang168@163.com
