猪羰基还原酶1(CBR1)基因克隆及组织表达谱分析
2016-10-08张爱玲孙显月李加琪广东第二师范学院生物与食品工程学院广东高校应用生态工程技术开发中心广东广州5100华南农业大学动物科学学院广东省农业动物基因组学与分子育种重点实验室广东广州51064广东温氏食品集团股份有限公司广东云浮57400
张爱玲,孙显月,尹 琪,李加琪,张 豪(1. 广东第二师范学院生物与食品工程学院/广东高校应用生态工程技术开发中心,广东 广州 5100;. 华南农业大学动物科学学院/广东省农业动物基因组学与分子育种重点实验室,广东 广州 51064;. 广东温氏食品集团股份有限公司,广东 云浮 57400)
猪羰基还原酶1(CBR1)基因克隆及组织表达谱分析
张爱玲1,2,孙显月2,尹 琪3,李加琪2,张 豪2
(1. 广东第二师范学院生物与食品工程学院/广东高校应用生态工程技术开发中心,广东 广州 510303;2. 华南农业大学动物科学学院/广东省农业动物基因组学与分子育种重点实验室,广东 广州 510642;3. 广东温氏食品集团股份有限公司,广东 云浮 527400)
为了深入研究猪羰基还原酶1(CBR1)基因的表达调控,通过PCR获得包括猪CBR1基因启动子和外显子、内含子的序列,并进行蛋白结构分析和系统进化关系比较,通过RT-PCR方法检测了CBR1基因在不同组织的表达丰度。结果表明,猪CBR1基因启动子区长度为2 875 bp,具有潜在典型的NFκB等转录因子结合位点;CBR1基因由3个外显子和2个内含子组成,外显子长度分别为289、108和437 bp,其中5′UTR和3′UTR分别为107 bp和242 bp,内含子长度分别为572 bp和3 219 bp,编码区由289个氨基酸组成;该蛋白为亲水性蛋白,无明显的信号肽,有2个跨膜区域;蛋白二级结构和三级结构主要由7 个α-螺旋、7个β-折叠以及loop环构成。猪CBR1基因氨基酸序列与人、绵羊氨基酸的相似性较高,为84.48%。qRT-PCR结果表明,怀孕12 d的二花脸子宫内膜中CBR1基因mRNA的表达量极显著高于长大二元母猪;在怀孕12 d母猪9个组织中,CBR1在肾脏中的表达量最高,其次是肝脏和小肠 。
猪;CBR1;基因表达;启动子
张爱玲,孙显月,尹琪,等. 猪羰基还原酶1(CBR1)基因克隆及组织表达谱分析[J].广东农业科学,2016,43(8):151-157.
母猪妊娠的建立和维持是一个复杂的生理过程,子宫内环境、子宫内膜发生了巨大变化,同时多种生殖激素在该过程中发挥着重要作用。其中,前列腺素(Prostaglandins,PG)对妊娠识别和建立具有重要作用。前列腺素包括PGF2α、PGE2、PGH2等多个成员,但是各自功能大不相同,如PGF2α具有溶解黄体的功能[1],而PGE2具有黄体保护作用,PGE2能够刺激怀孕10~12 d母猪黄体细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[2],并通过抑制黄体溶解从而促进妊娠建立和维持[3-4]。由于PGE2可以转变为PGF2α,而两者具有相反的生理功能,因此PGE2与PGF2α比例(PGE2/PGF2α)必须受到严格调控才能适应机体生理状态并为妊娠做准备。研究表明,较高的PGE2/PGF2α比例可能是我国高繁殖力猪种二花脸猪具有高产仔数性状的一个因素[5]。羰基还原酶1(Carbonyl Reductase 1,CBR1)是催化PGE2向PGF2α转变过程中的一个限速酶,影响PGE2/PGF2α比例的高低。有文献报道,在母猪怀孕早期胎儿尚未附植时,来自孕体分泌的不断升高的雌激素会降低CBR1水平,进而增强PGE2水平和PGE2/PGF2α比例[6]。研究表明,人工授精14 d后的怀孕母猪外周血中的CBR1表达水平要低于非怀孕母猪[7],同样说明低水平的CBR1意味着较高的PGE2/PGF2α比例,进而有利于妊娠的维持。此外,CBR1还在类固醇代谢、药物代谢、解毒、药物抗性、变异发生、认信号转导和肿瘤发生等生理过程中发挥着重要作用[8-9]。因此,CBR1基因的表达调控就显得尤为重要,CBR1基因的表达强度实际上决定了其催化强度。已发现人类CBR1基因启动子上存在多个特异的顺式作用元件[10],且通过AHR通路激活CBR1基因的表达。目前,对猪CBR1基因启动子的关注并不多。为了深入研究猪CBR1基因的表达调控,本研究将对其启动子和编码区等进行克隆及蛋白性质分析,并检测其在不同猪种子宫内膜等组织中的表达,为探索猪繁殖性能分子机制调控积累资料。
1 材料与方法
1.1试验材料
怀孕第3胎的3头纯种二花脸母猪(ER)和3头长白、大白杂交母猪(LY)来自广东温氏食品集团股份有限公司,分别采集耳组织和子宫内膜上皮组织,用于获得基因片段克隆的DNA模板和cDNA模板。
1.2试验方法
1.2.1DNA和RNA的提取 耳组织DNA提取参考基因组DNA提取试剂盒(上海生工生物工程有限公司)操作说明书进行,子宫内膜等组织总RNA提取按照Invitrogen Trizol 操作说明书,总RNA的反转录参照TaKaRa公司的反转录试剂盒说明进行。
1.2.2CBR1基因序列的克隆 参照GenBank上公布的猪CBR1基因(Gene ID:397143)部分序列,采用Primer软件设计引物CBR1-5′扩增启动子序列,引物CBR1-In1和CBR1-In2扩增内含子序列,具体见表1,引物由广州英骏公司合成,所用模板是DNA。普通PCR扩增体系为50 μL,其中5×PrimerSTARTMBuffer(含Mg2+)10 μL,dNTP 4 μL,上下游引物各1μL,DNA模板1μL,PrimerSTARTMHS DN Polymerase 为0.5 μL,添加双蒸水至50 μL。反应程序为:95℃预变性5 min;94℃ 30 s,退火温度为58~62℃,72℃延伸3 min,然后转至94℃,33个循环数,最后72℃后延伸10 min。
1.2.3CBR1基因组织表达谱分析 采用实时荧光定量PCR,检测CBR1基因在各组织的表达水平。采用SYBR Green Realtime PCR Mix,按照说明进行。首先,设计CBR1基因的荧光定量PCR的引物q-CBR1及内参引物q-RPS20(表1)。荧光定量PCR反应体系20 μL:SYBR /RoX qPCR Master Mix(2×)10 μL,上下游引物(10 μmol/L)各0.4 μL,DNA模板0.6 μL,补充灭菌双蒸水8.6 μL。荧光定量PCR反应条件为:94℃预变性5 min;94℃变性30 s,61℃退火30 s,72℃延伸30 s,40个循环;72℃后延伸40 s。

表1 猪CBR1基因克隆和mRNA荧光定量PCR引物信息
1.2.4猪CBR1基因的生物信息学分析 猪CBR1基因启动子转录因子结合位点通过在线软件分析:http://www.genomatix.de/,MatIspector
CpG岛预测:http://www.uragene.org/ methprimer/indexl.html
核酸序列比对、拼接:D N A M A N、DNASTAR、Vector NTI等软件
蛋白基本理化性质预测:http://www.expasy. org/cgi-bin/protscale.pl,ExPASy 的ProtScal 程序
蛋白跨膜预测:http://www.ch.embnet.org/ software/TMPRED_form.html,TMpred
信号肽预测:http://www.cbs.dtu.dk/services/ SignalP/
蛋白结构功能域预测:http://www.expasy. org/prosite/蛋白二级结构预测:http://www.expasy.org蛋白质三级结构预测:http://swissmodel. expasy.org/
蛋白质分子进化分析:http://www.ebi.ac.uk/ clustalw
1.3数据分析
样品设置相同的阈值线,用CFX Manager软件输出扩增的Ct值,在Excel表格中采用2-△△Ct法分析组织相对表达量,选择RPS20基因作为内标基因进行均一化处理[11],以二花脸(ER)中CBR1作为参照因子,从而得到二花脸和长大二元杂猪种中CBR1基因的相对表达量,同时进行t检验分析差异显著性。CBR1基因的9个组织表达谱分析以β-actin基因作为内标基因,其他分析同上。
2 结果与分析
2.1猪CBR1基因及其启动子的克隆
以长大二元杂母猪基因组DNA为模板,根据GenBank公布的猪CBR1基因(Gene ID:397143)部分序列设计引物CBR1-5′进行PCR扩增,获得2 997 bp序列(图1),与网上mRNA序列比对,获得了转录起始位点前面2 875 bp的5′调控区,其中-2370~-1304共1 067 bp是参考序列的缺失序列。通过CBR1-In1 和CBR1-In2引物分别扩增获得883、3 611 bp片段(图1),将其测序后与mRNA序列比对可知,获得的内含子1和内含子2长度分别为572、3 219 bp,且内含子边界符合GT-AG规则,5′UTR为107 bp,编码区1、2、3长度分别为289、108、473 bp,3′UTR为242 bp,CBR1基因编码区由867个碱基组成,编码298个氨基酸。将所获的上述序列拼接后,提交GenBank获得登录号为JQ743647。

图1 猪CBR1基因启动子和内含子序列的扩增
2.2猪CBR1基因启动子的生物信息学分析
将猪CBR1基因启动子区序列通过在线软件进行分析,预测启动子区潜在的顺式作用元件和反式作用因子(转录因子),结果如图2所示。猪CBR1基因5'调控区存在典型的TATA box、GCbox等顺式作用元件;存在与基因转录调控相关的核转录因子,如cAMP应答元件结合蛋白(cAMP-response element binding protein,CREB)、CCAAT增强子结合蛋白 (CCAAT/ enhancer binding protein,C/EBP)、E-box结合因子(E-box binding factors)、TATA盒结合蛋白因子(Vertebrate TATA binding protein factor,VTBP)、核因子κB(nuclear factor κB,NFκB)、OCT-1等结合位点;通过Uragene预测发现,猪CBR1基因启动子不存在明显的CpG岛。

图2 猪CBR1 基因启动子区重要调控元件域结合因子预测
2.3猪CBR1蛋白质结构与同源性分析
2.3.1猪CBR1蛋白质结构分析 通过ProtParam在线软件,预测猪CBR1蛋白质总分子量为31 693.3 ku,理论pI值为7.60,正/负电荷残基数为33/34,不稳定系数为41.49(一般<40为稳定、>40为不稳定);脂肪系数(Aliphatic index)为 88.69,总平均亲水性(Grand average of hydropathicity,GRAVY)为 -0.219,推测该蛋白为亲水性蛋白。通过预测,发现该蛋白无明显的信号肽区域。通过InterProScan,发现猪CBR1基因存在两个功能结构域:7~148位氨基酸为短链脱氢酶(short-chain dehydrogenase)功能域,5~271位为NAD(P)结合域。
猪CBR1蛋白质二级结构预测结果表明,该蛋白二级结构主要由loop环构成,α螺旋(H,helix)和β折叠(E,sheet)比例总和低于50%(图3)。利用在线软件TMpred对蛋白进行跨膜分析,结果(图4)显示,按膜的取向来分,由内向外无明显的跨膜信号,而由外向内则有两个较明显的跨膜螺旋区,分别为7~23位氨基酸和189~209位氨基酸,但从分值来看并不显著。利用SWISS-MODEL工具对该蛋白质进行三级结构预测,并与人CBR1蛋白三级结构进行比较,发现虽然两者存在氨基酸数目的差异,但是两者的三级结构非常类似,由7个α-螺旋、7个β-折叠以及大部分的loop环构成(图5)。

图3 猪CBR1蛋白质二级结构分析

图4 猪CBR1蛋白跨膜区分析结果
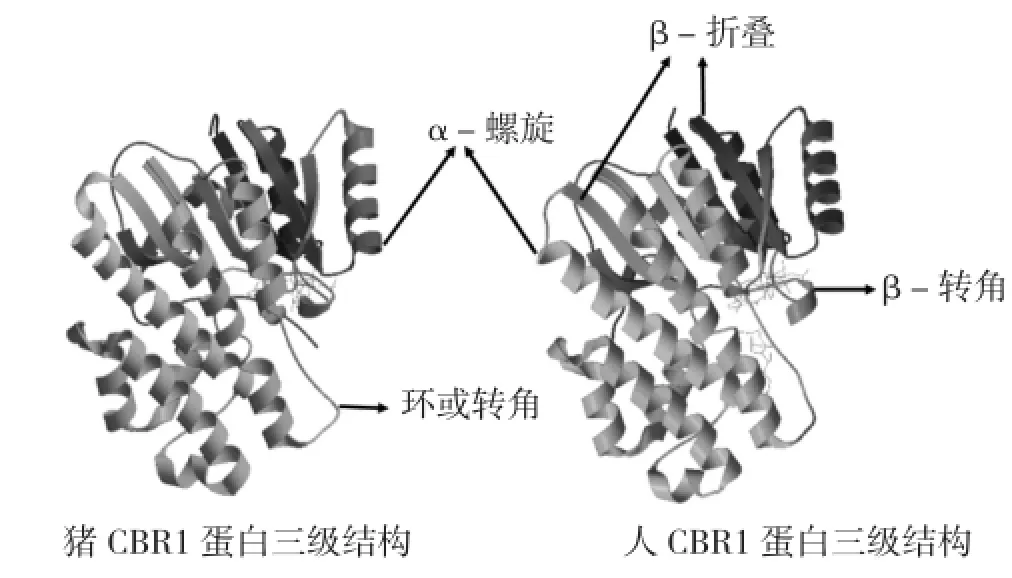
图5 猪和人CBR1蛋白三级结构比较
2.3.2猪CBR1蛋白质同源性分析 通过Clustal Omega软件,将人、猪、牛、绵羊、小鼠、鸡、斑马鱼7个物种CBR1基因开放阅读框转录所得氨基酸序列相似性分析,并进行邻接聚类和同源性分析,构建蛋白质氨基酸序列进化分支图(图6)。猪CBR1基因编码289个氨基酸,而其他多个物种编码氨基酸数目在277个左右。对于CBR1氨基酸序列,猪与人和绵羊有更高的相似性,为84.48%;与牛和小鼠相似性分别为83.33%和79.78%;与鸡和斑马鱼的相似性较低,分别为73.19%和60.51%。
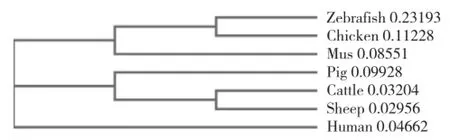
图6 7个物种CBR1蛋白氨基酸序列进化分支
2.4猪CBR1基因在长大杂和二花脸猪子宫内膜表达及不同组织表达谱分析
用RPS20作为内参基因进行校准,以二花脸猪(ER)中的CBR1基因作为参考基因进行定量PCR分析,检测了CBR1基因在二花脸和长大二元母猪怀孕12~13 d子宫内膜的表达差异,表明二花脸子宫内膜CBR1基因mRNA表达量显著高于长大二元杂母猪(图7A)。通过定量PCR分析了二花脸母猪怀孕第12天二花脸母猪的9个组织(心、肝、脾、肺、肾、小肠、背最长肌、背膘、子宫内膜)中的表达量(图7B),CBR1基因在9种组织中呈不同程度表达,其中在肾脏表达量最高,其次是肝脏和小肠、背膘,而在背最长肌和子宫内膜呈低丰度表达。
3 结论与讨论

图7 猪CBR1基因组织表达谱分析
为了深入研究猪CBR1基因的表达调控,本研究首先克隆了猪CBR1基因的启动子区,并完善了GenBank公布的参考序列所缺失的碱基序列。生物信息学预测结果表明,该基因启动子潜在的转录因子包括NFκB、OCT-1、CREB等,值得注意的是存在两个潜在的NFκB结合位点(-1539和-876位置)。研究表明,人和鼠的子宫内膜中,NFκB作为炎性因子被激活并与胚胎附植有关[12-13]。在母猪发情周期的中期(即卵泡期),子宫内膜会发生炎性反应,为受精卵的植入做准备,NFκB已经被证明作为转录因子介导一些基因的表达进而促进炎性反应的发生,如在植入前期和怀孕母猪子宫内膜中NFκB成员RELA表达量会增加[14]。在母猪发情周期、胚胎植入以及妊娠等炎性事件中,黄体变化起着重要作用,而由于PGE2和PGF2α对黄体分别具有保护和溶解功能,因此作为催化PGE2向PGF2α转化的限速酶,CBR1的表达调控更受到关注。但是,CBR1基因是否也像其他基因一样受到NFκB的调控作用仅通过生物信息学预测是不够的,虽然在-1539 和-876位置都存在NFκB典型的结合序列5′-GGGRNNYYCC-3′(R:嘌呤,Y:嘧啶,N:任意碱基),但仍需要进一步验证。相比人CBR1基因,猪CBR1基因启动子上并不存在明显的CpG岛,推测猪CBR1基因启动子可能受甲基化调控程度较低,且在人CBR1基因启动子中并未发现TATA和CAAT框这两个典型的顺式作用元件[10]。有研究人员对7个狗品种CBR1基因进行多态性分析,发现在启动子区存在Sp1结合区域,在5'UTR区存在10 bp的缺失突变[15],且该缺失区域可能会影响某抗癌药物应答。
利用生物信息学相关方法对猪CBR1蛋白进行基本性质分析,推测该蛋白为一种亲水性蛋白,没有明显的信号肽区域。预测猪CBR1肽链由外向内有两个较明显的跨膜螺旋区,分别为7~23位氨基酸和189~209位氨基酸,结合二级结构分析结果,这两个区域主要由α-螺旋构成,这也与其潜在的跨膜功能相适应。猪CBR1基因由4个外显子和3个内含子组成,与人、小鼠等物种CBR1基因结构相同,但是在C-端编码氨基酸数目则比人、小鼠等多12个,但比较猪和人CBR1基因三级结构,发现均由7个α-螺旋、7个β-折叠以及loop环构成,多出的12个氨基酸并没有导致猪CBR1蛋白与人CBR1蛋白三级结构存在较大差异;而且在猪CBR1蛋白的二级结构上发现了SDR和NAD (P)功能结构域,这与刘珊[16]对人CBR1蛋白的二级结构研究结果一致。从氨基酸聚类结果可以看出,哺乳动物CBR1基因的保守性较高,与鸡和斑马鱼一致性较低。
通过qRT-PCR发现,怀孕11~12 d的二花脸母猪子宫内膜CBR1基因的表达量高于长大二元母猪。二花脸猪是我国产仔数最高的品种,属于太湖猪,研究表明产前低死亡率是太湖猪高产的主要原因,且较高的PGE2/PGF2α比例可能是有利于高产仔数的一个因素[5]。而本研究发现,相比长大二元母猪,CBR1基因在二花脸子宫内膜中表达水平较高,意味着二花脸母猪子宫内膜PGE2/PGF2α比例可能低于长大二元母猪,看似与已有研究结果相矛盾,但分析其中的原因可能是CBR1并不是作为PGE2向PGF2α转化唯一的限速酶在发挥作用。另外CBR1基因在机体多个组织中呈现差异表达,如在人16个组织中CBR1在肝脏中的表达量明显高于其他各组织,而在二花脸母猪9个组织中,CBR1基因在肾脏中的表达量较高,在肝脏呈中度表达,子宫内膜表达量较低,物种间的差异是造成该基因在相同组织表达谱差异的因素之一。CBR1基因在猪不同组织中呈不同丰度表达,表明其表达呈组织特异性,可能与转录因子类型及其功能发挥有关,但这需要进一步深入研究。
[1] Christenson L K,Farley D B,Anderson L H,et al. Luteal maintenance during early pregnancy in the pig:role for prostaglandin E2[J]. Prostaglandins,1994,47(1):61-75.
[2] Kowalczyk A E,Kaczmarek M M,Schams D,et al. Effect of prostaglandin E2 and tumor necrosis factor alpha on the VEGF-receptor system expression in cultured porcine luteal cells[J]. Mol Reprod Dev,2008,75(10):1558-1566.
[3] Ziecik A J. Old,new and the newest concepts of inhibition of luteolysis during early pregnancy in pig[J]. Domest Anim Endocrinol,2002,23 (1-2):265-275.
[4] Gadsby J E,Lovdal J A,Britt J H,et al. Prostaglandin F2 alpha receptor concentrations in corpora lutea of cycling,pregnant,and pseudopregnant pigs[J]. Biology of Reproduction,1993,49(3):604-608.
[5] Bazer F W,Thatcher W W,Matinat-Botte F,et al. Composition of uterine flushings from Large White and prolific Chinese Meishan gilts[J]. Reprod Fertil Dev,1991,3(1):51-60.
[6] Waclawik A,Jabbour H N,Blitek A,et al. Estradiol-17beta,prostaglandin E2(PGE2),and the PGE2 receptor are involved in PGE2positive feedback loop in the porcine endometrium[J]. Endocrinology,2009,150(8):3823-3832.
[7] Shen J,Zhou C,Zhu S,et al. Comparative transcriptome analysis reveals early pregnancyspecific genes expressed in peripheral blood of pregnant sows[J]. PLoS One,2014,9(12):e114036.
[8] Forrest G L,Gonzalez B. Carbonyl reductase[J]. Chem Biol Interact,2000,129(1-2):21-40.
[9] Forrest G L,Gonzalez B,Tseng W,et al. Human carbonyl reductase overexpression in the heart advances the development of doxorubicin-induced cardiotoxicity in transgenic mice[J]. Cancer Res,2000,60(18):5158-5164.
[10] Lakhman S S,Chen X,Gonzalez-Covarrubias V,et al. Functional characterization of the promoter of human carbonyl reductase 1(CBR1). Role of XRE elements in mediating the induction of CBR1 by ligands of the aryl hydrocarbon receptor [J]. Mol Pharmacol,2007,72(3):734-743.
[11] Wang S,Li J,Zhang A,et al. Selection of reference genes for studies of porcine endometrial gene expression on gestational day 12[J]. Biochem Biophys Res Commun,2011,408(2):265-268.
[12] King A E,Critchley H,OKelly R W. The NF-kappaB pathway in human endometrium and first trimester decidua[J]. Mol Hum Reprod,2001,7 (2):175-183.
[13] Nakamura H,Kimura T,Ogita K,et al. Alteration of the timing of implantation by in vivo gene transfer:delay of implantation by suppression of nuclear factor kappaB activity and partial rescue by leukemia inhibitory factor[J]. Biochem Biophys Res Commun,2004,321(4):886-892.
[14] Ross J W,Ashworth M D,Mathew D,et al. Activation of the transcription factor,nuclear factor kappa-B,during the estrous cycle and early pregnancy in the pig[J]. Reprod Biol Endocrinol,2010,8:39.
[15] Cheng Q,Sanborn C,Ferguson D,et al. DNA sequence variants in the carbonyl reductase 1 (cbr1)gene in seven breeds of Canis lupus familiaris[J]. Genet Mol Res,2012,11(2):1109-1116.
[16] 刘珊. 人类羰基还原酶基因CBR1和DCXR的克隆及其编码蛋白的功能研究[D]. 上海:复旦大学,2004.
(责任编辑 崔建勋)
Cloning and expression of porcine carbonyl reductase1(CBR1) gene
ZHANG Ai-ling1,2,SUN Xian-yue2,YIN Qi3,LI Jia-qi2,ZHANG Hao2
(1. Biology and Food Engineering Institute,Guangdong University of Education/Guangdong Development Center of Applied Ecology and Ecological Engineering in Universities,Guangzhou 510303,China;2. College of Animal Science,South China Agricultural University/ Guangdong Provincial Key Lab of Agro-animal Genomics and Molecular Breeding,Guangzhou 510642,China;3. Guangdong Wen’s Food Group Limited Company,Yunfu 527400,China)
The promoter,exons and introns of porcine carbonyl reductase1 gene (CBR1) were cloned,and the structure of CBR1 protein was analyzed. The similarity of amino acid was compared with other species and the phylogen of the gene was constructed. The tissues expression of the gene was detected by RT-PCR. The results showed that the promoter of the gene contained 2 875 bp,and typical binding sites of NFκB were predicted. The gene included three exons and two introns,and the formers spanned 289,108 and 437 bp,respectively. The two introns spanned 572 bp and 3 219 bp,respectively. The 5′UTR of 107 bp and 3′UTR of 242 bp were identified. The CDS was encoded by 289 amino acids. The CBR1 protein was hydrophilic,and contained two transmembranedomains but no signal peptide was found. The tertiary structure of the protein was formed by seven α-helixes,seven sheets,and loops. The amino acid sequence of the gene exhibited higher similarity of 84.48% with that of human and sheep. The CBR1 mRNA in the endometrium of Erhualian sows was higher significantly than that of Landrace × large white sows on GD12 (gestation day 12) (P<0.01). The gene was expressed with the highest level in kidney tissue and the higher in liver and small bowel tissues of Erhualian on GD12.
pig;CBR1;gene expression;promoter
S813.3;Q786
A
1004-874X(2016)08-0151-07
2016-04-13
国家自然科学基金(31201771);国家科技支撑计划项目(2011BAD28B01);国家现代农业产业技术体系专项(CARS-36)
张爱玲(1977-),女,博士,讲师,E-mail:zhangmeixiaL@163.com
张豪(1965-),男,博士,教授,E-mail:zhanghao@scau.edu.cn
