小鼠骨髓树突状细胞对白念珠菌吞噬、杀伤作用的研究
2016-09-28王琼史冬梅刘维达
王琼 史冬梅 刘维达
(1.中国医学科学院皮肤病研究所,南京 210042;2.济宁市第一人民医院皮肤科,济宁 272011)
·论著·
小鼠骨髓树突状细胞对白念珠菌吞噬、杀伤作用的研究
王琼1史冬梅2刘维达1
(1.中国医学科学院皮肤病研究所,南京 210042;2.济宁市第一人民医院皮肤科,济宁 272011)
目的体外分离培养小鼠骨髓树突状细胞(Dendritic Cell,DC)并与白念珠菌共同孵育,研究不同浓度的DC对白念珠菌的吞噬、杀伤作用,并研究随着共孵育时间的延长DC表型的变化及其吞噬、杀伤白念珠菌能力的变化。方法无菌条件下分离培养C57小鼠骨髓DC;倒置显微镜下观察DC的形态;Cellometer Mini细胞计数仪测定DC生长曲线及细胞直径变化;流式细胞仪检测DC及白念珠菌刺激后DC表面标志物CD11c及其表面分子MHCⅡ、CD40、CD80及CD86的表达;光学显微镜、激光共聚焦显微镜及流式细胞仪测定DC对白念珠菌的吞噬及杀伤作用。结果体外培养10 d小鼠骨髓DC,倒置显微镜观察可见典型DC形态;随着培养时间的延长,细胞逐渐增大,培养第10天时,细胞直径分布最多的为10.2 μm;生长曲线显示,DC呈倍数增长,第2~9天为细胞对数生长期,第9天左右增殖曲线达到顶峰。培养第10天,未经白念珠菌刺激的DC表面CD11c分子及CD80分子高水平表达,CD40、CD86及MHCⅡ低表达;经白念珠菌刺激后,DC表面CD11c分子、CD80、CD40、CD86及MHCⅡ均高表达,呈成熟DC表型。激光共聚焦(Laser Scanning Confocal Microscope,LSCM)及流式细胞仪(Flow Cytometer,FCM)检测DC对白念珠菌吞噬作用,当DC与白念珠菌的比例为1∶1时,随着共培养时间的延长(30 min~1.5 h),吞噬率无明显变化(P=0.063);当DC与白念珠菌比例为2∶1、1∶2及1∶4,随着DC细胞所占比例的减小,DC细胞吞噬作用增强,当比例为1∶4时,DC吞噬作用最强,且随着共培养时间的延长(30 min~1.5 h),吞噬率也明显上升,差异有统计学意义(P=0.003;P=0.002;P=0.002)。显微镜检测DC对白念珠菌杀伤率,可见随着时间的延长,各实验组的杀伤率下降(P=0.000);当DC∶白念珠菌=1∶1时,较2∶1时,杀伤率明显下降,但随着白念珠菌比例在一定范围内的增高(从1∶1到1∶4),杀伤率明显增高,差异有统计学意义(P=0.000)。结论小鼠骨髓细胞体外经GM-CSF诱导可培养DC具有较高的纯度,呈未成熟细胞表型;且每只C57小鼠可获得3×107总数的细胞,可满足一些实验的DC用量。经白念珠菌刺激后DC表型成熟;在一定的比率范围内,DC对白念珠菌有较强的吞噬及杀伤作用,其吞噬作用随着DC与白念珠菌比例的减小而增强。且随着两者作用时间的延长,DC对白念珠菌的吞噬作用逐渐增强而杀伤作用逐渐减弱。
骨髓;树突状细胞;白念珠菌;吞噬;杀伤
[Chin J Mycol,2016,11(4):193-200]
白念珠菌是一种寄生在健康宿主消化道、呼吸道和女性生殖道黏膜的机会性致病真菌。一旦机体免疫力下降或者正常菌群平衡被破坏,它就会在黏膜表面大量繁殖并形成菌丝、侵入深层组织、引起念珠菌系统性感染,且这种感染常常是致命性的。白念珠菌入侵人体的第一道防线即是树突状细胞(Dendritic cells,DC),DC是连接天然免疫和适应性免疫的桥梁,负责监查机体中各种抗原成分并提呈抗原至下游免疫反应,在抗真菌免疫应答中起关键作用[1-3]。本研究通过原代分离培养小鼠骨髓来源DC,检测不同比例下其对白念珠菌吞噬及杀伤作用,为临床进一步研究与应用DC进行白念珠菌病的免疫治疗提供基础。
1 材料与方法
1.1材料
SPF级C57小鼠,雌性,6~8周,由扬州大学比较医学中心提供(动物合格证编号SCXK(苏2012-0004))提供。白念珠菌标准菌株(ATCC5314),由中国医学真菌保藏管理中心保藏。重组粒细胞-巨噬细胞集落刺激因子(GM-CSF,Propetech公司)、RPMI 1640培养液(Gibco公司)、胎牛血清(Gibco公司)、PBS缓冲液(实验室自配)、75%乙醇(实验室自配)、胰蛋白胨、酵母提取物、葡萄糖、FITC(sigma公司)、抗鼠CD11c、CD40、CD80、CD86、MHCⅡ荧光抗体(eBioscience公司)。
1.2小鼠骨髓来源DC的培养及形态学观察
取C57小鼠,颈椎脱臼处死,立即浸入75%乙醇中5~10 min;在超净工作台中,无菌手术取出胫骨及股骨,尽量将肌肉和结缔组织去除干净。放于PBS缓冲液中,剪掉骨的两端,用1 mL无菌注射器反复冲洗骨髓腔,直至骨变白,将冲洗液收入15 mL离心管中,离心(800×g,5 min)弃上清,收集沉淀的骨髓细胞。以含10% FCS的RPMI-1640完全培养基重悬细胞,并加入200 U/mL GM-CSF细胞因子,将细胞摇匀后置于37℃、5%CO2培养箱中培养,第3天第2天加入等量含有200 U/mL GM-CSF的完全培养基;第6天、第8天半量换液。每天观察DC形态变化、大小、数量、分布及细胞集落生长状况,于培养后第1、3、5、7、10天拍照并用Cellometer Mini细胞计数仪记录细胞生长直径变化。
1.3小鼠骨髓来源DC生长曲线
取原代分离小鼠骨髓DC,将细胞悬液按照2×104/mL接种于24孔培养板,12 h后开始计数,每天取3个孔,用Cellometer Mini细胞计数仪分别计数,计算平均值,共计10 d。根据细胞计数结果,以单位细胞数(细胞数/mL)为纵坐标,以时间为横坐标绘制生长曲线。
1.4流式细胞仪检测DC表面分子的表达
收集培养第10天的DC,分为处理组和对照组。处理组与白念珠菌共培养1 h,对照组不加白念珠菌,流式细胞术检测处理组及对照组的DC表型。将培养第7天的细胞用PBS洗涤2次,调整细胞浓度为1×106个/mL。加入FITC标记的抗鼠CD11c荧光抗体,PE标记的抗鼠CD40、CD80、CD86、MHCⅡ荧光抗体,室温避光孵育20 min,洗涤液洗涤2次,每次加洗涤液2.5 mL,去除游离的荧光抗体,再用2%的多聚甲醛固定液500 μL重悬细胞,流式细胞仪检测CD11c 、CD40、CD80、CD86、MHCⅡ分子的表达,FlowJo软件分析。
1.5激光共聚焦检测DC对白念珠菌吞噬作用[4]
白念珠菌培养及染色白念珠菌于沙堡弱培养基(1%蛋白胨,2%琼脂,4%麦芽糖)培养48 h,挑取沙堡弱培养基上的白念珠菌转种于YPD液体培养基(2%葡萄糖,1%胰蛋白胨,0.5%酵母提取物),30℃恒温摇床振荡培养8 h。取上述培养好的白念珠菌,离心(1 500×g,5 min),PBS洗2遍,调整菌液浓度至5×105/mL,倒掉上清后,加入200 μL FITC溶液(1.25 mmol/L FITC溶于含0.5% DMSO的0.1 mmol/L NaHCO3溶液中,PH9.0)标记,37℃,避光振摇染色1.5 h,PBS冲洗2遍,备用。
DC细胞与白念珠菌共培养取培养第10天的DC,每个培养皿接种5×105个细胞,置于37℃、5%CO2培养箱中培养2 h。分别按DC∶白念珠菌2∶1、1∶1、1∶2、1∶4的比例加入FITC荧光标记的白念珠菌作为试验组,同时按相同比例加入未染色白念珠菌作为对照组,置于37℃、5%CO2培养箱中共培养1 h;将共培养物加入离心管中,PBS洗涤2次,弃掉上清液,后按照PKH26染液说明书进行后续染色操作:向上述沉淀中加入少量的稀释液C重悬细胞,后加入事先准备好的PKH26染液(用稀释液C稀释),立即用吸管均匀快速混合样品,室温孵育4 min(期间轻轻颠倒离心管混匀使染色充分),加入等量血清终止染色反应,孵育1 min,用等量含血清培养基稀释中止的反应液,800 g离心10 min,去上清,PBS清洗3次,制片,激光共聚焦检测。
1.6流式细胞仪检测DC对白念珠菌吞噬作用
按照“DC细胞与白念珠菌共培养”的步骤,DC细胞和FITC染色的白念珠菌分别共培养30 min、1 h、1.5 h后,每孔加入100 μL台盼蓝(250 mg/mL),室温放置1 min以淬灭荧光,PBS洗涤2遍,再用2%的多聚甲醛固定液500 μL重悬,流式细胞仪检测FITC荧光的表达,同时设DC细胞和未染色的白念珠菌做阴性对照。
1.7DC对白念珠菌的杀伤作用[5]
收集第10天的DC,按每孔4×104的密度接种于96孔板,每孔加入100 μL含10% FCS的RPMI-1640完全培养基,并加入200 U/mL GM-CSF细胞因子,将细胞摇匀后置于37℃、5%CO2培养箱中培养过夜。之后实验组分别按DC∶白念珠菌2∶1、1∶1、1∶2、1∶4的比例加入新鲜振摇过夜的白念珠菌,后每孔1∶6倍比稀释;对照组中不加细胞,白念珠菌接种比例同实验组。所有组均设3个复孔。分别于共培养后24 h、48 h用显微镜计数96孔板中的菌落数,从左至右菌落数逐渐减少,观察可清楚计数的孔(比如第6列可清楚计数则乘以依次的稀释倍数65,即为第一列的菌落数)。DC对白念珠菌杀伤比率=(1-实验组菌落数/对照组菌落数)×100%。所有组均设3个复孔。
1.8统计学方法
2 结 果
2.1倒置显微镜观察小鼠骨髓来源DC形态
从倒置显微镜下可以看出,新鲜分离的小鼠骨髓来源DC呈圆形、透亮、体积小;第3天后,在细胞因子的刺激下细胞数量明显增多、体积增大、形状不规则,可见细胞向各个方向伸展细小伪足、大小不一、有细胞聚集现象、呈集落样生长;培养5天后,细胞成簇生长,细胞核呈圆形或椭圆形较小,细胞周边可见明显的细胞毛刺状突起,大部分细胞呈半悬浮状态,细胞体积较以前增大;培养10 d后,多数细胞具有毛刺状突起(见图1)。
2.2小鼠骨髓来源DC直径变化
Cellometer Mini细胞计数仪记录DC生长直径变化(见图2),培养第1天,DC细胞直径较小,分布最多的直径约为5.7 μm;培养第3天,DC直径分布最多的增加到7.9 μm;第5天,增加到8.3 μm;培养到第7天,直径增加到8.6 μm;到第10天时,细胞直径增加到10.2 μm。由直径变化可知,随着培养时间的延长,细胞逐渐增大,此结果与显微镜下观察细胞形态结果一致。
2.3小鼠骨髓来源DC生长曲线
通过10 d连续计数,其生长曲线显示(见图3),DC呈倍数增长,DC在培养第2~9天为细胞对数生长期,第9天左右增殖曲线达到顶峰,停止生长,进入平台期。
2.4流式细胞仪检测DC表面分子的表达
对照组DC表面高水平表达CD11c分子及CD80分子,分别占93.85.67%±2.90%及84.83%±0.31%,CD40、CD86及MHCⅡ低表达,分别为36.4%±0.82%、44.87%±2.44%及33.2%±0.75%;经白念珠菌刺激后,DC表面CD11c、CD80、CD40、CD86及MHCⅡ均高表达,分别为92.4%±0.62%、98.27%±0.71%、92.17%±0.76%、90.73%±0.35%及95.7%±0.46%,见图4。
2.5荧光显微镜检测白念珠菌染色效果
荧光显微镜下观察FITC染色白念珠菌,可见镜下白念珠菌呈绿色,明显可见真菌形态,孢子可见,染色效率可达98%以上(见图5),可以进行后续实验。
2.6激光共聚焦检测DC对白念珠菌吞噬作用
PKH26是一种对细胞膜脂质非常敏感的红色荧光染料,荧光显微镜下可见标记PKH26的DC,染料在细胞膜上分布均匀一致,细胞呈红色荧光,标记效率达100%。通过激光共聚焦扫描成像可以准确地观察到单个DC细胞吞噬白念珠菌的情况(见图6)。由图6可见,随着DC∶白念珠菌比例的减小(由2∶1到1∶4),DC细胞吞噬作用增强,图6e显示DC∶白念珠菌的比例为1∶4时,DC吞噬作用最强,每个DC细胞内可见多个白念珠菌,最多可见9个。
2.7流式细胞仪检测DC对白念珠菌吞噬作用
用流式细胞仪检测不同时间DC对白念珠菌吞噬率,结果见表1。可见在相同的共培养时间,随着DC∶白念比例的减小(由2∶1到1∶4),DC细胞吞噬作用增强,差异有统计学意义(P=0.000;P=0.000;P=0.000);当DC∶白念的比例为1∶4时,DC吞噬作用最强,分别为8.32±0.29、11.73±0.23、11.9±1.22(见表1),此结果与激光共聚焦观察结果一致。DC∶白念珠菌的比例为2∶1、1∶2及1∶4时,随着共培养时间的延长(30 min到1.5 h),吞噬率也明显上升,差异有统计学意义(P=0.003;P=0.002;P=0.002);当DC∶白念珠菌的比例为1∶1时,随着共培养时间的延长(30 min到1.5 h),吞噬率无明显变化(P=0.063)。
2.8DC对白念珠菌杀伤作用
培养后24 h,在显微镜下可观察到白念珠菌菌落,分枝呈树枝状,见图7。分别于共培养后24 h及48 h,在显微镜下计数白念珠菌形成菌落(见表2),可见随着时间的延长,各实验组的杀伤率下降(P=0.000);当DC∶白念珠菌=1∶1时,与2∶1相比,DC杀伤作用明显下降,但随着白念珠菌比例在一定范围内的增高(从1∶1到1∶4),杀伤作用明显增高,差异有统计学意义(P=0.000)。
3 讨 论
DC是目前已知的唯一可以活化Th细胞的专职抗原提呈细胞,也是连接固有免疫和获得性免疫应答的枢纽[6-7]。白念珠菌是一种自然界最常见的分布于多种组织器官的机会性致病菌[8],包括皮肤、口腔、胃肠道、阴道等。随着白念珠菌对各种抗真菌药物的耐药性逐年增加,给临床治疗带来一定的困难。机体通过识别白念珠菌细胞壁及其代谢产物进行不同的免疫应答,由于T细胞在免疫反应中处于核心地位,而DC作为目前已知的唯一可以活化初始辅助性T细胞的专职抗原提呈细胞,研究DC对白念珠菌的抗感染免疫显得尤为重要。
DC起源于骨髓CD34+造血干细胞[9],是1973年由Steinman和Cohn[10]首先由小鼠脾脏组织中分离发现。DC细胞表面具有典型的树突状突起,在体内分布广泛。DC是机体抵御病原菌及毒素等有害物质的第一道防线,当机体受到抗原刺激后,DC可以有效地摄取抗原,并通过抗原肽/MHC分子复合物的形式,将抗原有效提呈给T0细胞,刺激生成Tc细胞,从而启动机体相应的免疫反应。DC的鉴定一般要结合形态、分子表达及其功能3方面进行。本研究从C57小鼠骨髓中分离树突状细胞,并对其进行形态观察和鉴定,经过10 d的体外培养,可达到93%,细胞数量为3×107/只,基本上满足后续实验的要求。本研究通过倒置显微镜观察,细胞由贴壁生长逐渐到半悬浮生长,细胞由圆形逐渐变为不规则,数量明显增多,体积增大,表面出现大量不规则的树突样突起,有细胞聚集现象,呈集落样典型树突状细胞形态。通过对DC连续10 d计数发现,DC呈倍数增长,DC在培养第2~9天为细胞对数生长期,第9天左右增殖曲线达到顶峰,停止生长,进入平台期。DC表面有多种表面标志,包括CD11c、CD83、CD86、MHCⅡ、体内大部分DC处于非成熟状态,通常少量分布于与外界接触的皮肤(黏膜)部位,主要为皮肤和鼻腔、肺、胃与肠的内层,血液中也可发现他们的未成熟型,低水平表达的共刺激因子和黏附因子,体外激发同种混合淋巴细胞增殖反应的能力较低,但未成熟DC具有极强的抗原吞噬能力。作为人体的第一道防线,DC表达多种模式的识别受体,如甘露糖受体、Toll样受体等,可单独或协同识别多种病原微生物(细菌、真菌等),通过胞饮作用、吞噬作用等摄取抗原进而杀伤之,从而行使固有免疫应答。宿主的天然免疫状况决定了对白念珠菌致病的易感性,白念珠菌的酵母、菌丝能被DC介导的固有免疫系统识别,通过不同的机制启动不同的免疫效应。因此检测DC对真菌细胞的吞噬作用及杀伤作用,可以为今后抗感染领域尤其是抗真菌感染领域加强以DC为基础的免疫、基因治疗提供基础。本实验结果发现随着DC∶白念珠菌比例的减小(由2∶1到1∶4),DC细胞吞噬作用增强,当比例为1∶4时,DC吞噬作用最强,此结果与激光共聚焦观察结果一致。DC∶白念珠菌的比例为2∶1、1∶2及1∶4时,随着共培养时间的延长(30 min到1.5 h),吞噬率也明显上升,差异有统计学意义(P=0.003;P=0.002;P=0.002);然当进一步增加白念珠菌的比例,DC与白念珠菌比例为1∶1时,随着共培养时间的延长(30 min到1.5 h),吞噬率无明显变化(P=0.063)。显微镜检测DC对白念珠菌杀伤率,可见随着时间的延长,各实验组的杀伤率下降(P=0.000);当DC∶白念珠菌=1∶1时,较2∶1时,杀伤率明显下降,但随着白念珠菌比例在一定范围内的增高(从1∶1到1∶4),杀伤率明显增高,差异有统计学意义(P=0.000)。这提示当体内白念珠菌量较大时,而体内DC量固定,DC不能有效杀伤白念珠菌,这可能是造成白念珠菌菌局部感染甚至系统性白念珠菌感染的原因之一。

图1倒置显微镜观察小鼠骨髓DC形态学变化:A.第1天(原始放大倍数×20);B.第3天(×20);C.第5天(×20);D.第7天(×20);E.第10天(×20);F.第1天(×40);G.第3天(×40);H.第5天(×40);I.第7天(×40);J.第10天(×40)图2小鼠骨髓DC平均直径变化图图3小鼠骨髓来源DC生长曲线图4DC细胞表面分子表达
Fig.1The morphological of DC were observed by optical microscope:A.1 d(original magnification 20×);B.3 d(original magnification 20×);C.5 d(original magnification 20×);D.7 d(original magnification 20×);E.10 d(original magnification 20×);F.1 d(original magnification 40×);G.3 d(original magnification 40×);H.5 d(original magnification 40×);I.7 d(original magnification 40×);J.10 d(original magnification 40×)Fig.2The average diameter changes of DCFig.3The growth curve of mouse bone marrow-derived dendritic cellsFig.4The positive expression rates of DC
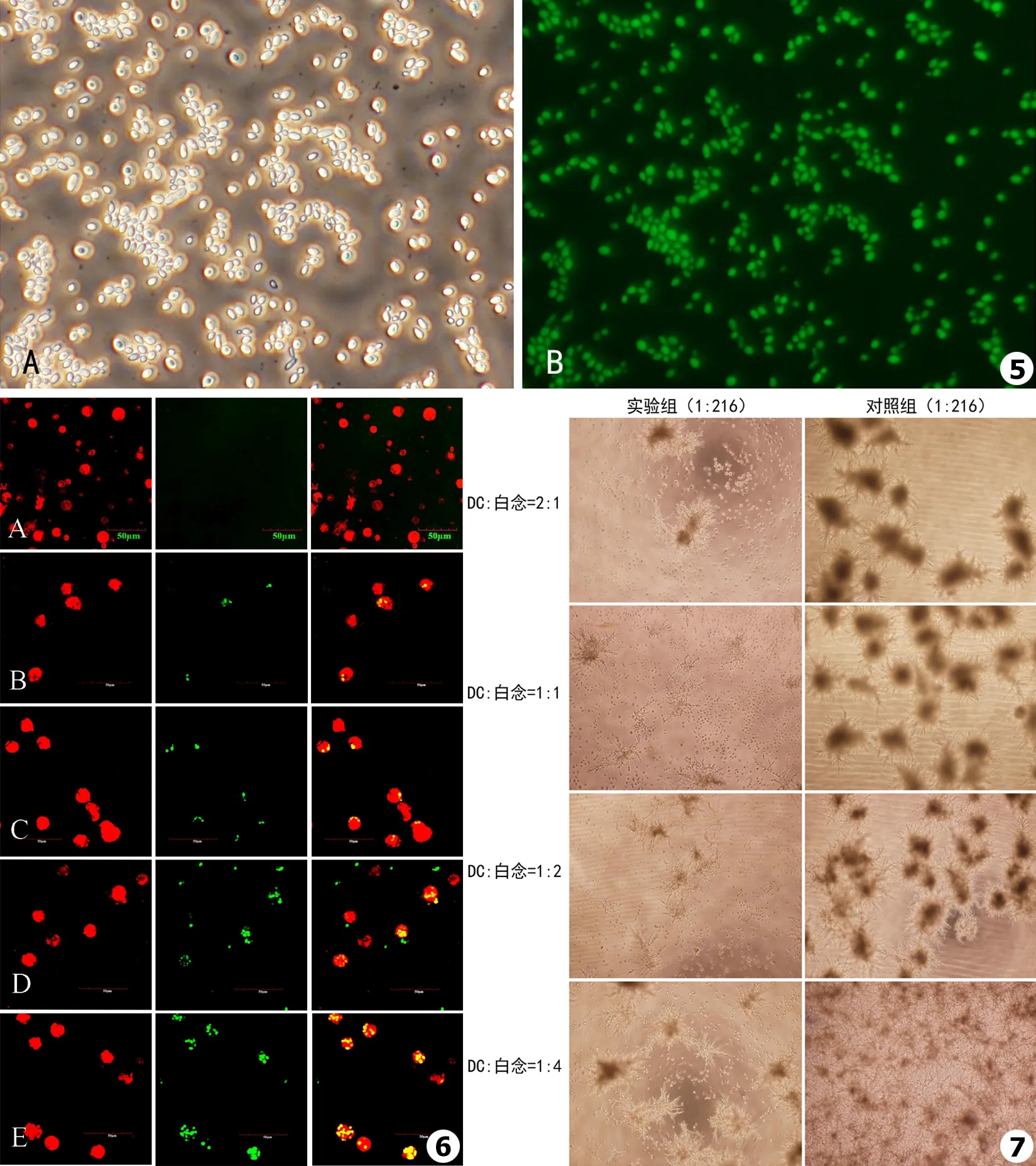
图5荧光显微镜下观察白念珠菌染色(×10,A.白光;B.荧光)图6激光共聚焦检测DC对白念珠菌吞噬作用(×10):A.阴性对照;B.DC∶白念珠菌=2∶1;C.DC∶白念珠菌=1∶1;D.DC∶白念珠菌=1∶2;E.DC∶白念珠菌=1∶4图724 h显微镜下观察白念珠菌形成的菌落(×4)
Fig.5The stainedCandida albicans detected by fluorescence microscope(original magnification 10×,A.white light,B.fluorescence)Fig.6 The phagocytosis of DC against Candida albicans detected by LSCM:A.Negative control;B.DC∶Candida albicans=2∶1;C.DC∶Candida albicans=1∶1;D.DC∶Candida albicans=1∶2;E.DC∶Candida albicans=1∶4Fig.7The colony of Candida albicans detected by microscope after 24 h(original magnification 4×)
表1流式细胞仪检测DC对白念珠菌吞噬率(%)
Tab.1The phagocytosis of DC against Candida albicans detected by flow cytometry

共培养时间2∶11∶11∶21∶4FP30min2.29±0.244.09±0.635.85±1.038.32±0.2938.1430.0001h2.87±0.164.91±0.855.33±1.1511.73±0.2398.7500.0001.5h3.20±0.185.61±0.149.71±0.3411.90±1.22120.9660.000F17.3464.52220.46722.680P0.0030.0630.0020.002
表2显微镜下计数DC对白念珠菌菌落杀伤率(%)
Tab.2The killing rates of DC against Candida albicans detected by microscope
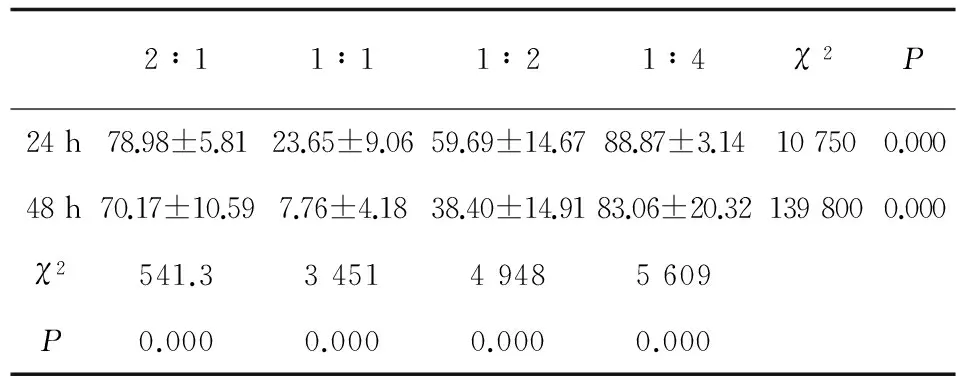
2∶11∶11∶21∶4χ2P24h78.98±5.8123.65±9.0659.69±14.6788.87±3.14107500.00048h70.17±10.597.76±4.1838.40±14.9183.06±20.321398000.000χ2541.3345149485609P0.0000.0000.0000.000
综上所述,本实验自C57小鼠骨髓细胞体外单纯经GM-CSF诱导可培养DC具有较高的纯度及数量,且呈未成熟DC表型,可满足后续实验的DC用量。通过以上实验证实,经过白念珠菌刺激后DC表型成熟;DC对白念珠菌有较强的吞噬及杀伤作用,其吞噬作用随着DC与白念珠菌比例的减小而增强。且随着两者作用时间的延长,DC对白念珠菌的吞噬作用逐渐增强而杀伤作用逐渐减弱。初步揭示了DC与白念珠菌量之间比例变化可能在白念珠菌的发病中起到关键性作用;DC对白念珠菌吞噬及杀伤作用的探讨在白念珠感染性疾病治疗中具有积极的意义。
[1]Zeng Z,liu X,Jiang Y,et al.Biophysical studies on the differentiation of human CD14+ monocytes into dendritic cells[J].Cell Biochem Biophys,2006,45(1):19-30.
[2]Perruccio K,Boza S,Montagnoli C,et al.Prospects for dendritic cell vaccination against fungal infections in hematopoetic transplantation[J].Blood Cells,2004,33(3):248-255.
[3]Gafa V,Remoli MR,Giacomini E,et al.In vitro infection of human dendritic cells by Aspergillus fumigatus conidia triggers the secretion of chemokines for neutrophil and Th1 lymphocyte recruitment[J].Microb Infect,2007,9(8):971-980.
[4]Shi D,Li D,Yin Q,et al.Silenced suppressor of cytokine signaling 1(SOCS1) enhances the maturation and antifungal immunity of dendritic cells in response to Candida albicans in vitro[J].Immunol Res,2015,61(3):206-218.
[5]She X,Zhang L,Chen H,Calderone R,Li D.Cell surface changes in the Candida albicans mitochondrial mutant goa1Delta are associated with reduced recognition by innate immune cells[J].Cell Microbiol,2013,15(9):1572-1584.
[6]Steinman RM,Idoyaga J.Features of the dendritic cell linesge[J].Immunol Rev,2010,234(1):5-17.
[7]Li Y,Zeng X,He L,et al.Dendritic cell activation and maturation induced by recombinant calreticulin fragment 39-272[J].Int J Clin Exp Med,2015,8(5):7288-7296.
[8]Magalhães YC,Bomfim MR,Melnio LC,et al.Clinical significance of the isolation of Candida species from hospitalized patients[J].Braz J Microbiol,2015,46(1):117-123.
[9]Wang Y,Liang Y,Zhang Y,et al.Bortezomib inhibits bone marrow-derived dendritic cells[J].Int J Clin Exp Pathol,2015,8(5):4857-4862.
[10]Steinman RM,Chon ZA.Identification of a novel cell type in peripheral lymphoid organs of mice.I.Morphology,quantitation,tissue distribution[J].J Exp Med,1973,137(5):1142-1162.
[11]Fidan I,Kalkanci A,Yesilyurt E,et al.In vitro effects of Candida albicans and Aspergillus fumigatus on dendritic cells and the role of beta glucan in this effect[J].Adv Clin Exp Med,2014,23(1):17-24.
[12]Reschner A,Hubert P,Delvenne P,et al.Innate lymphocyte and dendritic cell cross-talk:a key factor in the regulation of the immune response[J].Clin Exp Immunol,2008,152(2):219-226.
[本文编辑]王飞
The study of mouse bone marrow-derived dendritic cells phagocytosis and cytotoxicity against Candida albicans in vitro
WANG Qiong1,SHI Dong-mei2,LIU Wei-da1
(1.Institute of Dermatology,Chinese Academy of Medical Science & Peking Union Medical College,Nanjing 210042,China;2.Department of Dermatology,Jining No.1 People’s Hospital,Jining 272011,China)
ObjectiveMouse bone marrow-derived dendritic cells were isolated and cultured in vitro and co-incubated with Candida albicans,in order to study the phenotype,phagocytosis and cytotoxicity of which against Candida albicans under different concentration and time.MethodsDendritic cells from C57 mouse bone marrow were isolated and cultured under aseptic conditions.The morphological and the growth curve and cell diameter of DC were observed by optical microscope and Cellometer Mini cell counter.The expression levels of CD11c,MHCII,CD40,CD80 and CD86 of DC were measured by flow cytometer.The phagocytosis and cytotoxicity of DC against Candida albicans were detected by microscope,Laser Scanning Confocal Microscope(LSCM) and flow cytometry.ResultsTypical morphology of DC cells was observed under inverted microscope 10 days after culture.10.2 μm was the most widely distributed diameter of DC as illustrated and the size of DC increased with the extension of incubation time.The growth curve showed that DC increased multiply.After inoculation,2-9 days were logarithmic phase and stagnate phase was from 9 days.The result of immunological phenotype detected by FCM showed that the CD11c and CD80 were highly expressed and MHCII,CD40,CD86 were lower expressed in control group.After stimulated by Candida albicans,the DC were appeared mature phenotype and CD11c,CD80,CD40,CD86 and MHCⅡ were all highly expressed.As the ratio(DC∶Candida albicans) reduced(from 2∶1 to 1∶4),the phagocytosis effects of DC enhanced and the strongest effect appeared when the ratio was 1∶4.When the ratio was 1∶1,the phagocytosis effects of DC was no significant change(P=0.063) with the extension of co-incubation time(30 min to 1.5 h).But when the ratio were 2∶1,1∶2 and 1∶4,the phagocytosis effects of DC were obviously rised with the extension of co-incubation time(30 min to 1.5 h),a statistically significant difference(P=0.003,P=0.002,P=0.002).When co-incubation time was prolonged,the cytotoxicity of DC was dramatic descend(P=0.000) detected by microscope.When the ratio(DC∶Candida albicans) was 1∶1,compared with the 2∶1 group,the cytotoxicity effects of DC was dramatic declined.But when the ratio of Candida albicans increased within limits(from 1∶1 to 1∶4),the cytotoxicity was significantly increased(P=0.000),with statistical significance.Conclusion Dendritic cells isolated from mouse bone marrow had high purity and immature cell phenotype.We could obtain 3×107cells per C57 mouse DC which could meet the requirements of experiments very well.After stimulated by Candida albicans,mature DCs were obvious increased.DC had strong phagocytosis and cytotoxicity against Candida albicans,and the effects of phagocytosis and cytotoxicity enhanced with the ratio(DC∶Candida albicans) reduced.When co-incubation time was prolonged,the phagocytosis of DC against Candida albicans was increased and the cytotoxicity was decreased.
bone marrow;dendritic cells;Candida albicans;phagocytosis;cytotoxicity
973计划项目(2013CB531605);国家自然科学基金(81401653);山东省自然科学基金(ZR2015HL127);济宁市医学科学计划(2014jnnk13)
王琼,女(汉族),硕士,主管技师.E-mail:chongziqiong@163.com
史冬梅,E-mail:shidongmei28@163.com
R 379.4
A
1673-3827(2016)11-0193-08
2016-01-20
