Dectin-1及相关细胞因子在足菌肿皮损中的表达
2016-09-28伍方佩胡小平于波陈朝丰刘晓云黄国新
伍方佩 胡小平 于波 陈朝丰 刘晓云 黄国新
(北京大学深圳医院皮肤科,深圳 518000)
·论著·
Dectin-1及相关细胞因子在足菌肿皮损中的表达
伍方佩胡小平于波陈朝丰刘晓云黄国新
(北京大学深圳医院皮肤科,深圳 518000)
目的观察Dectin-1在真菌性足菌肿皮损中的表达,初步分析其在足菌肿发病中的作用。方法实验分为3组,A组8例足菌肿病例,B组为10例着色芽生菌病病例,A组和B组统称为感染组,C组为18例正常皮肤组织。应用免疫组化法检测3组病例的组织蜡块中Dectin-1、IL-4,IL-10,IFN-γ,TNF-α的表达。结果与正常组相比,感染组皮肤的Dectin-1、IL-4、IFN-γ、TNF-α、IL-10的积分光密度增高(P<0.05)。A组与B组相比,两组间Dectin-1、IL-4、IFN-γ,TNF-α的积分光密度值比较无差异(P>0.05)。结论真菌感染皮损中Dectin-1的表达上调,可能说明Dectin-1在足菌肿发病中具有一定作用。
Dectin-1;真菌性足菌肿;IL-4;IL-10;IFN-γ;TNF-α
[Chin J Mycol,2016,11(4):201-204]
Dectin-1可介导识别包括曲霉属在内的多种真菌病原体,通过Dectin-1识别这些菌体可促进机体的保护性应答反应,包括对真菌的摄取及杀伤(通过呼吸爆发介导),以及产生大量的细胞因子和趋化因子包括TNF、IL-1、IL-6和粒细胞、单核细胞集落刺激因子等[1]。本研究通过观察Dectin-1及细胞因子IL-4、IL-10、IFN-γ、TNF-α在真菌性足菌肿皮损中的表达变化,初步分析Dectin-1在足菌肿发病中的作用。
1 材料与方法
1.1材料
收集患者的组织蜡块在北京大学深圳医院皮肤科门诊,从2012~2015年收集了8例真菌性足菌肿和10例着色芽生菌病患者,分别为A组和B组。根据患者临床表现,病理活检和真菌学检查确诊,皮损活检后制成蜡块保存备用。确诊的患者中有14名男性和4名女性,平均年龄46.9岁(26~69岁)。A组共有8例患者,男性7例,女性1例,平均年龄47.5岁;B组10例患者,男性7例,女性3例,平均年龄46.5岁。同时整形外科留取18例正常的皮肤组织,制成蜡块保存备用,分为正常C组,同时进行组织的免疫组化。本实验通过医院伦理委员会批准。
主要试剂生物技术公司Abcam Anti IL-4 antibody(ab9622)、Anti IL-10 antibody(ab34843)、Anti-Interferon gamma antibody(ab25101)、Anti-TNF alpha antibody(ab6671)、Anti-beta Glucan Receptor antibody(ab189961);中杉金桥PV-6001兔二步法检测试剂盒(K142304F);中杉金桥PV-9003山羊超敏二步法检测试剂盒(K145620B);中杉金桥ZLI-9036 AEC酶底物试剂盒(K146620D);中杉金桥ZLI-9056进口羊血清工作液(15A52806)。
1.2方法
蜡块切片后的病理切片置入65度恒温烤箱烤片1 h,然后进行常规的无水二甲苯脱水,由高到低浓度梯度酒精复水,随后使用pH=6.0的枸橼酸钠煮沸抗原修复,3%双氧水浸泡阻断内源性过氧化物酶,正常羊血清工作液封闭非特异性抗原1 h,分别滴加稀释单抗孵育12 h。第2天常温下复温15 min,滴加相应二抗常温静置45 min,AEC染色,静置5~10 min,显微镜下观察病理组织是否染色。苏木素液体浸泡复染5 min,分化液分化,流水冲洗10 min,待显微镜下观察细胞核显色后,晾干水性胶水固定,盖玻片完成。与之前制备好的阳性玻片进行对比。用显微成相系统进行照相。
1.3统计方法
使用Image-Pro Plus软件分析免疫组化图片并进行半定量比较,Spss 13.0统计软件分析统计数据(见图1)。
2 结 果
对A、B、C组之间Dectin-1、IL-4、IL-10、IFN-γ,TNF-α的积分光密度值分别进行两独立样本t检验(见表1,图2)。

表1 A、B、C组间t、P值的比较
2.1A和B组与C组积分光密度值比较
与C组相比,感染组A和B组皮肤的Dectin-1、IL-4、IFN-γ,TNF-α,IL-10的积分光密度值均增高(P<0.05)(见图3)。
2.2A组与C组积分光密度值比较
与C组相比,A组IL-4、IFN-γ的积分光密度值增高(P<0.05),而A组Dectin-1、IL-10、TNF-α积分光密度值无统计学差异(P>0.05)。
2.3B组与C组积分光密度值比较
与C组相比,B组IL-4、IFN-γ、IL-10、TNF-α的积分光密度值增高(P<0.05),而B组Dectin-1积分光密度值无统计学差异(P>0.05)。
2.4A组与B组积分光密度值比较
A组与B组相比,两组间Dectin-1、IL-4、IFN-γ,TNF-α的积分光密度无统计学差异(P>0.05)。
3 讨 论
Dectin-1属第V组C型凝集素,是由胞外C型凝集素样碳水化合物识别域(CTLD)、短杆(Stalk)和具有免疫受体酪氨酸激酶活化基序(ITAM)的胞质尾部构成的糖基化的II型跨膜受体。人Dectin-1基因编码33 kDa的糖蛋白,其多肽由247个氨基酸残基组成。过去在对酿酒酵母、白色念珠菌的识别和非调理素性吞噬过程中,阻断Dectin-1可显著抑制巨噬细胞对酵母多糖的吞噬[2],这提示Dectin-1可识别具有β-1,3连接和β-1,6连接的葡聚糖。又有研究发现Dectin-1是α-甘露糖的特异性受体[3]。因而Dectin-1是β-葡聚糖和α-甘露糖的特异性受体。Palma等[4]研究发现吞噬细胞、树突状细胞、中性粒细胞通过Dectin-1识别β-葡聚糖,表明Dectin-1广泛分布于髓样细胞,包括巨噬细胞、DC和中性粒细胞。而在人正常表皮中,Dectin-1蛋白选择性表达于朗格罕细胞。Li等[5]对真菌性角膜炎的研究发现,Dectin-1在正常角膜上皮和真菌感染的角膜上皮均有表达,而体外实验发现角膜上皮细胞在曲霉抗原刺激24 h后表达增加。
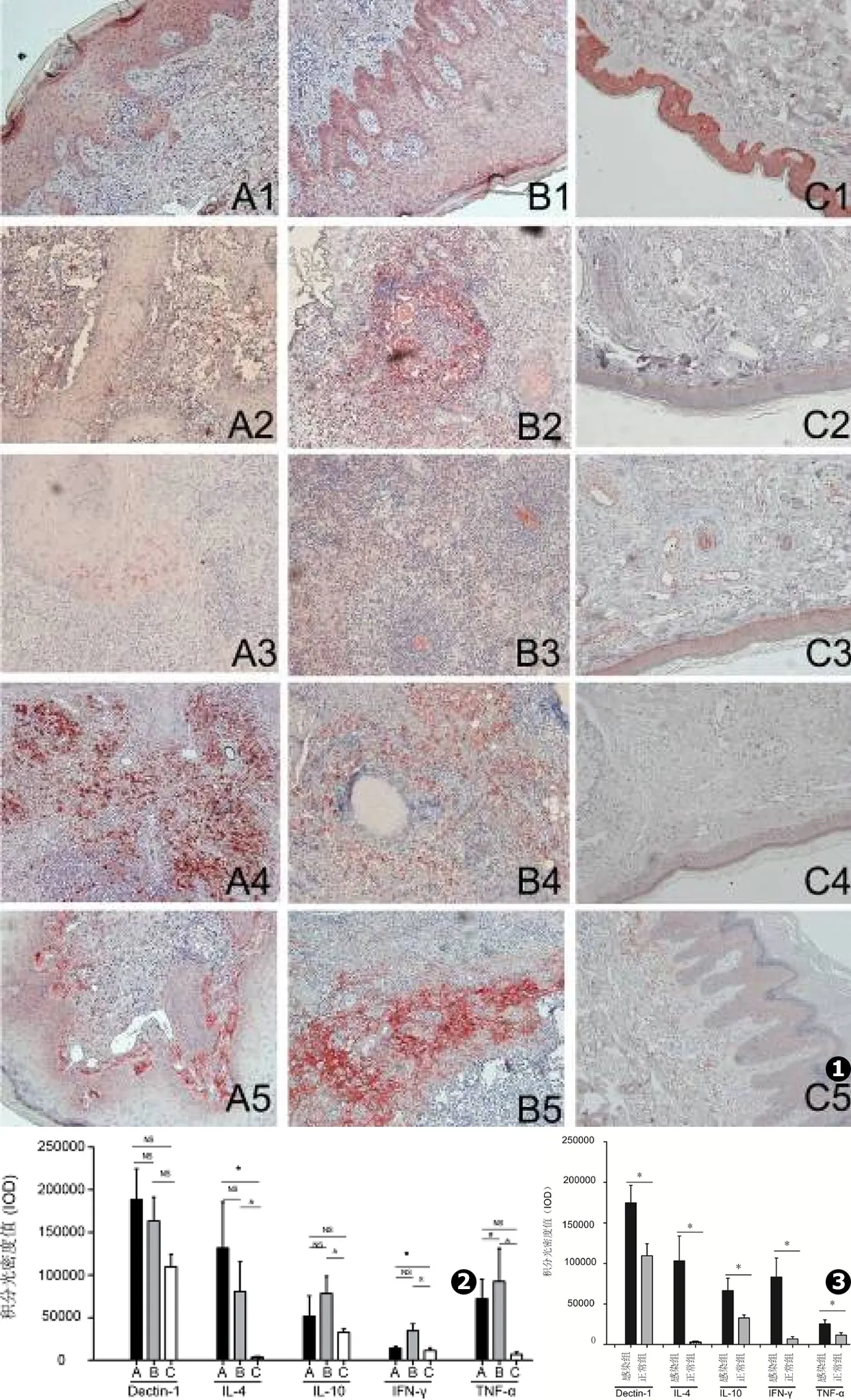
图1各组免疫组化的比较:A1、A2、A3、A4、A5为A组Dectin-1、IL-4、IL-10、IFN-γ、TNF-α的表达;B1、B2、B3、B4、B5为B组Dectin-1、IL-4、IL-10、IFN-γ、TNF-α的表达;C1、C2、C3、C4、C5为C组Dectin-1、IL-4、IL-10、IFN-γ、TNF-α的表达图2各组积分光密度值的比较(* # &表示两组间具有统计学意义)图3感染组与正常组积分光密度的比较(*表示两组间具有统计学意义)
Fig.1Comparison of each immunohistochemical group:A1-A5.The group A expression of Dectin-1,IL-4,IL-10,IFN-γ,TNF-α;B1-B5.The group B expression of Dectin-1,IL-4,IL-10,IFN-γ,TNF-α;C1-C5.The group C expression of Dectin-1,IL-4,IL-10,IFN-γ,TNF-α)Fig.2The comparison of each integral optical density valuesFig.3The comparison of the integral optical density values between the infected group and normal group
本研究中发现A、B、C三组皮肤中均可以表达Dectin-1。在正常表皮,Dectin-1表达于郎罕氏细胞,本实验中Dectin-1正常组皮肤表达证实了Dectin-1可以作为一种模式识别分子存在于表皮。真菌感染组A、B组皮肤中Dectin-1的表达高于正常皮肤组,推测当真菌感染皮肤组织,树突状细胞和吞噬细胞通过Dectin-1识别真菌β-葡聚糖,趋化中性粒细胞等炎性细胞,因大多数固有免疫细胞表面均有Dectin-1的表达,导致感染组的Dectin-1升高。
有研究报道,组织荚膜菌感染CRR2-小鼠,使其体内IL-4明显上升,且在小鼠肺部产生高浓度IL-4。升高的IL-4抑制宿主抗真菌感染,导致小鼠因感染加重而死亡[6]。IL-4能刺激吞噬细胞产生一种能减少产生一氧化氮获得抗真菌活性的精氨酸酶-1[7]。此外,IL-4能够阻滞粒细胞巨噬细胞刺激因子的活化,提高细胞内的锌以维持真菌生长[8-9],因此认为IL-4能够抑制抗真菌免疫。宿主对病原真菌有效的适应性免疫反应主要依靠Thl和Thl7的共同协同作用,而菌体的生长则主要依靠抑制Thl、Thl7和上调Th2细胞的免疫反应[10-11]。d'Avila等[12]对着色芽生菌病不同临床时期如疣状斑块期和萎缩红斑期进行研究时发现,所有的皮损组织均表达IL-4,因此推测为机体启动细胞免疫。
本研究中发现IL-4可以在正常组织和真菌感染组织中表达,而真菌感染皮肤组织中IL-4的表达高于正常组,推测本研究中感染组的标本均来源为疾病中晚期患者,着色芽生菌病患者临床表现主要为疣状斑块、萎缩性斑块或者混合型,而足菌肿患者主要表现为肉芽肿结节,机体启动了Th2细胞免疫,抑制抗真菌作用,同时IL-4是一种典型的Th2细胞因子,还可以促进伤口愈合、组织修复[13],因而IL-4的产生可以促进患者组织的纤维化,修复伤口。
Hardison等[14]研究发现硫代乙酸纳诱导的Dectin-1缺失的巨噬细胞中,β-葡聚糖诱导细胞因子生成的过程被大部分阻断,巨噬细胞几乎无法表达TNF-α、IL-10。吴呈霖等[15]研究将24只大鼠随机分为两组,感染组用热处理的光滑念珠菌处理侵袭大鼠肺部,对照组不做处理,在第3、6天测定两组大鼠肺泡灌洗液中IL-10、TNF-α的表达及肺组织,发现感染组肺组织Dectin-1及肺泡灌洗液中IL-10、TNF-α的表达呈进行性升高。这些研究均表明在真菌感染组织中TNF-α、IL-10的表达均与Dectin-1呈相关性。
本研究中真菌感染组织皮肤中TNF-α、IL-10的表达同d'Avila的研究结果一致。d'Avila等[12]对不同程度着色芽生菌病患者的皮损进行免疫组化研究时,发现TNF-α在全部皮损中表达,IL-10在大多数的皮损中表达。TNF-α是多功能细胞因子,主要由树突状细胞和吞噬细胞产生,调节炎症性和免疫反应,导致细胞内感染的细胞凋亡。推测在真菌感染后期,聚集的吞噬细胞通过Dectin-1的表达产生大量的细胞因子TNF-α,抑制皮肤组织增生。IL-10作为Th2细胞因子,作用是免疫抑制,能阻抑T细胞和单核巨噬细胞的活性和功能[16]。推测本研究中入组的患者真菌感染机体后活化固有免疫,免疫反应持续加强,IL-10表达增加,抑制Th1促炎反应,避免组织伤害。
胡志德等[17]发现不同浓度Dectin-1封闭剂昆布多糖与PBMC培养1 h后,再用热灭活白念珠菌刺激PBMC 4 d,再用不同剂量的Dectin-1激活剂酵母聚糖刺激PBMC 4 d,收集培养液上清检测IFN-γ水平,在此体系中加入不同浓度的昆布多糖则可以部分抑制热灭活白念珠菌诱导IL-12和IFN-γ的能力,且具有浓度依赖。这提示Dectin-1的激活可能是导致Th1相关的细胞因子IFN-γ生成的原因。Gow等[18]研究发现经热处理杀死的白念珠菌能使其细胞壁最内层的β-葡聚糖暴露从而被Dectin-1识别。用人、鼠腹腔巨噬细胞培养液分别与活白念珠菌、紫外线杀死、热杀死白念珠菌孵育,热杀死组较活的白念珠菌释放更高的IFN-γ,而经Dectin-1阻断剂阻断后,热杀死组IFN-γ释放无差异。这提示了IFN-γ的产生有Dectin-1的参与,可能同时存在其他途径。
本次研究中感染组皮损IFN-γ表达较正常皮肤组升高,考虑为真菌感染后期启动Th1细胞免疫,IFN-γ是Th1细胞因子。这个结果与d'Avila等[12]的研究发现是相违背的,考虑原因可能是测量研究数据的方式不一样,因此得到的结果也不一样。A组与B组皮损中IFN-γ结果无差异,考虑原因还是研究对象例数不够。
综上,本研究中验证了Dectin-1在正常皮肤和真菌感染的皮肤均可以表达。在足菌肿与着色芽生菌病中Dectin-1表达的无差异,推测Dectin-1受体识别真菌的防御普遍存在于皮肤真菌感染疾病。而真菌性足菌肿皮损中Dectin-1的表达上调,可能说明Dectin-1在足菌肿发病中具有一定作用。
[1]Drummond RA,Saijo S,Iwakura Y,et al.The role of Syk/CARD9 coupled C-type lectins in antifungal immunity[J].Eur J Immunol,2011,41(2):276-281.
[2]Diniz SN,Nomizo R,Cisalpino PS,et al.PTX 3 function as an opsonin for the dectin-1-dependent internalization of zymosan by macrophages[J].J Leukoc Biol,2004,75(4):649-656.
[3]Saijo S,Ikeda S,Yamabe K,et al.Dectin-2 recognition of a-mannans and induction of Th17 cell differentiation is essential for host defense against Candida albicans[J].Immunity,2010,32(5):681-691.
[4]Palma AS,Feizi T,Zhang Y,et al.Ligands for the beta-glucan receptor,Dectin-1,assigned using designer microarrays of oligosaccharide probes(neoglcolipids) generated from glucan polysaccarides[J].J Biol Chen,2006,281(9):5771-5779.
[5]Li C,Zhao GQ,Che CY,et al.Expression of dectin-1 during fungus infection in human corneal epithelial cells[J].Int J Ophthalmol,2014,7(1):34-37.
[6]Szymczak WA,Deepe GS Jr.The CCL7-CCL2-CCR2 axis regulates IL-4 production in lungs and fungal immunity[J].J Immunol,2009,183(3):1964-1974.
[7]Davis MJ,Tsang TM,Qiu Y,et al.Macrophage M1/M2 polarization dynamically adapts to changes in cytokine microenvironments in Cryptococcus neoformans infection[J].MBio,2013,4(3):e00213-00264.
[8]Subramanian Vignesh K,Landero Figueroa JA,Porollo A,et al.Granulocyte macrophage-colony stimulating factor induced Zn sequestration enhances macrophage superoxide and limits intracellular pathogen survival[J].Immunity,2013,39(4):697-710.
[9]Winters MS,Chan Q,Caruso JA,et al.Metallomic analysis of macrophages infected with Histoplasma capsulatum reveals a fundamental role for zinc in host defenses[J].J Infect Dis,2010,202(7):1136-1145.
[10]Wevers BA,Kaptein TM,Zijlstra-Willems EM,et al.Fungal angagement of the C-type lcctin mincle suppresses dectin-1-induced antifungal immunity[J].Cell Host Microbe,2014,15(4):494-505.
[11]Wuthrieh M,Deepe Gs Jr,Klein B.Adaptive immunity to fungi[J].Annu Rev Immunol,2012,30:115-148.
[12]d'Avila SC,Pagliari C,Duarte MI.The cell-mediated immune reaction in the cutaneous lesion of chromoblastomycosis and their correlation with different clinical forms of the disease[J].Mycopathologia,2002,156(2):51-60.
[13]Gause WC,Wynn TA,Allen JE.Type 2 immunity and wound healing:evolutionary refinement of adaptive immunity by helminths[J].Nat Rev Immunol,2013,13(8):607-614.
[14]Hardison SE,Brown GD,Gringhuis SI.C-type lectin-1 receptors Orchestrate anti-fungal immunity[J].Immunol,2012,13(9):817-822.
[15]吴呈霖,骆雪萍,吴晔,等.大鼠侵袭性肺部热处理光滑念珠菌感染肺组织Dectin-1和IL-10的表达[J].广东医学,2014,35(22):3468-3470.
[16]Xu Q,Zhao G,Lin J,et al.Role of Dectin-1 in the innate immune response of rat corneal epithelial cells to Aspergillus fumigatus[J].BMC Ophthalmology,2015,15:126.
[17]胡志德,黄元兰,孙懿,等.热灭活白念珠菌通过Dectin-1诱导外周单个核细胞表达IL-12和IFN-y[J].现代免疫学,2011,31(1):48-51.
[18]Gow NA,Netea MG,Munro CA,et al.Immune Recognition of Candida albicans β-glucan by Dectin-1[J].J Infect Dis,2007,196(10):1565-1571.
Express of Dectin-1 and related cytokines in skin with eumycetic mycetoma
WU Fang-pei,HU Xiao-ping,YU Bo,CHEN Chao-feng,LIU Xiao-yun,HUANG Guo-xin
(1.Department of Dermatology,Peking University Shenzhen hospital,Shenzhen 518000)
ObjectiveTo observe the expression of dectin-1 in the skin with eumycetic mycetoma,and to analyze the role of the pattern recognition receptors dectin-1 when the skin infected with eumycetic mycetoma.MethodsThere were three experiment al groups,group A included 8 cases of chromoblastomycosis,and group B contained 10 cases of mycetoma.The infection group included group A and B.The normal group contained 18 normal skin tissue.The expression of Dectin-1,IL-4,IL-10,IFN-γ and TNF-α were tested by immunohistochemical method in the paraffin embedded tissues.ResultsCompared with normal group,the integral optical density values of Dectin-1,IL-4,IFN-γ,TNF-α,IL-10 of the infected group were increased(P<0.05).The integral optical density values of Dectin-1 and IL-4,IFN-γ,TNF-α had no difference between group A and B.ConclusionIncreased expression of Dectin-1 of the skin with eumycetic mycetoma,suggested that Dectin-1 might have a certain role on the skin with fungal infection.
Dectin-1;eumycetic mycetoma;IL-4;IL-10;IFN-γ;TNF-α
深圳市科创委基金(JCYJ20140415162542984);深圳市卫计委基金(201401028)
伍方佩,女(汉族),硕士研究生在读.E-mail:491937713@qq.com
胡小平,E-mail:47776040@qq.com
R 756.6
A
1673-3827(2016)11-0201-04
2016-02-18[本文编辑]卫凤莲
