板蓝根及其所含靛蓝和靛玉红对小鼠肾有机阳离子转运体OCT1和OCT2的影响
2016-09-26奇锦峰余文浩王永辉广州中医药大学药理教研室广东广州50006驻马店人民医院药剂科河南驻马店46000佛山南海中医院西药房广东佛山5800
张 娜,奇锦峰,孙 晨,余文浩,王永辉,林 梅(.广州中医药大学药理教研室,广东广州 50006;.驻马店人民医院药剂科,河南驻马店 46000;.佛山南海中医院西药房,广东佛山 5800)
板蓝根及其所含靛蓝和靛玉红对小鼠肾有机阳离子转运体OCT1和OCT2的影响
张 娜1,奇锦峰1,孙 晨1,余文浩1,王永辉2,林 梅3
(1.广州中医药大学药理教研室,广东广州 510006;2.驻马店人民医院药剂科,河南驻马店 463000;3.佛山南海中医院西药房,广东佛山 528200)
目的 探讨板蓝根饮片水煎液(DRI)、板蓝根颗粒(GRI)及其所含成分靛蓝、靛玉红对小鼠肾有机阳离子转运体(OCT)中2个主要亚型OCT1和OCT2的影响。方法 NIH小鼠每组60只,分别ig给予DRI 1.6 和6.4 g·kg-1(生药量),GRI 0.615和2.460 g·kg-1,靛蓝0.008和0.640 mg·kg-1,靛玉红0.0192和1.5360 mg·kg-1,每天2次,连续5 d。同时设纯水和0.5%羧甲纤维素钠(CMC)为对照组,糊精加蔗糖(各1.5 g·kg-1)添加剂组和奎尼丁(0.025 g·kg-1)阳性对照组。末次给药后60 min静脉注射二甲双胍(Met)5 mg·kg-1,给Met后1.0,2.5,5.0,7.5,10.0和20.0 min时每组分别各取10只小鼠处死,收集全血并摘取双肾,右肾匀浆后测定Met蓄积量,左肾用于检测OCT mRNA表达。另取NIH小鼠每组10只,同法给药,摘取左肾制备肾切片进行Met摄取实验。用高效液相色谱法测定血清、肾组织及肾切片匀浆液中Met浓度;药动学软件(DAS 2.0)分析血清及肾组织中Met的主要药动学参数;实时定量PCR法测定小鼠肾OCT1和OCT2 mRNA的表达。结果 与纯水对照组比,0.5%CMC组和蔗糖加糊精组各项检测指标均无显著性差异;DRI 6.4 g·kg-1、GRI 2.460 g·kg-1、靛蓝0.640 mg·kg-1和靛玉红1.5360 mg·kg-1组血液药动学参数均出现显著变化(P<0.05,P<0.01):t1/2β延长13%~97%,Vd减少13%~72%,Cl降低9%~65%,AUC0-20 min增加13%~135%;各供试物组肾组织Met蓄积量显著升高(P<0.01);肾切片Met摄取量均明显降低(P<0.05,P<0.01);肾组织OCT1和OCT2 mRNA表达水平均不同程度下调(P<0.05,P<0.01)。结论 DRI、GRI、靛蓝和靛玉红在所用剂量下对小鼠肾OCT1和OCT2均有明显抑制作用,DRI和GRI的这种抑制作用可能主要来自其所含的靛蓝和靛玉红。
板蓝根;靛蓝;靛玉红;二甲双胍;有机阳离子转运体
生理pH下约40%的常用处方药是有机阳离子,这些化合物最终由肾、肝和脉络丛的有机阳离子转运体(organic cation transporters,OCT)系统处理[1]。OCT是溶质转运(solute carrier,SLC)超家族中SLC22A基因大家族的成员[2],其主要成员OCT1和OCT2主要表达于肾近曲小管上皮细胞基底膜侧,参与多种内、外源性物质,包括临床药物的转运及排泄。转运体的易调控性是引起代谢性药物相互作用的原因之一,而OCT也具有这种特性。药物相互作用一方面可导致药物的药效减弱或毒性增加,另一方面亦可作为降低药物毒副作用的辅助手段[3]。OCT介导的药物相互作用已引发不少严重的药害事件,例如喷他脒和呋喃二脒[4]、铂类衍生物[5]和双胍类药物[6]。
近年来,关于板蓝根的不良反应时有报道,其中不乏致肾衰的案例[7]。本实验室已发表的板蓝根致肾衰的可能机制是抑制了有机阴离子转运体(organic anion transporters,OAT)中的几个主要成员[8]。本文报道板蓝根及其所含靛蓝(indigo)和靛玉红(indirubin)对肾OCT中的2个主要亚型OCT1 和OCT2的影响。
1 材料与方法
1.1动物、药物、试剂和仪器
SPF级NIH小鼠,雌雄各半,体质量22~30 g,广州中医药大学实验动物中心,动物合格证号SCXK(粤)2013-0020。饲养条件为室温20~26℃,湿度50%~70%,12 h明暗交替,随意摄食饮水。动物福利和实验均符合相关实验动物管理条例和实验动物伦理要求。板蓝根饮片水煎液(decoction of Radix Isatidis,DRI),广州采芝林药业有限公司,批号YPA4H0001,经广州中医药大学中药学院黄海波教授鉴定为北板蓝根;板蓝根颗粒(granules of Radix Isatidis,GRI),广州市香雪制药股份有限公司,批号201309108;靛蓝(98%,批号110716)、靛玉红(95%,批号110717)、盐酸二甲双胍(metformin,Met,97%,批号M107827)、奎尼丁(quinidine,98%,批号1308376)和辛烷磺酸钠(98%,批号L8707),均购自阿拉丁试剂有限公司;Folin-酚蛋白定量试剂盒,北京鼎国昌盛生物技术公司;总RNA提取试剂、PrimeScriptTMRT试剂盒和SYBR®Premix Ex TaqTMⅡ试剂盒,均购自日本TaKaRa公司;特异性引物(上海生工生物工程有限公司)序列[9]见表1。甲醇为色谱纯;其他常用试剂均为市售分析纯。
Himac CR22G高速冷冻离心机,日本日立制作所;G7-953T组织匀浆机,日本As One公司;WFG7200紫外可见分光光度计,尤尼柯上海仪器有限责任公司;SmartSpec plus核酸蛋白检测仪,美国Bio-Rad公司;ABI7500实时定量PCR仪,美国Applied Biosystems公司;日立L2000高效液相色谱系统:L2130泵,L2420紫外检测器,L2200自动进样器,上海天美科学仪器有限公司。
板蓝根水提物的制备[10]及板蓝根类供试物所含靛蓝和靛玉红的定量方法同文献[11]。
1.2OCT功能检测实验[12]

Tab.1 Primer sequences for real time PCR[9]
受试小鼠随机分为12组:纯水对照组,0.5%羧基纤维素钠(sodium carboxymethyl cellulose,CMC)对照组(奎尼丁、靛蓝、靛玉红均用CMC研磨成细腻的混悬液),糊精加蔗糖添加剂组(各1.5 g kg-1),奎尼丁0.025 g·kg-1阳性对照组,DRI 1.6和6.4 g·kg-1(生药量)组,GRI 0.615和2.460 g·kg-1组,靛蓝0.008和0.640 mg·kg-1组,靛玉红0.0192和1.5360 mg·kg-1组,每组60只,各供试物灌胃给药20 mL kg-1,每天2次,连续5 d。末次给药60 min后,所有受试小鼠iv给予Met 5 mg·kg-1。给Met后1.0,2.5,5.0,7.5,10.0和20.0 min时每组各取10只小鼠颈椎脱臼处死取全血,室温放置60 min后3000×g离心5 min,取血清-20℃保存;迅速摘取双肾并即刻存入-80℃冰箱,右肾用于OCT功能检测实验,左肾用于OCT mRNA表达量检测。取出-80℃保存的小鼠右肾,剪成2 mm小块放入电动匀浆器中,加入5倍量的磷酸盐缓冲液(pH 7.4)后匀浆(20 s×5次,每次间隔10 s),20 000×g离心30 min后弃沉淀,Folin-酚法测定上清中蛋白质含量。按文献[13]方法测定肾组织和血清中Met含量。日本岛津公司C18色谱柱150 mm×4.6 mm,粒径5 μm;流动相:磷酸二氢钠5 mmol L-1,含辛烷磺酸钠2 mmol L-1,有机相为甲醇。水相∶有机相= 80∶20(V∶V)。流速1.0 mL min-1,室温25℃,检测波长235 nm,进样量20 μL。
1.3肾切片摄取Met实验[12]
取SPF级NIH小鼠,每组10只,给药方法同1.2(糊精加蔗糖对照组略)。末次给药后60 min处死,迅速摘取左肾于已消毒的瓷板上。用无菌手术刀片从肾门沿长轴将肾均分成2份。每份沿长轴切成均等3条(约2 mm厚),再将其均等切成3块。冰冷PBS涮洗后用滤纸吸干,放入24孔培养板(内有氧饱和的PBS 1 mL,含Met 0.604 mmol L-1,每孔1个肾),置5%CO2培养箱中37℃孵育20 min,每隔5 min振摇5 s。取出培养板后迅速加入250 μL甲醇振摇混匀以终止反应。按1.2方法制备肾切片匀浆和测定蛋白,并测定肾切片中Met浓度,色谱条件同1.2。Met的摄取量以mg g-1蛋白表示,并计算出各组摄取量占对照组摄取量的百分比。
1.4实时定量PCR法检测肾组织OCT mRNA水平
从-80℃冰箱中取出各受试鼠左肾提取总RNA,操作步骤按照RNA提取试剂盒说明书进行。取A260 nm/A280 nm比值在1.8~2.2的样本进行逆转录操作。逆转录反应用PrimeScriptTMRT试剂盒,在ABI 7500实时定量PCR仪上进行。反应条件为37℃15 min,85℃31 s,1个循环。PCR反应用SYBR Premix Ex TaqTMⅡ试剂盒。反应条件为95℃预变性30 s,进入循环阶段,每个循环包括95℃变性15 s,56℃退火30 s,72℃延伸31 s,共40个循环。以GAPDH作为内参照,用2- Ct法计算目的基因的相对表达水平。
1.5统计学分析
血中Met的主要药动学参数(t1/2β,Vd,Cl,AUC0-20 min)及肾组织中Met蓄积量的AUC0-20 min由药动学软件DAS 2.0计算[14]。所有实验结果数据用表示,以统计软件SPSS 17.0进行单因素方差分析(one-way ANOVA)及最小显著性检验(LSD)。以P<0.05为差异具有统计学意义。
2 结果
2.1DRI和GRI中靛蓝和靛玉红的含量
靛蓝和靛玉红含量测定显示,本研究所用DRI中每克含靛蓝29.45 μg(0.002945%),靛玉红3.12 μg(0.000312%),GRI中每克含靛蓝3.03 μg(0.000303%),靛玉红3.92 μg(0.000392%),远低于文献报道的板蓝根饮片含靛蓝和靛玉红分别为0.000005%~0.09574%和0.0~0.08639%[11,15-16]。
2.2OCT功能检测结果
2.2.1血中Met的主要药动学参数变化
由系列Met标准溶液(0.2441~250.0 mg L-1,10个浓度梯度)得标准曲线Y=60370.0X-8723.4,R=0.999,以此标准曲线计算出血清及肾组织中Met浓度。日内变异0.41%~5.52%,日间变异3.65%~8.85%,重现性92.81%~105.14%。
小鼠血中Met的药-时曲线(图1)符合二室模型,可用等式Cs=Ae-at+Be-βt描述,Cs是在iv后t (min)时的Met浓度。血中Met的主要药动学参数见表2。纯水、CMC和糊精加蔗糖3个对照组所测药动学参数均无显著差异;与纯水对照组相比,t1/2β在DRI 6.4 g·kg-1、GRI 0.615和2.460 g·kg-1、靛蓝0.640 mg·kg-1、靛玉红0.0192和1.5360 mg·kg-1组显著延长(P<0.05,P<0.01);Vd在DRI 6.4 g·kg-1、靛蓝0.640 mg·kg-1和靛玉红1.5360 mg·kg-1组显著降低(P<0.01);Cl在DRI 1.6和6.4 g·kg-1、GRI 2.460 g·kg-1、靛蓝0.640 mg·kg-1和靛玉红1.5360 mg·kg-1组显著降低(P<0.05,P<0.01),AUC0-20 min在各供试物高剂量组均显著增加(P<0.01)。

Fig.1 Effect of decoction of Radix Isatidis(DRI),granules of Radix Isatidis(GRI),indigo and indirubin on metformin(Met)concentration in serum of mice.Quinidine 0.025 g·kg-1,DRI 1.6 and 6.4 g·kg-1,GRI 0.615 and 2.460 g·kg-1,indigo 0.008 and 0.640 mg·kg-1,indirubin 0.0192 and 1.5360 mg·kg-1were ig given,respectively,twice a day for 5 d.Sixty minutes after the last ig drugs,Met 5 mg·kg-1was iv given.Blood samples were collected at 1.0,2.5,5.0,7.5,10.0 and 20.0 min after iv Met.,n=10.*P<0.05,**P<0.01,compared with water control group.
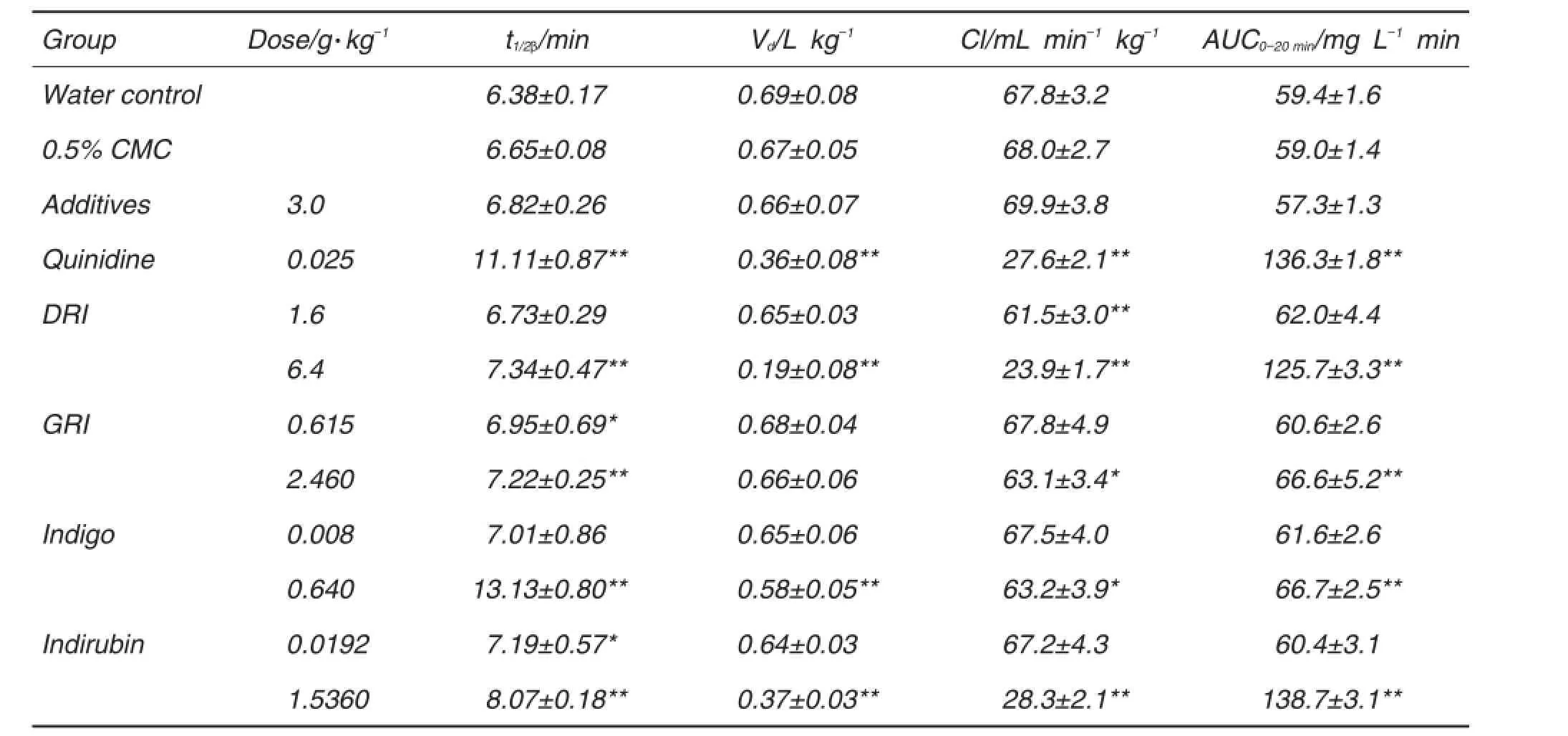
Tab.2 Effect of DRI,GRI,indigo and indirubin on pharmacokinetic parameters of Met in serum
2.2.2小鼠肾组织中Met蓄积量的改变
小鼠肾组织中Met的药-时曲线见图2。Met在小鼠肾组织的蓄积量(AUC0-20 min)见表3。纯水、CMC和糊精加蔗糖组之间无显著差异;与纯水对照组相比,DRI 1.6和6.4 g·kg-1、GRI 2.460 g·kg-1、靛蓝0.640 mg·kg-1及靛玉红1.5360 mg·kg-1组Met蓄积量显著增加(P<0.01)。
2.3肾切片Met摄取量的改变
小鼠肾切片摄取Met的结果见表4。各供试物组Met摄取量均低于纯水对照组(P<0.05,P<0.01),其中DRI 6.4 g·kg-1和靛玉红1.5360 mg·kg-1组Met摄取量<纯水对照组的60%(P<0.01)。

Fig.2 Effects of DRI,GRI,indigo and indirubin on Met concentration in kidney of mice.See Fig.1 for the mouse treatment.,n=10.*P<0.05,**P<0.01,compared with water control group.

Tab.3 AUC0-20 minof Met in blood and kidney of mice after treatment with DRI,GRI,indigo and indirubin
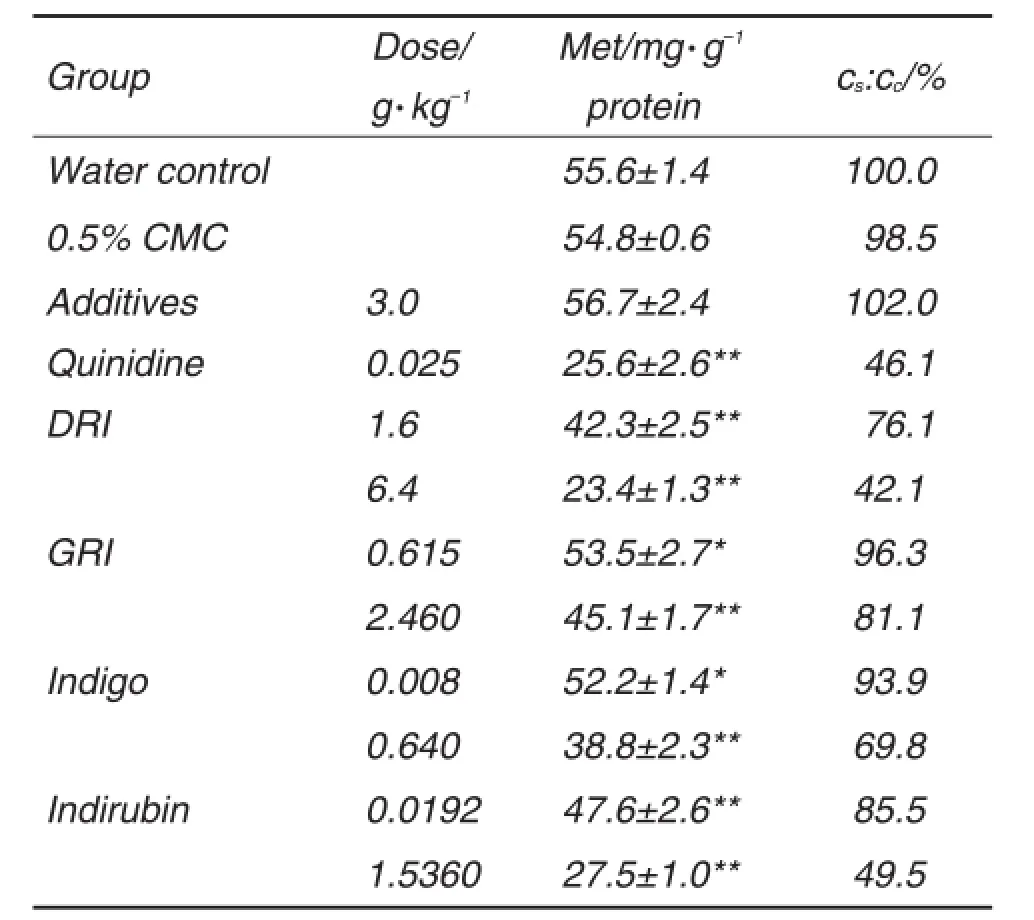
Tab.4 Effect of DRI,GRI,indigo and indirubin on Met uptake by kidney slices of mice
2.4小鼠肾组织中OCT mRNA表达水平的改变
各供试物组小鼠肾组织OCT1和OCT2 mRNA的表达水平见图3。与纯水对照组相比,DRI 6.4 g·kg-1和靛玉红1.5360 mg·kg-1组OCT1和OCT2 mRNA表达水平均下调(P<0.05,P<0.01);GRI 2.460 g·kg-1和靛蓝0.640 mg·kg-1组OCT1 mRNA表达水平下调(P<0.05,P<0.01)。
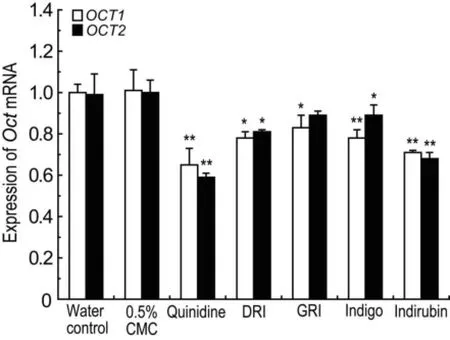
3 讨论
转运体是一类跨细胞膜转运体内各种内、外源性化合物的功能蛋白,在药物吸收、分布、排泄、药效发挥以及药物毒副作用中起关键作用[2-3]。药物经肾小管表皮细胞的分泌由众多转运体介导,如有机阳离子型化合物由摄取型转运体OCT在近曲小管基底膜侧吸收入管腔以便排出体外[17]。
本研究以Met为探针药和奎尼丁为阳性对照[18],用体内和体外方法检测了板蓝根及其所含2种成分对小鼠肾OCT1和OCT2功能及其基因的调控,进而推测板蓝根及其所含靛蓝和靛玉红对人肾主要OCT(OCT1和OCT2)是否有影响。
DRI临床用量为每人10~15 g,每天1次(本研究取每人13 g),GRI临床用量为每次5~10 g,每天3~4次(本研究取每人5 g)[10]。依据黄继汉等[19]的建议,本研究将小鼠等效于人临床用量的8倍设为低剂量,32倍设为高剂量,DRI和GRI剂量分别为1.6,6.4 g kg-1和0.615,2.460 g·kg-1(生药量)。靛蓝和靛玉红有抗菌作用,长期以来都被作为DRI、GRI及大青叶等中药的活性成分和质控及工艺考察的指标[11,15-16]。因此,本研究将其作为板蓝根中的主要活性成分予以观察。本研究所用DRI和GRI所含靛蓝、靛玉红总体上低于文献报道[11,15-16],但实验结果仍显示它们对小鼠肾OCT1及OCT2有明显的抑制作用。
文献检索未发现GRI中的添加剂糊精和蔗糖对药物代谢酶及转运体有何明显影响[10]。本研究体内体外实验结果中,糊精加蔗糖组与纯水或CMC对照组间均未见任何显著性差异,故在PCR实验中省略了该对照组。
本研究预实验结果显示,血中Met浓度在0~30 min各时间点间差异明显,故正式实验在0~20 min设了6个时间点。血中Met的主要药动学参数显示,与纯水对照组相比,DRI、GRI、靛蓝和靛玉红高剂量组t1/2β延长了13%~97%;DRI、靛蓝和靛玉红高剂量组Vd降低了13%~72%;DRI 2个剂量组和靛玉红高剂量组Cl减少了9%~65%;各供试物高剂量组AUC0-20 min增加了13%~135%。表明DRI、GRI、靛蓝和靛玉红对小鼠肾OCT功能有明显的抑制作用。
通常认为AUC是最重要的药动学参数,故本研究参照文献[20]对各供试物的血清及肾组织AUC予以关注。各供试物肾组织与血清AUC的比值与纯水或CMC对照组的比值相近,均在0.452~0.560,说明血中Met浓度升高后肾组织中Met蓄积量也同比例增加,即在此过程中可能没有或少有其他药物代谢酶及转运体参与Met的消除。
在体外肾切片摄取Met预实验中摸索了孵育液中Met的最佳浓度和最佳孵育时间,Met浓度在0.604 mmol L-1、孵育时间以20 min为宜。在该实验结果中,各供试物组肾切片Met摄取量均明显低于纯水对照组(为溶媒对照组的23%~54%),说明各供试物对肾OCT摄取Met的功能有不同程度的干扰。
小鼠肾OCT mRNA表达研究结果表明,DRI、 GRI、靛蓝和靛玉红高剂量组与纯水对照组相比均出现不同程度的下调,此结果与OCT功能检测结果相吻合。这进一步表明,DRI、GRI、靛蓝和靛玉红可明显抑制小鼠肾OCT功能。
DRI和GRI及其所含成分靛蓝、靛玉红在所分析的Met主要药动学参数(t1/2β、Vd、Cl和AUC0-20min)、肾组织Met蓄积量、体外肾切片摄取Met量及OCT1 和OCT2 mRNA表达等结果均与抑制剂奎尼丁相似。因此,推断DRI、GRI及其所含成分靛蓝、靛玉红可能对人OCT1和OCT2也有干扰,提示在服用阳离子型化学药物时应谨慎同时使用板蓝根及其制剂,以确保临床用药的有效性和安全性。
OCT家族分布广泛,几乎遍布全身各组织,且处方药中约40%属于有机阳离子型化合物[1],由此可预见某化合物若对OCT产生干扰作用,则此作用影响范围很大。以口服降糖药Met为例,肾分泌是双胍类药物消除的主要途径,肾功能障碍时会造成双胍类药物的血药浓度明显升高,最终导致乳酸中毒。口服Met发生乳酸中毒时,>50%患者死亡[21]。
2010版《中国药典》中有35个处方含有板蓝根[10]。本研究团队已报道了板蓝根及其所含成分抑制小鼠Oat1,Oat2和Oat3各亚型[8]。本研究结果表明,上述供试物同样也抑制小鼠OCT1和OCT2。由这些结果不难看出,板蓝根及其所含靛蓝、靛玉红对肾的确存在影响,提示应进行必要的临床试验对此进行验证。
致谢:本校2012级药学专业部分毕业实习生参与了本研究,在此表示谢意。
[1]Neuhoff S,Ungell AL,Zamora I,Artursson P.pH-dependent bidirectional transport of weakly basic drugs across Caco-2 monolayers:implications for drug-drug interactions[J].Pharm Res,2003,20 (8):1141-1148.
[2]Nies AT,Koepsell H,Damme K,Schwab M.Organic cation transporters(OCTs,MATEs),in vitro and in vivo evidence for the importance in drug therapy [J].Handb Exp Pharmacol,2011,(201):105-167.
[3]Giacomini KM,Huang SM,Tweedie DJ,Brouwer KL,Chu XY,Dahlin A,et al.Membrane transporters in drug development[J].Nat Rev Drug Discov,2010,9(3):215-236.
[4]Ming X,Ju WJ,Wu HL,Tidwell RR,Hall JE,Thakker DR.Transport of dicationic drugs pentamidine and furamidine by human organic cation transporters[J].Drug Metab Dispos,2009,37(2):424-430.
[5]Ciarimboli G,Deuster D,Knief A,Sperling M,Holtkamp M,Edemir B,et al.Organic cation transporter 2 mediates cisplatin-induced oto-and nephrotoxicity and is a target for protective interventions [J].Am J Pathol,2010,176(3):1169-1180.
[6]Wang DS,Kusuhara H,Kato Y,Jonker JW,Schinkel AA.Involvement of organic cation transporter 1 in the lactic acidosis caused bv metformin [J].Mol Pharmacol,2003,63(4):844-848.
[7]Wang CW,Liu WH.Renal lesion induced by oral preparations of traditional Chinese medicines:analysis of 619 cases[J].China Pharm(中国药房),2009,20(15):1187-1188.
[8]Qi JF,Sun C,Wang YH,Yu WH,Han J,Lin M,et al.Inhibition of Radix Isatidis and its constituents indigo and indirubin on major organic anion transporters oat1,oat2 and oat3 in mouse kidneys [J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(6):878-886.
[9]Holle SK,Ciarimboli G,Edemir B,Neugebauer U,Pavenstädt H,Schlatter E.Properties and regulation of organic cation transport in freshly isolated mouse proximal tubules analyzed with a fluorescence reader-based method[J].Pflügers Arch,2011,462(2):359-369.
[10] Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia.Vol.1(中华人民共和国药典一部)[S].Beijing:China Medical Science and Technology Press,2010:800-801.
[11]Ma L,Sun Q,Li Y,Xiao XH.HPLC determination of indigo and indirubin in Radix Isatidis and Banlangen granules[J].Chin J Pharm Anal(药物分析杂志),2010,30(9):1642-1645.
[12]Ito S,Kusuhara H,Yokochi M,Toyoshima J,Inoue K,Yuasa H,et al.Competitive inhibition of the luminal efflux by multidrug and toxin extrusions,but not basolateral uptake by organic cation transporter 2,is the likely mechanism underlying the pharmacokinetic drug-drug interactions caused by cimetidine in the kidney[J].J Pharmacol Exp Ther,2012,340(2):393-403.
[13]Zhang H,Shi J,Mou LY.Detection of metformin hydrochloride concentration in human plasma by RP-HPLC method[J].Anti-infect Pharm(抗感染药学),2006,3(2):60-62.
[14]Chen ZY,Zheng QS,Sun RY.Functions of the DAS software for pharmacological calculation[J]. Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2002,7(6):562-565.
[15]Fan LF,Zhang LT,Yuan ZF,Xu HJ,He W. HPLC determination of the contents of indigo and indirubin in Radix Isatidis[J].Chin J Pharm Anal(药物分析杂志),2008,28(4):540-543.
[16]Xiao SS,Jin Y,Sun YQ.Recent progress in the studies of chemical constituents,pharmacological effects and quality control methods on the roots of Isatis indigotica[J].J Shenyang Pharm Univ(沈阳药科大学学报),2003,20(6):455-459.
[17]Koepsell H,Endo H.The SLC22 drug transporter family[J].Pflügers Arch,2004,447(5):666-676.
[18]Minematsu T,Iwai M, Umehara K, Usui T,Kamimura H.Characterization of human organic cation transporter 1(OCT1/SLC22A1)-and OCT2 (SLC22A2)-mediated transport of 1-(2-methoxyethyl)-2-methyl-4,9-dioxo-3-(pyrazin-2-ylmethyl)-4,9-dihydro-1H-naphtho[2,3-d]imidazolium bromide (YM155 monobromide),a novel small molecule survivin suppressant[J].DrugMetabDispos,2010,38(1):1-4.
[19]Huang JH,Huang XH,Chen ZY,Zheng QS,Sun RY. Dose conversion among different animals and healthy volunteers in pharmacological study[J]. Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2004,9(9):1069-1072.
[20]Chew WK,Segarra I,Ambu S,Mak JW.Significant reduction of brain cysts caused by Toxoplasma gondii after treatment with spiramycin coadministered with metronidazole in a mouse model of chronictoxoplasmosis[J].AntimicrobAgents Chemother,2012,56(4):1762-1768.
[21] Ei MM,Nogueira V,Fontaine E,Avéret N,Rigoulet M,Leverve X.Dimethylbiguanide inhibits cell respiration via an indirect effect targeted on the respiratory chain complex I[J].J Biol Chem,2000,275 (1):223-228.
Effects of Radix Isatidis and contained indigo and indirubin on organic cation transporters OCT1 and OCT2 in mouse kidney
ZHANG Na1,QI Jin-feng1,SUN Chen1,YU Wen-hao1,WANG Yong-hui2,LIN Mei3
(1.Department of Pharmacology,College of Chinese Materia Medica,Guangzhou University of Chinese Medicine,Guangzhou 510006,China;2.Pharmacy Department,Zhumadian People′s Hospital,Zhumadian 463000,China;3.Pharmacy Department,Nanhai Hospital of Chinese Medicine,Foshan 528200,China)
OBJECTIVE To investigate the effect of Radix Isatidis and its constituents indigo and indirubin on two principal subtypes of organic cation transporters(OCT)OCT1,OCT2 in vivo in mice. METHODS Decoction of Radix Isatidis(DRI)1.6 and 6.4 g·kg-1,granules of Radix Isatidis(GRI)0.615 and 2.460 g·kg-1,indigo 0.008 and 0.640 mg·kg-1and indirubin 0.0192 and 1.536 mg·kg-1were ig given to NIH mice(60 mice per group),twice a day for 5 d.Four control groups were set up,including the vehicle of water,0.5%sodium carboxymethyl cellulose(CMC),additives of sucrose plus dextrin (1.5 g·kg-1)and positive control quinidine(0.025 g·kg-1).Sixty minutes after the last dosing,all the mice were iv given metformin(Met)5 mg·kg-1,and at 1.0,2.5,5.0,7.5,10.0 and 20.0 min after Met iv,10 mice in each group were sacrificed to collect whole blood and kidneys respectively.The right kidney was homogenized for Met accumulation test and the left one used to extract total RNA for analysis of OCT1 and OCT2 mRNA expressions by real-time PCR.The contents of Met in sera and kidneys were quantified by HPLC.Major pharmacokinetic parameters of Met in sera were analyzed by pharmacokinetic software(DAS 2.0).RESULTS There was no significant difference between water control group,0.5% CMC group and sucrose plus dextrin group in any examined item.Compared with vehicle control group (water and 0.5%CMC group),all the related pharmacokinetic parameters in DRI 6.4 g·kg-1,GRI 2.46 g·kg-1,indigo 0.640 mg·kg-1and indirubin 1.536 mg·kg-1groups were changed significantly (P<0.05,P<0.01).The elimination half time(t1/2β)was prolonged 13%-97%,volume of distribution reduced by 13%-72%,clearance(Cl)reduced by 9%-65%,and the area under the concentration-time curve(AUC0-20 min)increased by 13%-135%.AUC0-20 minobtained from renal Met accumulations was significantly increased(P<0.01)while Met uptake by kidney slices was reduced(P<0.05,P<0.01).The expressions of OCT1 and OCT2 mRNA were obviously down-regulated(P<0.05,P<0.01).CONCLUSION The mouse renal OCT1 and OCT2 are significantly inhibited by DRI,GRI,indigo and indirubin.The inhibitory effect of Radix Isatidis on OCT1 and OCT2 probably arises from indigo and indirubin contained.
Radix Isatidis;indigo;indirubin;metformin;organic cation transporters
QI Jin-feng,Tel:13711301907,E-mail;qijinfeng2005@aliyun.com
R285.1
A
1000-3002(2016)02-0127-08
10.3867/j.issn.1000-3002.2016.02.007
2015-06-19接受日期:2015-12-03)
(本文编辑:齐春会)
张 娜,女,硕士研究生,主要从事药动学研究。
奇锦峰,E-mail;qijinfeng2005@aliyun.com,Tel:13711301907
