广西中华眼镜蛇的蛇毒蛋白natrin对过氧化氢损伤乳大鼠原代心肌细胞钙超载及相关基因表达的影响
2016-09-21梁永红苏延旭马兴才张洪也蒋兴明陆世银苏志恒广西医科大学药学院广西南宁500中国人民解放军第0医院药剂科广西南宁500南宁第七人民医院广西南宁500
梁永红,苏延旭,马兴才,张洪也,蒋兴明,陆世银,苏志恒,郑 华,宋 慧(.广西医科大学药学院,广西南宁 500;.中国人民解放军第0医院药剂科,广西南宁500;.南宁第七人民医院,广西南宁 500)
广西中华眼镜蛇的蛇毒蛋白natrin对过氧化氢损伤乳大鼠原代心肌细胞钙超载及相关基因表达的影响
梁永红1,苏延旭2,马兴才3,张洪也1,蒋兴明1,陆世银1,苏志恒1,郑 华1,宋 慧1
(1.广西医科大学药学院,广西南宁 530021;2.中国人民解放军第303医院药剂科,广西南宁530021;3.南宁第七人民医院,广西南宁 530022)
目的 观察广西中华眼镜蛇(Naja naja atra)的蛇毒蛋白(natrin)对SD大鼠原代心肌细胞钙超载的影响,并探讨natrin对心肌的保护作用及对心肌钙、钾离子通道影响的可能作用机制。方法 分别用natrin 5,25和125 mg·L-1预处理原代SD乳大鼠心肌细胞24 h后,再以H2O20.3 mmol·L-1诱导损伤,以Fluo-3为Ca2+荧光探针,应用激光共聚焦显微镜动态检测细胞内游离钙离子浓度变化;另外用natrin 5,25和125 mg·L-1及维拉帕米(Ver)5 nmol·L-1预处理24 h后,再以H2O20.3 mmol·L-1诱导损伤15 min,FQPCR法检测心肌细胞钙离子通道Cav1.2,Calm,RyR2和钾离子通道Kir6.2的mRNA表达情况。结果 激光共聚焦显微镜检测结果发现,与正常对照组比较,H2O2作用3~15 min心肌细胞内钙荧光平均峰值增强49.37%(P<0.01);而给予natrin 5,25,125 mg·L-1预处理24 h组该平均峰值分别增强27.52%,12.71%和5.15%,显著低于H2O2组(P<0.01)。PCR结果表明,H2O2损伤组其心肌细胞Cav1.2,Calm,RyR2及Kir6.2 的mRNA表达分别为正常对照组的1.78倍,1.26倍,4.34倍和0.79倍(P<0.01);而给予natrin及维拉帕米干预组,细胞Cav1.2,Calm和RyR2的mRNA表达较H2O2损伤组均显著降低(P<0.01),而Kir6.2的mRNA表达较H2O2损伤组显著升高(P<0.05)。结论 广西中华眼镜蛇natrin可明显减轻H2O2所致的心肌细胞钙超载,对心肌细胞过氧化损伤有良好的保护作用,其作用机制可能与降低H2O2损伤的心肌细胞的Cav1.2,Calm和RyR2的mRNA表达及增加Kir6.2的mRNA表达有关。
natrin;钙超载;肌细胞;心脏;离子通道
富含半胱氨酸分泌蛋白(cysteine-rich secretory proteins,CRISP)是近年来在蛇毒中发现的一类新的蛋白,是一类相对分子质量为20~30 ku的单链多肽[1]。研究表明,已有的蛇毒CRISP家族成员能阻断不同的离子通道,如钾离子通道Kv,L型钙离子通道和环核苷酸门控离子通道(cyclic nucleotidegated ion channels,CNG)通道等。因此,判断此类家族蛋白可能组成新型的离子通道阻断剂,且功能研究还推测它们可能是通过一段关键的残基和离子通道相互作用的[2-4]。眼镜蛇蛇毒蛋白(natrin)是近年从中华眼镜蛇(Naja naja atra)毒中分离纯化得到的一个新型CRISP家族蛋白,相对分子质量为25 ku。natrin可阻断不同的离子通道,如兰尼碱受体(ryanodine receptor,RyR)、大电导钙激活钾通道(large-conductance Ca2+-activated K+channel,BKCa)、CNG和钾离子通道Kv1.3等,可能是一种新型的离子通道阻断剂[5-6]。近期研究发现,natrin可抑制由亚铁离子激发的·OH引起的脂质过氧化产物MDA的生成发挥抗脂质过氧化作用[7]。本研究通过natrin对心肌细胞离子通道作用及其对离子通道相关基因表达的影响测定,为研究natrin及离子通道作用机制提供理论依据,同时为寻找治疗心律失常疾病的新途径提供研究基础。
1 材料与方法
1.1动物、主要试剂和仪器
1~3d龄SD大鼠,雌雄不限,动物生产许可证:SCXK桂2003-0003,动物使用许可证:SYKG桂2003-0005,由广西医科大学实验动物中心提供。Natrin由广西医科大学蛇毒所提供粗毒经分离纯化而得:取中眼镜蛇蛇毒冻干粉溶解后离心,取上清上样Sephadex-G50(美国Pharmacia公司)柱进行分离,收集第二峰。透析浓缩后上Sepharose CL-6B柱(美国Pharmacia公司),进行线性梯度洗脱。取样透析浓缩,上mono S柱(HR5/5)在FPLC系统(美国Pharmacia公司)反复经mono S柱层析纯化,组分浓缩除盐冻干即得。DMEM-F12培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);Fluo-3/ AM,PluronicF-127和5-溴脱氧尿嘧啶核苷(BrdU)(美国Sigma公司);0.25%胰蛋白酶(北京索莱宝公司);RNAiso Plus(总RNA提取试剂),逆转录试剂和SYBR GREEN(大连TaKaRa公司);琼脂糖(西班牙Biowest公司);上下游引物:由上海捷瑞生物工程有限公司合成。
1.2新生SD大鼠原代心肌细胞培养
[8]方法进行改良。取1~3 d龄SD乳大鼠,开胸切取心脏,剪取心尖置于4℃磷酸盐缓冲液中反复冲洗3次,剪成约1 mm3的块状,室温下加入2 mL 0.125%胰酶反复消化,直至组织块全部消化。将收集所得消化液置于15 mL离心管以1000×g离心10 min,细胞沉淀重悬于10%胎牛血清DMEM培养基中,经200目滤网过滤,所得细胞滤液差速贴壁法初步提纯心肌细胞。把心肌细胞悬液转移至培养瓶,于5%CO2的37℃恒温细胞培养箱培养,前3 d每天向培养液中添加终浓度为0.1 mmol·L-1的BrdU以抑制成纤维细胞的增殖。待培养4~5 d细胞融合成片,取搏动良好的细胞进行实验。
1.3激光共聚焦显微法测定细胞内游离钙离子浓度
取1.2搏动良好的细胞随机分成5组,药物处理组分别给以终浓度为5,25和125 mg·L-1natrin的无血清培养基,正常对照组和H2O2损伤组以无血清培养基代替。细胞给药24 h后将各组弃去原处理培养液,用PBS缓冲液洗涤3次,往培养皿中加入含有Fluo-3/AM和PluronicF-127的PBS负载液(Fluo-3/AM终浓度5 μmol·L-1,PluronicF-127终浓度为0.1%),37℃避光温育45 min。吸去负载液,再用PBS漂洗2~3次,加入无血清低糖DMEM,于37℃培养箱孵育15 min。各实验组及H2O2损伤组在激光共聚焦测定前即刻加入H2O2(终浓度为0.3 mmol·L-1),正常对照组以PBS缓冲液代替。激发波长488 nm,发射波长526 nm,每隔15 s扫描1次,每个样本扫描15 min。利用其图像量化、分析系统进行图像分析,并换算出选定区域内钙荧光强度值,以同一时间点平均荧光强度反映其细胞内游离钙浓度的相对水平。
1.4荧光定量PCR法测定心肌细胞Cav1.2,Calm,RyR2和Kir6.2 mRNA表达
取搏动良好的细胞,随机分为9组。正常对照组,不加任何药物处理;分别给予natrin 5,25和125 mg·L-1作用24 h组;分别给予natrin 5,25,125 mg·L-1和维拉帕米5 nmol·L-1作用24 h,再加入H2O20.3 mmol·L-1作用 15 min组;H2O20.3 mmol·L-1作用15 min组。然后分别后提取细胞总RNA,核酸测定仪测定RNA含量浓度和纯度测定,A260 nm/A280 nm比值在1.8~2.0间为合格RNA。根据逆转录试剂盒说明取1 μg总RNA逆转录为cDNA,取等量的cDNA,用相应的引物以SYBR Green MIX荧光染料进行荧光定量PCR(FQ-PCR)扩增反应,各基因引物如表1。PCR反应条件按PCR扩增和熔解曲线两步法条件进行反应:95℃预变性10 min,95℃变性15 s,60℃退火1 min,95℃15 s,72℃延伸15 s,反应40个循环;最后进行产物熔解曲线测定:从60℃逐渐增温到95℃,时间20 min,95℃15 s。以2%的琼脂糖凝胶电泳测定PCR产物大小。所有PCR均进行3次重复,每次3个平行样本。采用比较2- Ct法分析各基因在细胞中的相对表达水平。

Tab.1 Primers for Cav1.2,Calm,RyR2and Kir6.2 gene
1.5统计学分析
2 结果
2.1natrin对H2O2损伤乳大鼠原代心肌细胞内游离钙离子浓度的影响
正常对照组心肌细胞,部分细胞荧光较强,细胞质荧光稍弱(图1),其细胞内平均钙荧光强度值为1766±37。动态监测H2O20.3 mmol·L-1处理15 min组,0 s时细胞内平均钙荧光强度基础值为1760± 41,与正常对照组比较无显著差异。30~60 s内其荧光强度达到峰值,平均峰荧光强度值为2634±119,60 s~3 min内荧光强度值逐渐下降,3 min后荧光强度基本稳定,达到稳态荧光值(表2),从3~15 min其细胞内平均荧光强度值为2468±130,细胞内荧光均较强,呈均匀分布。与正常对照组比较,钙超载模型组经H2O2处理后的荧光强度峰值、稳态值均显著升高(P<0.01),峰值较正常对照组增强(49.4±7.3)%,表明给予H2O20.3 mmol·L-1可明显造成心肌细胞内钙超载。natrin 5,25和125 mg·L-1预处理24 h组,细胞部分组织荧光较强,细胞质荧光稍弱,其稳态值与H2O2组比较均显著降低(P<0.01)。

Fig.1 Effect of natrin on[Ca2+]iin neonatal rat primary cardiomyocytes injured by H2O2(×200).The cardiomyocytes were pretreated with Natrin 5,25 and 125 mg·L-1for 24 h,then H2O20.3 mmol·L-1was added.B:Intracellular[Ca2+]iquantified by mean fluorescence intensity of A.,n=9.**P<0.01,compared with normal control group;##P<0.01,compared with H2O2group.
2.2natrin对H2O2损伤乳大鼠原代心肌细胞钙、钾离子通道相关基因表达的影响
表3结果显示,与正常对照组比较,单纯给予natrin 125 mg·L-1组Cav1.2和Calm mRNA表达明显降低(P<0.05),而RyR2,Kir6.2基因的mRNA表达无明显变化,natrin 5,25 mg·L-1组的Calm mRNA表达无明显变化。与正常对照组比较,H2O2组Cav1.2,Calm,RyR2和Kir6.2 mRNA表达明显升高(P<0.01);与H2O2模型组比较,分别给予natrin 5,25和125 mg·L-1及维拉帕米5 nmol·L-1预处理再经H2O2作用组Cav1.2,Calm和RyR2mRNA表达显著降低(P<0.05),Kir6.2 mRNA表达显著增加(P<0.05)。

Tab.2 Effect of natrin on[Ca2+]iin neonatal rat primary cadiomyocytes injured by H2O2
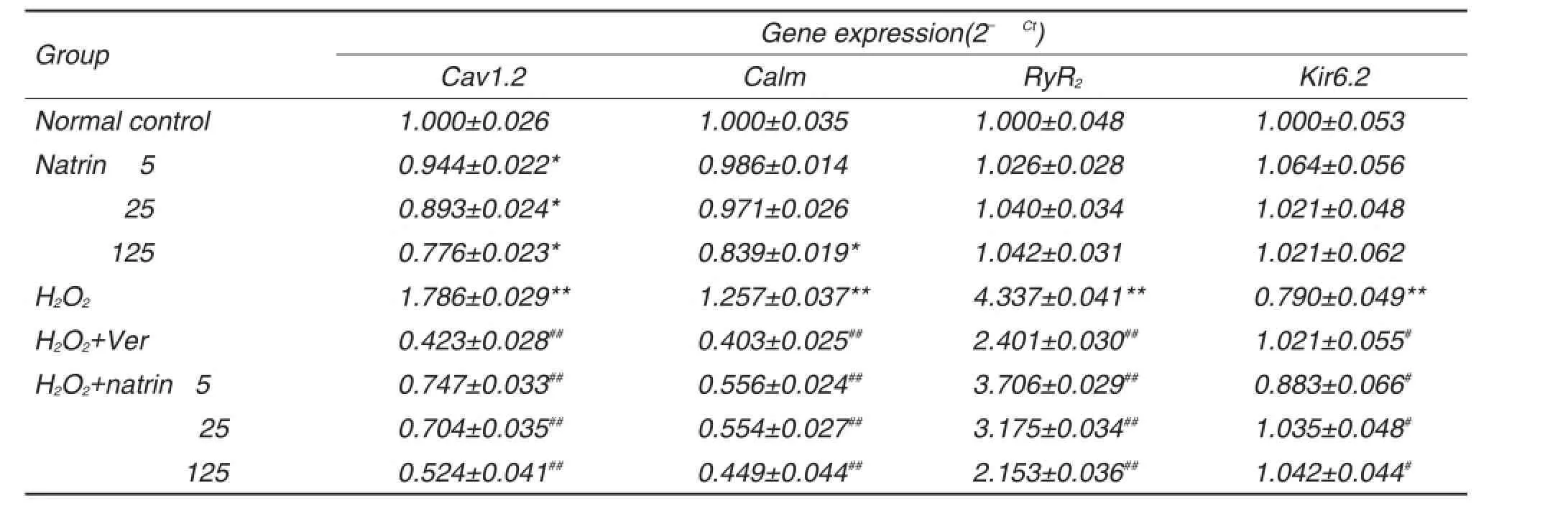
Tab.3 Effect of natrin on Cav1.2,Calm,RyR2and Kir6.2 gene expression in neonatal rat primary cadiomyocytes
3 讨论
本研究发现,natrin可显著减轻H2O2所诱导的心肌细胞钙超载,在有或无H2O2损伤的情况下均能降低L型钙通道亚基Cav1.2及钙调控蛋白亚基Calm mRNA的表达量;natrin能显著降低H2O2损伤后心肌细胞肌RyR2mRNA的表达量;natrin预干预可使Kir6.2 mRNA表达量比较H2O2损伤组的心肌细胞明显升高。同时,natrin 125 mg·L-1组Cav1.2,Calm,Kir6.2的表达量与维拉帕米组相仿,而RyR2的表达量甚至低于维拉帕米组。可见natrin的作用可能是通过抑制L型钙通道的开放,同时激发肌浆网RyR2受体表达的降低,减少细胞外Ca2+的内流和肌浆网对Ca2+释放,从而可能减轻如缺血低氧等过氧化损伤的心肌细胞所导致的细胞内钙超载。
氧化应激是心肌损伤常见的重要因素之一。心肌缺血再灌注损伤和心力衰竭等心肌疾病时,细胞内的活性氧会大量增加,引发心肌细胞的凋亡。H2O2是体内的一种重要的氧化代谢产物之一,同时也是氧自由基的一种,它可通过与细胞膜上的不饱和脂肪酸作用,可通过蛋白激酶C依赖机制激活NADPH氧化酶活性诱导过量活性氧簇生成,从而诱发心肌细胞L-型钙通道电流增强,导致细胞发生钙超载。而活性氧自由基能触发肌浆网和分离的线粒体使细胞内贮存的Ca2+释放,从而进一步加重细胞内的钙超载[9,11]。利用低浓度的H2O2(0.3 mmol·L-1)直接作用于心肌细胞,可用于模拟心肌缺血再灌注损伤等心肌疾病模型,避免了全身神经体液激素水平及局部不同类型细胞间的互相影响,而且最大限度地克服了个体差异,具有较强的特异性及可控性[12-13]。本研究结果也显示,当心肌细胞受H2O2作用后即刻细胞内强光强度增加,30~60 s便能达到最强荧光值,说明利用低浓度的H2O2直接作用于心肌细胞能成功建立心肌细胞过氧化损伤的钙超载病理模型。
[Ca2+]i变化对心肌的兴奋收缩耦联和维持心肌自律性起着决定性作用。在正常生理状态下,心肌胞浆内[Ca2+]i维持在较低的浓度水平(约1× 10-7mol·L-1),远低于细胞外浓度。心肌细胞钙平衡主要依靠细胞膜钙通道和肌浆网中受体的调节,可能通过诱导钙调蛋白的表达增加,调控Cav1.2通道开放,使L型钙通道开放增加,失活减慢,导致细胞内的钙超载[14]。而由于这些膜电位的变化形成动作电位效应,胞外Ca2+迅速内流,引发RyR高亲和位点与Ca2+结合,使RyR表达增加,促进Ca2+通道开放,大量Ca2+从SR中释放[15]。KATP是ATP敏感钾通道,由内向整流钾通道IKATP与ATP结合组成,Kir6.2是KATP的主要亚基单位。当心肌细胞破坏性刺激如缺血低氧、过氧化损伤等,由于细胞耗氧量的增加和能量代谢障碍,使胞内ATP浓度降低,KATP通道开放,K+的内流可使膜去极化,抑制Ca2+内流,减轻心肌钙超载[16]。已有研究发现,在缺血再灌注或过氧化损伤的心肌,若对KATP进行基因敲除,则其损伤较未敲除组明显加重,而使用KATP进通道开放剂可显著减少细胞内氧化因子的释放,减轻再灌注的过氧化损伤[17-18]。我们的前期研究也发现,natrin可抑制由亚铁离子激发的·OH引起的脂质过氧化产物MDA的生成发挥抗脂质过氧化作用[7]。因此我们推测natrin通过上调过氧化损伤的心肌细胞KATP通道的表达,增加KATP通道开放,进而减轻心肌钙超载,对心肌细胞产生保护作用。
综上所述,natrin可显著减轻H2O2所致的心肌细胞钙超载,对H2O2损伤的心肌细胞起到良好的保护作用。其作用机制可能通过降低经H2O2损伤的心肌细胞钙通道的Cav1.2,Calm和RyR2mRNA的表达和增加Kir6.2 mRNA的表达,减少Ca2+的内流及肌浆网Ca2+释放,从而减轻H2O2损伤导致的细胞内钙超载。
参考文献:
[1]Moore A,Ensrud KM,White TW,Frethem CD,Hamilton DW.Rat epididymis-specific sperm maturation antigens.I.Evidence that the 26 kD 4E9 antigen found on rat caudal epididymal sperm tail is derived from a protein secreted by the epididymis [J].Mol Reprod Dev,1994,37(2):181-194.
[2] Yamazaki Y,Morita T.Structure and function of snake venom cysteine-rich secretory proteins[J]. Toxicon,2004,44(3):227-231.
[3]Guo M,Teng M,Niu L,Liu Q,Huang Q,Hao Q. Crystal structure of the cysteine-rich secretory protein stecrisp reveals that the cysteine-rich domain has a K+channel inhibitor-like fold[J].J Biol Chem,2005,280(13):12405-12412.
[4]Shikamoto Y,Suto K,Yamazaki Y,Morita T,Mizuno H.Crystal structure of a CRISP family Ca2+-channel blocker derived from snake venom[J]. J Mol Biol,2005,350(4):735-743.
[5]Wang F,Li H,Liu MN,Song H,Han HM,Wang QL,et al.Structural and functional analysis of natrin,a venom protein that targets various ion channels[J].Biochem Biophys Res Commun,2006,351(2):443-448.
[6]Wang J,Shen B,Guo M,Lou X,Duan Y,Cheng XP,et al.Blocking effect and crystal structure of natrin toxin,a cysteine-rich secretory protein from Naja atra venom that targets the BKCa Channel [J].Biochemistry,2005,44(30):10145-10152.
[7]Huang YJ,Song H,Li FS,Li S,Jiao Y,Huang Y. Effect of natrin from Guangxi cobra venom on antilipid peroxidation[J].Popul Sci Technol(大众科技),2011,(10):178-179.
[8]Li B,Wu HY,Piao HL,Liu KX.The primary culture of neonatal rat cardiac cells[J].Chin J Lab Diagn(中国实验诊断学),2012,16(2):200-203.
[9]Wang L,Lopaschuk GD,Clanachan AS.H2O2-induced left ventricular dysfunction in isolated working rat hearts is independent of calcium accumulation [J].J Mol Cell Cardiol,2008,45(6):787-795.
[10]Huang YP, Gao FF,Zhang YM,Chen YA,Zheng YS,Shi GG.N-n-Butyl haloperidol iodide inhibits the augmented Na+/Ca2+exchanger currents and l-type Ca2+current induced by hypoxia/reoxygenation or H2O2in cardiomyocytes[J].Biochem Biophys Res Commun,2012,421(1):86-90.
[11]Oliveira PJ, Esteves T, Rolo AP, Monteiro P,Gonçalves L,Palmeira CM,et al.Carvedilol:relation between antioxidant activity and inhibition of the mitochondrial permeability transition[J].Rev Port Cardiol,2003,22(1):55-62.
[12]Zheng YS,Li YS,Gong WQ,Sun B.Experimental model of H2O2-induced oxidative injury in cardiomyocytes[J].J Fourth Mil Med Univ(第四军医大学学报),2001,22(20):1849-1851.
[13]Deng CY,Lin SG,Qian WM,Wu SL,Shan ZX,Yang M,et al.Effects of H2O2on L-type calcium channel current in rat ventricular myocytes[J]. Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2005,10(8):867-870.
[14]Yang L,Xu J,Minobe E,Yu L,Feng R,Kameyama A,et al.Mechanisms underlying the modulation of L-type Ca2+channel by hydrogen peroxide in guinea pig ventricular myocytes[J].J Physiol Sci,2013,63(6):419-426.
[15]Song YH,Cho H,Ryu SY,Yoon JY,Park SH,Noh CI,et al.L-type Ca2+channel facilitation mediated by H2O2-induced activation of CaMKII in rat ventricular myocytes[J].J Mol Cell Cardiol,2010,48(4):773-780.
[16]Zingman LV,Alekseev AE,Hodgson-Zingman DM,Terzic A.ATP-Sensitive potassium channels:metabolic sensing and cardioprotection[J].J Appl Physiol,2007,103(5):1888-1893.
[17]Zhou X,Teng B,Tilley S,Ledent C,Mustafa SJ. Metabolic hyperemia requiresATP-sensitiveK+channels and H2O2but not adenosine in isolated mouse hearts[J].Am J Physiol Heart Circ Physiol,2014,307(7):H1046-H1055.
[18]Xie C,Kauffman J,Akar FG.Functional crosstalk between the mitochondrial PTP and KATP channels determinearrhythmicvulnerabilitytooxidative stress[J].Front Physiol,2014,5(5):264.
Effect of natrin from Naja naja atra on calcium overload and expression of related genes in neonatal rat primary cardio myocytes exposed to hydrogen peroxide
LIANG Yong-hong1,SU Yan-xu1,MA Xing-cai3,ZHANG Hong-ye1,JIANG Xing-ming1,LU Shi-yin1,
SU Zhi-heng1,ZHENG Hua1,SONG Hui1
(1.College of Pharmacy,Guangxi Medical University,Nanning 530021,China;2.Department of Pharmacy,Hospital 303 of PLA,Nanning 530021,China;3.the Seventh People′s Hospital of Nanning,Nanning 530012,China)
OBJECTIVE To observe the effect of natrin from Naja naja atra(Chinese cobra)on intracellular free calcium overload,and to discuss the protective effect and the possible mechanism of natrin on myocardium calcium(Ca2+)and potassium(K+)ion channels in the primary cardiomyocytes of SD neonatal rats.METHODS The primary cardiomyocytes of SD neonatal rats were used,which were respectively pretreated with natrin 5,25 and 125 mg·L-1for 24 h before injury was induced by H2O20.3 mmol·L-1.The dynamic variation of intracellular calcium was monitored by laser confocal microscopy using Fluo-3 as Ca2+fluorescence probe.Additionally,the cardio myocytes of neonatal rats were pretreated for 24 h using different concentrations of natrin 5,25,125 mg·L-1and verapamil 5 nmol·L-1,followed by exposure to H2O20.3 mmol·L-1for 15 min.Then,the mRNA expressions of calcium channels subunits Cav1.2,Calm,RyR2and potassium channel Kir6.2 were analyzed by FQPCR method.RESULTS Laser confocal microscopy revealed that H2O2obviously caused calcium overload in cardiomyocytes,giving rise to 49.37%fluorescence increase in intracellular calcium compared with the control group(P<0.01).However,natrin 5,25 and 125 mg·L-1resulted in 27.52%,12.71%and 5.15%fluorescence increase in intracellular calcium,respectively,compared with the control group(P<0.01).Moreover,the PCR results showed that the mRNA expressions of Cav1.2,Calm and RyR2in the myocardial cells treated with H2O2were increased 2.78,2.26,and 5.34 times as compared with the control group,while Kir6.2 displayed a 1.79-fold expression level(P<0.01).By contrast,the combination of natrin and verapamil significantly decreased the mRNA expression of Cav1.2,Calm and RyR2,compared to the H2O2-treated group(P<0.01).Meanwhile,the expression of Kir6.2 was considerably higher than that of the H2O2-treated group(P<0.05).CONCLUSION Natrin can reduce the intracellular calcium overload of cardiomyocytes induced by H2O2and shows a protective effect against oxidative damage for cardiomyocytes.The possible mechanism is that natrin can decrease the mRNA expression of Cav1.2,Calm,RyR2and increase the expression of Kir6.2 of the H2O2-induced cardiomyocytes.
natrin;calcium overload;myocytes,cardiao;ion channel
The project supported bye Natural Science Foundation of Guangxi Zhuang Autonomous Region (0991127);and Natural Science Foundation of Guangxi Zhuang Autonomous Region(0542043)
SONG Hui,E-mail:gxsonghui@163.com;ZHENG Hua,E-mail:215831305@qq.com
R963
A
1000-3002(2016)02-0095-06
10.3867/j.issn.1000-3002.2016.02.002
2015-05-06接受日期:2015-11-12)
(本文编辑:乔 虹)
广西壮族自治区科技厅科学基金(0991127);广西壮族自治区科技厅科学基金资助项目(0542043)
梁永红,女,副教授,主要从事蛇毒的药理学与分子生物学研究。
宋慧,E-mail:gxsonghui@163.com,郑华,E-mail:215831305@qq.com
