甘露醇诱导人肾小管上皮细胞的氧化应激作用
2016-09-21张琼丽罗文鸿林哲绚汕头大学医学院生物分析实验室广东汕头515041
张琼丽,罗文鸿,林哲绚(汕头大学医学院生物分析实验室,广东汕头 515041)
甘露醇诱导人肾小管上皮细胞的氧化应激作用
张琼丽,罗文鸿,林哲绚
(汕头大学医学院生物分析实验室,广东汕头 515041)
目的 观察甘露醇是否通过引起人肾小管上皮细胞(HK-2)的氧化应激反应而损伤细胞。方法MTT法检测不同浓度甘露醇(50,100,150,200,250,300,350和400 mmol·L-1)处理HK-2细胞4,10,24,48和72 h对细胞活性的影响;甘露醇100和250 mmol·L-1作用细胞4~72 h,DCFH-DA荧光探针法检测细胞内活性氧(ROS)水平,倒置显微镜下观察细胞形态的变化,丙二醛(MDA)、超氧化物岐化酶(SOD)和谷胱甘肽(GSH)检测试剂盒分别检测MDA含量、SOD活性和GSH含量。结果 甘露醇250 mmol·L-1作用72 h,细胞增殖活性约为溶剂对照组的50%(P<0.05);孵育4 h,细胞ROS的荧光强度(68.7±3.6)显著高于溶剂对照组(50.3±4.6)(P<0.05);孵育4~72 h,细胞形态出现细胞肿胀、空泡化,细胞脱落;细胞内MDA含量明显增高(P<0.05),SOD活性和GSH含量明显下降(P<0.05)。孵育4 h时,溶剂对照组和甘露醇250 mmol·L-1处理组细胞内MDA含量分别为(3.1±1.6)和(20.9±5.7)μmol·g-1蛋白,SOD活性分别为(71.8±6.5)和(47.3±8.8)kU·g-1蛋白,GSH含量分别为(60.8±2.3)和(13.6±3.3)μmol·g-1蛋白。甘露醇100 mmol·L-1处理组GSH含量显著降低(P<0.05),其余各项指标变化不明显。结论 高浓度(250 mmol·L-1)甘露醇可能通过氧化应激途径损伤肾小管上皮细胞而产生细胞毒性作用。
甘露醇;肾小管;上皮细胞;氧化应激;丙二醛
临床上,甘露醇(mannitol)作为渗透性利尿剂,广泛应用于组织脱水(如脑水肿)和降低眼内压、颅内高压等。但近年来的临床应用发现,一些患者在大剂量、长时间给药后易出现某种程度的肾损伤或肾毒性。已有报道,甘露醇有引发急性肾功能衰竭(acute renal failure,ARF)的毒性作用[1-2]。实验研究表明,动物静脉注射甘露醇后,可使肾近端小管上皮细胞广泛空泡变性;超微结构显示,胞浆内高密度胞浆体数目减少;大剂量较长时间使用甘露醇可致动物死亡或诱发出现ARF并急性肾小管损伤[3-5]。近年来,氧自由基对肾的损伤作用已引起广泛关注,在各种肾病中可见肾小管上皮细胞氧化损伤,包括移植肾缺血再灌注损伤和肾中毒等[6-7],而这些均可诱导引起ARF。本研究采用体外培养人肾小管上皮细胞(HK-2细胞),研究甘露醇对其毒性损伤作用的机制,探讨甘露醇对肾组织及肾细胞的损伤类型是否与氧化应激有关。
1 材料与方法
1.1药品、试剂和仪器
甘露醇,购自阿拉丁试剂公司;DMEM/F12 (1∶1)培养基,美国Hyclone公司;新生牛血清,杭州四季青公司;BCA蛋白定量试剂盒,中国碧云天生物技术研究所;MTT和2′,7′-二氯荧光-二乙酸酯(DCFH-DA),美国Sigma公司;Triton-X 100和胰蛋白酶(1∶250),美国Amresco公司;DMSO和EDTA,上海生物工程有限公司;牛血清白蛋白,上海吉泰科技有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)检测试剂盒,南京建成生物工程研究所。SW-CJ-ZF超净工作操作台,AIR TECH苏州安泰空气技术有限公司;TMS倒置生物显微镜,日本Nikon公司;371-184LCO2培养箱,Multiskan酶标仪,美国ThemoForma公司;GEMINI XS紫外/荧光扫描酶标仪,美国SPECTRA MAX公司;PB602-E型精密天平,德国Sartorius公司;Centrifuge 5804R高速台式冷冻离心机,德国Eppendorf公司;DKS-12电热恒温水浴装置,上海中兴医疗仪器厂。
1.2HK-2细胞的培养
HK-2细胞购于中国医学科学院基础医学研究所。在37℃、饱和湿度、体积分数为5%CO2的条件下,HK-2细胞接种于含有10%新生牛血清的DMEM/F12的培养基中,每2~3 d换液1次,直到细胞生长到对数生长期时,用含有0.05%胰蛋白酶和0.02%EDTA的消化液消化细胞,进行细胞传代或接种。
1.3MTT检测细胞活性
将对数生长期的HK-2细胞按每孔5×103细胞接种于96孔细胞培养板中,经24 h贴壁后,换以含不同浓度甘露醇(50,100,150,200,250,300,350 和400 mmol·L-1)的培养基分别孵育细胞4,10,24,48和72 h,以等体积溶剂作为阴性对照组,每组设4~5复孔。孵育结束后,每孔加入20 μL MTT (5 g·L-1)溶液,继续孵育4 h,吸弃培养基,每孔加入DMSO 200 μL溶解结晶,避光低速摇匀10 min后,酶标仪490 nm处测定吸光值(A490 nm)。按以下公式计算细胞存活率。处理组细胞存活率(%)=处理组(A490 nm)/对照组(A490 nm)×100%。
1.4DCFH-DA检测细胞的活性氧水平
将HK-2细胞接种于细胞培养板中,用不同浓度甘露醇(100和250 mmol·L-1)孵育细胞4 h,用PBS洗3次后,20 μmol·L-1DCFH-DA荧光染料孵育细胞30 min,PBS洗3次后,各孔加入0.1% Triton X-100(V/V)500 μL,摇床裂解10 min,收集裂解液。用荧光扫描酶标仪在485 nm激发波长和530 nm发射波长下检测荧光强度。活性氧水平与荧光强度呈正相关。
1.5氧化应激指标的检测
将HK-2细胞接种于6孔培养板中,用含不同浓度甘露醇(100和250 mmol·L-1)的培养基分别孵育细胞4,10,24,48和72 h,以等体积溶剂作为阴性对照组,倒置显微镜下拍照观察,记录细胞各时间点和浓度下的细胞形态变化。孵育结束后,PBS洗3次,用细胞刮铲收集细胞于1.5 mL的EP管中,800×g离心5 min,弃上清,PBS重悬细胞,超声破碎细胞,制成悬液。按MDA,SOD和GSH检测试剂盒说明书的方法对样本进行检测和分析,每组设3复孔。
1.6统计学分析
2 结果
2.1甘露醇对HK-2细胞存活的影响
MTT法检测结果表明,甘露醇对HK-2细胞有明显毒性作用,且4个时间点均随药物浓度增加细胞存活率降低,呈浓度依赖性(4 h,r2=0.89,P<0.01;10 h,r2=0.91,P<0.01;24 h,r2=0.90,P<0.01;48 h,r2=0.92,P<0.01;72 h,r2=0.94,P<0.01)。甘露醇<100 mmol·L-1孵育72 h对HK-2细胞存活无显著影响;甘露醇150 mmol·L-1孵育>24 h或>200 mmol·L-1孵育>4 h可显著降低细胞存活率(P<0.05);甘露醇250 mmol·L-1孵育72 h,细胞存活率约为溶剂对照组的50%(图1)。因此,后续实验选择对细胞存活率无显著影响的甘露醇浓度100 mmol·L-1和对细胞损伤约50%的250 mmol·L-1进行。

Fig.1 Effect of mannitol on HK-2 cell viability.HK-2 cell viability was detected with MTT assay.Cell viability(%)=A490 nmof mannitol treated group/A490 nmof solvent control group×100%.,n=4.*P<0.05,compared with solvent control(0 mmol·L-1)group.
2.2甘露醇对HK-2细胞形态的影响
用甘露醇100和250 mmol·L-1分别孵育HK-2细胞4,10,24,48和72 h后观察细胞形态的变化。甘露醇100 mmol·L-1与HK-2细胞孵育4,10,24,48和72 h,细胞形态与正常细胞无明显区别,形态正常;但甘露醇250 mmol·L-1处理后细胞形态出现明显变化,细胞肿胀、空泡化,细胞脱落。图2为甘露醇孵育72 h细胞形态的变化。
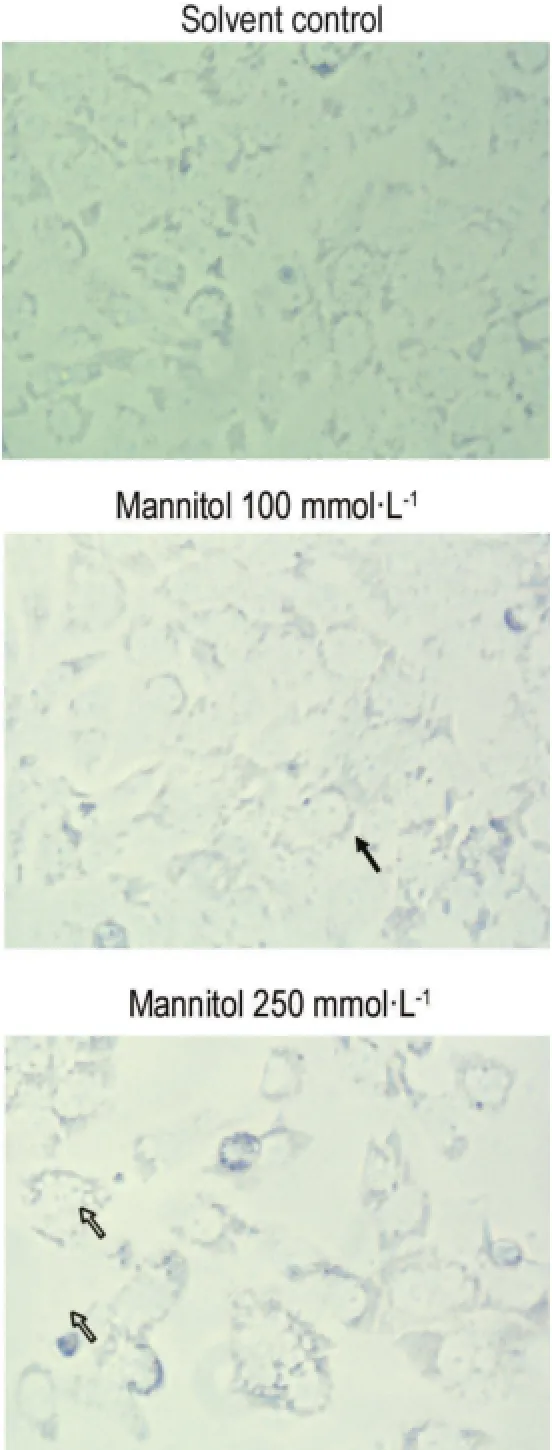
Fig.2 Morphological changes of HK-2 cells after treatment with mannitol for 72 h(×40). :cell swelling;:cell vacuoles or fall off.
2.3甘露醇对HK-2细胞活性氧水平的影响
与溶剂对照组(荧光强度50.3±4.6)相比,甘露醇100和250 mmol·L-1作用细胞4 h荧光强度分别为59.8±3.0和68.7±3.6,表明细胞内活性氧水平升高(n=3,P<0.05)。甘露醇250 mmol·L-1使细胞内活性氧增加的幅度约为100 mmol·L-1的2倍(n=3,P<0.05)。
2.4甘露醇对HK-2细胞MDA和GSH含量及SOD活性的影响
与溶剂对照组相比,甘露醇100 mmol·L-1作用细胞4,10,24,48和72 h后,细胞MDA含量和SOD活性无显著改变(图3A,3B),GSH含量显著降低(P<0.05)(图3C);甘露醇250 mmol·L-1作用4~72 h细胞MDA含量显著增高,约为溶剂对照组的6倍,同时细胞内SOD活性降低50%左右,GSH含量减少70%~80%(图3)。
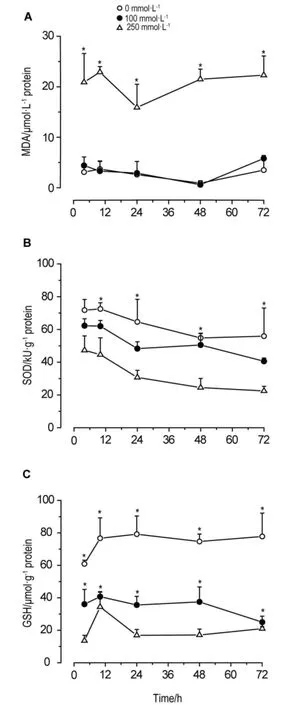
Fig.3 Effect of mannitol on malondialdehyde(MDA),glutathione(GSH)content and superoxide dismutase (SOD)activity in HK-2 cells.,n=3.A:MDA content;B:SOD activity;C:GSH content.*P<0.05,compared with solvent control(0 mmol·L-1)group.
3 讨论
目前,甘露醇引起ARF的机制尚不明确,临床认为甘露醇可能通过升高血液渗透压使之超过肾小球滤过压,导致肾小球滤过降低或停止而发生肾损害。在临床上,甘露醇成人的常规剂量是1~2g·kg-1,按成人体质量60 kg,血容量70 mL·kg-1计算,1.35 g·kg-1的给药剂量约为100 mmol·L-1的血药浓度。据报道,甘露醇大剂量、长时间给药,如200 g·d-1持续4 d(共800 g),或在甘露醇总给药剂量600 g时,已出现ARF和肾损伤的不良反应,而此时的剂量约为常规剂量的2.5倍,即250 mmol·L-1。所以在临床上,治疗一般的组织脱水,常规给药剂量约为100 mmol·L-1的血药浓度。当大剂量给药时,如250 mmol·L-1,即有可能出现肾毒性和不同程度肾损伤,这与本研究的实验结果大致相同。所以本研究选择了甘露醇常规浓度100 mmol·L-1和高浓度250 mmol·L-1作用于细胞,进一步研究甘露醇引起ARF或肾损伤的可能机制。
氧化应激代谢中脂质过氧化产物MDA的水平可反映细胞氧化应激的程度;MDA可破坏细胞生物膜结构,改变细胞膜通透性,导致细胞肿胀坏死,并可通过影响线粒体呼吸链复合物及线粒体内关键酶活性等途径损伤细胞。抗氧化系统中包括抗氧化酶和非酶抗氧化剂,主要的抗氧化酶之一是SOD,其可通过清除自由基而减少或消除氧化损伤;非酶抗氧化剂中的GSH也可通过清除自由基中的低分子质量物质而起到保护细胞免受氧化损伤的作用。所以,本研究选择这3个指标观察甘露醇对细胞脂质过氧化的影响。研究发现,甘露醇250 mmol·L-1作用4 h可引起细胞内活性氧显著增加,细胞内MDA含量在4~72 h也显著增加,而同时细胞内的SOD活性和GSH含量显著下降,说明高浓度(250 mmol·L-1)甘露醇可能通过促进细胞活性氧大量产生,使胞内脂质过氧化产物急剧增加,同时抗氧化系统被破坏,大量MDA的积累可以产生细胞毒性作用,从而损伤肾细胞的结构和功能。常规浓度的甘露醇100 mmol·L-1作用4 h也可引起细胞活性氧的小幅增加,但此时可能机体自身的抗氧化防御系统可以阻止活性氧氧化生物膜上的不饱和脂肪酸,而不导致MDA含量的明显变化。细胞内GSH含量的下降提示细胞抗氧化防御中可能优先消耗GSH抗氧化物质,通过清除自由基中的低分子质量物质,保护细胞免受氧化损伤的作用。张鑫等[8]在研究七叶皂苷对HK-2细胞的细胞毒性时也认为GSH作为抗氧化剂可以清除活性氧而减轻细胞氧化损伤。Baliga等[6]在研究甘油诱导所致ARF时,肾GSH含量也显著下降,表明GSH在其中起到重要的保护作用。
由于机体自身的抗氧化防御系统能清除外界少量的活性氧而保护细胞免受氧化损伤,常规浓度的甘露醇可能只使细胞处于轻度氧化应激状态,而高浓度的甘露醇则可能通过促进细胞产生大量活性氧,打破细胞氧化和抗氧化系统平衡。因此,高浓度(250 mmol·L-1)甘露醇可能通过氧化应激途径损伤肾小管上皮细胞而产生细胞毒性作用。
[1]Dormán HR,Sondheimer JH,Cadnapaphornchai P. Mannitol induced acute renal failure[J].Medicine,1990,69(3):153-159.
[2]Gadallah MF,Lynn M,Work J.Casereport:mannitol nephrotoxicity syndrome:role of hemodialysis and postulate of mechanisms[J].Am J Med Sci,1995,309(4):219-222.
[3]Maunsbach AB,Madden SC,Latta H.Light and electron microscopic changes in proximal tubules of rats after administration of glucose,mannitol,sucrose,or dextran[J].Lab Invest,1962,11:421.
[4]Stuart FP, Torres E,Fletcher R,Crocker D,Moore FD.Effects of single,repeated and massive mannitol infusion in the dog:structural and functional changes in kidney and brain[J].Ann Surg,1970,172(2):190-204.
[5]Zhu XP,Liu FY,Lou J,Liu RB,Xu XP.The functionalstructuralchangesofrabbitkidney following different dosage mannitol treatment[J]. Chin J Nephrol Dialy Transplant(肾脏病与透析肾移植杂志),1998,7(5):438-441.
[6]Baliga R,Ueda N,Walker PD,Shah SV.Oxidant mechanisms in toxic acute renal failure[J].Am J Kidney Dis,1997,29(3):465-477.
[7]Aragno M,Cutrin JC,Mastrocola R,Perrelli MG,Restivo F,Poli G,et al.Oxidant stress and kidney dysfunction due to ischemia-reperfusion inrat:attenuation by dehydroepiandrosterone[J].Kidney lnt,2003,64(3):836-843.
[8]Zhang X,Yuan L,Yang XW,JIAO SY,WANG Q. Oxidative mechanism for toxicity induced by sodium aescinate in HK-2 cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2010,24(6):471-475.
Effect of mannitol on oxidative stress of human kidney tubular epithelial cells
ZHANG Qiong-li,LUO Wen-hong,LIN Zhe-xuan
(Bioanalytical Laboratory,Medical College of Shantou University,Shantou 515041,China)
OBJECTIVE To observe the effect of mannitol on oxidative stress of human kidney tubular epithelial cells(HK-2).METHODS MTT assay was applied to detect HK-2 cell viability after exposure to different concentrations(50,100,150,200,250,300,350 and 400 mmol·L-1)of mannitol for 4,10,24,48 and 72 h.DCFH-DA method was used to determine the level of reactive oxygen species (ROS)after HK-2 cells were exposed to mannitol 100 and 250 mmol·L-1for 4 h.Furthermore,cell morphology and indexes of oxidative stress such as malondialdehyde(MDA)content,superoxide dismutase(SOD)activity and glutathione(GSH)content were observed at different time points. RESULTS HK-2 cell viability decreased by about 50%after being treated with mannitol 250 mmol·L-1for 72 h(P<0.05).ROS production in mannitol 250 mmol·L-1treated group(68.7±3.6)was higher than in solvent control group(50.3±4.6)(P<0.05).HK-2 cells exhibited morphological changes after treatment with mannitol 250 mmol·L-1for 4-72 h,including cell swelling,vacuoles and fall off.After treatment with mannitol 250 mmol·L-1for 4,10,24,48 ahd 72 h,the MDA content increased significantly(P<0.05),while the activity of SOD and the content of GSH decreased significantly compared with solvent control group(P<0.05).CONCLUSION Over-production of ROS in HK-2 cells induced by high concentration(250 mmol·L-1)of mannitol may cause lipid peroxidation and injure the ability of antioxidation,which may contribute to mannitol induced cytotoxicity.
mannitol;renal tubule;epithelial cells;oxidative stress;malondialdehyde
The project supported by Natural Science Foundation of China(81170315);and Team Research Project of Guangdong Provincial Natural Science Foundation(9351503102000001)
LIN Zhe-xuan,Tel:(0754)8900530,E-mail:g_zxlin@stu.edu.cn
R969.3,R983.1
A
1000-3002(2016)02-0122-05
10.3867/j.issn.1000-3002.2016.02.006
2015-06-15接受日期:2016-01-13)
(本文编辑:齐春会)
国家自然科学基金项目(81170315);广东省自然科学基金团队资助项目(9351507102000-001)
张琼丽(1988-),硕士研究生,主要从事药物分析与代谢研究。
林哲绚,E-mail:g_zxlin@stu.edu.cn,Tel:(0754)88900530
