怀牛膝果寡糖对H1N1流感疫苗佐剂活性及免疫细胞功能的影响
2016-09-21汪艳艳李海霞巫亚俊赵修南刘坤璐武军华单俊杰王玉霞王海南贵州大学药学院贵州贵阳55005军事医学科学院毒物药物研究所北京100850国家食品药品监督管理总局北京100053
汪艳艳,李海霞,巫亚俊,赵修南,麻 浩,刘坤璐,武军华,单俊杰,王玉霞,王海南(1.贵州大学药学院,贵州贵阳 55005;.军事医学科学院毒物药物研究所,北京 100850;3.国家食品药品监督管理总局,北京100053)
怀牛膝果寡糖对H1N1流感疫苗佐剂活性及免疫细胞功能的影响
汪艳艳1,2,,李海霞2,巫亚俊2,赵修南2,麻浩2,刘坤璐2,武军华2,单俊杰2,王玉霞2,王海南1,3
(1.贵州大学药学院,贵州贵阳 550025;2.军事医学科学院毒物药物研究所,北京 100850;3.国家食品药品监督管理总局,北京100053)
目的 研究牛膝果寡糖ABP-50-FOS对H1N1流感疫苗的佐剂活性及免疫细胞功能的影响。方法 采用凝胶渗透色谱、毛细管电泳、红外光谱和核磁共振等方法研究ABP-50-FOS的理化性质;BALB/c小鼠肌肉注射H1N1流感疫苗3 μg和ABP-50-FOS 200 μg初次免疫,28 d后加强免疫。分别于初次和再次免疫后14 d用ELISA法检测小鼠血清特异性IgG,IgG1,IgG2a,IgG2b,IgG3和IgM抗体水平;流式细胞仪测定脾细胞中CD3+,CD19+,CD4+和CD8+淋巴细胞亚群百分率;MTT法测定小鼠脾细胞增殖活性;ELISA法测定脾细胞培养上清干扰素γ(IFN-γ)、胸腺细胞培养上清白细胞介素4(IL-4)、腹腔巨噬细胞培养上清肿瘤坏死因子α(TNF-α)和一氧化氮及小鼠骨髓细胞和DC2.4树突状细胞培养上清IL-12p70含量。结果ABP-50-FOS是一种果寡糖,峰高分子质量为1885 u,骨架结构为1,2-连接和1,6-连接的果糖。该寡糖能明显升高H1N1流感疫苗免疫小鼠血清特异性IgG,IgG2a和IgM抗体水平(P<0.01),提高免疫小鼠脾CD3+,CD4+和CD8+T淋巴细胞亚群的百分率。体外实验表明,ABP-50-FOS能促进小鼠脾细胞增殖反应和IFN-γ分泌(P<0.01),促进胸腺细胞IL-4分泌(P<0.01),刺激腹腔巨噬细胞分泌TNF-α(P<0.01)和DC2.4树突状细胞分泌IL-12p70(P<0.01),对巨噬细胞一氧化氮的分泌有抑制作用。结论 牛膝果寡糖ABP-50-FOS对H1N1流感疫苗具有良好的佐剂活性,体外对小鼠免疫细胞功能具有促进作用。
牛膝;多糖;果寡糖;疫苗;佐剂
怀牛膝(Achyranthes bidentata Blume)为苋科多年生草本植物,其干燥根入药,可用来治疗肝阳眩晕、产后腹痛、跌打损伤等病症[1]。多糖作为牛膝药材的主要活性成分之一,近年来对其研究和报道较多,如免疫调节[2]、抗肿瘤[3]、抗凝血[4]、抗病毒[5]、抗疟疾[6]和治疗关节炎[7]等作用。邱妍等[8]采用水煎醇沉法提取怀牛膝粗多糖(糖含量为54%),用该多糖点眼滴鼻免疫鸡新支二联弱毒苗,同时分别肌肉注射怀牛膝多糖1.5或3.0 mg。结果表明,怀牛膝多糖3.0 mg能提高抗体效价,促进T淋巴细胞增殖。封海波等[9]在室温下采用超声辅助水提醇沉法提取牛膝粗多糖(糖含量为78.9%),分别按25,50 和100 mg·kg-1与O型口蹄疫灭活疫苗协同免疫ICR小鼠2次。结果发现,牛膝粗多糖明显增强共刺激信号分子CD40,CD80和CD86的表达水平,同时提高主要组织相容性复合体Ⅰ(major histocompatibility complex-Ⅰ,MHC-Ⅰ)、MHC-Ⅱ、趋化因子受体 4(chemokine receptor 4,CXCR4)和CC趋化因子受体7(CC chemokine receptor 7,CCR7)mRNA表达水平。上述研究表明,牛膝粗多糖具有显著的疫苗佐剂活性,但对其中的活性成分尚未见进一步的追踪和报道。
本研究在50℃条件下采用水提、醇沉、透析和冷冻干燥方法制备牛膝粗多糖ABP-50。ABP-50 经DEAE-纤维素柱层析获得多糖组分ABP-50-A,再用Sephadex G-50柱纯化,获得果寡糖ABP-50-FOS。继而采用H1N1流感疫苗评价该果寡糖的疫苗佐剂活性,同时评价该寡糖对疫苗免疫小鼠及正常小鼠免疫细胞功能的影响,为深入研究牛膝果寡糖佐剂作用机制提供实验依据。
1 材料与方法
1.1药材、试剂、仪器和动物
怀牛膝购于北京同仁堂药店,产地河南,批号30770101,北京三和药业有限公司炮制。牛膝果寡糖ABP-50-FOS由本课题组分离和纯化获得。甲型H1N1流感病毒裂解液由北京科兴生物制品有限公司生产;刀豆蛋白(concanavalin A,Con A)和脂多糖(lipopolysaccharides,LPS)均购自美国Sigma公司;HRP标记山羊抗小鼠IgG和兔抗山羊IgG和N-四甲基联苯胺(TMB)均购自北京中杉金桥生物技术公司;小鼠抗体及亚类(IgG1,IgG2a,IgG2b,IgG3,IgM和IgA)测定试剂盒购于美国Sigma公司;PerCP标记仓鼠抗小鼠CD3e、APC标记大鼠抗小鼠CD19、PE标记大鼠抗小鼠CD4以及FITC标记大鼠抗小鼠CD8抗体均购于美国BD Bioscience公司;小鼠干扰素γ(interferon-γ,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)4、IL-12和一氧化氮(nitrogen monoxide,NO)ELISA试剂盒均购于欣博盛生物科技有限公司;胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;RPMI 1640培养基购自美国Hyclone公司;MTT购自Amresco公司。Varioskau Flash version 2.4.3酶标仪和F1-01620型洗板机均为美国Thermo Scientific公司产品,流式细胞仪为美国BD公司产品。BALB/c小鼠,雌性,6~8周龄,合格证号:军科院SCXK(军)2012-001,由军事医学科学院实验动物中心供给。DC2.4细胞株购于上海研谨生物科技有限公司。
1.2ABP-50-FOS的制备
怀牛膝1 kg粉碎,加入15 L去离子水浸泡,在50℃条件下提取4 h。离心,残渣采用同样条件重复提取1次,合并上清液,55℃减压浓缩至2 L,然后加入95%乙醇8 L进行醇沉48 h。离心,沉淀部分加入1 L水搅拌溶解、离心。沉淀部分再重复加水2次溶解,合并上清液,装入透析袋(截留分子质量>1000 u),流水透析48 h,去离子水透析24 h。袋内溶液离心、减压浓缩和冷冻干燥,获得粗多糖ABP-50。ABP-50 500 mg溶于20 mL水,上样于DEAE-纤维素层析柱,连续采用水和NaHCO30.25 mol·L-1洗脱,蒽酮-硫酸法检测含糖流份,收集、透析、冷冻干燥,分别获得ABP-50-A和ABP-50-B组分。ABP-50-A 200 mg溶于2 mL水,上样于Sephadex G-50层析柱,水洗脱,蒽酮-硫酸法检测含糖流分,收集、冷冻干燥,获得分子质量均一的多糖成分ABP-50-FOS。
1.3ABP-50-FOS的理化性质
采用凝胶过滤色谱法测定果寡糖ABP-50-FOS的纯度和分子质量[10],毛细管电泳法测定其单糖组成[11-12]。IR,[1H]NMR和[13C]NMR确定其结构特点。
1.4H1N1流感疫苗免疫方案
BALB/c小鼠随机分为4组:生理盐水组、H1N1抗原组、H1N1+ABP-50-FOS组和H1N1+铝佐剂组,每组6只。H1N1抗原的免疫剂量为每只小鼠3 μg,ABP-50-FOS和铝佐剂的剂量均为每只小鼠200 μg。采用后肢内侧肌内注射途径,初次免疫28 d进行再次免疫,分别在初次和再次免疫后14 d小鼠尾静脉采血,分离血清,测定血清特异性IgG抗体及亚类抗体滴度。
1.5ELISA法检测血清IgG类抗体滴度
小鼠血清用含0.1%吐温-20的磷酸缓冲溶液(PBST,pH 7.4)按1∶400的比例稀释。采用抗原2 g·L-1包被96孔板,每孔100 μL,4℃包被过夜。每孔再加入1%牛血清白蛋白200 μL,37℃孵育封闭1 h。封闭后用PBST洗3次,然后每孔加入100 μL倍比稀释的血清(以1∶400稀释液为原液),再37℃继续孵育1 h。用PBST洗板3次后,每孔加入1∶1000稀释的HRP标记山羊抗小鼠IgG抗体100 μL,37℃孵育1 h。再用PBST洗板5次,TMB底物显色,用酶标仪测定波长450 nm处的吸光度(A450nm)。
1.6ELISA法检测血清IgM,IgA和IgG亚类抗体滴度
抗原用碳酸盐缓冲液0.5 mol·L-1(pH 9.6)稀释,终浓度为3 mg·L-1,加入96孔板中,每孔100 μL,4℃包被过夜。每孔用PBST洗3次后加入5%脱脂奶粉37℃封闭1 h。PBST洗涤3次,加入100 μL倍比稀释的血清(以1:400稀释液为原液),37℃继续孵育1 h。PBST再洗涤3次,每孔加入山羊抗小鼠(IgG1,IgG2a,IgG2b,IgG3,IgM和IgA)抗体100 μL(用PBST 1∶1000倍稀释),37℃孵育1 h。PBST洗涤3次,加入HRP标记的兔抗山羊IgG抗体100 μL(用PBST 1∶1000倍稀释),37℃孵育1 h。再用PBST洗涤5次,加入TMB显色底物,每孔100 μL,室温避光显色15 min。最后每孔加入0.2 mol·L-1硫酸溶液50 μL终止显色,酶标仪测定A450 nm。
1.7流式细胞仪检测脾B淋巴细胞和T细胞亚群
H1N1流感疫苗免疫后28 d小鼠眼球取血,颈椎脱臼处死。无菌条件下取脾制备脾细胞悬液,调整细胞密度为2×1010L-1。取脾细胞悬液100 μL,加入100 μL混合抗体(含PerCP-仓鼠抗小鼠CD3e抗体0.25 μg,APC-大鼠抗小鼠CD19抗体0.5 μg,PE-大鼠抗小鼠CD4抗体0.125 μg,FITC-大鼠抗小鼠CD8a抗体0.5 μg),每组设3平行管。另外设4个相应的单标抗体对照。室温下避光孵育25 min,各管加入洗液1.5 mL,混匀,4℃离心10 min(600×g),弃上清,再重复离心和洗涤3次,重悬细胞,加入PBS 500 μL摇匀,进行流式细胞仪分析,测定CD3+,CD19+,CD4+和CD8+细胞的百分率。
1.8体外脾细胞增殖活性的测定
正常BALB/c小鼠眼球取血,颈椎脱臼处死。无菌条件下取出脾,制备脾细胞悬液,用锥虫蓝染色法检测细胞存活率>95%,进行细胞计数,调整细胞密度为5×109L-1。将计数后的脾细胞悬液按每孔100 μL加入到96孔细胞培养板,各孔分别加入50 μL细胞培养液、Con A(终浓度4 mg·L-1)或LPS(终浓度15 mg·L-1)溶液,各孔再分别加入50 μL ABP-50-FOS溶液(终浓度分别为0,2,10和50 mg·L-1)。每组设3复孔。将培养板置于含5%CO2培养箱中,37℃孵育48 h。加入20 μL MTT(5 g·L-1),继续孵育4 h。弃上清液,每孔中加入150 μL DMSO,酶标仪检测A570 nm,计算细胞增殖百分率。
1.9脾细胞分泌IFN- 和胸腺细胞分泌IL-4水平的测定
BALB/c小鼠眼球取血,颈椎脱臼处死,无菌摘取脾和胸腺,分别制备脾细胞悬液(5×109L-1)和胸腺细胞悬液(2×1010L-1)。将脾细胞和胸腺细胞悬液分别加入24孔细胞培养板,每孔500 μL。细胞样品孔中加500 μL培养液、Con A(终浓度为2 mg·L-1)或ABP-50-FOS溶液(终浓度分别为2,10和50 mg·L-1),每组设3复孔。然后置于37℃,5%CO2培养箱中培养。脾细胞培养48 h,胸腺细胞培养72 h,然后取出细胞培养液,离心10 min(600×g)收集上清,按照ELISA试剂盒说明书分别测定脾细胞培养上清IFN-γ含量和胸腺细胞培养上清IL-4含量。
1.10腹腔巨噬细胞分泌TNF- 和NO水平的测定
正常BALB/c小鼠,颈椎脱臼处死,无菌条件下腹腔注射含5%FBS的RPMI 1640培养液,然后抽取腹腔溶液,离心10 min(600×g),弃上清,加入红细胞溶胀液后,用细胞培养液洗涤3次。用含10% FBS的RPMI 1640培养液重悬细胞,调整细胞密度,加入24孔培养板每孔0.5 mL,含5×105个细胞,置于37℃,5%CO2,饱和湿度孵温箱培养2 h。吸去上清,用0.9%NaCl去除未贴附的细胞,每孔分别加入0.5 mL细胞培养液、LPS(终浓度30 mg·L-1)和ABP-50-FOS(终浓度分别为2,10和50 mg·L-1)。每组设3复孔,然后置于培养箱中培养24 h。离心,收集培养液上清,用ELISA试剂盒测定细胞上清液的TNF-α和NO含量。
1.11小鼠骨髓细胞和DC2.4树突状细胞分泌IL-12p70含量的测定
正常BALB/c小鼠,颈椎脱臼处死,无菌条件下剥离和剪断股骨,向骨髓腔内注射细胞培养液,冲洗3次。冲洗液过筛、离心,然后加入Tris-NH4Cl缓冲液裂解红细胞。再用细胞培养液洗涤2次,重悬细胞、计数,然后用含20%FBS的培养液调制密度为4×109L-1骨髓细胞悬液。24孔培养板中加入骨髓细胞悬液(终密度4×108L-1),然后分别加入生理盐水、LPS(终浓度30 mg·L-1)或ABP-50-FOS(终浓度2,10和50 mg·L-1),37℃,5%CO2孵育48 h。离心,测定上清液IL-12p70含量。
取传代培养DC2.4树突状细胞,加入含10%FBS 的RPMI 1640培养液,调整细胞密度为2.5×109L-1。24孔培养板中加入树突状细胞悬液(终密度1.25× 108L-1),分别加入生理盐水、LPS(终浓度30 mg·L-1)及ABP-50-FOS(终浓度2,10和50 mg·L-1),37℃,5%CO2孵育48 h。离心,测定上清液IL-12p70含量。
1.12统计学分析
2 结果
2.1ABP-50-FOS的得率和理化性质
在50℃条件下牛膝经水提、醇沉、透析和冷冻干燥获得粗多糖ABP-50,淡黄色,得率5.76%。ABP-50经DEAE-纤维素柱层析分别得到ABP-50-A 和ABP-50-B组分,得率分别为69.6%和3.2%。ABP-50-A再经Sephadex G-50纯化,获得果寡糖ABP-50-FOS,呈白色片状粉末,得率为85%。
HPGPC分析表明,ABP-50-FOS呈单一对称色谱峰,峰高分子质量为1885 u。IR,[1H]NMR和[13C]NMR图谱与文献报道基本一致[13],提示ABP-50-FOS可能为已知结构的果寡糖。
2.2ABP-50-FOS对H1N1流感疫苗免疫小鼠体液免疫反应的影响
ABP-50-FOS与H1N1流感疫苗联用初次免疫后14 d,所有免疫组小鼠血清IgG抗体滴度均很低,各组之间无明显差异(图1A)。加强免疫14 d后,与生理盐水组相比,单独H1N1疫苗组血清特异性IgG,IgG1和IgM滴度显著升高(P<0.01),同时IgG2a和IgG2b滴度也明显升高(P<0.01)。与单独H1N1疫苗组相比,联用ABP-50-FOS能进一步升高IgG,IgG2a和IgM滴度(P<0.05,P<0.01);相反,铝佐剂显著降低IgG,IgG1和IgM水平(P<0.01),推测原因之一是铝佐剂可能吸附抗原,影响抗原的释放。上述结果提示,ABP-50-FOS能提高H1N1疫苗免疫小鼠体液免疫反应(图1B和C)。

Fig.1 Co-administration of fructoolgosaccharide ABP-50-FOS adjuvant from A.bidentata with H1N1 influenza vaccine enhances humoral responses.BALB/c mice were immunized intramuscularly with H1N1 antigen 3 μg,ABP-50-FOS 200 μg or alum 200 μg per mouse.Blood samples were collected at 14 d after first(A)and second(B,C)immunizations and total IgG(A,B)and its isotypes(C)titers were measured by ELISA.,n=6.*P<0.05,**P<0.01,compared with saline group;#P<0.05,##P<0.01,compared with H1N1 antigen alone group.
2.3ABP-50-FOS对H1N1免疫小鼠脾淋巴细胞亚群的影响
H1N1流感疫苗与ABP-50-FOS联用免疫小鼠2次后,测定对脾T和B细胞分化及T细胞亚群的影响。从表1结果可以看出,与生理盐水组相比,单独H1N1疫苗免疫小鼠2次后,CD19+亚群细胞百分率降低,CD3+细胞百分率及CD3+/CD19+的比值均升高(P<0.01)。与单独H1N1疫苗组相比,联用ABP-50-FOS能进一步升高CD3+细胞百分率和CD3+/CD19+的比值(P<0.01),提示H1N1抗原联用ABP-50-FOS有利于向T细胞分化。联用铝佐剂组CD3+细胞百分率和CD3+/CD19+比值明显降低(P<0.01)。表2结果表明,与生理盐水组相比,单独免疫H1N1抗原能提高CD4+T细胞的百分率(P<0.05),但对CD8+T细胞的百分率及CD4+/CD8+比值无明显影响。与单独H1N1抗原组相比,联用ABP-50-FOS能明显升高CD4+和CD8+T细胞百分率(P<0.01),降低CD4+/CD8+比值(P<0.01)。铝佐剂与ABP-50-FOS相反,降低CD4+T细胞百分率和CD4+/ CD8+比值(P<0.05)。2.4 ABP-50-FOS体外对正常小鼠脾细胞增殖和分泌IFN- 的影响

Tab.1 Effect of ABP-50-FOS on CD3+and CD19+cell percentage in spleen of H1N1 influenza vaccine immunized mice
BALB/c小鼠脾细胞分别在Con A(4 mg·L-1)或LPS(15 mg·L-1)刺激下,与不同浓度ABP-50-FOS共孵育48 h。表3结果表明,在无丝裂原刺激下,小鼠原代脾细胞与ABP-50-FOS 2,10和50 mg·L-1共孵育48 h能显著促进脾细胞增殖反应。在Con A刺激下脾细胞发生明显增殖(P<0.01),ABP-50-FOS 10和50 mg·L-1对Con A有协同作用(P<0.05),而ABP-50-FOS只有在50 mg·L-1浓度下对LPS有协同效应(P<0.05)。表4结果表明,与生理盐水组相比,ABP-50-FOS 3个浓度均能明显促进脾细胞分泌IFN-γ(P<0.01)。推测ABP-50-FOS能提高小鼠脾T和B细胞增殖反应,促进T细胞向Th1细胞分化。

Tab.2 Effect of ABP-50-FOS on CD4+and CD8+T cell percentage in spleen of H1N1 influenza vaccine immunized mice
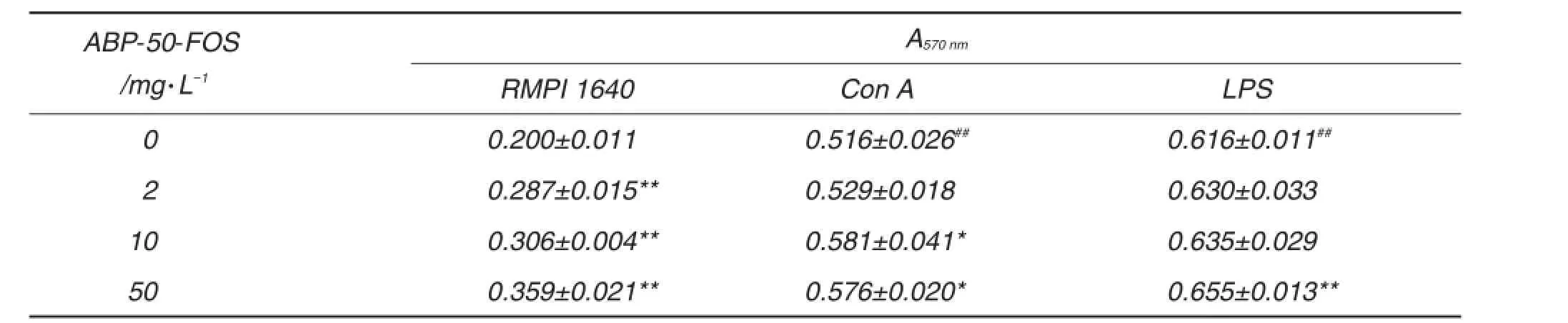
Tab.3 Splencyte proliferation of BALB/c mice stimulated by ABP-50-FOS in vitro
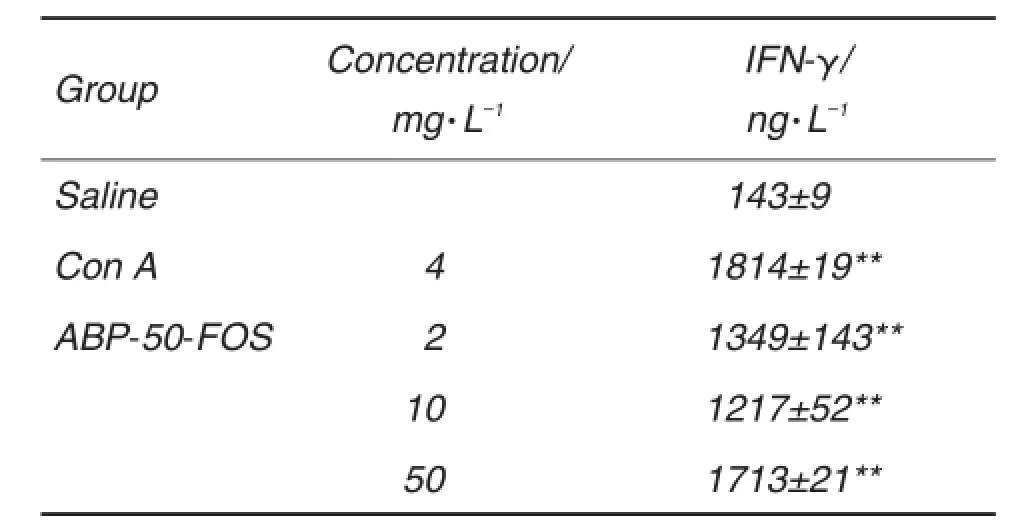
Tab.4 Effect of ABP-50-FOS on interferonI- (IFN- )secretion of splencytes in BALB/c mice in vitro
2.5ABP-50-FOS对胸腺细胞分泌IL-4的影响
由表5可见,BALB/c小鼠胸腺细胞在生理盐水、Con A或不同浓度ABP-50-FOS刺激下培养72 h,与生理盐水组相比,Con A刺激能显著促进小鼠胸腺细胞IL-4的分泌(P<0.01);ABP-50-FOS 2,10和50 mg·L-1也能显著刺激小鼠胸腺细胞分泌IL-4。

Tab.5 Effect of ABP-50-FOS on interleukin-4(IL-4)secretion of thymocytes in BALB/c mice in vitro
2.6ABP-50-FOS对腹腔巨噬细胞分泌TNF- 和NO的影响
BALB/c小鼠腹腔巨噬细胞在生理盐水、LPS或不同浓度ABP-50-FOS刺激下培养24 h,测定细胞培养上清液中TNF-α和NO的含量。表6结果表明,LPS能刺激小鼠腹腔巨噬细胞分泌TNF-α (P<0.01),但对NO分泌无影响。ABP-50-FOS 50 mg·L-1LPS作用相似,也能促进TNF-α的分泌(P<0.01),但对NO的分泌有一定抑制作用(P<0.05)。

Tab.6 Effect of ABP-50-FOS on tumor necrosis factor-(TNF- )and nitrogen monoxide(NO)secretions of peritoneal macrophages in BALB/c mice in vitro
2.7ABP-50-FOS对小鼠骨髓细胞和DC2.4树突状细胞系分泌IL-12p70的影响
BALB/c小鼠的原代骨髓细胞或DC2.4树突细胞分别在生理盐水、LPS或不同浓度ABP-50-FOS刺激下培养48 h,测定细胞培养上清液中IL-12p70的含量。表7结果表明,LPS能明显小鼠骨髓细胞和DC2.4树突状细胞分泌IL-12p70(P<0.01)。ABP-50-FOS 50 mg·L-1对小鼠骨髓细胞分泌IL-12p70有促进作用(P<0.05),ABP-50-FOS 10 和50 mg·L-1则能显著刺激DC2.4树突状细胞分泌IL-12p70(P<0.01)。提示ABP-50-FOS具有活化树突状细胞的作用。

Tab.7 Effect of ABP-50-FOS on IL-12p70 secretion of dendritic cells in BALB/c mice in vitro
3 讨论
牛膝是我国传统的常用中药材之一,具有补肝肾、强筋骨、逐瘀通经和引血下行等攻补兼具的作用,其中多糖可能是主要活性成分之一。近年来大量文献报道,牛膝粗多糖和果聚糖具有多种药理活性[14-15],特别是在免疫调节和抗肿瘤方面[3,16]。时春娟等[17]对牛膝多糖结构修饰物(硫酸酯化、磷酸酯化、羧甲基化和羟甲基化)的抗肿瘤活性也进行了综述和评价,表明经过修饰后抗肿瘤活性进一步提高。文献中研究的牛膝多糖主要分为牛膝粗多糖和牛膝果聚糖(A.bidentata polyfructose,ABPS)。由于果糖是一种酮糖,经完全酸水解、硼氢化钠还原和乙酸酯衍生,最终为葡萄糖和甘露糖的乙酰化产物。早期文献报道,牛膝中葡甘寡糖(分子质量1400 u)具有显著的免疫调节活性[18-19];之后田庚元等[13]再一次研究确证,该寡糖是由果糖和葡萄糖组成,二者摩尔比为8∶1。
巨噬细胞在体液免疫中不仅直接吞噬和杀伤病原体,还能介导炎症反应、加工和递呈抗原,分泌多种细胞因子启动免疫应答。TNF-α是巨噬细胞分泌的主要细胞因子之一,对B细胞和T细胞的激活有重要意义。树突状细胞同样在免疫应答中也至关重要,不仅向B细胞和T细胞递呈抗原,同时还参与固有免疫和T细胞亚群的分化。树突状细胞活化后分泌IL-12和NO,IL-12与NO结合,能刺激NK细胞的细胞毒性,促使释放IFN-γ,继而促进Th1淋巴细胞的分化[20]。Chen等[21]将ABPS分别按1000和1500 mg·kg-1剂量灌胃给予断奶乳猪14和28 d,能明显提高血清中IgG,IgM,IgA,IL-2和IFN-γ含量,呈时-效和量-效关系。Jin等[3]将ABPS按200 mg·kg-1剂量腹腔注射Lewis肺癌小鼠,在抑制肿瘤细胞生长的同时能上调脾细胞IL-6和TNF-α mRNA的表达。Zhu等[6]先给小鼠每天腹腔注射ABPS 50 mg·kg-1,连续15 d,然后感染约氏疟原虫(P.y)17XL株,发现ABPS能显著增强Th1反应,增加表达F4/80+CD36+的巨噬细胞数量以及IFN-γ,TNF-α和NO含量。更重要是ABPS能增加骨髓CD11c+CD11b+树突状细胞和浆细胞样CD11c+CD45R+/B220+树突状细胞的数量,促进CD11c+树突状细胞表达MHC-Ⅱ和CD86及TLR-9。Zou等[22]研究发现ABPS通过提高CD86,CD40和MHC-Ⅱ的表达而促进小鼠树突状细胞成熟,增强其抗原递呈能力和IL-12的分泌。吕建新等[23]研究了ABPS对人胸腔巨噬细胞的激活作用。结果表明,其能上调胸腔巨噬细胞内乳酸脱氢酶和酸性磷酸酶活性,并能显著诱导胸腔巨噬细胞表达TNF-α和IL-6。以上文献提示,ABPS能明显激活巨噬细胞和树突状细胞,促进成熟和抗原递呈相关分子和细胞因子的表达(但均未提及果聚糖的理化性质)。有文献报道,从其他植物中提取的果寡糖具有良好的免疫调节和抗肿瘤活性,如Kardošová等[24]从牛蒡根中分离一种分子质量为2950 u的果寡糖,连接方式为 1)-Fruf-(2 ,具有镇咳作用。Chandrashekar等[25]从大蒜(Allium sativum)中分离出2个分子质量分别>3.5 ku和<3.0 u的果聚糖(命名HF和LF),结构均为 1)-β-Fruf-(2 。HF和LF能促进小鼠淋巴细胞增殖,增强腹腔巨噬细胞吞噬能力。Chen等[26]从川牛膝(Cyathula officinalis)中分离一个分子质量1.4 ku的果寡糖CoPS3,结构为β-D-果寡糖骨架,同时还有1,2和1,6-果糖支链及葡萄糖末端。CoPS3具有良好的抗肿瘤活性,能抑制小鼠Lewis肺癌生长。Wu等[27]从沿阶草(Ophiopogon japonicus)根中分离一个分子质量为14 ku的果聚糖Opaw-2,骨架结构为β-(1 2)-Fruf和β-(2 6)-Fruf,还有β-(1 2)-Fruf支链,能在10~100 mg·L-1范围内浓度依赖性促进小鼠淋巴细胞的增殖。
本研究从怀牛膝中分离得到果寡糖ABP-50-FOS,研究其疫苗佐剂活性。该果寡糖能明显提高H1N1流感疫苗免疫小鼠血清中抗原特异性IgG,IgG1和IgM抗体水平,同时还能促进免疫小鼠脾T细胞及Th1和Th2细胞分化。体外实验表明,ABP-50-FOS能促进小鼠脾T和B细胞增殖及IFN-γ分泌,刺激腹腔巨噬细胞分泌TNF-α,促进树突状细胞活化和分泌IL-12p70。以上结果提示,牛膝果寡糖ABP-50-FOS能提高疫苗免疫小鼠的体液免疫和细胞免疫应答能力,激活与抗原递呈密切相关的巨噬细胞和树突状细胞,对H1N1流感疫苗具有良好的疫苗佐剂活性。。其可能的作用机制有待进一步研究。
[1]State Pharmacopoeia Committee.Pharmacopoeia of the People′s Republic of China(中华人民共和国典)[M].Beijing:People′s Medical Publishing House,2010:67.
[2]Chen QH,Liu ZY,He JH.Achyranthes bidentata polysaccharideenhancesimmuneresponsein weaned piglets[J].Immunopharmacol Immunotoxicol,2009,31(2):253-260.
[3]Jin LQ,Zheng ZJ,Peng Y,Li WX,Chen XM,Lu JX.Opposite effects on tumor growth depending on dose of Achyranthes bidentata polysaccharides in C57BL/6 mice[J].Int Immunopharmacol,2007,7 (5):568-577.
[4]Mao P,Xia HL,Yuan XR,Ye WC.The experimental research on anticoagulant function of polysaccharides in Achyranthes bidentata[J].Lishizhen Med Mater Med Res(时珍国医国药),2000,11 (12):1075-1076.
[5]Liu C,Chen H,Chen K,Gao Y,Gao S,Liu X,et al.Sulfated modification can enhance antiviral activities of Achyranthes bidentata polysaccharideagainst porcine reproductive and respiratory syndrome virus(PRRSV)in vitro[J].Int J Biol Macromol,2013,52:21-24.
[6]Zhu XT,Pan YY,Zheng L,Cui LW,Cao YM. Polysaccharides from the Chinese medicinal herb Achyranthes bidentata enhance anti-malarial immunity during Plasmodium yoelii 17XL infection in mice [J].Malar J,2012,11:49-56.
[7]Fang F,Zou LY,Tang QZ.Effect of achyranthan on the repair of rabbit knee osteoarthritis[J].Hebei J TCM(河北中医),2014,36(5):749-751.
[8]Qiu Y,Hu YL,Cui B,Zhang HY,Wang YG. Effects of Achyranthes bidentata polysaccharide on immune efficacy of vaccine in chickens[J].Acta Veterit Zootech Sin(畜牧兽医学报),2007,38(7):723-727.
[9]Feng HB,Liu J,Song Z,Du X,Han XF,Zhao B. Effects of the polysaccharide from the Radix Cyathulae Offcinalis Kuan(RC)on maturation of dendritic cells(DCs)from the mice immunized with FMD vaccine[J].Chin J Veter Med(中国兽医杂志),2014,50(3):18-21.
[10]Zhu T,Yin RW,Zhang GQ,Ma H,Wang YX,Shan JJ.Extract technology of total polysaccharides and active components effect from root of Isatis indigotica[J].Chin J New Drugs(中国新药杂志),2013,22(12):1390-1395.
[11]Diao YL,Ren JW,Ma H,Zhang GQ,Li S,Shan JJ,et al.Physicochemical properties of a polysaccharide RAP-B-1 from Rubus amabilis and its immunomodulating effects[J].J Int Pharm Res(国际药学研究杂志),2014,41(4):404-410.
[12]Rovio S,Yli-Kauhaluoma J,Siren H.Determination of neutral carbohydrates by CZE with direct UV detection[J].Electrophoresis,2007,28(17,SI):3129-3135.
[13]Chen XM,Xu YJ,Tian GY.Physico-chemical properties and structure elucidation of AbPS isolated from the root of Achyranthes bidentata[J].Acta Pharm Sin(药学学报),2005,40(1):32-35.
[14]Shen JF,Zhao J.Research process of Achyranthes bidentata polysaccharides[J].Tianjin Pharm(天津药学),2006,18(1):59-61.
[15]Chen QH,Liu ZY,He JH.Research process of Achyranthes bidentata polysaccharides on biological function and mechanism[J].Feed Res(饲料研究),2008,9:8-10.
[16]Shao SJ,Liu CY,Liu XB,Wang TY.The effects of ABP on mice immunological function[J].China Cancer Prev Treat(肿瘤防治杂志),2002,9(1):57-58.
[17]Shi CJ,Zhou YD,Zhang JB,Tian GY.Researches of polysaccharide from Achyranthes bidentata[J]. Chin J New Drug(中国新药杂志),2006,15(16):1330-1334.
[18]Xiang DB,Li XY.Effect of Achyranthes bidentata polysaccharides on interleukin-1 and tumor necrosis factor-alpha productionfrommouseperitoneal macrophages[J].Acta Pharmacol Sin(中国药理学报),1993,14(4):332-336.
[19]Xiang DB,Li XY.Antitum or activity and immunpotentiating actions of Achyranthes bidentata polysaccharides[J].Acta Pharmacol Sin(中国药理学报),1993,14(6):556-561.
[20]Zhan XL.Viral Immunology(病毒免疫学)[M]. Beijing:Science Press,2009:14-17.
[21]Chen QH,Liu ZY,He JH.Achyranthes bidentata polysaccharideenhancesimmuneresponsein weaned piglets[J].Immunopharm Immunotoxi,2009,31(2):253-260.
[22]Zou YX,Meng JJ,Chen WN,Liu JL,Li X,Li WW,et al.Modulation of phenotypic and functional maturation of murine dendritic cells(DCs)by purified Achyranthes bidentata polysaccharide (ABP)[J].Int Immunopharmacol,2011,11(8):1103-1108.
[23]Lu JX,Yu K,Jin LQ,Yuan Q,Xie KJ,Lu YS. The activated effect of Achyrathes bidentata polysaccharides on thoracic cavity macrophages of human[J].Chin J Immunol(中国免疫学杂志),1999,15:422-424.
[24]Kardošová A,Ebringerová A,Alföldi J,Nosálóá G,Frǎnová S,H r′íbalová V.A biologically active fructan from the roots of Arctium lappa L var Herkules[J].Int J Biol Macromol,2003,33(1):135-140.
[25]Chandrashekar PM, Prashanth KV.Isolation,structural elucidation and immunomodulatory activity of fructans from aged garlic extract[J].Phytochemistry,2011,72(2-3):255-264.
[26]Chen XM,Tian GY.Structural elucidation and antitumor activity of a fructan from Cyathula officinalis Kuan[J].Carbohydr Res,2003,338(11):1235-1241.
[27]Wu XM,Dai H,Huang LX,Gao XM,Tsim KW,Tu PF.A fructan,from Radix Ophiopogonis,stimulates the proliferation of cultured lymphocytes:structural and functional analyses[J].J Nat Prod,2006,69(9):1257-1260.
Adjuvant effect of fructooligosaccharide from Achyranthes bidentata on H1N1 influenza vaccine and immunocyte function
WANG Yan-yan1,2,LI Hai-xia2,WU Ya-jun2,ZHAO Xiu-nan2,MA Hao2,LIU Kun-lu2,WU Jun-hua2,
SHAN Jun-jie2*,WANG Yu-xia2*,WANG Hai-nan1,3*
(1.College of Pharmacy,Guizhou University,Guiyang 550025,China;2.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,
China;3.China Food and Drug Administration,Beijing 100053,China)
OBJECTIVE To investigate chemical properties of a fructooligosaccharide(ABP-50-FOS)separated from Achyranthes bidentata and immune response in mice immunized H1N1 influenza vaccine.METHODS The methods of GPC,CE,IR and NMR were used to study chemical properties of ABP-50-FOS.BALB/c mice were immunized intramuscularly twice with H1N1 influenza vaccine (3 μg)plus ABP-50-FOS(200 μg)each mouse.The serum total antibody titer and its isotypes titers were analyzed by ELISA.The populations of CD4+,CD8+,CD3+and CD19+lymphocytes were determined by flow cytometry.The proliferation activities of spleen T and B lymphocytes were determined with MTT method.The levels of cytokines interferon-γ(IFN-γ),tumor necrosis factor-α(TNF-α),interleukin-4(IL-4),IL-12 and NO were measured by ELISA kits.RESULTS ABP-50-FOS was a fructooligosaccharide with moleculer mass 1885 u.Its bone linkages contained 1,2-and 1,6-fructose residues. ABP-50-FOS could induce high specific-IgG,IgG1,IgG2a,IgG2b and IgM titers after immunization with H1N1 influenza antigen twice(P<0.01).ABP-50-FOS significantly elevated the percentage of CD3+,CD4+and CD8+spleen lymphocytes and IFN-γ secretions(P<0.01)in vitro.It also stimulated peritoneal macrophage of mice and DC2.4 dendritic cells to produce TNF-α and IL-12p70 respectively (P<0.01).However,ABP-50-FOS inhibited secretions of NO in macrophage.CONCLUSION The fructooligosaccharide ABP-50-FOS separated from A.bidentata can exhibit strong adjuvant activity for H1N1 influenza vaccine.
Achyranthes bidentata;polysaccharide;fructooligosaccharide;vaccine;adjuvant
The project supported by National Key Technology R&D Program(2011BAD26B02-3)
SHAN Jun-jie,E-mail:shanjunjie0012@126.com;WANG Yu-xia,E-mail:wangyuxia1962@ hotmail.com,Tel:(010)66931645;WANG Hai-nan,E-mail:md_wanghainan@126.com,Tel:(010)88330710
R285.5
A
1000-3002(2016)02-0113-09
10.3867/j.issn.1000-3002.2016.02.005
2015-08-31接受日期:2015-12-28)
(本文编辑:齐春会)
国家科技支撑计划课题(2011BAD26B02-3)
汪艳艳,女,硕士研究生,主要从事多糖化学及生物活性的研究。
单俊杰,E-mail:shanjunjie0012@126.com,王玉霞,E-mail:wangyuxia1962@hotmail.com,Tel:(010)66931645;王海南,E-mail:md_wanghainan@126.com,Tel:(010)88330710
