吐鲁番锦鸡儿根总黄酮的提取纯化工艺△
2016-09-25帕孜莱提艾尼瓦尔潘兰贾新岳力瓦衣丁买合苏提郑承剑贾晓光
帕孜莱提·艾尼瓦尔,潘兰,贾新岳,力瓦衣丁·买合苏提,郑承剑,贾晓光
(1.新疆大学,新疆 乌鲁木齐 830046;2.新疆维吾尔自治区中药民族药研究所,新疆 乌鲁木齐 830002;3.中国人民解放军第二军医大学,上海 200433)
·中药工业·
吐鲁番锦鸡儿根总黄酮的提取纯化工艺△
帕孜莱提·艾尼瓦尔1,潘兰2,贾新岳2,力瓦衣丁·买合苏提2,郑承剑3,贾晓光
(1.新疆大学,新疆 乌鲁木齐 830046;2.新疆维吾尔自治区中药民族药研究所,新疆 乌鲁木齐 830002;3.中国人民解放军第二军医大学,上海 200433)
目的:优选吐鲁番锦鸡儿中总黄酮提取纯化工艺条件。方法:以吐鲁番锦鸡儿根总黄酮含量为指标,采用正交试验设计法优选吐鲁番锦鸡儿根总黄酮提取的工艺条件;利用静态吸附方法筛选分离吐鲁番锦鸡儿根总黄酮的最适大孔树脂,利用动态吸附方法研究最合适大孔树脂纯化吐鲁番锦鸡儿总黄酮的条件,并用紫外分光光度法测定其含量。结果:最佳提取工艺条件为乙醇回流提取法,80%乙醇,料液比为1∶30,提取1 h,温度为80 ℃。最佳纯化工艺条件为上样液质量浓度5 mg·mL-1,上样液用量5 BV,上样液流速2 BV·h-1,洗脱剂浓度90%乙醇,洗脱剂流速2 BV·h-1,洗脱剂用量6 BV。结论:优选的工艺稳定、合理,可用于吐鲁番锦鸡儿根中总黄酮的提取及纯化。
吐鲁番锦鸡儿;总黄酮;大孔树脂;提取;纯化
吐鲁番锦鸡儿Caraganaturfanensis(Krassn.) Kom为豆科锦鸡儿属植物,生于海拔1280~3040 m的山坡、河流阶地、峭壁,分布于新疆的伊犁地区、塔里木盆地、吐鲁番盆地[1]。该植物以根入药,具有活血、利尿、止痛功能,在民间多用于治疗风湿性关节炎等疾病[2-3]。本课题组在前期对锦鸡儿属植物的研究中发现,该植物中的黄酮含量较高且种类丰富,主要有黄酮醇、异黄酮、紫檀素、黄酮等类型[4-8]。现代药理研究表明,黄酮类物质具有抗肿瘤、护肝、抗炎、抗病毒、调解内分泌系统等功能[9-11],因此,本文以吐鲁番锦鸡儿的根为研究对象,进行总黄酮的提取纯化工艺研究,以期为该资源的开发利用提供科学支撑。
1 仪器与材料
1.1 仪器
KQ-5200DB型数控超声波清洗器(昆山市超声仪器有限公司);FA2104N电子分析天平(上海民桥精密科学仪器有限公司);DU-7型紫外可见分光光度计(Bekman公司);HH-S2数显恒温水浴锅(金坛市医疗仪器厂);回流提取装置(自制);玻璃层析柱(自制)。
1.2 材料
吐鲁番锦鸡儿根采集于新疆乌恰县(经度E75°25′41.76",纬度N40°05′19.05"),凭证标本存放于新疆维吾尔自治区中药民族药研究所标本室;芦丁对照品(中国食品药品检定研究院,批号:NIC-100080,含量测定用);乙醇、亚硝酸钠、硝酸铝、氢氧化钠为分析纯;XDA-1、HPD-100、XDA-6、AB-8、D101型大孔吸附树脂(河北省沧州宝恩吸附材料科技有限公司)。
2 方法与结果
2.1 总黄酮的测定
2.1.1 对照品的制备 精密称取120 ℃干燥至恒重的芦丁对照品适量,用80%乙醇定容至刻度,制成质量浓度为125 μg·mL-1的溶液,摇匀,备用。
2.1.2 供试液的制备 精密称取样品1 g,加80%乙醇30倍,回流提取1 h,滤过,80%乙醇定容至100 mL,摇匀,即得。
2.1.3 标准曲线的制备 精密移取对照品溶液0、0.5、1.0、2.0、3.0、4.0 mL分别置于10 mL具塞试管中。取样品及对照品适量于10 mL具塞试管中,以70%乙醇补足为4 mL,加5%亚硝酸钠0.4 mL,放置6 min后加10%硝酸铝0.4 mL,放置6 min,再加4%氢氧化钠4 mL,用70%乙醇定容,摇匀,放置15 min。处理后,于500 nm处测定吸光度,建立回归方程Y=0.012X+0.011 1(Y为吸光度,X为芦丁浓度),r=0.999 7。表明芦丁在5.87~47.67 g·mL-1与吸光度线性关系良好。
2.1.4 精密度试验 精密量取供试品溶液6份,同2.1.3标准曲线制备项下的方法,自“以70%乙醇补足为4 mL”起,以70%乙醇为空白对照,于500 nm处测定吸光度,结果分别为0.290 4、0.297 1、0.298 9、0.299 1、0.300 6、0.301 4,总黄酮平均含量为2.38%,RSD为1.36%,表明仪器精密度良好。
2.1.5 稳定性试验 取同一份供试品,分别于0、30、60、90、120、150、180、240、300、360 min测定吸光值,吸光值随时间变化趋势见图1。在30 min内该样品稳定,表明该方法的耐用性良好。
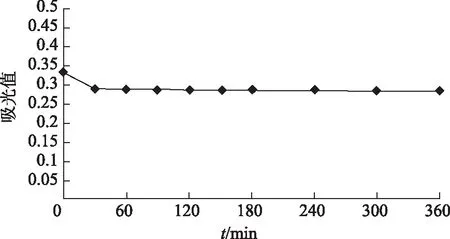
图1 吸光值随时间变化趋势图
2.1.6 重复性试验 取同一批样品5份,按照供试品溶液进行制备,同2.1.3标准曲线制备项下的方法,于500 nm处依次测定吸光度,结果总黄酮平均含量为2.33%,RSD=1.53%。表明该方法重复性良好。
2.1.7 加样回收试验 精密称取已知含量的样品4份,每份约0.5 g。各加入5 mg芦丁对照品,按照供试品溶液制备方法进行制备,在500 nm处依次测定吸光度,计算回收率为98.16%,RSD为0.32%。表明本方法准确可靠。
2.2 总黄酮提取工艺
2.2.1 单因素试验 乙醇浓度对提取效果的影响:精密称取同一批样品1 g,分别加入40%、50%、60%、70%、80%、90%的乙醇20倍,70 ℃提取1.5 h,滤过,定容至50 mL,测定总黄酮含量,结果见图2。随着乙醇浓度的增加,总黄酮提取率先逐步上升后迅速下降,当乙醇浓度70%时的提取效果最好,总黄酮含量为2.64%。
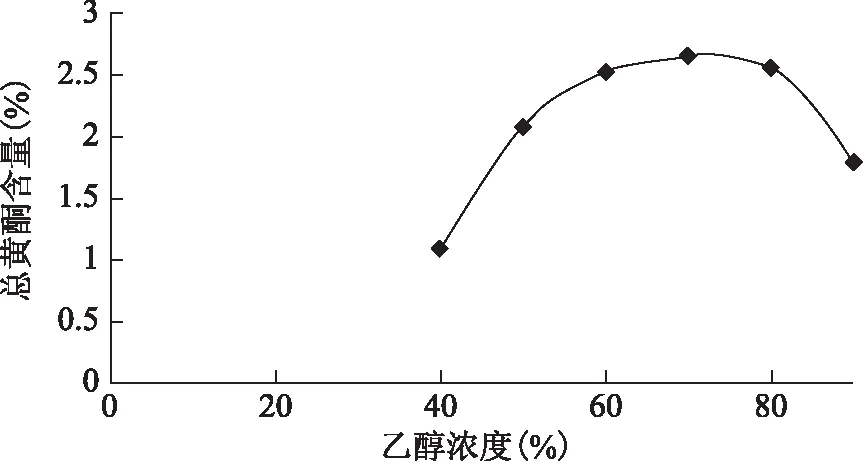
图2 总黄酮含量随乙醇浓度变化趋势
提取温度对提取效果的影响:精密称取样品1 g,分别于40、50、60、70、80、90 ℃加20倍的70%乙醇,提取1.5 h,滤过,定容至50 mL,测定总黄酮含量。结果见图3。总黄酮含量随着提取温度的升高而提高,尽管图中显示90 ℃时的黄酮含量最高,但考虑提取温度过高有可能破坏黄酮类化合物中的有效成分,且80 ℃与90 ℃条件下,总黄酮含量差异较小,因此提取温度选择80 ℃。
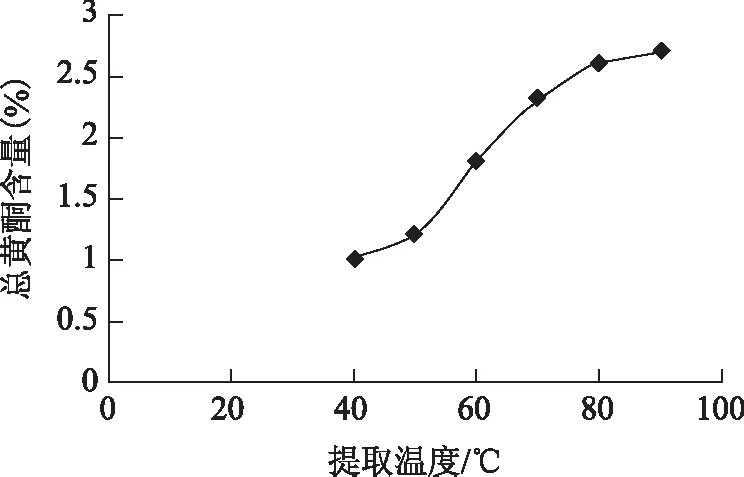
图3 总黄酮含量随提取温度变化趋势
料液比对提取效果的影响:精密称取样品1 g,分别加入10 倍、20倍、30 倍、40 倍的70%的乙醇,于80 ℃下提取1.5 h,滤过,定容至50 mL,测定总黄酮含量。结果图4。总黄酮含量随料液比的提高而有明显增加,且料液比为40 mL·g-1的总黄酮的提取率较30 mL·g-1时低。因此料液比选择30倍。

图4 总黄酮含量随料液比变化趋势
提取时间对提取效果的影响:精密称取样品1 g,30倍的70%的乙醇,在80 ℃下分别提取1.0、1.5、2.0、2.5 h,滤过,定容至50 mL,测定总黄酮含量。结果图5。提取时间为1.5 h的时候总黄酮含量最佳,所以提取时间选择1.5 h。
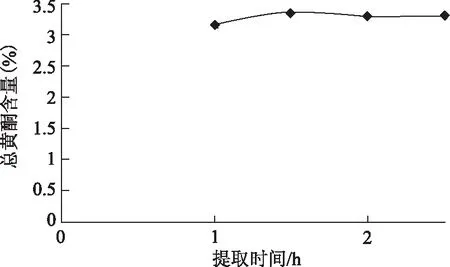
图5 总黄酮含量随提取时间变化趋势
2.2.2 正交试验 根据单因素试验结果,选取乙醇浓度、料液比、提取温度、提取时间4个因素,以吐鲁番锦鸡儿总黄酮的含量为指标,设计L9(34)正交试验,结果见表1。
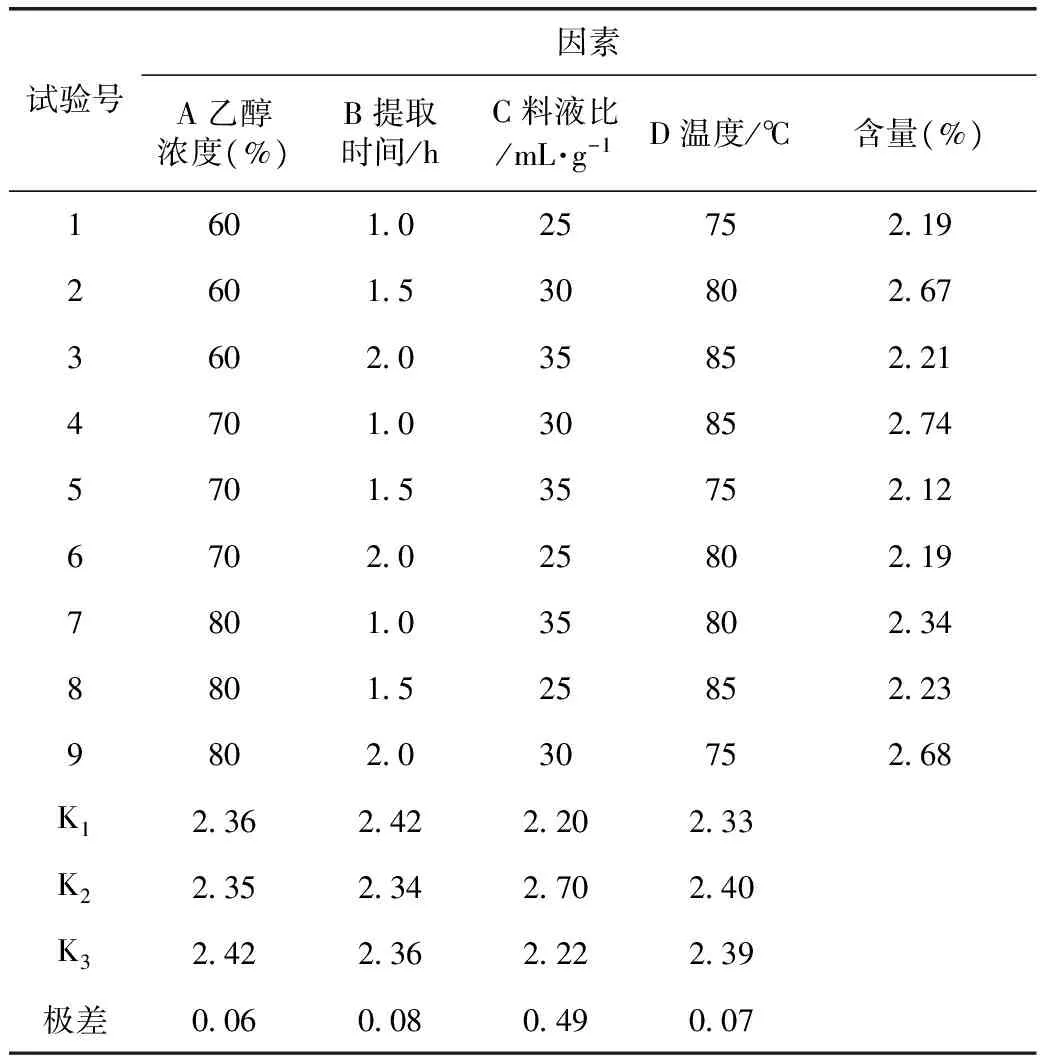
表1 正交试验结果及数据分析

表2 正交试验方差分析
由表1可知,吐鲁番锦鸡儿中黄酮类物质提取的最优参数组合是A3B1C2D2,即乙醇提取提取最佳工艺条件:乙醇浓度为80%,提取温度为80 ℃,料液比为1∶30,提取时间为1 h。由表2可知,影响吐鲁番锦鸡儿根总黄酮提取效果的各因素排序为料液比>提取时间>温度>乙醇浓度。料液比对总黄酮提取量有显著影响。
2.2.3 验证试验 按正交试验所确定条件,80%乙醇,提取提取1 h,料液比为1∶30,温度为80 ℃,提取1次,平行做3次,进行验证试验,结果吐鲁番锦鸡儿中总黄酮平均含量为2.96%。
2.3 吐鲁番锦鸡儿总黄酮纯化
2.3.1 样品溶液的制备 取吐鲁番锦鸡儿样品适量,加入30倍量的80%乙醇,80 ℃提取1 h,样液过滤,在55 ℃下烘干,得样品干膏。
2.3.2 大孔树脂的预处理 XDA-1、HPD-100型等大孔树脂用体积分数95%的乙醇浸泡24 h,充分溶胀后,再用大量蒸馏水洗尽至无醇味,备用。
2.3.3 树脂的筛选 静态吸附考察:分别称取已处理好的5种型号的树脂XDA-1、HPD-100、XDA-6、AB-8、D101各2 g(湿重)置于锥形瓶中,分别加入质量浓度为1.0 mg·mL-1的样液20 mL,室温下静置吸附24 h,过滤。将过滤后的样品液按2.1方法测定总黄酮含量,并计算树脂的吸附率。按下式计算吸附量及吸附率。
吸附率(S)= ( P0-Pa)/P0
吸附量(E)= ( P0-Pa) Va/M
式中P0为吸附前样液浓度(mg·mL-1);Pa为吸附后样液浓度(mg·mL-1);Va为溶液体积(mL);M为树脂重量(mg)。
静态洗脱考察:取上述经吸附总黄酮后滤出的树脂,分别精密加入体积分数80%的乙醇20 mL,洗脱,在室温下静止解吸24 h,过滤,取各样品2 mL,于10 mL具塞试管中,按下式计算各型号树脂的解吸率。
解吸率=(解吸液浓度×解吸液体积)/(树脂重量×吸附量)。结果见表3。

表3 大孔吸附树脂对总黄酮的静态吸附量和解吸率
由表知,HPD-100 和XDA-1型树脂的吸附能力较强,这可能与HPD-100 和XDA-1型树脂的比表面积大有关。HPD-100的解析率最高。综合考虑吸附率及解析率,选用HPD-100树脂进行总黄酮的纯化。
2.3.4 HPD-100型吸附树脂纯化总黄酮的工艺参数考擦 最佳上样浓度的选择:在保持黄酮总量不变的情况下分别取5份质量浓度分别为3、4、5、6、7 mg·mL-1的样品液分别通过大孔吸附树脂柱,以2 BV·h-1(BV为树脂体积数,下同)的流速进行动态吸附,待上样完后,用3 BV的蒸馏水,以2 BV·h-1的流速洗柱,并将流出液和水洗液收集在一起作为吸附残液,记录残液体积,计算吸附率。在浓度范围内,吸附率随上样液浓度的增加而增大,但当上样液质量浓度高于5 mg·mL-1后吸附率增长的速度渐缓。因此最终选择上样液质量浓度为5 mg·mL-1。结果见图6。
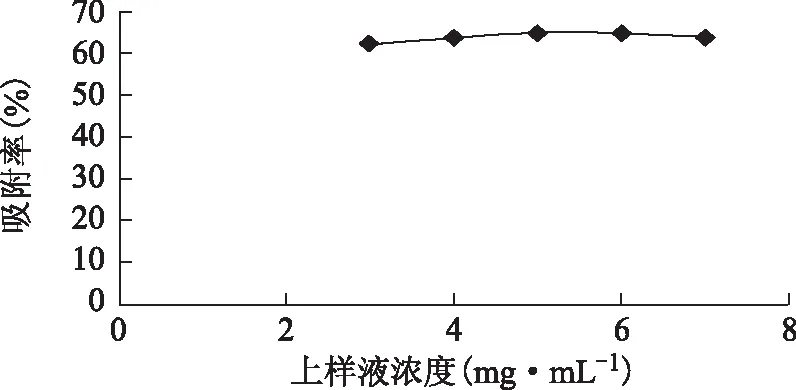
图6 上样液浓度对吸附率的影响
最佳上样量的选择:按确定的上样液浓度,分别上样1、2、3、4、5、6、7、8 BV,以2 BV·h-1的流速进行动态吸附,再以3 BV的蒸馏水,收集残液,准确记录残液体积,测定残液中黄酮的吸光度值,计算出黄酮浓度,确定上样量。随着上样量的增加,流出液中的黄酮含量增大,当上样量为5 BV时,黄酮泄漏开始明显增加,因此,综合考虑上样量为5 BV适宜。结果见图7。

图7 上样量对黄酮吸附效果的影响
最佳吸附流速的选择:按上述确定的上样液浓度及上样量,分别以2、3、4、5 BV·h-1的速率加入装有大孔树脂的层析柱内,进行动态吸附试验。待上样完后,用3 BV的蒸馏水洗柱,并将流出液和水洗液收集在一起作为吸附残液,记录残液体积,测定残液的吸光度值,计算吸附率。根据结果选择吸附流速为2 BV·h-1。结果见图8。

图8 吸附速率对黄酮吸附效果的影响
洗脱剂用量的选择:按上述确定的吸附与洗脱条件,取样品液进行上柱、吸附、洗脱,按树脂床体积分段收集洗脱液16份(每半个柱体积收集一份),测定每一份流出液中总黄酮浓度。结果见图9。当乙醇的用量为6 BV时,黄酮浓度最大,但当乙醇的用量大于6 BV后,洗脱液中的总黄酮含量明显降低,故洗脱剂的用量应选择6 BV为宜。
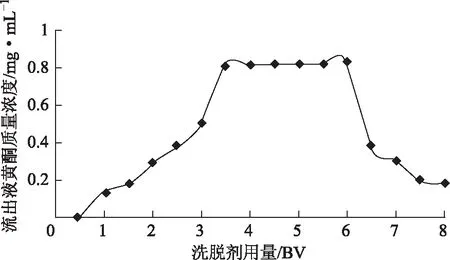
图9 洗脱剂用量对黄酮解吸效果的影响
洗脱剂流速的选择:按上述确定的吸附条件,取样品液进行动态吸附。树脂柱分别用水洗脱至洗脱液近无色,再用6 BV 90%的乙醇分别以2、3、4 BV·h-1的速率进行动态解吸,收集解吸液,记录解吸液体积,测定吸光度值,计算解吸液中黄酮浓度。结果见图10。

图10 洗脱剂流速对黄酮解吸效果的影响
结果表明,随着解吸速率的不断增加,黄酮浓度在不断的降低,当流速为2 BV·h-1时,解吸效果较好,故洗脱速率选择2 BV·h-1为宜。
2.3.5 验证试验 按上述确定的吸附与洗脱条件,取3份样品液进行上柱、吸附、洗脱,依法测定吸附残液与洗脱液中黄酮的吸光度值,计算解吸率。结果吐鲁番锦鸡儿解吸率分别为99.12%、99.86%、99.82%,平均为99.60%,收率为47.5%,纯化后的含量为58.24%。
3 讨论与结论
黄酮类化合物易溶于乙醇等溶剂中,且乙醇对环境污染性小、成本低,因此,本试验采用乙醇作为提取溶剂。研究进行了总黄酮回流提取及超声提取的比较,发现回流提取法得到的黄酮含量是超声提取的2倍,且本方法简便、高效,便于操作,故选择回流提取法提取吐鲁番锦鸡儿中的总黄酮。
本对于一定量的溶质来讲,增加上样浓度意味着增大了溶质与树脂的接触机会,因此,树脂对溶质的物理吸附作用和化学吸附作用均较强,吸附效果也更好。但上样液浓度过高将导致吸附选择性降低,所以必须选择适宜的吸附液浓度。
研究确定了吐鲁番总黄酮提取及纯化的工艺。乙醇回流提取总黄酮的最佳工艺:80%乙醇提取1 h,料液比为1∶30,温度为80 ℃。方差分析表明,在不考虑交互作用的情况下,料液比对总黄酮提取量有显著影响。采用静态吸附法考察5种不同类型的树脂对吐鲁番锦鸡儿总黄酮的吸附与解吸能力。吐鲁番锦鸡儿纯化的条件:上样液质量浓度为5 mg·mL-1,上样液用量为5 BV,上样液流速为2 BV·h-1,洗脱剂为90%乙醇,洗脱剂流速为2 BV·h-1,洗脱剂用量为6 BV。在此条件下,吐鲁番锦鸡儿总黄酮的收率为47.5%,纯化后的含量为58.24%。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第四十二卷第一分册[M].北京:科学出版社,1993.
[2] 贾敏如,李星炜.中国民族药志要[M].北京:中国医药科技出版社,2005.
[3] 潘兰,贾新岳,石明辉,等.新疆产四种锦鸡儿的民族植物学调查[J].中国现代中药,2013,15 (7):578-579.
[4] Shi J,Chen B,Sun Z H,et al.Studies on flavonoid constituents ofCaraganaintermedia[J].Acta Pharmaceutica Sinica,2003,38(8):599-602.
[5] Yuldashev M P,Batirov E K,Butayarov A V,et al.Flavonoids of above-ground parts ofCaraganaalaicaPojark[J].Rastitel'nye Resursy,2000,36(4):53-55.
[6] 刘红霞,林文翰,杨峻山.锦鸡儿属植物化学成分及药理作用研究进展[J].中国药学杂志,2004,39(5):327-330.
[7] Olennikov D N,Tankhaeva L M,Partilkhaev V V.Chemical study ofCaraganaspinosaseeds[J].Chemistry of Natural Compounds,2012,48(1): 114-117.
[8] 亓建斌.金雀根化学成分研究与含量分析[D].上海:复旦大学,2007.
[9] Xiang T,Uno T,Ogino F,et al.Antioxidant constituents ofCaraganatibetica.[J].Chemical & Pharmaceutical Bulletin,2005,53(9):1204-1206.
[10] Yang G,Zhou J,Li Y,et al.Anti-HIV bioactive stilbene dimmers ofCaraganarosea.[J].Planta medica,2005,71(6):569-571.
[11] 高海峰,郑兵兵,王蓟花,等.白皮锦鸡儿黄酮醇类化合物及其抗菌和抗氧化活性[J].天然产物研究与开发,2011,23(5):853-856.
[12] 孔鲁裔.分光光度法测定保健食品中总黄酮[J].生命科学仪器,2009,8(2):29-35.
ExtractionandPurificationofTotalFlavonoidsinCaraganaturfanensisRoot
Pazilaiti·Ainiwaer1,PAN Lan2,JIA Xinyue2,Liwayiding·Maihesuti2,ZHENG Chengjian3,JIA Xiaoguang
(1.XinjiangUniversity,XinjiangUrumqi,830046,China;2.XinjiangInstituteofChineseMateriaMadicaandEthnodrug,XinjiangUrumqi830002,China; 3.SecondMilitaryMedicalUniversityofChina,Shanghai200433,China)
Objective:To optimize the extraction and purification process conditions of total flavonoids inCaraganaturfanensis(Krassn.) Kom.root.Methods:According to content of total flavonoids as indexes,the orthogonal experiment design was used to optimize the extraction process of total flavonoids inC.turfanensisroot.Static absorption method was adopted to optimize macroporous resin for separating total flavonoids.Dynamic absorption was introduced to study the conditions for purifying total flavonoids by using the selected optimum macroporous adsorption resin.The analysis of the contents of total flavonoids was accomplished with UV spectrophotometry.Results:The optimized extraction conditions are 80% ethanol,liquid to solid ratio 1∶30,1 h extraction time,80 ℃ extraction temperature.The optimum purification conditions were 5 mg·mL-1of the sampling liquid concentration,5 BV of the sample liquid volume,2 BV·h-1of the sampling velocity,and 2 BV·h-1of the elution speed with 90% ethanol.Conclusion:The extraction and purification process is stable,rational and feasible for the extraction of total flavonoids fromC.turfanensisroot.
Caraganaturfanensis(Krassn.) Kom;total flavonoids;macroporous adsorption resin;extraction;purification
10.13313/j.issn.1673-4890.2016.10.017
2016-01-14)
NSFC-新疆联合基金(U1203202);新疆维吾尔自治区重点实验室开放课题(XJDX0201-2013-02)
*
贾晓光,研究员,研究生导师,研究方向:中药民族药;E-mail:xgjia@vip.sina.com
