Nualgi营养素、硅藻藻种对池塘水质和浮游植物的短期效应研究
2016-09-23毛梦哲李晓莉高毛林
毛梦哲,李晓莉,陶 玲,4,高毛林,李 谷
(1.上海海洋大学海洋科学学院,上海 201306;2.中国水产科学研究院长江水产研究所,武汉 430223;3.农业部热带亚热带水产资源利用与养殖重点实验室,中国水产科学研究院珠江水产研究所,广州 510380;4.淡水水产健康养殖湖北省协同创新中心,武汉 430223)
Nualgi营养素、硅藻藻种对池塘水质和浮游植物的短期效应研究
毛梦哲1,3,李晓莉2,3,陶玲2,3,4,高毛林1,李谷2,3
(1.上海海洋大学海洋科学学院,上海201306;2.中国水产科学研究院长江水产研究所,武汉430223;3.农业部热带亚热带水产资源利用与养殖重点实验室,中国水产科学研究院珠江水产研究所,广州510380;4.淡水水产健康养殖湖北省协同创新中心,武汉430223)
为探讨短期内Nualgi营养素对池塘水质和藻类群落结构的影响,本研究在池塘中的不透水有底帆布围隔内共设计了4个试验组,依次分别添加Nualgi营养素(M1组)、补充硅藻藻种(M2组)、同时添加Nualgi营养素并补充硅藻藻种(M3组)、不做任何处理的空白对照(C组)。经过近一个月的试验,结果显示:各组的pH值、DO、TN、TP之间没有显著性差异;Nualgi可以显著降低水体中IP的含量,M1组和M3组的IP显著低于M2组和C组;M1组、M2组和M3组中的NH4+-N、NO2--N和CODMn含量显著低于C组,表明Nualgi和硅藻藻种都可以显著降低水体中NH4+-N、NO2--N和CODMn的含量,对养殖水质具有显著的调控效果。试验各组的藻类种群极为丰富,试验期间共检出浮游植物7门109属186种,其中绿藻门47属86种,硅藻门26属48种,蓝藻门18属27种,裸藻门11属17种,甲藻门3属3种,隐藻门2属3种,金藻门2属2种。结果显示:添加Nualgi和补充硅藻藻种都可以有效提高水体中硅藻的生物量并抑制绿藻和蓝藻的生长,同时可以改变水体中浮游植物的群落结构,试验进行到第20天时,M1组、M2组和M3组中硅藻的生物量均显著高于C组,绿藻和蓝藻的生物量显著低于C组。试验中,颗粒直链藻在M1组、M2组和M3组中成为优势藻种,但并未在C组中成为优势藻种,小空星藻和四足十字藻仅在C组中成为优势藻种,四尾栅藻在M1组、M2组和C组中均成为优势藻种。在试验期内,各试验组之间的多样性指数没有显著差异,香农-威纳指数均在2.00以上,表明Nualgi和硅藻藻种并没有影响到水体中藻类的多样性。
Nualgi营养素;硅藻;浮游植物;池塘水质
浮游植物是水体中主要的初级生产者,其中硅藻的初级生产量占全球初级生产量的60%[1]。硅藻既可以作为天然饵料被水产动物摄食和消化,也可以净化水质、维持水体的生态平衡[2]。在淡水养殖中,以硅藻为优势种群的水体多呈茶色或茶褐色,是水产养殖的最佳水环境之一[3],因此人们希望能够培养出以硅藻占优势种群的养殖水体。
硅藻的生长不仅需要碳、氢、氧、氮、磷等大量元素,同时也需要硅、铁、钙等多种微量元素[4],其中硅元素作为硅藻生长发育过程中的必要元素,不仅是硅藻细胞壁的重要组成成分,还参与硅藻细胞中光和色素、蛋白质和DNA的合成,细胞的分裂及多种生长代谢过程[5-9]。铁元素在硅藻生长过程中对营养盐的吸收利用,电子传递,叶绿素合成等方面有重要作用,并可以影响硅藻的光合作用和呼吸作用,含有高质量浓度Fe3+的水体中,硅藻门有较强的竞争优势,可以在浮游植物群落中占优势地位[10-15]。在硅藻的生长过程中,Ca2+可以吸附在硅藻细胞膜表面影响硅藻的运动,帮助硅藻抵抗各种金属的毒性,维持硅藻细胞膜的相关功能,对硅藻的生长起到一定的促进作用[16]。
本研究主要探讨了向养殖水体中加入一种含有纳米级硅、铁、钙等微量元素的营养素Nualgi,接种优良硅藻藻种等不同措施对池塘水质和浮游植物群落结构的影响,以期为养殖池塘水质的改善和浮游植物群落结构的调控提供一种可靠的参考。
1 材料与方法
1.1试验设施
试验在位于湖北荆州的中国水产科学研究院池塘生态工程研究中心的试验池塘内进行,试验所用池塘规格为20 m×33 m,养殖期平均水深1.5 m,池塘为泥质底、水泥护坡,养殖鱼种为草鱼,投放密度1.8×104ind./hm2,规格(70±10)g/ind.,试验期间,每日上午9:00投喂全价商品饲料14 kg,下午3:00投喂12 kg。
试验所用围隔采用钢骨架作为支架,搭建长、宽各1 m,高1.4 m的不透水帆布有底围隔,每3个围隔连接为一组并视为同一试验组的3个平行,共搭建4组,为防止鱼类跳入,围隔高出水面0.2 m,搭建好后将围隔放入池塘中,为排除浮游动物对浮游植物摄食的影响向围隔内抽入经200目绢纱过滤后的池塘水,静置7 d,在围隔内的生态系统稳定后开展试验。
1.2生态营养素Nualgi
生态营养素Nualgi是由青山绿水科技生产的一种生态养殖营养素,该产品主要以纳米二氧化硅为核心,包埋铁、钴、镁、锰、钙等诸多微量、痕量营养元素制成,纳米颗粒由于直径较小更易被浮游植物吸收利用。Nualgi可以激发水体中土著硅藻的生长并通过硅藻的生长吸收水体中大量的氮、磷等营养物质,净化水质;硅藻通过光合作用在水体各个部位产生大量溶解氧,促进土著喜氧菌生长并降解水体中的有机污染物,溶解氧抑制水体中厌氧菌的生长继而抑制硫化氢、氨气、甲烷等有毒有害性恶臭气体的产生,防止水体二次污染。
1.3硅藻藻种
试验所需硅藻藻种选用湖北肽洋红生物工程有限公司生产的藻种,主要成分为针杆藻,舟形藻和直链藻等硅藻,丰度为(267.42±3.68)×106ind./L。
1.4试验设计
试验分为Nualgi组(M1)、硅藻藻种组(M2)、Nualgi加硅藻藻种组(M3)和对照组(C组)4个组。试验期间围隔内无换水和排水。每7 d向M1组、M2组和M3组中按商品使用说明添加Nualgi和硅藻藻种,剂量分别为:M1组中每次添加Nualgi 120 μL,M2组每次添加硅藻藻种150 μL,M3组每次添加Nualgi120 μL、硅藻藻种150 μL,C组不作处理。
1.5样品的采集和测试方法
试验于2015年10月4日—10月24日进行。试验期间每4 d取样测试水体理化指标和浮游植物指标,10月4日记为0 d,10月8日记为4 d,此后依次为8 d……20 d,取样时间为上午8:00~8:30。
1.5.1水质理化指标的测定方法
用2.5L有机玻璃采水器取水面下约0.5 m处的水样1.5 L带回实验室用于水质指标总氮(TN)、亚硝酸盐氮(NO2--N)、氨氮(NH4+-N)、总磷(TP)、无机磷(IP)和高锰酸盐指数(CODMn)的测定,以上指标的测定方法按国家环境保护总局编写的《水和废水监测分析方法》进行[17]。在线指标pH值、溶解氧(DO)采用YFI水质分析仪现场测定。
1.5.2浮游植物的测定方法
浮游植物采样与水化因子采样同时进行,用2.5 L有机玻璃采水器取水面下约0.5 m处的水样1 L现场用10 mL鲁哥试剂固定,带回实验室静置48 h,用带有2 μm孔径绢纱的细小虹吸管吸去上清液将样品浓缩至50 mL,加数滴福尔马林保存。定性和定量计数均在10×40倍的Olympus显微镜下用迅数R100软件进行,每个样本重复计数两次,每次计数200个视野。浮游植物的鉴定方法参照胡鸿钧等[18],生物量的估算及优势种大小测量方法参照文献[19-20]。
1.6统计方法
数据分析使用SPSS 11.5进行方差(ANOVA)分析和Pearson系数的相关性检验。P>0.05,反映比较指标之间无显著性差异;P<0.05,反映比较指标之间有显著性差异。结果与分析中不一一标示。
2 结果与分析
试验开始前,对各试验组水质理化指标的本底值进行测定,结果见表1。

表1 试验前各组主要水质理化参数平均值Tab.1 Mean value of water quality in all groups before aquaculture
2.1水质理化指标
试验开始后,每4 d对养殖水体的各项理化指标进行测定,结果如图1所示。
本试验中,各组pH值的变化趋势均为先降低后升高再降低,范围分别为:M1组7.54~8.10,M2组7.58~8.16,M3组7.57~8.10,C组7.58~8.13;各组DO的变化趋势一致,均为先降低后升高,变化范围分别是:M1组5.60~9.50 mg/L,M2组5.70~9.15 mg/L,M3组5.46~9.10 mg/L,C组4.88~8.23 mg/L;各组的pH值和DO均符合渔业水质标准的规定,统计分析显示,在试验期间M1组、M2组、M3组和C组各组之间的pH值、DO等常规水质指标并没有显著性差异。试验中,各组的TN均呈上升趋势,变化范围分别是:M1组9.36~13.00 mg/L,M2组9.38~12.98 mg/L,M3组9.29~12.95 mg/L、C组9.19~13.66 mg/L,M1组、M2组、M3组和C组各组之间的TN含量没有显著性差异。M1组和M3组的NH4+-N含量在试验期间呈缓慢下降趋势,M2组和C组的NH4+-N含量先升高后降低,各组的NH4+-N含量变化范围分别是:M1组1.76~2.18 mg/L,M2组1.98~2.19 mg/L,M3组1.35~2.18 mg/L,C组2.18~2.59 mg/L,统计分析显示,从试验开始后第12天到试验结束,M1组和M3组中NH4+-N含量显著低于C组,第12天到第16天,M2组中的NH4+-N含量显著低于C组。M1组、M2组和C组的NO2--N变化趋势一致,均为先升高后降低再升高,M3组的NO2--N先升高后持续降低,各组NO2--N的变化范围分别是:M1组0.031~0.067 mg/L,M2组0.036~0.072 mg/L,M3组0.025~0.068 mg/L,C组0.056~0.073 mg/L,统计分析显示,试验开始后第12天到试验结束,M1组和M3组的NO2--N含量显著低于C组,第16天M2组的NO2--N含量显著低于C组。各试验组的TP含量在试验期间均缓慢升高,变化范围分别是:M1组1.24~1.62 mg/L,M2组1.23~1.64 mg/L,M3组1.24~1.67 mg/L,C组1.24~1.66 mg/L,试验期间,M1组、M2组、M3组和C组各组之间的TP含量没有显著差异。各组IP含量的变化趋势各不相同,M1组为先上升后下降,M2组IP的变化趋势为先上升后下降再上升,M3组为先下降后上升,C组为先上升后下降,变化范围分别是:M1组0.152~0.178 mg/L,M2组0.168~0.193 mg/L,M3组0.111~0.16 mg/L,C组0.165~0.181 mg/L,统计分析显示,试验开始后第16天,M1组的IP含量显著低于M2组和C组,第12天到试验结束,M3组的IP含量显著低于M2组和C组。M1组、M2组和M3组的CODMn的变化趋势一致,均为先下降后上升再下降,C组的CODMn的变化趋势为先上升后下降,各组CODMn的变化范围分别是:M1组18.84~27.13 mg/L,M2组19.01~25.99 mg/L,M3组17.10~23.77 mg/L,C组22.55~31.10 mg/L,统计分析显示:试验开始后第8天到第12天,M1组和M3组的CODMn的含量显著低于C组,第12天,M2组的CODMn的含量显著低于C组。
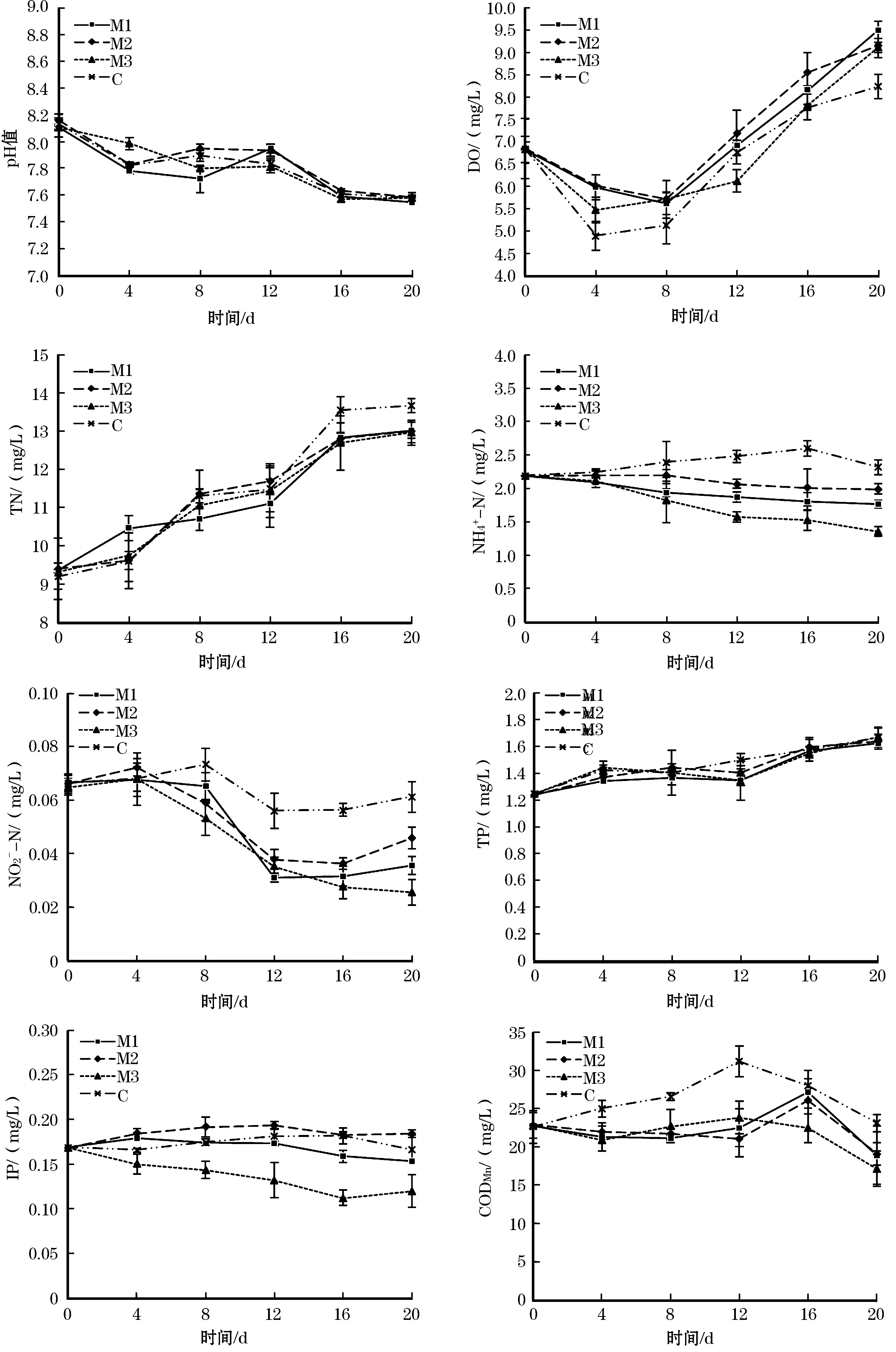
图1 各试验组水质理化指标随时间的变化Fig.1 Variations of water physicochemical parameters quality in all groups
2.2浮游植物
2.2.1浮游植物种类组成
在试验期间,从各试验组共发现浮游植物7门109属186种。其中绿藻门47属86种,占种类总数的46.24%;其次是硅藻门,26属48种,占种类总数的25.81%;蓝藻门18属27种,占种类总数的14.52%;裸藻门11属17种,占种类总数的9.14%;甲藻门3属3种,占种类总数的1.61%;隐藻门2属3种,占种类总数的1.61%;金藻门2属2种,占种类总数的1.08%。
在试验过程中,各组浮游植物种类的组成见表2。试验结束和试验开始时相比各组浮游植物种类数量变化不大,其中M1组中浮游植物的种类增加了1种;M2组减少了1种;M3组增加了3种,C组减少了3种。
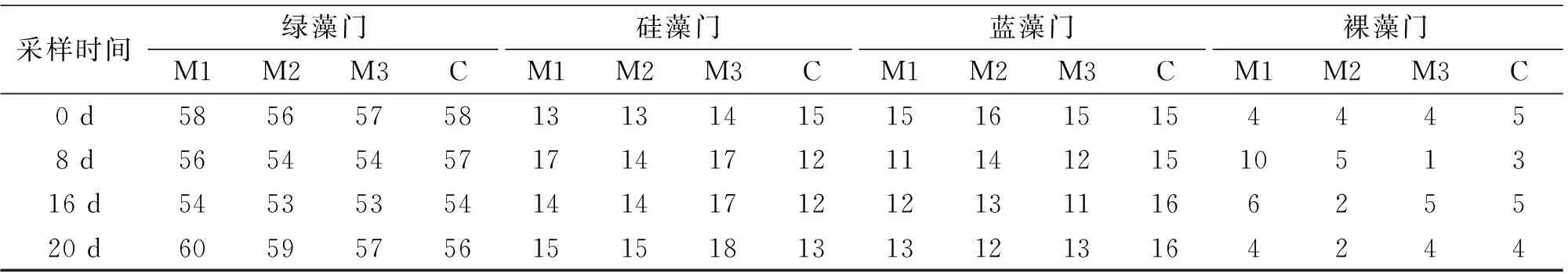
表2 试验期间各组浮游植物种类的组成Tab.2 Numbers of species of each phylum in all groups during the experimental period

采样时间甲藻门隐藻门金藻门总计M1M2M3CM1M2M3CM1M2M3CM1M2M3C0d211121111111949393968d1101111112129791869116d1111111121009085889020d11221111121195929693
2.2.2各组浮游植物的数量和生物量
(1) 浮游植物的数量
试验开始时各组浮游植物的数量之间没有显著性差异,分别为:M1组(307.65±4.54)×106ind./L,M2组(333.82±3.28)×106ind./L,M3组(313.45±3.65)×106ind./L,C组(300.92±5.41)×106ind./L;试验开始后,M1和M3组中浮游植物的数量先上升后下降,M2组和C组中浮游植物的数量上升后基本保持稳定趋势,整个试验过程中M1组和M2组中浮游植物的数量和C组没有显著差异;试验开始后第12天及第16天M3组中浮游植物的数量分别为(316.71±20.32)×106ind./L和(293.17±52.30)×106ind./L,显著低于第12天及第16天C组中浮游植物的数量(401.96±28.68)×106ind./L和(417.82±31.90)×106ind./L(图2a)。
(2) 浮游植物的生物量
试验开始时各组浮游植物的生物量分别为:M1组(222.79±5.04)mg/L,M2组(234.32±3.67)mg/L,M3组(214.29±5.32)mg/L,C组(235.21±4.34)mg/L,整个试验期间各组浮游植物的生物量先上升后基本维持稳定趋势,试验期间各组浮游植物的生物量之间没有显著性差异(图2b)。

图2 浮游植物数量和生物量随时间的变化Fig.2 Variations of phytoplankton number and biomass in different treatments during the experimental period
2.2.3浮游植物群落结构的变化
随着浮游植物数量和生物量的变化,浮游植物的群落结构也在改变。
(1) 浮游植物群落结构的动态变化
本试验中绿藻、硅藻和蓝藻的贡献率一直占各试验组浮游植物总数量的95%以上。统计分析显示:试验开始时,各组浮游植物的绿藻、硅藻和蓝藻数量占浮游植物总数量的百分比之间没有显著性差异;随着时间的推移,M1组中硅藻的数量明显增加,至第20天M1组中硅藻的数量百分比显著高于C组;M2组中蓝藻的数量呈降低趋势,在第20天M2组中蓝藻的数量百分比显著低于C组;M3组中,硅藻的数量一直呈上升趋势,蓝藻门的数量却持续降低,从试验开始后第4天到试验结束M3组中硅藻数量的百分比显著高于C组,从第12天到试验结束M3组中蓝藻数量的百分比显著低于C组(图3)。

图3 试验期间各组浮游植物群落结构的变化Fig.3 Dynamic of the structure of the phytoplankton community
(2)浮游植物各门类生物量的变化
试验开始时,各组绿藻、硅藻和蓝藻的生物量没有显著性差异;试验开始后第12天和第20天,M1组中绿藻、蓝藻的生物量显著低于C组中绿藻和蓝藻的生物量,第20天,硅藻的生物量显著高于C组;M2组中绿藻的生物量在试验开始后第12天和第20天显著低于C组,蓝藻的生物量在第20天显著低于C组,硅藻的生物量在第20天显著高于C组;M3组中绿藻和蓝藻的生物量在第12天和20天显著低于C组,硅藻的生物量在第4天、16天、20天显著高于C组。在试验过程中,M1组和M3组中硅藻的生物量在试验开始后第12天超过绿藻,成为生物量最多的门类,M2组中硅藻的生物量在第20天超过绿藻成为生物量最多的门类,C组绿藻的生物量始终高于其余门类的生物量(图4)。
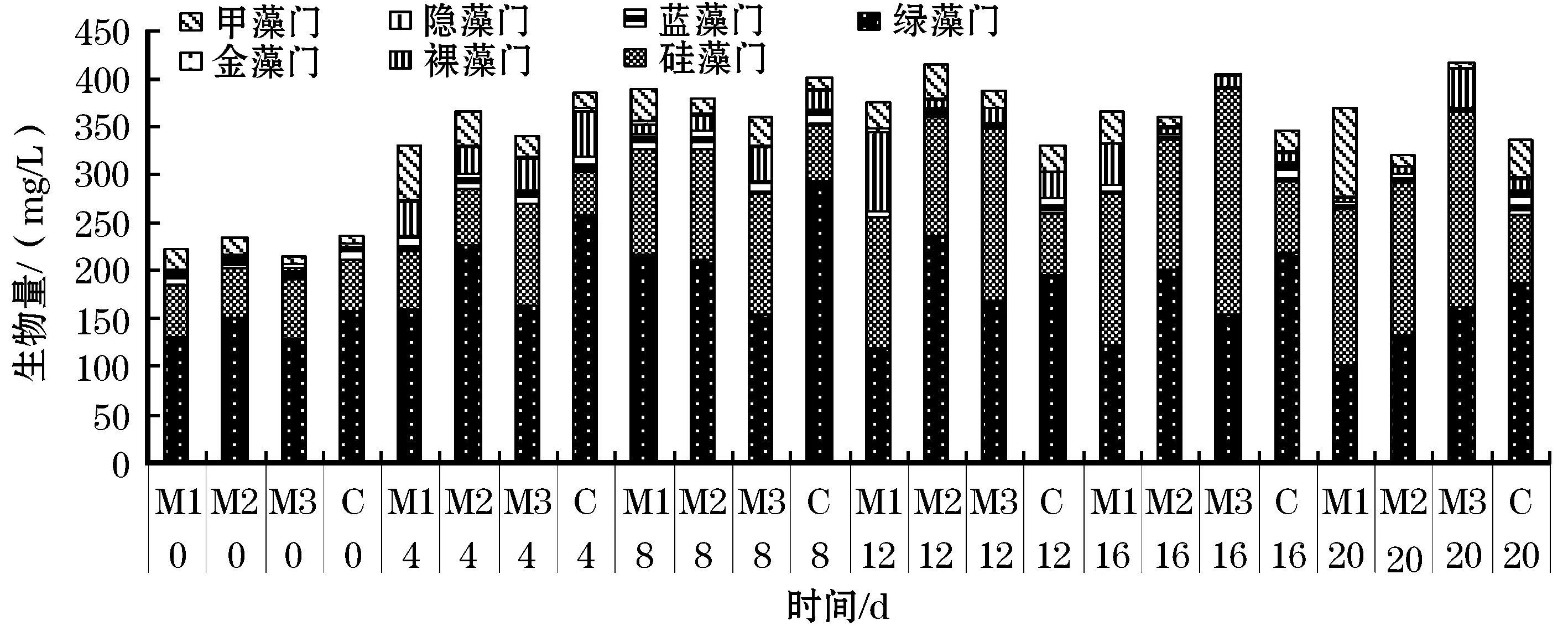
图4 试验期间各处理组浮游植物生物量随时间的变化Fig.4 Dynamic of the total biomass of phytoplankton during the experimental period
(3) 浮游植物的多样性指数
试验过程中,各试验组多样性指数的动态变化如表3所示,统计分析显示:香农-威纳指数、辛普森多样性指数、物种丰富度指数和均匀度指数在试验期间M1组、M2组、M3组和对照组C组各组之间没有显著差异,香农-威纳指数均在2.00以上,说明各试验组的物种多样性较高,添加Nualgi和硅藻藻种并没有影响到水体中浮游植物的多样性。

表3 不同处理组之间浮游植物种类多样性的变化Tab.3 The bio-diversity of the phytoplankton community in different treatments
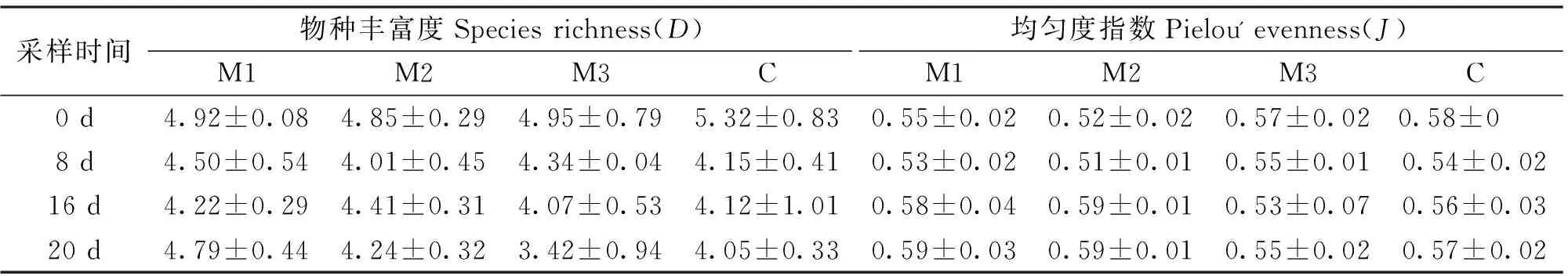
采样时间物种丰富度Speciesrichness(D)均匀度指数Pielou'evenness(J)M1M2M3CM1M2M3C0d4.92±0.084.85±0.294.95±0.795.32±0.830.55±0.020.52±0.020.57±0.020.58±0 8d4.50±0.544.01±0.454.34±0.044.15±0.410.53±0.020.51±0.010.55±0.010.54±0.0216d4.22±0.294.41±0.314.07±0.534.12±1.010.58±0.040.59±0.010.53±0.070.56±0.0320d4.79±0.444.24±0.323.42±0.944.05±0.330.59±0.030.59±0.010.55±0.020.57±0.02
(4) 浮游植物优势种的变化
试验开始时,各试验组的优势藻类一致,主要表现为绿藻门的小球藻和蓝藻门的细小平裂藻,试验开始后第4天,M3组中的细小平裂藻不再成为优势种;试验进行到第8天,M2组、M3组和C组中蓝藻门的铜绿微囊藻占据优势地位成为这三组新的优势种;第12天,蓝藻门的铜绿微囊藻和硅藻门的颗粒直链藻取代细小平裂藻成为M1组中的优势藻种,M3组中的优势藻种比第8天多了硅藻门的颗粒直链藻,C组中的优势藻种变为绿藻门的小空星藻和蓝藻门的细小平裂藻;第16天,M1组的优势藻种为绿藻门的小球藻和四尾栅藻,硅藻门的颗粒直链藻,M2组中的优势藻种为绿藻门的小球藻和四尾栅藻,蓝藻门的细小平裂藻,M3组的优势藻为绿藻门的小球藻和硅藻门的直链藻,C组的优势藻为绿藻门的小空星藻和四尾栅藻,蓝藻门的铜绿微囊藻;试验结束时,M1组和M3组中的优势藻种和第16天相比没有变化,硅藻门的颗粒直链藻取代M2组中的细小平裂藻成为M2组中的优势藻种,C组中,绿藻门的四足十字藻代替小空星藻成为C组中新的优势藻种(表4)。

表4 试验期间各组浮游植物优势种变化Tab.4 Dominant species in different treatments during the experimental period
注:当某一个种的密度占浮游植物密度的20%以上时作为优势种
3 讨论
浮游植物作为水生态系统中重要的初级生产者,其种群结构、丰度、生物量的变化和与环境因子密切相关[21-22]。本试验中第12天和16天M3组中浮游植物的数量显著低于C组但生物量和C组没有显著差异,原因是M3组中硅藻所占浮游植物丰度的百分比大于C组,硅藻的细胞壁高度硅质化,密度大于其余门类的浮游植物所以M3组中浮游植物的总生物量和C组没有显著差异。研究表明硅、铁等微量元素能够提高硅藻的竞争力并使硅藻在较长时间内成为生物量最多的门类,本试验中,M1组、M3组中添加的含有硅、铁、钙等营养元素的Nualgi刺激了土著硅藻的生长,试验结束时M1组和M3组中硅藻门的生物量显著高于C组,这与Dafner[23]等的研究结果一致;M2组中硅藻藻种的加入增加了水体中硅藻的数量,所以在试验结束时M2组的硅藻生物量也显著高于对照组,M3组中硅藻生物量的快速增加和添加硅藻藻种有一定的关系。
试验期间,各组的TN和TP含量均有增加,分析原因可能是饵料投喂导致了水体中溶解的TN、TP增加,这与我们前期研究中在养殖季节TN、TP呈上升趋势的结果一致[24]。M1组、M2组和M3组中NH4+-N的含量显著低于C组,是因为硅藻对NH4+-N的摄取优于硝态氮等其它氮源,Mccarthy等[25]的研究也得到了同样的结论;试验中M1组、M2组和M3组中NO2--N和CODMn的含量显著低于C组这一结果符合硅藻对水质净化有一定效果的报道[26]。M1组和M3组中的IP含量显著低于M2组和C组主要是因为浮游植物的生长主要利用IP[27],M1和M3组中浮游植物的生物量高于M2组和C组中浮游植物的生物量,虽未达到显著水平,但可能已影响到IP含量的变化,该结果表明Nualgi可以显著降低水体中IP的含量。M1组、M2组和M3组中绿藻门和蓝藻门的生物量显著低于C组是浮游植物的种间竞争造成的,硅藻生物量的增加占用了更多的空间和营养物质导致了绿藻和蓝藻生物量的下降。试验中,各试验组优势种的不同说明通过向水体中添加硅藻藻种和Nualgi均可影响水体中浮游植物优势种的变化。在试验期间,绿藻门的四尾栅藻仅未在M3组中形成优势藻种原因是因为M3组中的营养盐含量低于M1组、M2组和C组,而四尾栅藻属于耐有机污染藻种[28]。绿藻门的细小平裂藻和铜绿微囊藻具有体积小、表面积大的特点,对营养盐具有更高的吸收效率,成为四组中均常见的优势藻种[29]。
目前对养殖池塘中浮游植物群落结构的调控研究较少,据报道,通过向水体中添加藻液或投放芽孢杆菌对浮游植物群落结构的调控有一定效果[30-31],但由于成本高、适用条件有限,在实际生产推广应用中受到限制,本研究通过同时向水体中添加Nualgi和硅藻藻种快速持续地促进了硅藻的生长,改变了水体中浮游植物的群落结构,有效降低了养殖水体中IP、NH4+-N、NO2--N和CODMn的含量,维护了水体的生态平衡,为养殖水体中浮游植物的调控提供了一种新参考。
[1]Treguer P,Nelson D M,Van Bennekom A J.The silica balance in the world ocean:A reestimate[J] Science,1995,268:375.
[2]李信书,阎斌伦.微藻在河蟹工厂化育苗中的作用[J].淡水渔业,2001,31(4):34-35.
[3]施正学.水产养殖中水色藻相变化规律初探[J].水产养殖,2012,(6):35-36.
[4]Huisman J,Jonker R R,Zonneveld C,et al.Competition for light between phytoplankton species:Experimental tests of mechanistic theory [J].Ecology,1999,80 (1):211-222.
[5]Motomura H,Mita N,Suzuki M.Silica accumulation in long-lived leaves of Sasa veitchii (Carrière) Rehder (Poaceae:Bambusoideae) [J].Annals of Botany,2002,90(1):149-152.
[6]Brecht M O,Datnoff L E,Kucharek T A,et al.Influence of silicon and chlorothalonil on the suppression of gray leaf spot and increase plant growth in St.Augustinegrass [J].Plant Disease,2004,88(4):338-344.
[7]Morikawa C K,Saigusa M.Mineral composition and accumulation of silicon in tissues of blueberry (Vaccinum corymbosus cv.Bluecrop) cuttings[J].Plant and Soil,2004,258(1):1-8.
[8]Turbulence K T.Phytoplankton cell-size,and the structure of pelagic food webs[J].Advances in Marine Biology,1993,29:1-72.
[9]Egge J K.Are diatoms poor competitors at low phosphate concentrations? [J].Journal of Marine Systems,1998,16(3/4):191-198.
[10]Roy S,Alam S,Chattopadhyay J.Competing effects of toxin-producing phytoplankton on overall plankton populations in the Bay of Bengal [J].Bulletin of Mathematical Biology,2006,68(8):2303-2320.
[11]Cardenas J R.Effect of iron supply on the activities of the nitrate-reducing system from Chlorella [J].Archives of Microbiology,1972,81(3):260-263.
[12]梁英,刘春强,田传远,等.不同营养盐浓度对6种海洋微藻群落演替的影响[J].水产科学,2013,11:627-635.
[13]Coale K H,Johnson K S,Fitzwater S E,et al.Iron EX-I,an in situ iron-enrichment experiment:experimental design,implementation and results [J].Deep Sea Research Part II:Topical Studies in Oceanography,1998,45(6):919-945.
[14]Landry M R,Ondrusek M E,Tanner S J,et al.Biological response to iron fertilization in the eastern equatorial Pccific ( ironEx II).I.Microplankton community abundances and biomass [J],Marine Ecology Progress Series,2000,201(1):27- 42.
[15]阎峰,储昭升,金相灿,等.Fe(Ⅲ)对太湖铜绿微囊藻和四尾栅藻竞争的影响[J].环境科学研究,2007,(5):61-65.
[16]杨强,谢平,徐军,等.河流型硅藻水华研究进展[J].长江流域资源与环境,2011,(S1):159-165.
[17]国家环境保护局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].(第四版).北京:中国环境科学出版社,2002:88-284.
[18]胡鸿钧 魏印心. 中国淡水藻类: 系统、生态及分类[M].北京:科学出版社,2006.
[19]章宗涉,黄祥飞.淡水浮游生物研究方法[M].北京:科学出版社,1991:333-344.
[20]金相灿,屠清英.湖泊富营养化调查规范[M].北京:中国环境科学出版社,1990:286-302.
[21]Proul M,Pick F,Mazumder A,et al.Experimental evidence for interactive impacts of human activities on lake algal species richness[J].Oikos,1996,76(1):191-195.
[22]Naselli-Flores L.Phytoplankton assemblages in twenty-one Sicilian reservoirs:relationship between species composition and environmental factors[J].Hydrobiologia,2000,424:1-11.
[23]Dafner E V.Boscolo R.Bryden H L.The N:Si:P molar ratio in the strait of Gibraltar[J].Geophysical Research Letters.2003, 30(30):1506.
[24]李晓莉,陶玲,张世羊,等.陶粒浮床对草鱼养殖池塘水质和浮游植物的影响[J].水生生物学报.2015,(3):507-516.
[25]Mccarthy J J,Taylor W R.Marine chemistry in the coastal environment ACS symposium series[C],1975.18:664-681.
[26]刘霞,陆晓华,陈宇炜.太湖浮游硅藻时空演化与环境因子的关系[J].环境科学学报,2012,(4):821-827.
[27]陈慈美,郑爱榕,周慈由,等.铁对中肋骨条藻生长、色素化程度及氮同化能力的影响[J].海洋学报(中文版),1997,(3):50-56.
[28]Li Y F,Chen N,et al.A new type of compound ecological floating bed system and its effect on phytoplankton community structure[J].Water Resources Protection,2014,30(2):46-51.
[29]邴旭文, 陈家长. 浮床无土栽培植物控制池塘富营养化水质[J].广东海洋大学学报, 2001,21(3):29-33.
[30]许倩倩,吕乐,陈建,等.利用小球藻USTB-01控制蓝藻水华污染研究[J].现代化工,2010,(S2):334-337.
[31]张汉华,李卓佳,郭志勋,等.有益微生物对海水养虾池浮游生物生态特征的影响研究[J].南方水产,2005,(2):7-14.
(责任编辑:张红林)
The short-term effects of biological nutrient Nualgi and diatom algaes on the water quality and phytoplankton in culture pond
MAO Meng-zhe1,3,LI Xiao-li2,3,TAO Ling2,3,4,GAO Mao-lin1,LI Gu2,3
(1.CollegeofMarineSciences,ShanghaiOceanUniversity,Shanghai201306,China;2.YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China;3.KeyLaboratoryofTropical&SubtropicalFisheryResourceApplicationandCultivation,MinistryofAgriculture,P.R.China,PearlRiverFisheriesResearchInstituteChineseAcademyofFisherySciences,Guangzhou510380,China;4.FreshwaterAquacultureCollaborativeInnovationCenterofHubeiProvince,Wuhan430070,China)
In order to study the short-term effects of biological nutrient Nualgi on water quality and phytoplankton in fishpond,we conducted continuous and regular surveys for three weeks on the phytoplankton community and the water quality indexes in 4 groups.The 4 groups were a Nualgi group(M1),an algae group(M2),a Nualgi and algae group(M3) and a control group(C).The results showed that the pH,DO,TN,TP had no remarkable difference among the 4 groups.IP in group M1 and M3 were remarkably lower than group M2 and group C,meaning Nualgi can reduce IP in water.Levels of NH4+-N,NO2--N and CODMnin group M1,M2 and M3 were remarkably lower than that of group C,meaning Nualgi or algae can both reduce NH4+-N,NO2--N and CODMnto adjust water quality.During the test,we identified 186 species that belonged to 7 phyla and 109 genera.86 species were Chlorophyta,48 were Bacillariophyta,27 were Cyanophyta,17 were Euglenophyta,3 were Dinophyta,3 were Cryptophyta and 2 were Chrysophyta.Adding diatom algae or Nualgi can both promote the growth of Bacillariophyta and restrain the growth of Chlorophyta and Cyanophyta.In the test,Melosira granulata became the dominant algae in group M1,M2 and M3 but without groupCoelastrummicroporumandCrucigeniatetrapediaare the dominant algae in group C only.Scenedesmus quadricauda became the dominant algae in group M1,M2 and C.There were no remarkable difference between the 4 groups about the diversity index,and the Shannon-Wiener index were all above 2.00,which showed that the species diversity is abundant.
Nualgi;diatom;phytoplankton;ponds water quality
2015-11-06;
2016-05-20
引进国际先进农业科学技术计划(2015Z-15),“十二五”国家科技支撑计划(2015BAD13B03,2012BAD25B05),现代农业产业技术体系建设专项资金(CARS-46),农业部热带亚热带水产资源利用与养殖重点实验室开放课题
毛梦哲(1988-),女,硕士研究生,专业方向淡水池塘水质修复,E-mail:maomengzhe@163.com
李谷。E-mail:ligu667@yahoo.com
S959
A
1000-6907-(2016)05-0055-09
