饲料中添加L-肉碱对吉富罗非鱼生长、肝脏脂肪代谢及抗氧化能力的影响
2016-09-23苟庚午
苟庚午,蒋 明,文 华,吴 凡,刘 伟,田 娟
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院长江水产研究所,农业部淡水生物多样性保护与利用重点开放实验室,武汉 430223)
饲料中添加L-肉碱对吉富罗非鱼生长、肝脏脂肪代谢及抗氧化能力的影响
苟庚午1,2,蒋明2,文华2,吴凡2,刘伟2,田娟2
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院长江水产研究所,农业部淡水生物多样性保护与利用重点开放实验室,武汉430223)
分别在3组等氮等能的吉富罗非鱼(GIFT,Oreochromisniloticus)饲料中添加不同水平的L-肉碱[0(对照组)、150和300 mg/kg],试验选用初始体重为(8.21±0.33) g的幼鱼投喂9周,探讨L-肉碱对吉富罗非鱼生长、体成分、血清生化指标、肝脏脂肪代谢酶活性和抗氧化能力的影响。结果表明:添加150或300 mg/kg L-肉碱显著提高了罗非鱼增重率(WGR)和特定生长率(SGR),显著降低了实验鱼肝体比(HSI)和脏体比(VSI);添加150 mg/kg L-肉碱组WGR和SGR最高,HSI和VSI最低。添加150 mg/kg L-肉碱显著提高了鱼体肥满度(CF)。饲料系数(FCR)和存活率(SR)在对照组和实验组间无显著差异。添加150或300 mg/kg L-肉碱显著提高了鱼体肝脏中粗蛋白含量,添加150 mg/kg L-肉碱显著降低了肝脏粗脂肪含量。添加150或300 mg/kg L-肉碱时,血清甘油三酯(TG)含量显著降低,肝脏脂蛋白脂酶(LPL)、肝脂酶(HL)、总酯酶(LPL)和脂肪酶(LPS)活性显著上升,肝脏过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)活性显著增加,肝脏丙二醛(MDA)含量显著下降。添加300 mg/kg L-肉碱显著提高了鱼体肝脏超氧化物歧化酶(SOD)活性和溶菌酶(LZM)活性。综上,饲料中添加适量L-肉碱对提高吉富罗非鱼生长性能,促进其脂肪代谢和提高鱼体抗氧化能力有良好效果。基于L-肉碱对罗非鱼增重率和特定生长率的影响,推荐L-肉碱在吉富罗非鱼饲料中的添加量为150 mg/kg。
吉富罗非鱼(GIFT,Oreochromisniloticus);L-肉碱;生长;脂肪代谢;抗氧化
1905年两位俄国科学(Gulewitsch和Krimberg)从肉浸汁中发现肉碱(Carnitine)。化学名称为β-羟基-γ-三甲基氨基丁酸,分为L-型和D-型,是一类非蛋白氨基酸,其中只有L-肉碱(L-Carnitine)具有生理活性,常称之为维生素BT[1]。L-肉碱广泛分布于自然界,是动物体内脂肪代谢不可或缺的物质,其主要作用是携带长链脂肪酸的脂酰基团通过线粒体内膜,进而促进脂肪酸β-氧化释放能量[2-3]。大部分动物能合成肉碱,鱼类本身也能在肝脏中合成肉碱,随着鱼类高密度集约化养殖模式的发展和颗粒配合饲料的应用,鱼体内合成肉碱的速度不能满足鱼类快速生长的需求,可能会造成鱼体脂肪代谢受阻,影响鱼类摄食,存活率降低。据报道幼龄动物合成肉碱的能力低于成年动物,所以幼龄动物更容易缺乏肉碱[4-5]。
国内外已有研究报道,饲料中添加外源L-肉碱提高了奥尼罗非鱼(Oreochromisniloticus♀×Oreochromisaureus♂)[6-7]、虹鳟(Oncorhynchusmykiss)[8]、草鱼(Ctenopharyngodonidellus)[9]、银鲈(Bidyanusbidyanus)[10]的生长性能和饲料利用率,提高了奥尼罗非鱼[6-7]和银鲈[10]的蛋白利用率,使草鱼[9]和银鲈[10]全鱼的脂肪含量和腹脂率下降。同时Twibell等[11]研究发现饲料中添加低浓度L-肉碱对杂交条纹鲈(Moronesaxatilis♂×M.chrysops♀)的增重率、摄食量和体组成没有显著影响。杜震宇等(2002)[12]报道了L-肉碱对罗非鱼生长、体成分无显著影响,但能降低肝脂沉积。
吉富罗非鱼(GIFT,Oreochromisniloticus)是我国高密度集约化养殖中重要的养殖对象之一。当前由于罗非鱼市场价格较低,其使用的饲料中的廉价低质饲料原料较多,而长期投喂低质饲料会导致罗非鱼肝脏代谢负荷大,出现代谢紊乱,肝脏脂肪异常沉积,抗氧化和抗应激能力差,容易死亡等问题。L-肉碱作为长链脂肪酸通过线粒体内膜的转运载体,促进长链脂肪酸氧化供能,同时对短链脂肪酸的氧化起辅助作用;L-肉碱可以防止铁螯合物形成,可以作为次级抗氧化剂捕捉体内自由基,维护机体健康。肉碱对养殖鱼类的营养作用报道较多,在奥尼罗非鱼上也有相应报道,但研究结果显示肉碱在不同试验条件下的作用不同。鉴于上述问题,本研究选用吉富罗非鱼为研究对象,研究和探讨L-肉碱对吉富罗非鱼生长、体组成、血清生化指标、肝脏脂肪代谢酶活性和抗氧化能力的影响,旨在为L-肉碱在生产实际中的应用效果提供一定的理论依据。
1 材料与方法
1.1实验饲料
以玉米蛋白粉、豆粕、棉粕和菜粕为蛋白源,混合油脂(玉米油、大豆油,质量比为1∶1)为脂肪源,面粉为糖源配制成3组饲料,其基础饲料配方和营养成分见表1。实验饲料中L-肉碱的添加水平为0(对照组)、150、300 mg/kg(L-肉碱添加水平的增减用微晶纤维素来调平)。饲料原料粉碎过60目筛,称重后混匀,少量的成分采用逐级扩大法混合,用饲料机制成直径为2 mm,长约3 mm的圆柱形颗粒,自然风干后,选取颗粒大小适宜的饲料用胶袋密封,置于冰柜中冷藏备用。
1.2实验鱼及日常管理
实验用鱼来源于广西罗非鱼国家级育种实验场。正式实验前挑选健康活泼、规格一致的吉富罗非鱼暂养于长江水产研究所室内循环水养殖系统养殖桶(500 L)中。用对照组饲料驯化2周后,挑选规格均匀的吉富罗非鱼[平均初始体质量为(8.21±0.33) g]随机投放到9个养殖桶中,每养殖桶放养40尾,随机分为3组,每组3个重复,分别投喂3组实验饲料,每天投喂3次(9:00,13:00,17:00),表观饱食投喂,每天早上9:00反冲1次,清除桶内粪便并加注约20%新水。每3周称取一次鱼体质量,每天记录水温、摄食情况和实验鱼死亡情况。饲养期间水温为24~30 ℃,溶解氧>5 mg/L,pH:6.5~7.0,总氨氮<0.2 mg/L,亚硝酸盐<0.05 mg/L,自然光照周期,养殖实验持续9周。

表1 基础饲料的原料组成及营养成分Tab.1 Ingredients and proximate chemical composition of the basic experimental diet
注:1)维生素预混料可为每千克饲料提供:VA 5 000 IU,VD32 000 IU,VE 60 mg,VB15 mg,VB220 mg,VB610 mg,VC 120 mg,VK35 mg,肌醇400 mg,烟酸120 mg,泛酸钙10 mg,叶酸1 mg,生物素0.1 mg。
2)矿物质预混料可为每千克饲料提供:Ca(H2PO4)226 000 mg,Ca(CH3CHOHCOO)26 540 mg,FeSO442.5 mg,MgSO41 340 mg,NaH2PO41 744 mg,NaCl 870 mg,AlCl33 mg,KIO32.5 mg,KCl 1 500 mg,CuCl22 mg,MnSO416 mg,CoCl220 mg,ZnSO460 mg。
1.3样品采集
养殖实验开始前,实验鱼均饥饿24 h,随机选取10尾鱼,使用MS-222(100 mg/L)将样品鱼麻醉后用于初始体成分分析。养殖实验结束后,将鱼体饥饿24 h,以桶为单位计数并称重。每桶随机取3尾样品鱼测定全鱼常规营养成分。另外取3尾样品鱼用于测定生长性能、血清生化指标和组织常规营养成分、肝脏脂肪代谢酶和抗氧化酶活性。具体操作如下:先测量体长体重;再从尾部静脉采血,全血在4 ℃静置4 h后,以3000 r/min离心10 min,制成血清;然后解剖取出内脏并称重,再分离出肝脏称重后装袋保存;最后取肌肉(第一根背鳍至最后一根背鳍之间,侧线以上白肌)。将所有样品存放在-80 ℃冰箱备用。
1.4指标测定
1.4.1生长性能指标测定
根据以下公式,计算增重率、特定生长率、饲料系数、成活率、肥满度、肝体比和脏体比。
增重率(WGR)=(Wt-W0)/W0×100%
特定生长率(SGR)=(LnWt-LnW0)/t×100%
饲料系数(FCR)=Wf/(Wt-W0)
成活率(SR)=Nt/N0×100%
肥满度(CF)=Wt(g)/[L(cm)]3×100
肝体比(HSI)=Wh(g)/W(g)×100%
脏体比(VSI)=Wv(g)/W(g)×100%
式中:Wt代表鱼体末质量(g),W0代表鱼体初始重量(g),t代表实验天数,Wf代表投喂饲料总质量(g),L代表鱼体体长(cm),W代表鱼体质量(g),Wh代表鱼体肝脏质量(g),Wv代表鱼体内脏质量(g)。
1.4.2常规营养成分测定
饲料水分采用105 ℃恒温干燥失重法测定(GB/T 5009.3);肌肉、肝脏和全鱼水分含量采用冷冻干燥法测定,即使用CHRIST型冷冻干燥机冷冻干燥48 h;粗蛋白采用凯氏定氮法(GB/T 5009.5)测定;粗脂肪采用索氏抽提法(GB/T 5009.6)测定;粗灰分采用马福炉550 ℃灼烧法称重法(GB/T 5009.4)测定。
1.4.3血清生化指标测定
总胆固醇(TCHO)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、总蛋白(TP)含量及谷草转氨酶(AST)、谷丙转氨酶(ALT)活性由Sysmex全自动生化分析仪(CHEMIX-800)测定,所用试剂均购自Sysmex公司。
1.4.4肝脏脂肪代谢酶和抗氧化酶测定
脂蛋白脂酶(LPL)、肝脂酶(HL)、脂肪酶(LPS)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)、溶菌酶(LZM)活性和丙二醛(MDA)含量均采用南京建成生物技术研究所测试盒测定。
1.5数据处理
实验结果均采用平均值±标准差(mean±SD)表示,采用SPSS 21.0软件进行单因素One-Way ANOVA方差分析和Duncan′s多重比较法对实验结果的差异显著性进行处理分析,以P<0.05为显著性水平。
2 结果
2.1饲料中添加L-肉碱对吉富罗非鱼幼鱼生长性能和饲料利用的影响
由表2可知,饲料中添加L-肉碱显著提高了罗非鱼FBW、WGR和SGR,均在150 mg/kg实验组最高。FCR和SR在对照组和实验组间无显著性差异,但150 mg/kg实验组FCR有降低趋势。饲料中添加L-肉碱显著降低了罗非鱼HSI和VSI,150 mg/kg实验组鱼体CF显著高于对照组。综合各生长指标可知,添加量为150 mg/kg时,生长效果最好。
2.2饲料中添加L-肉碱对吉富罗非鱼全鱼、肌肉和肝脏营养成分的影响
由表3可知,饲料中添加L-肉碱对全鱼和肌肉组织的体成分(水分、粗蛋白和粗脂肪)含量无显著影响;添加150或300 mg/kg L-肉碱显著增加了肝脏组织的粗蛋白含量,150 mg/kg实验组肝脏粗脂肪含量显著低于对照组。
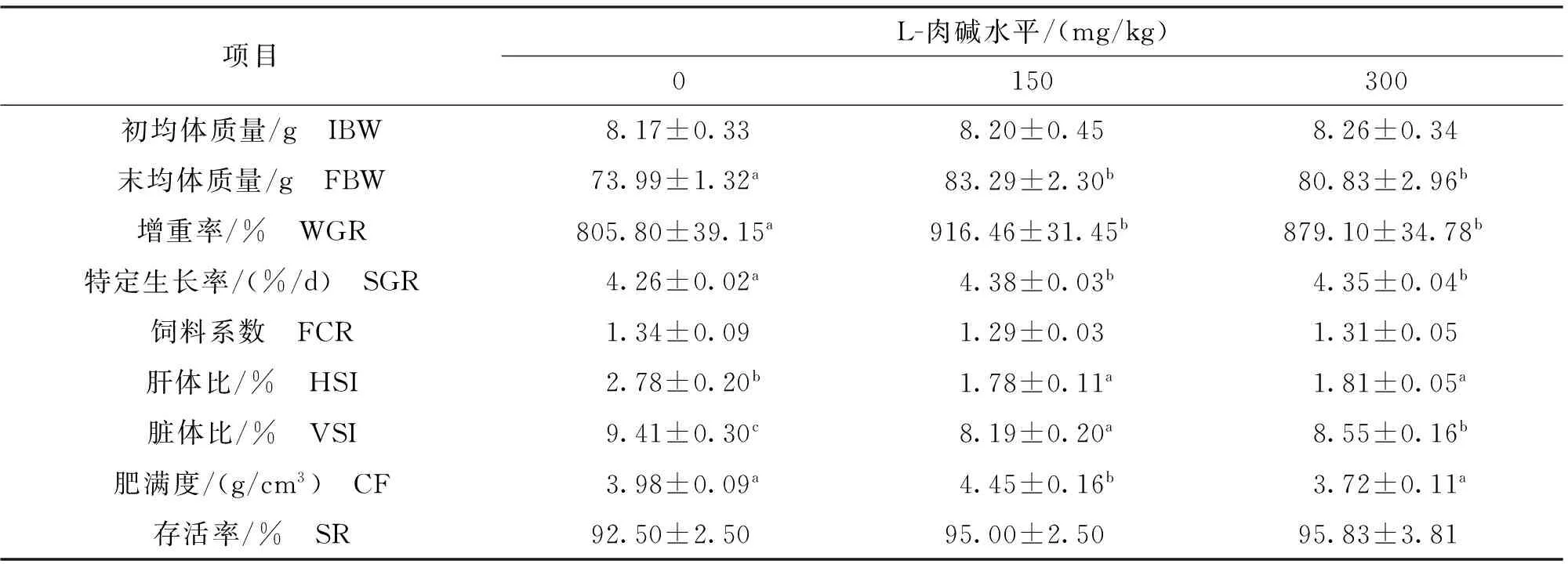
表2 饲料中添加L-肉碱对吉富罗非鱼幼鱼生长性能和饲料利用率的影响Tab.2 Effect of dietary L-Carnitine levels on growth performance and feed utilization of GIFI,O.niloticus
注:同一行数据肩标字母不同表示差异显著(P< 0.05)。下表同。
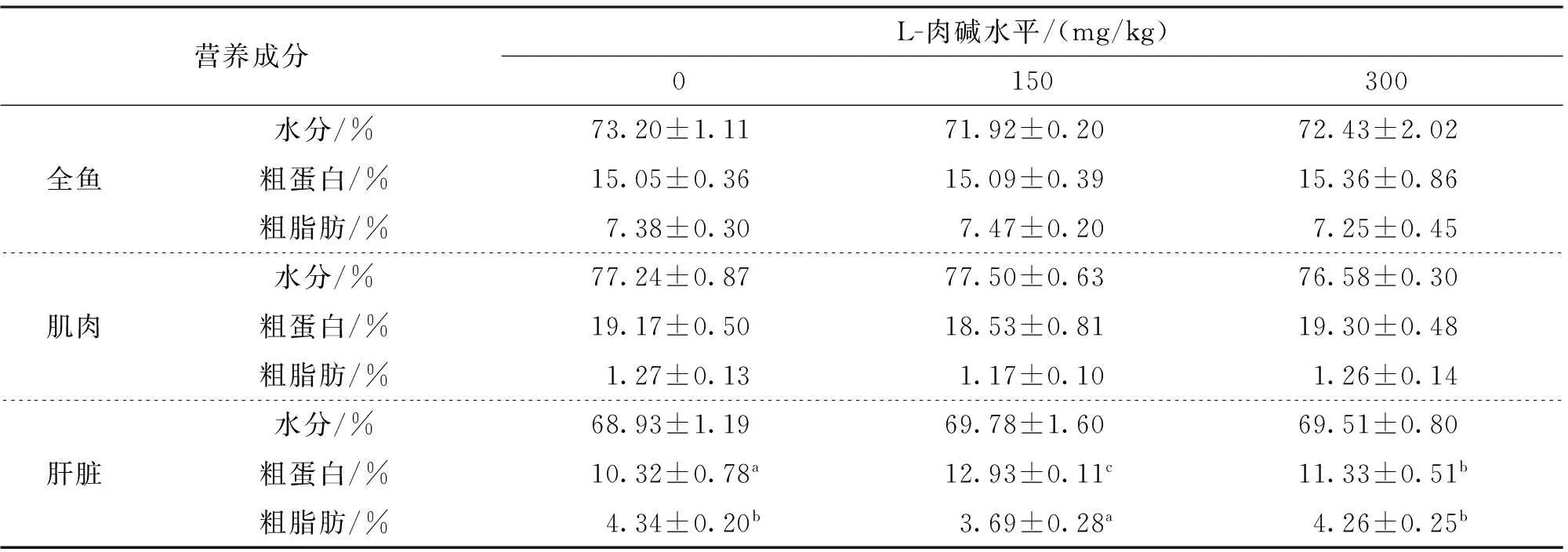
表3 饲料中L-肉碱水平对吉富罗非鱼全鱼、肌肉和肝脏营养成分的影响Tab.3 Effects of dietary L-Carnitine levels on body,muscle and liver composition of GIFT,O.niloticus
2.3饲料中添加L-肉碱对吉富罗非鱼血清生化指标的影响
由表4可知,饲料中添加L-肉碱对血清TCHO、HDL-C、LDL-C含量无显著影响,血清甘油三酯含量显著低于对照组,AST和ALT活性随L-肉碱水平升高呈下降趋势,均低于对照组,但差异不显著。血清总蛋白含量在150 mg/kg显著高于对照组。

表4 饲料中添加L-肉碱对吉富罗非鱼血清生化指标的影响Tab.4 Effects of dietary L-Carnitine levels on serum biochemical indices of GIFT,O.niloticus
2.4饲料中添加L-肉碱对吉富罗非鱼肝脏脂肪代谢酶的影响
由表5可知,添加150 mg/kg L-肉碱时,肝脏LPL、HL、TL和LPS活性分别较对照组提高了43.15%、83.71%、65.23%和39.03%;添加300 mg/kg L-肉碱时,LPL、HL、TL和LPS分别较对照组提高了76.03%、92.13%、84.31%和53.01%。且LPL、TL和LPS酶活性随L-肉碱添加水平增加呈显著上升趋势。

表5 饲料中添加L-肉碱对吉富罗非鱼肝脏脂肪代谢酶的影响Tab.5 Effects of dietary L-Carnitine levels on liver lipid metabolism enzymes of GIFT,O.niloticus
2.5饲料中添加L-肉碱对吉富罗非鱼肝脏抗氧化酶的影响
由表6可知,饲料中添加150或300 mg/kg L-肉碱显著提高了吉富罗非鱼肝脏CAT和GSH-PX活力,在150和300 mg/kg两实验组间无显著差异;肝脏SOD活性随L-肉碱添加有上升趋势,添加量为300 mg/kg时显著高于对照组;实验组肝脏MDA含量较对照组显著降低,并随着L-肉碱水平升高而逐渐降低;添加300 mg/kg L-肉碱显著提高了实验鱼肝脏LZM活性。
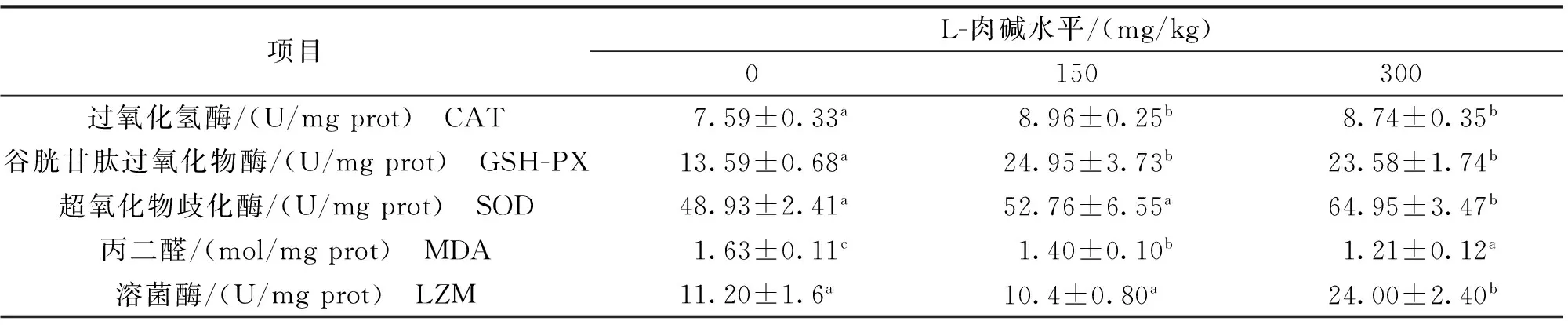
表6 饲料中添加L-肉碱对吉富罗非鱼肝脏抗氧化酶活性的影响Tab.6 Effects of dietary L-Carnitine levels on liver antioxidase activities of GIFT,O.niloticus
3 讨论
3.1饲料中添加L-肉碱对吉富罗非鱼生长性能的影响
L-肉碱是长链脂肪酸进入线粒体内膜进行β-氧化的重要因子,参与脂肪酸氧化供能,同时排除体内多余酰基,避免机体内酰基累积变成代谢毒素[1,13]。L-肉碱在生物体内的合成需要赖氨酸和甲硫氨酸[14-15],这两种必需氨基酸属于鱼类生长发育的限制性氨基酸,在鱼、虾类饲料中容易缺乏。补充L-肉碱可以提高脂肪利用率,同时减少鱼体内生长限制性氨基酸的消耗,达到促进生长和节约蛋白质的目的。本实验中,添加L-肉碱显著提高了罗非鱼FBW、WGR、SGR和CF,综合各生长指标,添加L-肉碱能够提高吉富罗非鱼生长,在150 mg/kg组生长效果最好。这可能与肉碱的营养机理有关,作为脂肪酸转运载体促进了长链脂肪酸氧化,为罗非鱼快速生长提供了所需能量;同时外源L-肉碱减少了罗非鱼体内赖氨酸和甲硫氨酸的消耗,有利于罗非鱼增长。FCR在对照组与实验组间没有差异,这可能与实验鱼的投食频率为每天3次,同时饱食投喂提高了摄食量有关。此外,L-肉碱添加组FCR低于对照组,也说明添加L-肉碱对降低吉富罗非鱼饲料系数有积极作用。
国内外研究报道了饲料中添加L-肉碱显著提高了奥尼罗非鱼(150 mg/kg)[6]、杂交条纹鲈(369.7 mg/kg)[11]、鲫鱼(Carassiusauratus)(100 mg/kg)[16]、吉富罗非鱼(200 mg/kg)[17]、草鱼(200 mg/kg)[9]、异育银鲫(carassiusauratusgibelio)(200 mg/kg)[18]、牙鲆(Paralichthysolivaceus)(1 200 mg/kg)[19]、青鱼(MylopharyngodonPiceus)(150 mg/kg)[20]、白鲸(HusohusoL.)(350~650 mg/kg)[21]、小龙虾(AstacusleptodactylusleptodactylusEschscholtz)(650 mg/kg)[22]生长性能和饲料效率,与本实验结果相似。也有研究报道了L-肉碱对欧洲鲈鱼(Dicentrarchuslabrax)(300~3 000 mg/kg)[23]、非洲鲶鱼(Clariasgariepinus)(660 mg/kg)[24]、罗非鱼(200 mg/kg)[12]、大口鲈(Micropterussalmoides)(1 000 mg/kg)[25]、虹鳟(500 mg/kg)[26]生长和饲料利用率无显著影响,与本实验结果存在差异。造成了这种差异的因素很多,比如实验鱼种类不同[8,12],L-肉碱添加量不同[6,12],温度差异[7,12],鱼体发育阶段不同[24]以及饲料中脂肪和蛋白质含量不同均会影响实验结果。
肝体比(HSI)和脏体比(VSI)也是评价鱼体健康和品质的重要指标,饲料中添加150 mg/kg L-肉碱显著降低了肝体比和脏体比,说明添加适量的L-肉碱对吉富罗非鱼健康生长有利。周萌等[27]指出添加肉碱(100 mg/kg)降低了军曹鱼(Rachycentroncanadum)HSI和VSI;黄凯等[7]也表明添加肉碱(200 mg/kg)能降低罗非鱼HSI;与本实验结果相同。Yang等[10]研究表明L-肉碱(400 mg/kg)对银鲈HSI和VSI无显著影响。这可能与鱼类食性、脂肪添加量和L-肉碱水平不同有关。
3.2饲料中添加L-肉碱对吉富罗非鱼脂肪代谢的影响
L-肉碱参与机体脂肪酸氧化供能,外源L-肉碱促进了脂肪氧化活动,减少游离脂肪酸含量,促进脂肪利用,减少甘油三酯含量和脂肪积累。本实验添加L-肉碱对全鱼和肌肉体成分无显著影响,添加150 mg/kg L-肉碱显著降低了肝脏粗脂肪含量,提高了肝脏粗蛋白含量,血清TG含量显著降低,血清TP含量显著高于对照组,而对TCHO、HDL-C和LDLC无显著影响。肝脏和血液是机体内物质和能量代谢的重要场所,肝脏脂肪和血清中TG降低均能说明L-肉碱对罗非鱼脂肪氧化和利用有一定促进作用。Santulli等[28]报道了L-肉碱降低了鲈鱼(Dicentrarchuslabrax. L.)肝脏和肌肉中的脂肪含量;Burtle等[29]指出添加L-肉碱降低了斑点叉尾鮰(Ietaluruspunetaus)全鱼、肝脏和肌肉中的脂肪含量,腹脂率也相应降低,同时提高了全鱼粗蛋白含量;Ji H等[30]研究表明L-肉碱对降低大西洋鲑(Salmosalar)腹脂含量有重要作用。亦有部分报道表明L-肉碱对虹鳟[31]、奥尼罗非鱼[6]、杂交条纹鲈[11]、欧洲鲈鱼[23]全鱼、肌肉和肝脏的体组成无显著影响,对减少体脂沉积没有明显效果。
王立新等[16]研究表明饲料中添加L-肉碱对血清TP和TCHO和TG含量无显著影响;Selcuk等[26]也报道了饲料中添加L-肉碱对虹鳟血清TCHO和TG含量无显著影响;田娟等[9]指出饲料中添加400 mg/kg L-肉碱显著降低了草鱼血清TG含量;造成这种差异的原因可能因为实验饲料的脂肪源不同,饲料中所含脂肪酸成分和含量不同,而L-肉碱只促进长链脂肪酸的氧化作用,而对于机体内其他脂肪酸没有转运作用或效果微小。这也合理解释了L-肉碱对高脂(26%)饲料投喂下虹鳟的体脂含量无影响[31],但显著降低了低脂(10%)饲料投喂的大西洋鲑的体脂沉积[30]。
LPL、HL是重要的脂肪分解酶,TL是LPL和HL的总和,其活性直接影响肝胰脏的脂肪代谢,LPS是重要的脂肪消化酶。本实验中,添加150或300 mg/kg L-肉碱显著提高了肝脏LPL、HL、TL和LPS活性,也表明饲料中添加L-肉碱对脂肪代谢有促进作用。血清AST和ALT活性在一定程度上反映了肝脏的健康程度,AST和ALT维持在较低水平有利于肝脏健康[32],本实验中AST和ALT活性较对照组有降低趋势,说明L-肉碱降低肝脂和提高蛋白含量的同时对保护肝脏也有积极作用。
3.3饲料中添加L-肉碱对吉富罗非鱼抗氧化能力和抗免疫的影响
Arduini[33]认为肉碱可以防止铁螯合物的形成,捕捉自由基,可以作为次级抗氧化剂,肉碱作为长链脂肪酰基的载体,对膜修复过程中膜磷脂的去酰化和重酰化有重要作用,当初级抗氧化屏障不能完全清除自由基时,可以作为次级抗氧化防御屏障。CAT、GSH-PX、SOD和MDA是主要的抗氧化指标,CAT、GSH-PX和SOD组成抗氧化酶系统,在体内的主要作用是清除自由基和过氧化物,使机体免受氧化自由基损害。MDA是脂质过氧化的终产物,其含量能反映脂质过氧化程度[34]。研究表明L-肉碱可以通过提高抗氧化酶活性和mRNA基因表达来提高机体抗氧化能力。José L等[35]指出L-肉碱提高了大鼠体内GSH-PX和SOD的基因表达量。明建华等[20]报道添加L-肉碱提高了青鱼血清CAT、GSH-PX和SOD活性,降低了MDA含量。Mohseni等[21]报道了饲料中添加350~650 mg/kg L-肉碱显著提高了白鲸肝脏SOD和GSH-PX活性。Safari等[22]指出,饲料中添加650 mg/kg L-肉碱显著提高了小龙虾SOD和GSH-PX活性,提升了抗氧化能力。本实验中,添加适量L-肉碱显著提高了肝脏CAT、GSH-PX和SOD活性,显著降低了MDA含量,说明添加L-肉碱提高了肝脏抗氧化能力,对减少鱼体内自由基和过氧化物含量,降低脂质过氧化有良好效果,L-肉碱可以作为抗氧化剂在动物营养上加以利用。溶菌酶属于非特异性免疫物质,本实验添加300 mg/kg L-肉碱提高了肝脏溶菌酶活性,说明L-肉碱提高了机体非特异性免疫能力。耿爱莲等[36]报道了L-肉碱对腹水敏感肉仔鸡溶菌酶活性没有影响,目前关于L-肉碱对鱼体免疫作用的研究报道较少,其作用机理需进一步深入研究。
4 小结
本实验研究结果表明:饲料中添加L-肉碱对吉富罗非鱼生长性能、肝脏脂肪代谢和抗氧化能力影响明显。以生长为评价指标,建议罗非鱼中L-肉碱添加量为150 mg/kg。
[1]沈同,王镜岩.生物化学(下册)[M].第2版.北京:高等教育出版社,1991:153-154.
[2]Bremer J.Carnitine-metabolism and functions[J].Physiol Rev,1983,63(4):1420-1480.
[3]Rebouche C J,Paulson D J.Carnitine metabolism and function in humans[J].Ann Rev Nutr,1986,6(1):41-66.
[4]Rebouche C J,Seim H.Carnitine metabolism and its regulation in microorganisms and mammals[J].Ann Rev Nutr,1998,18(1):39-61.
[5]杨奇慧,周小秋.L-肉碱对水产动物脂肪代谢的影响[J].饲料博览,2004,(5):9-11.
[6]Becker K,Schreiber S,Angoni C,et al.Growth performance and feed utilization response ofOreochromisniloticus×Oreochromisaureushybrids toL-carnitine measured over a full fattening cycle under commercial conditions[J].Aquaculture,1999,174(3-4):313-322.
[7]黄凯,陈涛,战歌,等.L-肉碱对奥尼罗非鱼生长、脂肪含量及血浆相关生化指标的影响[J].上海海洋大学学报,2010,19(2):201-206.
[8]Schuhmacher A,Gropp J M.Carnitine-a vitamin for rainbow trout?[J].J Appl Ichthyol,1998,14(1-2):87-90.
[9]田娟,冷向军,李小勤,等.肉碱对草鱼生长性能、体成分和脂肪代谢酶活性的影响[J].水产学报,2009,33(2):295-302.
[10]Yang S D,Liu F J,Liou C H.Effects of dietary L-carnitine,plant proteins and lipid levels on growth performance,body composition,blood traits and muscular carnitine status in juvenile silver perch (Bidyanusbidyanus)[J].Aquaculture,2012,342-343:48-55.
[11]Twibell R G,Brown P B.Effects of dietary carnitine on growth rates and body composition of hybrid striped bass (Moronesaxatilismale×M.chrysopsfemale)[J].Aquaculture,2000,187(1-2):153-161.
[12]杜震宇,刘永坚,田丽霞,等.添加不同构型肉碱对于罗非鱼生长和鱼体营养成分组成的影响[J].水产学报,2002,26(3):259-264.
[13]尤新.功能性发酵制品[M].北京:中国轻工业出版社,2000:298-309.
[14]张爱军,沈继红,吴海歌,等.L-肉碱的研究与应用现状[J].中国食品添加剂,2006,(3):89-95.
[15]徐少辉,武书庚,张海军,等.L-肉碱生理作用及其机理的研究进展[J].动物营养学报,2011,23(3):357-363.
[16]王立新,周继术,杨元昊,等.L-肉碱对鲫鱼生长和代谢的影响[J].西北农林科技大学学报(自然科学版),2004,32(10):63-65,70.
[17]张明辉,陈刚,董宏标,等.不同饲料蛋白水平下L-肉碱对新吉富品系尼罗罗非鱼生长和饲料利用的影响[J].广东海洋大学学报,2008,28(6):35-40.
[18]章世元,薛永峰,姜德兴.L-肉碱对异育银鲫生长、肌肉组成和血液生化指标的影响[J].湖北农业科学,2009,48(3):681-684.
[19]高小强,田青杰,石洪玥,等.饲料中添加L-肉碱对牙鲆幼鱼生长、生化组成及血液指标的影响[J].广东海洋大学学报,2012,32(1):39-46.
[20]明建华,叶金云,张易祥,等.蝇蛆粉和L-肉碱对青鱼生长、免疫与抗氧化指标及抗病力的影响[J].中国粮油学报,2013,28(2):80-86.
[21]Mohseni M,Ozório R O A.Effects of dietary L-carnitine level on growth performance,body composition and antioxidant status in beluga (HusohusoL.1758)[J].Aquacult Nutr,2014,20(5):477-485.
[22]Safari O,Atash M M S,Paolucci M.Effects of dietary L-carnitine level on growth performance,immune responses and stress resistance of juvenile narrow clawed crayfish,AstacusleptodactylusleptodactylusEschscholtz,1823[J].Aquaculture,2015,439:20-28.
[23]Dias J,Arzel J,Corraze G,et al.Effects of dietary L-carnitine supplementation on growth and lipid metabolism in European seabass (Dicentrarchuslabrax)[J].Aquacult Res,2001,32(S1):206-215.
[24]Ozório R O A,Van Eekeren T H B,Huisman E A,et al.Effects of dietary carnitine and protein energy:Nonprotein energy ratios on growth,ammonia excretion and respiratory quotient in African catfish,Clariasgariepinus(Burchell) juveniles[J].Aquacult Res,2001,32(S1):406-414.
[25]Li E C,Yu N,Chen L Q,et al.Protein sparing effect of lipid and L-carnitine in diets for largemouth bass (Micropterussalmoides)[J].Chin J Anim Nutr,2010,22(3):787-796.
[26]Selcuk Z,Tiril S U,Alagil F,et al.Effects of dietary L-carnitine and chromium picolinate supplementations on performance and some serum parameters in rainbow trout (Oncorhynchusmykiss)[J].Aquacult Int,2010,18(2):213-221.
[27]周萌,曹俊明,马利,等.饲料中添加磷脂油、胆碱、L-肉碱对军曹鱼生长及组织脂肪含量的影响[J].饲料工业,2007,28(10):23-25.
[28]Santulli A,D′Amelio V.Effects of supplemental dietary carnitine on growth and lipid metabolism of hatchery-reared sea bass (DicentrarchuslabraxL.)[J].Aquaculture,1986,59(3-4):177-186.
[29]Burtle G J,Liu Q H.Dietary carnitine and lysine affect channel catfish lipid and protein composition[J].J World Aquacult Soc,1994,25(2):169-174.
[30]Ji H,Bradley T M,Tremblay G C.Atlantic salmon (Salmosalar) fed L-carnitine exhibit altered intermediary metabolism and reduced tissue lipid,but no change in growth rate[J].J Nutr,1996,126(8):1937-1950.
[31]Rodehutscord M.Effects of supplemental dietary L-Carnitine on the growth and body composition of rainbow trout (Oncorhynchusmykiss) fed high-fat diets[J].J Anim Physiol Anim Nutr,1995,73(1-5):276-279.
[32]宋国培.正确判定肝功能检查的临床意义[J].中国实验诊断学,1997,1(2):11-14.
[33]Arduini A.Carnitine and its acyl esters as secondary antioxidants?[J].Am Heart J,1992,123(6):1726-1727.
[34]熊正英.运动自由基生物学研究[M].北京:科学出版社,2010:73-81.
[35]Miguel-Carrasco J L,Monserrat M,Mate A,et al.Comparative effects of captopril and L-carnitine on blood pressure and antioxidant enzyme gene expression in the heart of spontaneously hypertensive rats[J].Eur J Pharmacol,2010,632(1-3):65-72.
[36]耿爱莲,李保明,呙于明.L-肉碱和辅酶Q10添加对腹水症敏感肉鸡生产性能和部分免疫功能的影响[J].畜牧兽医学报,2007,38(8):806-813.
(责任编辑:邓薇)
Effects of dietary L-carnitine supplementation on growth,hepatic lipid metabolism and antioxidant ability in GIFT,Oreochromis niloticus
GOU Geng-wu1,2,JIANG Ming2,WEN Hua2,WU Fan2,LIU Wei2,TIAN Juan2
(1.CollegeofFisheryandLife,ShanghaiOceanUniversity,Shanghai201306,China;2.KeylaboratoryofFreshwaterBiodiversityConservationandUtilizationofMinistryofAgriculture/YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China)
A 9-week feeding experiment was performed to investigate the effects of dietary L-carnitine supplementation on growth performance,body composition,serum biochemical indices,hepatic lipid metabolism and antioxidant in juvenile GIFT strain (Genetically Improved Farmed Tilapia) of Nile tilapiaOreochromisniloticus(initial body weight:8.21±0.33 g,means±SD).Three practical diets were formulated with the incorporation of L-carnitine at the levels of 0(control),150 and 300 mg/kg.Our results were as follows:Compared with control group,dietary L-carnitine supplementation significantly increased weight gain rate (WGR) and specific growth rate(SGR),and significantly reduced hepatosomatic index(HSI) and viscerosomatic index (VSI).The highest WGR and SGR were observed on fish fed the diet containing 150 mg/kg L-carnitine,and HSI and VSI were the lowest in this group.There were no significant differences in feed conversation rate(FCR) and survival rate(SR) among all the groups.Feed added 150 or 300 mg/kg L-cranitine significantly increased the content of liver crude protein,and crude lipid of liver that fed with 150 mg/kg L-carnitine was significantly lower than that of the control group.Dietary L-carnitine supplementation significantly reduced triglyceride in serum,but there were no significant differences in total cholesterol(TCHO),high-density lipoprotein cholesterol(HDL-C) and low-density lipoprotein cholesterol (LDL-C).Dietary L-carntine supplementation significantly elevated the activities of lipoprotein lipase(LPL),hepatic lipase(HL),total lipase(TL) and lipase(LPS) in liver.Feed added 150 or 300 mg/kg L-carnitine significantly increased catalase(CAT),glutathione peroxidase(GSH-PX) activities and significantly reduced malondialdehyde(MDA) content in liver,the superoxide dismutase(SOD) and lysozyme(LZM) activities that fed with 300 mg/kg L-carnitine were significantly higher than that of the control group.All the above results indicated that appropriate dietary L-carnitine supplementation could improve growth performance and antioxidant ability,promote lipid degradation and utilization.Regarding the effects on growth performance,the proper dose of L-carnitine in the juvenile GIFT diet was suggested to be 150 mg/kg.
GIFT,Oreochromisniloticus;L-carnitine;growth performance;lipid metabolism;antioxidant ability
2016-03-11;
2016-04-28
现代农业产业技术体系建设专项资金项目(CARS-49);农业部公益性行业科研专项经费项目(201003020).
苟庚午(1990-),女,硕士研究生,专业方向为鱼类营养与饲料研究。 E-mail:249698592@qq.com
文华。 E-Mail:wenhua.hb@163.com
S963.73
A
1000-6907-(2016)05-0081-08
