饲料中添加红景天对吉富罗非鱼耐低温特性的影响
2016-09-23杨长庚喻丽娟
张 琛,杨长庚,文 华,蒋 明,刘 伟,喻丽娟,田 娟,吴 凡
(1.华中农业大学水产学院,武汉 430070;2.中国水产科学研究院长江水产研究所,武汉 430223)
饲料中添加红景天对吉富罗非鱼耐低温特性的影响
张琛1,2,杨长庚2,文华2,蒋明1,2,刘伟2,喻丽娟2,田娟2,吴凡2
(1.华中农业大学水产学院,武汉430070;2.中国水产科学研究院长江水产研究所,武汉430223)
实验采用高山红景天(Rhodiolasachalinensis)作为饲料添加剂,探究其对低温胁迫下的吉富罗非鱼(Oreochromisniloticus,GIFT)的影响。将0.1%、0.2%、0.4%的高山红景天水煎剂粗提干粉分别添加到基础饲料(对照组),用4种实验饲料投喂吉富罗非鱼54 d,然后进行低温胁迫处理并于30、25、20、15和10 ℃时分别取样。结果显示:水温为10 ℃时,添加组的成活率为100%,显著高于对照组,添加组血清中的血糖、高密度脂蛋白胆固醇、一氧化氮浓度和肝脏中的丙二醛水平较对照组显著降低;肝脏中的超氧化物歧化酶和谷胱甘肽过氧化物酶的酶活性水平较对照组显著升高,并且添加水平越高,效果越明显。以上结果说明,饲料中添加0.1%的高山红景天粗提干粉即能对提高罗非鱼的抗低温能力起到一定的积极作用,添加0.2%和0.4%的效果更好。
吉富罗非鱼(GIFT,Oreochromisniloticus);高山红景天(RhodiolasachalinensisA.Bor.);低温胁迫;添加剂
罗非鱼属于温水鱼类,其生长温度为16~38 ℃,适温为22~35 ℃,耐低温能力较差[1]。近年来,由于极端寒潮的影响,我国罗非鱼主产区经常发生罗非鱼大面积冻死冻伤的情况,造成严重的经济损失。如何提高罗非鱼耐低温能力已成为罗非鱼养殖产业发展所面临的重要问题之一。高山红景天(RhodiolasachalinensisA.Bor.)是我国传统的药用植物,含有40余种化学成分,其主要药理成分为红景天苷(salidroside,C14H20O7)、苷元酪醇(tyrosol,C6H10O2)和红景天多糖(R.SachalinensisPolysaccaride,RSP)等[2]。研究表明,红景天苷具有提高机体寒冷耐受性[3],提高特异性免疫及非特异性免疫的功能[4],高山红景天多糖具有降血糖、血脂[5]的作用, 高山红景天醇提取物具有良好的抗氧化和抗应激功能[6]。
吉富罗非鱼(Oreochromisniloticus,GIFT)是经过遗传性状改良的罗非鱼新品系,由尼罗罗非鱼(O.niloticus)的亚洲品系与非洲品系选育而成,生长速度快、鱼体高、背厚、出肉率高、遗传性状稳定,而耐低温能力较差[7]。已有研究表明,吉富罗非鱼在水温为15~16 ℃时表现出摄食减少的现象,致死温度范围为8.4~11 ℃[8]。本实验以吉富罗非鱼作为实验对象,投喂含不同浓度的高山红景天粗提干粉的实验饲料,在不同的温度下采样,通过检测实验鱼的成活率、血液生理生化指标以及抗氧化指标评估高山红景天对吉富罗非鱼耐低温胁迫的影响,为开发提高吉富罗非鱼耐低温能力的饲料添加剂提供理论依据。
1 材料与方法
1.1高山红景天粗提干粉的制备
高山红景天的水煎剂粗提干粉制作方法如下:将300 g高山红景天与双蒸水按100 g∶1 000 mL的比例置于烧杯中,浸泡1 h,随即煮沸,煎制30 min,用纱布过滤,取滤液,剩下的滤渣继续加双蒸水,与双蒸水的比例为100 g∶800 mL,煎制的时间为煮沸后40 min,用纱布过滤,取滤液,将其与第1次的滤液混合,将得到的滤液经过冷冻干燥机除去水分,即得水煎剂粗提干粉51 g。
1.2实验饲料
以豆粕、菜粕、棉粕为蛋白源,玉米油和大豆油为脂肪源,面粉为糖源制作基础饲料(表1),在基础饲料中分别添加质量分数为0%(NC)、0.1%(NP 0.1)、0.2%(NP 0.2)、0.4%(NP 0.4)的高山红景天水煎剂粗提干粉。按表1的配比将以上原料粉碎过60目筛,准确称量后逐级混匀,加适量水用绞肉机加工成直径2.0 mm条状,电风扇吹干后,破碎成长约4.0 mm圆柱形颗粒料,于-20 ℃冰柜中保存。

表1 基础饲料配方及其常规营养成分组成Tab.1 Formulation and proximate analysis of the basal diet
注:1.维生素预混料由下列成分组成(mg/kg饲料):盐酸硫胺素,5;核黄素,20;泛酸钙,10;烟酸,120;生物素,0.1;VB6,10;叶酸,1;肌醇,400;L-维生素C-2-磷酸镁,120; α-维生素E醋酸酯,60;VK3,5;视黄醇醋酸酯,5 000(IU)和VD3,2 000(IU)。
2.矿物盐预混料由下列成分组成(mg/kg饲料):乳酸钙,6 540;硫酸亚铁,42.5;硫酸镁,1 340;磷酸二氢钠,1 744;氯化钠,870;氯化铝,3;碘酸钾,2.5;氯化钾,1 500;氯化铜,2;硫酸锰,16;氯化钴,20;硫酸锌,60。
1.3实验鱼与实验方法
实验鱼由广西罗非鱼国家级育种实验场提供,在长江水产研究所的室内循环水养殖系统中驯养,投喂基础饲料。驯养2周后挑选体格健壮、大小均匀的吉富罗非鱼(初始平均体质量为21.0 g±0.5 g),随机分配于12个500 L桶中,每桶30尾,随机分成4个组,每组3个重复,分别投喂4组实验饲料。每天分3次投喂(8:30,12:30,16:30),表观饱食投喂,养殖周期为54 d。每日11:00进行一次系统反冲洗,每3 d换水1次(换水量占总体积约1/3)、观察记录水温、实验鱼摄食及死亡情况。养殖前两周通过循环水加热系统控制水温在30 ℃,随后使用制冷机将水温从30 ℃降至10 ℃,每2 d降低1 ℃,降温期间保持正常投喂。养殖期间水体pH 7.2~7.5,溶解氧高于5.0 mg/L、总氨氮低于0.5 mg/L。
1.4样品采集、测定与计算
在水温为30、25、20、15和10 ℃时进行采样,并在30 ℃和10 ℃时测定每个桶的实验鱼总重量并记录尾数。从每个桶随机取3尾鱼,测量其体长、体质量;从尾静脉采血后进行解剖,在冰盘上迅速分离内脏和肝脏,并称重,计算肝体比;肝脏样品置-40 ℃冰箱中保存备测肝脏谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性以及丙二醛(MDA)水平。血液在4 ℃静置2 h后,3 000 r/min离心15 min,取上清液(血清)用于血糖(Glu)、一氧化氮(NO)和高密度脂蛋白胆固醇(HDL-C)含量的检测。
相关计算公式如下:
成活率=100%×Nt/N0
增重率=100%×(FBW-IBW)/IBW
肝体比=100%×HW/W
脏体比=100%×VW/W
式中,Nt为终末尾数,N0为初始尾数,IBW为初始体质量(g),FBW为终末体质量(g),W为鱼体质量(g),HW为肝脏质量(g),VW为内脏质量(g)。
采用Sysmex全自动生化分析仪(Chemix-800)测定血清中Glu、HDL-C含量;采用碧云天生物技术有限公司测试盒测定血清中的NO含量;采用南京建成生物技术有限公司测试盒测定肝脏GSH-Px和SOD活性及MDA含量。
1.5统计分析
采用SPSS 21.0统计软件中One Way ANOVA方差分析和Duncan氏多重比较法,实验结果用平均值±标准差表示,显著水平为P<0.05。
2 结果
2.1高山红景天对低温胁迫下的吉富罗非鱼生长性能和成活率的影响
在养殖过程中发现,20 ℃时,对照组摄食量开始减少,至16 ℃时基本停止进食;添加组摄食量于18 ℃时开始减少,15 ℃时停止摄食。由表2可知,在温度为10 ℃时,添加组的成活率显著高于对照组(P<0.05),添加组的增重率显著高于对照组(P<0.05),并随着添加水平的提高而提高。在水温为10 ℃时,添加0.1%和0.4%组的肝体比显著大于对照组(P<0.05)(表3),而添加0.2%组的肝体比与对照组无显著差异。
2.2高山红景天对低温胁迫下的吉富罗非鱼血液生理生化指标的影响
随着温度的下降,血清中HDL-C,NO和Glu的浓度均呈现出先下降后回升的趋势(图1,图2,图3);在水温为30 ℃时,添加0.4%高山红景天粗提干粉组血清中Glu和NO的浓度显著高于对照组(P<0.05);在10 ℃时,对照组的HDL-C,NO,Glu的浓度显著高于添加组(P<0.05),并且添加0.2%组NO浓度显著低于其它两个添加组(P<0.05)。
2.3高山红景天对低温胁迫下的吉富罗非鱼抗氧化相关指标的影响
水温为30 ℃时,对照组肝脏中SOD的酶活力显著高于各添加组(P<0.05,图4),而在10 ℃时显著低于添加组(P<0.05);随着温度的下降,对照组肝脏中MDA的浓度均显著高于添加组(P<0.05,图5),GSH-Px的酶活力均显著低于添加组(P<0.05,图6)。

表2 高山红景天对低温胁迫下的吉富罗非鱼成活率和增重率的影响Tab.2 Effect of R.sachaliensis on the survive rate and weight gain rate of GIFT tilapia under low temperature stress
注:同行各数据肩标中有一个相同小写字母者表示差异不显著(P>0.05,Duncan's法)。表3同。

表3 高山红景天对低温胁迫的吉富罗非鱼肝体比的影响Tab.3 Effect of R.sachaliensis on the hepatosomatic of GIFT tilapia under low temperature stress

图1 添加不同浓度的高山红景天后血清中 HDL-C浓度的变化Fig.1 Effect of R.sachaliensis on HDL-C level of GIFT tilapia
注: a,b,c,d表示相同水温下各添加组具有显著性差异(P<0.05);A,B,C,D,E表示相同添加量在不同水温下具有显著性差异(P<0.05)。图2-图6同。
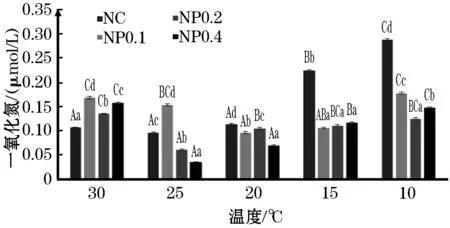
图2 添加不同浓度的高山红景天后血清中NO浓度的变化Fig.2 Effect of R.sachaliensis on NO level of GIFT tilapia

图3 添加不同浓度的高山红景天后血清中Glu含量的变化Fig.3 Effect of R.sachaliensis on blood glucosel level of GIFT tilapia

图4 添加不同浓度的高山红景天后 肝脏中SOD浓度的变化Fig.4 Effect of R.sachaliensis on SOD level of GIFT tilapia
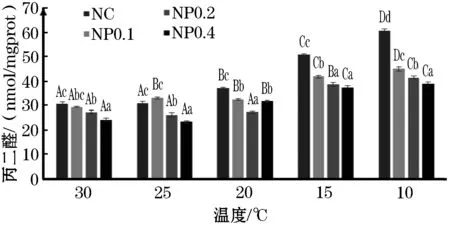
图5 添加不同浓度的高山红景天后 肝脏中MDA含量的变化Fig.5 Effect of R.sachaliensis on MDA level of GIFT tilapia
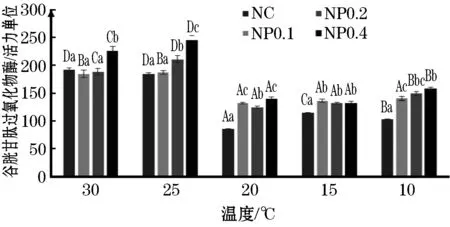
图6 添加不同浓度的高山红景天后 肝脏中GSH-Px含量的变化Fig.6 Effect of R.sachaliensis on GSH-Px level of GIFT tilapia
3 讨论
3.1高山红景天粗提干粉的主要活性成分
高山红景天的活性成分主要是红景天苷、苷元酪醇、红景天多糖等,还有一部分脂肪、甾醇、酚类化合物、有机酸以及多种氨基酸[2]。对本实验中添加的高山红景天水煎剂粗提干粉进行成分分析,发现红景天苷含量最高,红景天多糖含量次之,故推测在本实验中起主要作用的可能是红景天苷和红景天多糖。
3.2添加高山红景天对低温胁迫下的吉富罗非鱼生长性能的影响
温度作为一个重要的环境因子,对鱼类的生长发育起着十分重要的作用,低温会降低金钱鱼幼鱼[9]和大黄鱼[10]的成活率,使其摄食量减少,本实验的结果与以上文献报道一致。本实验添加组的成活率显著高于对照组,说明高山红景天能显著提高低温胁迫的吉富罗非鱼的成活率,降低其最低摄食温度,在吉富罗非鱼应对低温胁迫时起到积极作用。
有研究表明,红景天素能够抑制紫外线诱导的细胞死亡[11]和D-半乳糖胺诱导的细胞毒性[12],表现出保护肝脏的功能。本研究中,在水温为10 ℃时,添加组肝体比显著高于对照组,可能是由于高山红景天中的红景天素具有保护肝脏的作用,减缓了肝脏的萎缩,此结果与Nan 等[13]用红景天提取粉处理肝损伤大鼠的实验结果一致。
3.3添加高山红景天对低温胁迫状态下的吉富罗非鱼生理生化相关指标的影响
鱼类在受到低温胁迫时,血糖和血脂的浓度会发生变化。随着温度的下降,鱼体耗能降低,血糖浓度也降低,当温度处于吉富罗非鱼的致死温度范围[8]时,在应激作用下,血糖浓度升高[14]。 Hsieh等[15]用低温处理遮目鱼(Chanoschanos),发现其血清中Glu水平呈现出先下降后缓慢回升至初始水平的趋势。本实验中各实验组血清中Glu的浓度随着温度的下降呈现出先下降后缓慢回升至初始水平的趋势,与以上文献报道结果类似。此外,本实验中,水温为10 ℃时,各添加组的血糖浓度均显著低于对照组,可能是由于红景天能够减缓肝脏受到的氧化损伤,维持了罗非鱼在低温胁迫下的正常生理功能[16]。低温不仅影响鱼体的糖类代谢,还影响了脂质代谢,导致血清中HDL-C浓度升高[17]。本研究中,血清HDL-C的浓度随温度的下降而显著升高,这是由于在温度降低时,生物体会通过提高体内不饱和脂肪酸的浓度,改变细胞膜的膜脂结构,从而对低温进行适应[18-20]。此外,在水温为10 ℃时,添加组HDL-C浓度低于对照组,推测可能是由于高山红景天减弱了皮质醇应激性升高的幅度,避免了HDL-C的过量升高。
NO是一种能介导多种生化反应的生物信息分子,当其过量时,可介导细胞毒作用,与体内活性氧反应生成过氧亚硝酸盐,对机体造成损伤[21];还可诱发体内一系列脂质氧化连锁反应,造成生物膜的损伤[22]。在长期的低温胁迫下,雏鸡下丘脑中NO浓度会升高[23]。高山红景天中的红景天苷具有清除氧自由基的功能,可抑制血清中NO浓度的升高[24],导致在水温为10 ℃时,本实验中添加组NO浓度显著低于对照组,从而减少细胞毒作用的产生,使机体抗病力上升,添加0.2%高山红景天粗提干粉组的效果略优于其它添加组。
在低温胁迫状态下,鱼体肝脏的抗氧化功能也会发生改变,诱发氧化胁迫,导致体内自由基增多,造成损伤[25]。SOD可以清除自由基,减少脂质过氧化损伤[26]。MDA作为脂质过氧化物的主要分解产物,可造成蛋白质和酶类失活,降低细胞膜流动性,对机体造成损伤[27]。红景天苷能够提高机体抗氧化水平,降低肝脏MDA浓度[28]。高山红景天醇提物(RSAE)能显著增高低温胁迫过程中红细胞膜的SOD活性,抑制红细胞膜MDA浓度的增加[29]。本实验中,水温为10 ℃时,添加组肝脏中的SOD水平显著高于对照组,MDA水平显著低于对照组,并且MDA水平随着添加水平的升高而降低,与石晓峰[30]关于小鼠的研究结论一致,证明了高山红景天具有提高吉富罗非鱼抗低温胁迫能力的作用,并且在本实验的添加浓度范围内,添加水平越高,效果越明显。
GSH-Px能与过氧化氢发生还原反应,清除细胞内的自由基,保护细胞膜结构和功能的完整,进而使机体免受损伤。有研究表明,在低温胁迫状态下,小鼠脑和小肠中的GSH-Px活性会降低[31]。本实验中,水温为10 ℃时,添加组肝脏中的GSH-Px活性显著高于对照组,并且随着添加水平的升高而升高。推测是由于高山红景天提取物提高了肝脏中GSH-Px的活性,提高了机体抗自由基的能力,从而提高了机体低温耐受性[32]。
4 小结
在饲料中添加高山红景天,能提高吉富罗非鱼抗低温能力,提高成活率。
[1]李进荣.对池养罗非鱼耐寒能力的观察[J].水产科学,1985,4(1):37.
[2]倪付勇,陈重,许琼明.高山红景天化学成分研究[J].中草药,2013,44(7):798-802.
[3]Li Q,Zhou X D,Kolosov V P,et a1.Salidroside reduces cold-induced mucin production by inhibiting TRPM8 activation[J].Int J Mol Med,2013,32(3):637-646.
[4]李凤林.红景天苷药理作用的研究现状[J].现代食品科技,2013,29(4):916-920.
[5]崔艳梅,娄安如,赵长琦.红景天属植物化学成分及药理作用研究进展[J].北京师范大学学报(自然科学版),2008,44(3):328-333.
[6]Cui J L,Guo T T,Ren Z X,et al.Diversity and antioxidant activity of culturable endophytic fungi from alpine plants ofRhodiolacrenulata,R-angusta,andR-sachalinensis[J].Plos one,2015,10(3):1-16.
[7]刘波,何庆国,唐永凯,等.饥饿胁迫对吉富罗非鱼生长及生理生化指标的影响[J].中国水产科学,2009,16(2):230-237.
[8]Li S F,Li C H,Madan D,et al.Cold tolerance of three strains of Nile tilapia,Oreochromisniloticus,in China[J].Aquaculture,2002,213:123-129.
[9]宋郁,苏冒亮,刘南希,等.金钱鱼幼鱼低温耐受能力和饵料营养需求的研究[J].上海海洋大学学报,2012,21(5):715-719.
[10]Xu H,Zhang D L,Yu D H,et al.Molecular cloning and expression analysis of scd1 gene from large yellow croakerLarimichthyscroceaunder cold stress[J].Gene,2015,568:100-108.
[11]王方宇,李丹,韩志超,等.蔷薇红景天的化学成分及对紫外线诱导的A375-S2细胞死亡的抑制作用[J].沈阳药科大学学报,2007,24(5):280-283.
[12]Nakamura S,Li X,Matsuda H.Chemical structures and hepatoprotective effects of constituents from roots ofRhodiolasachalinensis[J].Chem Pharm Bull,2007,55(10):1505-1511.
[13]Nan J X,Jiang Y Z,Park E J,et al.Protective effect ofRhodiolasachalinensisextract on carbon tetrachloride-induced liver injury in rats[J].J Ethnopharmacol,2003,84:143-148.
[14]Mommsen T P,Vijayan M M,Moon T W.Cortisol in teleosts:Dynamics,mechanisms of action and metabolic regulation[J].Rev Fish Biol,1999,9:211-268.
[15]Hsieh S L,Chen Y N,Kuo C M.Physiological responses,desaturase activity,and fatty acid composition in milkfish (Chanoschanos) under cold acclimation[J].Aquaculture,2003,220(1/4):903-918.
[16]姜爱玲,张岩.红景天苷药理作用的研究进展[J].中国临床药理学与治疗,2015,20(10):1161-1164,1200.
[17]刘波,王美垚,谢骏,等.低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J].生态学报,2011,31(17):4866-4873.
[18]Delgado M,Akira M,Takao H,et al.Sensitivity to chilling of medaka (Oryziaslatipes) embryos at various developmental stages[J].Theriogenology,2005,64(1):112-122.
[19]Dey I,Buda C,Wiik T,et al.Molecular and structural composition of phospholipids membranes in livers of marine and freshwater fish in relation to temperature[J].Proc Natl Acad Sci USA,1993,90(16):7498-7502.
[20]Buda C,Dey I,Balogh N,et al.Structural order of membranes and composition of phospholipids in fish brain cells during thermal acclimatization[J].Eur J Clin Chem Clin Biochem J Forum Eur Clin Chem Soc,1994,91(17):8234-8238.
[21]Jeffrey D L,Diane E H,Carol R G,et al.Prooxidant and antioxidant functions of nitric oxide in liver toxicity[J].Antioxid Redox Signal,2004,3(2):261-271.
[22]Babizhayev M A,Deyev A I,Yegoroy Y E.Non-hydrolyzed in digestive tract and blood natural L-carnosine peptide (“bioactivated Jewish penicillin”) as a panacea of tomorrow for various flu ailments:signaling activity attenuating nitric oxide (NO) production,cytostasis,and NO-dependent inhibition of influenza virus replication in macrophages in the human body infected with the virulent swine influenza A (H1N1) virus[J].J Basic Clin Physiol Pharm,2013,24(1):1-26.
[23]王金涛,孙晓玉,徐世文.冷应激对雏鸡下丘脑NO代谢的影响[J].中国兽医科学,2007,37(05):429-434.
[24]李阳,孙文基.女贞子的药理作用研究[J].陕西中医学院学报,2006,29(5):58-60.
[25]Ye C X,Wan F,Sun Z Z,et al.Effect of phosphorus supplementation on cell viability,anti-oxidative capacity and comparative proteomic profiles of puffer fish (Takifuguobscurus) under low temperature stress[J].Aquaculture,2016,482:200-208.
[26]吕辉,张文斌,孟姗姗,等.复方中药制剂在寒冷诱导机体损伤中作用及其机制[J].现代生物医学进展,2012,12(5):855-860.
[27]Tuzgen S,Kaynar M Y,Guner A,et al.The effect of epidural cooling on lipid peroxidation after experimental spinal cord injury[J].Spinal cord,1998,36(9):654-657.
[28]Xu J,Li Y.Effects of salidroside on exhaustive exercise induced oxidative stress in rats[J].Mol Med Rep,2012,6 (5):1195-1198.
[29]杨义军,宋久荣,杨成君,等.高山红景天、刺五加提高冷适应机体红细胞膜功能的研究[J].沈阳部队医药,1996,9(4):312-314.
[30]石晓峰.复方红景天冲剂抗应激作用的实验研究[J].卫生职业教育,2003,21(7):136.
[31]崔雄,朴锦花,刘宇,等.高山红景天提取物对糖尿病大鼠谷胱甘肽过氧化物酶活性及丙二醛含量的影响[J].时珍国医国药,2007,18(9):2142-2143.
[32]Kaushik S,Jyotdeep K.Chronic cold exposure affects the antioxidant defense system in various rat tissues[J].Clin Chim Acta,2003,333(1):69-77.
(责任编辑:张红林)
Effects of Rhodiola sachaliensis on improving low-temperature tolerance characteristics of Tilapia (Oreochromis niloticus)
ZHANG Chen1,2,YANG Chang-geng2,WEN Hua2,JIANG Ming1,2,LIU Wei2,YU Li-juan2,TIAN Juan2,WU Fan2
(1.CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China;2.YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China)
An experiment was conducted to study the effect ofRhodiolasachaliensisaqueous extract powder on the tilapia under low-temperature.The fishes were divided into four groups:no additives group(control group,NC),R.sachaliensislow dose group(0.1%),R.sachaliensismid dose group (0.2%) andR.sachaliensishigh dose group (0.4%).And the fishes were fed at 30 ℃ for 2 weeks followed by the experimental temperature dropped from 30 ℃ to 10 ℃ with the rate of 0.5 ℃/d.The survival rate,blood biochemical indexes and antioxidant indexes of the fishes in four groups were determined at 30 ℃,25 ℃,20 ℃,15 ℃ and 10 ℃.The results showed that the survival rates of the all addingR.sachaliensisgroups were significantly higher than that of the control group.At 10 ℃,compared with the control group,high density lipoprotein-cholesterol,glucose,nitric oxide,malonaldehyde content of fishes inR.sachaliensissupplement groups were significantly reduced,meanwhile superoxide dismutase levels and glutathione peroxidase activities in liver of fishes were significantly increased with the increasingR.sachaliensislevel.In conclusion,R.sachaliensiscan play a positive role in resisting low temperature in tilapia.
Oreochromisniloticus;Rhodiolasachalinensis;low temperature stress;additives
2016-03-16;
2016-05-31
国家自然科学基金 (31402290);现代农业产业技术体系建设专项(CARS-49);农业部公益性行业科研专项(201003020);中国水产科学研究院长江水产研究所所长基金(SZ2012-04)。
张琛(1992-),女,硕士研究生,专业方向为鱼类营养与饲料学。 E-mail:444280354@qq.com
文华。 E-mail:wenhua.hb@163.com
S963.73
A
1000-6907-(2016)05-0075-06
