pH对日本沼虾存活及肝功能相关酶活性的影响
2016-09-23付监贵张磊磊宋学宏
付监贵,张磊磊,徐 乐,徐 逍,宋学宏
(苏州大学基础医学与生物科学学院,江苏苏州 215123)
pH对日本沼虾存活及肝功能相关酶活性的影响
付监贵,张磊磊,徐乐,徐逍,宋学宏
(苏州大学基础医学与生物科学学院,江苏苏州215123)
为揭示日本沼虾(Macrobrachiumnipponense)对水体pH的适应性,分析了不同pH胁迫下日本沼虾在不同时段的存活率以及96 h后蜕壳率,免疫、肝功能相关酶活性的变化。结果显示,pH胁迫处理96 h时,不同pH处理组日本沼虾的存活率显著低于对照组,除pH 7.0组的蜕壳率与对照组差异不显著外,其余pH处理组蜕壳率显著高于对照组;暴露在弱酸性水(pH 6.0)、弱碱性水(pH 8.0)、碱性水(PH9.0)中的成活率不同,其中PH6.0组虾的成活率在36 h时显著低于PH8.0组,24 h时显著低于pH 9.0组;pH 5.0酸性处理组日本沼虾在试验期间存活率始终最低,上述结果表明日本沼虾对碱性水体的适应性强于酸性水体。比较不同pH值对日本沼虾肝功能相关酶活性的影响程度时发现,日本沼虾T-SOD、ACP、GOT、T-AOC酶的耐受pH生态幅较窄,AKP酶的耐受pH生态幅较宽。通过96 h的pH值与相关酶回归分析得出,日本沼虾的最适pH值范围为7.3~7.6。
日本沼虾(Macrobrachiumnipponense);pH胁迫;存活率;肝功能酶
日本沼虾(Macrobrachiumnipponense),隶属软甲亚纲十足目游行亚目长臂虾科沼虾属,分布于中国、日本和东南亚地区,是我国淡水养殖业中主要的经济虾类之一[1]。目前,我国日本沼虾主混养面积已超过500万亩,总产量近26万吨(《中国渔业年鉴2015》),并有望成为我国今后虾类养殖的主导品种。
pH是虾类养殖水环境重要的环境因子,常因大量换水、阴天暴雨和浮游植物优势种群的突然改变或消失等因素影响而变化,尤其在池塘养殖中,易滋生杂草、青苔等造成pH偏高;因极端pH值导致渗透调节功能受损,虾生长缓慢,甚至出现病害暴发、大量死亡等现象[2],使养殖者蒙受经济损失。近年来,关于pH值变化对甲壳类动物生长、抗氧化能力、虾青素沉积的影响等研究引起关注,研究表明pH值与上述指标相关性较大[3,4]。生产上,人们常依据甲壳动物肝胰腺的形态结构变化来判断其是否健康,甲壳动物的肝功能及免疫功能与它们的生存与正常生长直接相关。目前,pH对中国对虾、凡纳滨对虾、日本囊对虾、克氏原螯虾和脊尾白虾的免疫功能及肝功能的影响已有报道[5-10]。关于水环境中pH对日本沼虾的影响,已有pH对日本沼虾存活率[11]、耗氧率及鳃组织 CAT、SOD 活性[12]、肝胰腺中消化酶活性[13]、血清酚氧化酶活性及稳定性[14]等方面的研究,而pH对日本沼虾免疫功能及肝功能相关酶活性的影响未见报道。本研究以生产上常见的引起日本沼虾生病死亡的极端pH值为界,设计pH值梯度,研究不同pH值对日本沼虾存活率、免疫功能及肝功能相关酶活性的影响,探索日本沼虾适宜的pH值范围,旨在为科学调控水环境、提高日本沼虾育种和养殖产量及品质提供依据。
1 材料与方法
1.1实验日本沼虾
实验用日本沼虾由苏州市阳澄湖现代农业发展有限公司提供。实验虾初始规格为(1.76±0.30) g。实验开始前于实验室内暂养3 d,挑选大小一致的健康沼虾进行实验。
1.2实验设计
以生产上常见的引起日本沼虾生病死亡的低pH值5.0和高pH值9.0为界,共设5个pH值处理组,分别为5.0、6.0、7.0、8.0、9.0,每个处理组均设3个重复。仿照GB/T18654《养殖鱼类种质检验》中耗氧率与临界窒息点测定的装置,在密闭装置中采用循环水法进行暂养实验,蓄水池为70 cm×60 cm×50 cm(长×宽×高)的塑料箱,塑料箱中的实验用水为曝气3 d的自来水,用FG2型pH计(Mettler-Toledo公司)测定pH值。蓄水池的pH值调控方法参照董双林等[15]的方法进行,实验开始前用1 mol/L HCl和1 mol/L NaOH将pH值调整至设定值,每天8:00和18:00校正实验pH值,使其波动范围在设定值±0.20范围内;用碘量法测定溶氧,使溶氧稳定在(6.0±0.5) mg/L。每只塑料箱供应3个测试室,测试室体积为2 L,出水经充氧后再循环使用。测试室的水控制流量约为3 800 mL/h,保持溶氧在(5.0±0.5 )mg/L。同时设1个对照组,对照组取水质良好的养殖池塘水(pH值为7.6),充气增氧,氧气含量保持与处理组一致。
1.3日本沼虾蜕壳率、存活率的测定
每个测试室投放实验虾30只,实验开始后每隔12 h统计各测试室内虾的蜕壳、死亡数量,实验时间为96 h。评判虾死亡的标准为失去游泳能力、附肢不能活动、对解剖针的刺激毫无反应[11]。计算各时段的实验虾存活率,并观察统计蜕壳实验虾的数量,实验期间不投饵,水温控制为(25±1)℃。
1.4日本沼虾免疫及肝功能相关酶的活性测定
pH胁迫处理96 h后采集样本,制备肝胰腺粗酶液。用镊子取日本沼虾新鲜肝胰腺,称重,加入10倍体积0.1 mol/L、pH 7.4的磷酸盐缓冲液,于玻璃匀浆器中冰浴匀浆,以10 000 r/min冷冻离心20 min,取上清供实验用。采用南京建成生物工程研究所的试剂盒测定总超氧化物歧化酶(T-SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)的活性、总抗氧化能力(T-AOC)和组织匀浆粗提液中蛋白含量。
1.5数据统计与分析
数据采用SPSS16.0统计软件的单因素方差分析(One-Way ANOVA)方法和Duncan氏多重比较进行分析,比较在不同pH胁迫下不同时间点日本沼虾的存活率,统计显著水平为P<0.05。
2 结果与分析
2.1日本沼虾在不同pH值水体中存活率、蜕壳率及其适宜pH范围
日本沼虾暴露在不同pH的水体96 h后,其存活率、蜕壳率差异较大。表1显示,暴露在养殖池塘水中的对照组日本沼虾存活率始终保持最高,处理组存活率从高到低的pH值顺序为7.0、8.0、6.0、9.0、5.0,其中,pH5.0组的存活率显著低于其它各组(pH9.0组除外),pH6.0、8.0、9.0组差异不显著,但均低于pH 7.0组。蜕壳率的变化与存活率不一致,其中pH 7.0组与对照组相同,显著低于其它各组,其它各组蜕壳率从低到高的pH值顺序为6.0、8.0、9.0、5.0,说明pH 7.0较适宜日本沼虾的蜕壳与生存。
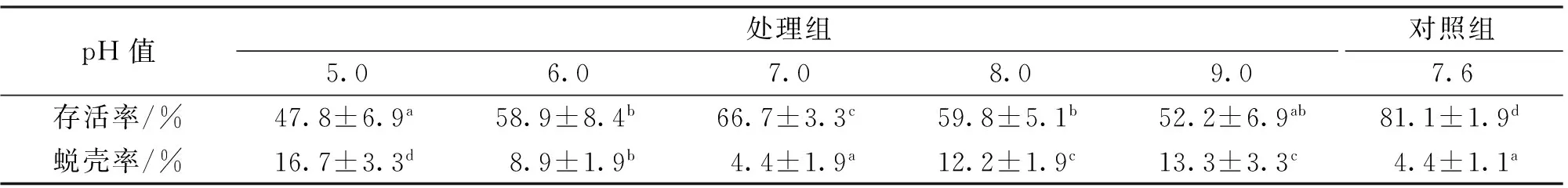
表1 不同pH值水体中暴露96 h时日本沼虾的存活率与蜕壳率Tab.1 The molting and survival rates of oriental river prawns under different pH conditions
注:同一行数字的肩标字母不同代表差异显著(P<0.05),n=3。
在96 h内,实验中暴露在不同pH水体中的日本沼虾生存曲线差异明显(图1),其中,对照组的存活率始终最高;pH 7.0组虾24 h内的存活率接近对照组,但在24 h后显著低于对照组。pH 8.0组虾的存活率在60 h后显著低于pH 7.0组;pH 9.0与pH 6.0组虾的存活率始终显著低于pH 7.0组,pH 6.0组虾在24 h内显著低于pH 9.0组,36 h内显著低于pH 8.0组。pH 5.0组日本沼虾存活率始终显著低于除pH 6.0组外的其它各组;与pH 6.0组相比,前者在48 h后显著低于后者。上述结果说明,日本沼虾能适应较碱性的水环境。将pH值与存活率进行抛物线回归分析,求得日本沼虾最适的pH值范围。日本沼虾的存活率与pH值的二次回归曲线方程为:Y=-3.72X2+53.07X-124.62(R2=0.954,P=0.007),按照抛物线回归方法计算,求得当水体pH=7.13时日本沼虾的存活率达到最高值,进一步说明,日本沼虾在中性偏微碱性的水体中适应性强。
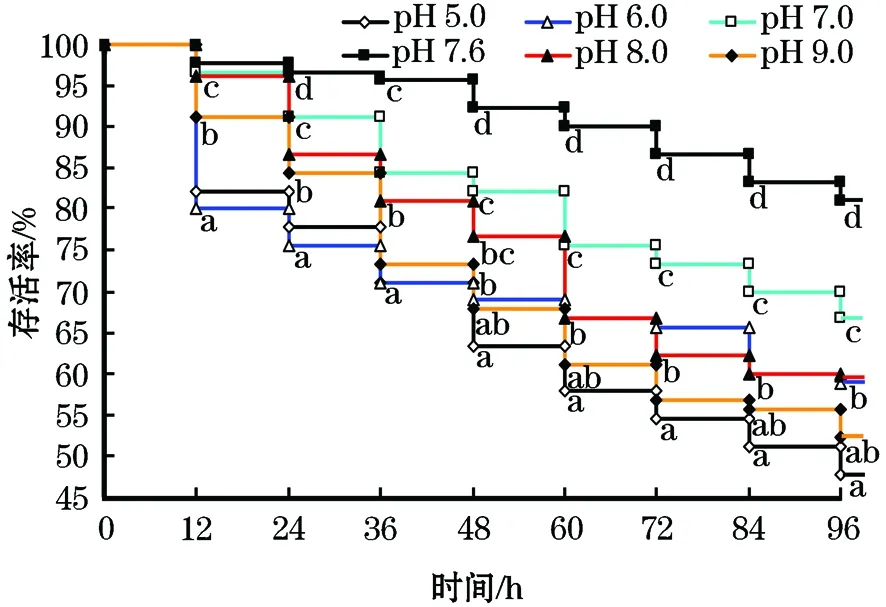
图1 不同pH胁迫12~96 h内日本沼虾的生存曲线Fig.1 The survival curve of oriental river prawn within 12~96 h after exposure to different pH levels同一个时间点的字母不同代表差异显著(P<0.05),n=3。
2.2pH值对日本沼虾免疫及肝功能相关酶活性的影响
养殖实验结束时,观察各组肝胰腺的形态与颜色发现,在pH 7.0、pH 8.0水体中的虾肝胰腺黄褐色,轮廓清晰,pH 6.0水体中的个别虾肝胰腺出现病变症状,颜色变浅、肿大、轮廓变模糊;而pH 9.0与pH 5.0水体中的多数虾肝胰腺呈灰白色,并开始糜烂,个别虾取不到完整的肝胰腺。测定对照组和不同pH值处理组日本沼虾肝胰腺中肝功能相关酶活性(图2)。图2显示,pH 7.0和8.0处理组的日本沼虾T-SOD、ACP、AKP、GPT、GOT等肝功能相关酶活性和T-AOC值均与对照组(pH 7.6)较一致。pH 5.0、9.0处理组的虾肝胰腺T-SOD酶活均显著低于pH 6.0~8.0处理组;GOT酶活性则均显著高于pH 6.0~8.0处理组;T-AOC也显著高于其它组。pH 5.0组与6.0组的ACP酶和GPT酶差异不显著,但显著高于其它组,pH 5.0组的AKP显著高于其它各组。说明日本沼虾T-SOD、ACP、GOT、T-AOC酶的耐受pH生态幅较窄,而AKP酶的耐受pH生态幅较宽。以上述酶活性变化值与pH值进行抛物线回归分析,求得日本沼虾最适的pH值范围(表2),综合表2中各项指标最适pH值的范围,得出日本沼虾的最适pH值为7.3~7.6,这显示日本沼虾适宜在中性略偏碱性的水体中生长。
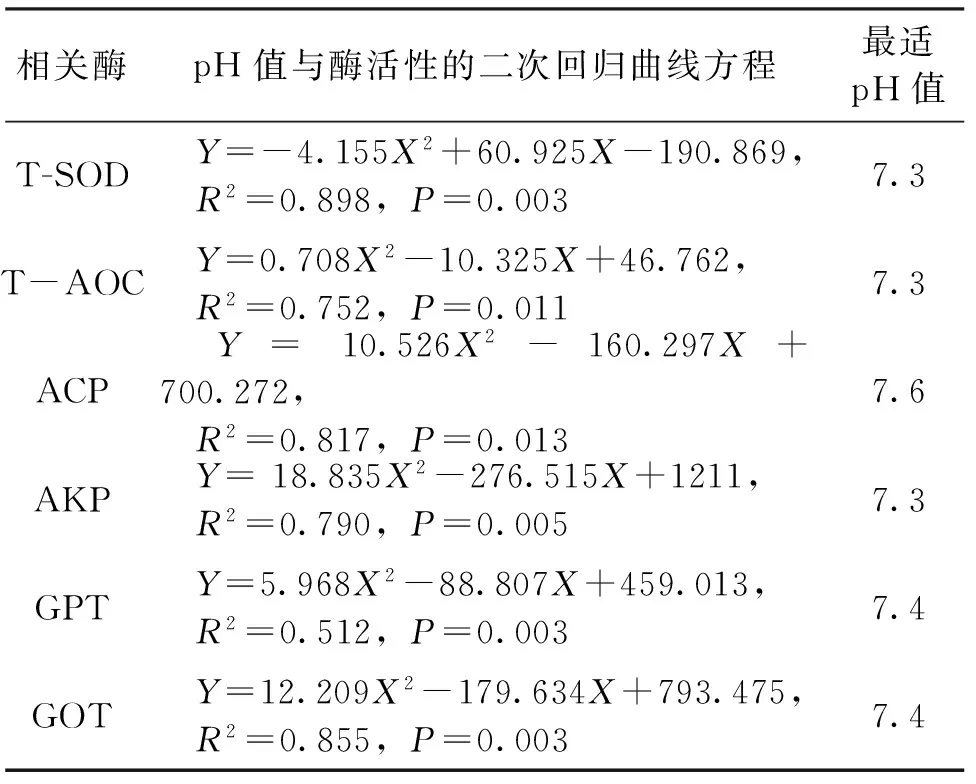
表2 pH值与酶活性的二次回归曲线方程Tab.2 The linear regression curve equation between pH levels and enzyme activities

图2 不同pH胁迫下日本沼虾免疫及肝功能相关酶的活性Fig.2 The activities of immune and/or liver function-related enzymes of oriental river prawn after exposure to different pH levels同一种指标中上标的字母不同代表差异显著(P < 0.05),n=3。
3 讨论
3.1pH值对日本沼虾生存与蜕壳的影响
pH值作为水生态平衡的指标,pH值的变化是水化学指标状况和生命活动的综合反映应。在养殖过程中,如果pH过高或过低,不仅会引起水中一些物质的化学变化,甚至会转变成有毒物质。当水环境pH严重偏离其耐受生态幅时,导致日本沼虾鳃组织受损[12],增加死亡率。试验组日本沼虾存活率最高的pH是7.0,较适宜生存的pH范围是6.0~8.0,沼虾在较碱性的水环境中存活率高于酸性及弱酸性水体,这一结果与吴一挺等[12]观察的结果相吻合。而从各实验组虾的存活率显著低于原养殖水体虾的现象推测,用自来水配制而成的试验用水可能缺乏某些营养元素(如Ca2+)[15]。
蜕壳是甲壳动物生长不可或缺的环节,蜕壳不仅需要体内积累足够的物质与能量,还需一定的环境因子刺激[16]。本研究在96 h内各水体中均有部分实验虾蜕壳,其中pH 7.0组与对照组的蜕壳数相同,且显著低于其它各组,其它各组蜕壳率从低到高的pH值顺序与生存率顺序并不一致,在pH 8.0碱性水体与pH 6.0弱酸性水体中日本沼虾存活率相同,但蜕壳率显著高于后者,这验证了蜕皮与正常生长所需要的水环境条件也不尽相同[11]的观点,说明在较适宜的pH值范围内,碱性条件的刺激更有利于日本沼虾的蜕壳。
3.2pH值对日本沼虾免疫及肝功能相关酶活性的影响
动物的肝脏是机体最大的消化腺,也是重要的免疫器官[17]。肝组织中的T-SOD与T-AOC分别为抗氧化酶和机体抗氧化系统功能指标,是表征生物体吞噬细胞防御能力、整体的免疫功能和新陈代谢受损程度高低的重要指标[18];ACP和AKP是肝胰腺中重要的调控酶,在免疫反应中发挥重要作用,其对钙质吸取、骨骼形成、磷酸钙沉积、甲壳素分泌及形成都具有重要作用[10];而GPT和GOT是广泛存在于动物细胞浆和线粒体中的重要氨基酸转氨酶[19],在甲壳类蛋白质代谢过程中发挥重要作用,是肝细胞功能的敏感指标。本研究结果显示,当水体pH值稍高于日本沼虾的pH值耐受生态幅(如pH为8.0)时,虾体产生“毒物兴奋效应”[20],维持机体的自身平衡来克服胁迫。但当pH值继续上升至9.0或下降至5.0时,虾体发生了一系列的病理变化,如T-SOD显著下降、T-AOC显著提高,虾体内自由基增高,造成肝胰腺组织损伤;GPT和GOT显著增高,并通过阻碍蛋白质代谢,影响肝的正常功能;ACP和AKP显著增高,影响了虾对钙质的吸取、甲壳的形成及磷酸钙沉积[21],即增加甲壳动物壳中Ca2+的沉积和吸收速率 。从表观上,我们发现沼虾的肝胰腺呈灰白色,轮廓模糊、糜烂,最终影响虾的蜕壳,在应激蜕壳的情况下,导致虾体死亡,存活率下降。上述结果与哈承旭等[22]对日本对虾观察的结果相类似。有研究表明,较长时间极端pH的胁迫,使虾体分解自身的能量物质如糖类、脂肪及蛋白质[23],提供更多的能量,维持体内的酸碱平衡和离子平衡,因而导致生长速度下降[12]。因此,碱性或酸性条件下实验日本沼虾上述酶活性的升高,既是机体的主动防御反应,也是一种被动的病理显示。
3.3日本沼虾适宜pH范围的确定
本研究中,暴露在pH 7.0、8.0水体中的虾肝胰腺形态与颜色较正常,而在pH 9.0、5.0水体中的虾肝胰腺则出现了不同程度的病变症状。将暴露在不同pH值水体中日本沼虾的存活率及各种酶的活性进行回归分析后计算出的日本沼虾最适pH值为7.3~7.6,日本沼虾适宜中性偏弱碱性的水体。
[1]黄玉玲.我国虾类淡水养殖概述[J].水利渔业,2003,23(1):1-3.
[2]张林娟,潘鲁青,栾治华.pH变化对日本囊对虾仔虾离子转运酶活力和存活、生长的影响[J].水产学报,2008,32(5):758-764.
[3]于天基,李健,李吉涛,等.pH胁迫对脊尾白虾抗氧化酶活力的影响[J].海洋科学,2015,39(5):47-53.
[4]龚志,蔡春芳,朱健明,等.高pH值对中华绒螯蟹抗氧化能力及虾青素沉积的影响[J].淡水渔业,2015,45(1):20-24.
[5]王芸,李健,李吉涛,等.pH胁迫对中国对虾抗氧化系统酶活力及基因表达的影响[J].中国水产科学,2011,18(3):556-564.
[6]赵先银,李健,李吉涛,等.pH胁迫对日本对虾非特异性免疫因子及RNA/DNA比值的影响[J].渔业科学进展,2011,32(1):60-66.
[7]赵先银,李健,陈萍,等.pH胁迫对3种对虾存活率离子转运酶和免疫酶活力的影响[J].上海海洋大学学报,2011,20(5):720-728.
[8]潘鲁青,姜令绪.盐度、pH突变对2种养殖对虾免疫力的影响[J].青岛海洋大学学报,2002,32(6):903-910.
[9]朱毅菲,熊传喜,王良发.温度、pH对克氏原螯虾血清酚氧化酶活力及稳定性的影响[J].淡水渔业,2006,36(5):16-19.
[10]李玉全.pH胁迫对脊尾白虾代谢酶活力的影响[J].南方农业学报,2014,45(6):1098-1101.
[11]杨富亿,李秀军,杨欣乔.日本沼虾幼虾对碱度和pH的适应性[J].动物学杂志,2005,40(6):74-79.
[12]吴一挺,王志铮,杨磊,等.pH对日本沼虾耗氧率及鳃组织CAT、SOD 活力的影响[J].浙江海洋学院学报(自然科学版),2011,30(6):503-506.
[13]王维娜,孙儒泳,王安利,等.环境因子对日本沼虾消化酶和碱性磷酸酶的影响[J].应用生态学报,2002,13(9):1153-1156.
[14]李义.温度、pH对日本沼虾血清酚氧化酶活力及稳定性的影响[J].海洋科学,2002,26(10):1-3.
[15]董双林,堵南山,赖伟.pH值和Ca2+浓度对日本沼虾生长和能量收支的影响[J].水产学报,1994,18(2):118-122.
[16]黄乾生,谢晓兰,石艳,等.不同生长期凡纳滨对虾肝胰腺NAGase的基本性质变化[J].厦门大学学报(自然科学版),2006,45(6):847-850.
[17]Knolle P A,Gerken G.Local control of the immun eresponse in the liver [J].Immunol Rev,2000,174:21-34.
[18]姚翠鸾,王维娜,王安利.水生动物体内超氧化物歧化酶的研究进展[J].海洋科学,2003,27(10):18-21.
[19]潘鲁青,吴众望,张红霞.重金属离子对凡纳滨对虾组织转氨酶活力的影响[J].中国海洋大学学报,2005,35(2):195-198.
[20]Calabrese E J,Cook R R.Hormesis:how it could affect the risk assessment process.[J].Human Exp Toxicol,2005,24(5):265-270.
[21]张辉.日本沼虾肝胰腺碱性磷酸酶的纯化及特性研究[D].保定:河北大学,2000.
[22]哈承旭,刘萍,何玉英,等.高pH胁迫对“黄海1号”中国对虾免疫相关酶的影响[J].中国水产科学,2009,16(2):303-306.
[23]张宽,黄金刚,许婷,等.饥饿对不同食性甲壳类动物肝脏谷丙转氨酶活性的影响[J].氨基酸和生物资源,2005,27(3):35-37.
(责任编辑:张红林)
Effects of pH on survival of oriental river prawn (Macrobrachium nipponense) and activities of liver function enzymes
FU Jian-gui,ZHANG Lei-lei,XU Le,XU Xiao,SONG Xue-hong
(SchoolofBiologyandBasicMedicalSciences,SoochowUniversity,Suzhou215123,Jiangsu,China)
To evaluate the tolerance of oriental river prawn (Macrobrachiumnipponense) to water pH variations,the survival rates of the oriental river prawn,at different water pH levels and time points after stress treatment,were examined.The molting rates of oriental river prawn,and the activities of immune-related and/or liver function enzymes at 96 h following treatment were also assayed.Results showed that,at 96 h following pH stress treatment,the survival rates of oriental river prawn at different water pH levels were significantly lower than control group.The molting rates at different water pH levels were significantly higher than control group,except for pH 7.0 group.The prawn survival rate from moderately acidic water (pH 6.0) was significantly lower than that from moderately alkaline water (pH 8.0) at 36 h,and also than that from severely alkaline water (pH 9.0) at 24 h.The lowest survival rate was always observed in severely acidic water (pH 5.0) at each time point.These results indicated that oriental river prawn survived better under alkaline than under acidic water conditions.By comparing the effects of different pH levels on the activities of liver function enzymes,it was found that T-SOD,ACP,GOT,and T-AOC enzymes exhibited relatively wide pH range tolerance,while AKP enzyme displayed relatively narrow range.The result of regression analysis between pH values and activities of those enzymes at 96 h showed that the optimum pH range for the prawn was between 7.3 and 7.6.
Macrobrachiumnipponense;pH stress;survival rate;liver function enzymes
2016-03-10;
2016-06-04
江苏省水产三新工程项目(Y2014-36)
付监贵(1991-),男,硕士研究生,专业方向为生态养殖与水生生物制品安全性。E-mail:927994442@qq.com
宋学宏。E-mail:songxh@suda.edu.cn
S966.12
A
1000-6907-(2016)05-0100-05
