杂交鳢(斑鳢♀×乌鳢♂)溃疡病病原菌的分离、鉴定及其防治中草药的筛选
2016-09-23金洁南宋长江黄晓声张学振
金洁南 ,宋长江 ,王 力 ,李 建 ,黄晓声 ,张学振
(1.华中农业大学水产学院,武汉 430070;2.中山市水产技术推广中心站,广东中山 528403)
杂交鳢(斑鳢♀×乌鳢♂)溃疡病病原菌的分离、鉴定及其防治中草药的筛选
金洁南1,宋长江2,王力1,李建1,黄晓声2,张学振1
(1.华中农业大学水产学院,武汉430070;2.中山市水产技术推广中心站,广东中山528403)
针对2014年发生在广东省中山市三角镇的杂交鳢(Channamaculate♀×Channaargus♂)溃疡病,开展了病原的分离鉴定和致病性研究、药物敏感性试验和中草药抑菌、杀菌试验。实验从杂交鳢脾脏中分离到一个菌株S8,该菌株为革兰氏阴性短杆菌,菌体直、两端钝圆。对该菌进行生理生化鉴定、16S rRNA和gyrB序列和系统发育分析结果表明,此致病菌株为温和气单胞菌(Aeromonassobria)。人工感染试验结果显示,当人工感染剂量大于1.0×107CFU/尾时,能引起杂交鳢100%发病死亡。抗菌药物敏感性试验表明,温和气单胞菌S8对阿米卡星、头孢拉啶等药物高度敏感,对头孢他啶、氨苄西林、复方新诺明等抗菌药物不敏感。应用二倍稀释法测定了18种中草药对温和气单胞菌S8的最小抑菌浓度和最小杀菌浓度,结果显示:石榴皮、五倍子、黄芩对温和气单胞菌S8的抑菌杀菌效果最佳,其次为山茱萸、地榆和芦荟。
杂交鳢(Channamaculate♀×Channaargus♂);溃疡病;温和气单胞菌(Aeromonassobria);中草药
杂交鳢由广东顺德地区率先培育,是以乌鳢(Channaargus)为父本,斑鳢(ChannaMaculata)为母本杂交繁育出的子一代杂交种,具有生长速度快、抗逆性强、产量高等杂交优势[1],其肌肉蛋白质氨基酸水平和物理特性均优于乌鳢[2]。据统计,我国杂交鳢年产量在10×104t以上,约占鳢科鱼类养殖量50%,在广东地区生鱼市场的占有率达90%,逐步取代乌鳢、斑鳢,成为鳢科鱼类主要养殖品种[3]。随着养殖密度的不断提高,杂交鳢疾病频繁暴发。溃疡病是杂交鳢养殖中常见的疾病,发病速度快、感染面积大,幸存个体因疤痕、畸形失去商品价值,给养殖户造成了巨大经济损失。国内关于溃疡病的报道集中在泥鳅(Misgurnusanguillicaudatus)、刺参(Stichopusjaponica)、黄颡鱼(Pelteobagrusfulvidraco)、大口黑鲈(Micropterussalmoides)、黄鳝(Monopterusalbus)等养殖品种[4-8],但关于杂交鳢溃疡病的研究开展较少,仅余银春等[9]和舒新华等[10]从皮肤溃烂的乌鳢中分离得到了一株嗜水气单胞菌(Aeromonas.hydrophila),其感染引起乌鳢造血功能障碍,导致患病个体死亡。本研究对杂交鳢溃疡病的病原菌进行了分离、鉴定,对分离菌株的致病性开展试验,并比较了18种中草药对该病原菌体外抑菌、杀菌实验,为该病的临床防治和诊断提供理论依据。
1 材料与方法
1.1材料
病鱼为150~250 g,于2014年3月采集自广东省中山市三角镇某养殖场。病鱼体表大面积溃烂,裸露肌肉坏死,腹部肿胀。健康杂交鳢购自广东省中山市三角镇某养殖场,体重75~100 g,暂养20 d确认健康无病后用于人工感染试验。
实验试剂:脑心浸液培养基(BHI)(美国BD公司)、细菌基因组DNA提取试剂盒(武汉鼎国生物技术有限公司)、细菌生化反应微量鉴定管和药物敏感试纸片(杭州微生物试剂有限公司)。中草药石榴皮(Punicagranatum)、五倍子(Gallnut)、黄芩(RadixScutellariae)、山茱萸(Fructuscorni)、地榆Radixsanguisorbae、芦荟(Aloe)、陈皮(Pericarpiumcitrireticulatae)、连翘(Fructusforsythiae)、苏木(Lignumsappan)、山楂(Fructuscrataegi)、艾叶(Foliumartemisiaeargyi)、板蓝根(Radixisatidis)、关黄柏(Cortexphellodendrichinsis)、虎杖(Rhizomapolygonicuspidati,)、苦参(Radixsophoraefiavescentis)、白芍(RadixPaeoniaeAlba)、大黄(Rheumofficinale)、茯苓(Poria)等均购自河北省保定市保康大药房。
1.2病原菌的分离、纯化
取患溃疡病的杂交鳢,用0.65%的无菌生理盐水冲洗体表,无菌操作取肝、脾、肾和体表溃疡组织,划线接种于BHI培养基上,28 ℃倒置培养24~36 h,选取形态一致的优势菌落,划线纯化。获得纯培养后,部分菌株4 ℃保存,用于开展实验;部分菌株,按照1∶1的体积量加入无菌30%甘油,混合均匀,-80 ℃长期保存备用。
1.3人工感染实验
杂交鳢饲养于半径0.4 m、高1.2 m鱼缸中,实验期间连续充气增氧,水温22~24 ℃,每天换水,不投饵。菌株接种于BHI液体培养基,28 ℃培养18 h,平板计数法计算菌液浓度,调整浓度至8.9×106、8.9×107、8.9×108CFU/mL。腹腔注射健康杂交鳢,每尾注射0.5 mL,同一浓度接种8尾,另设接种同批、同剂量无菌生理盐水的健康杂交鳢作为对照,隔离养殖于试验鱼缸中。连续观察15 d,记录试验鱼的发病、死亡情况,并对死亡鱼或濒死鱼进行病原菌再分离,观察再次分离菌株的形态和理化性质是否和原分离菌株一致,并再次进行人工感染试验。
1.4菌株形态观察及生理生化特性的测定
将纯化分离菌接种于BHI培养基中,28 ℃倒置培养24 h,观察细菌生长特性与菌落形态,通过革兰氏染色观察菌体形态特征。将纯培养细菌接种于微量生化反应管,进行理化特性检测。
1.5分离菌16S rRNA和gyrB基因序列测定及系统发育分析
取新鲜菌液,离心收集菌体,按照鼎国细菌基因组DNA提取试剂盒说明书提取细菌基因组DNA。16S rRNA基因的通用引物为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-TACGGCTACCTTGTTACGACTT-3′;gyrB基因引物为:F:5′-TCCGGCGGTCTGCACGGCGT-3′,R:5′-TTGTCCGGGTTGTACTCGTC-3′。16S rRNA基因PCR反应条件为:94 ℃预变性5 min;94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1.5 min,33个循环;72 ℃延伸10 min。gyrB基因PCR反应条件为:94 ℃预变性4 min;94 ℃变性30 s,53 ℃ 退火30 s,72 ℃延伸1 min,30个循环;72 ℃ 延伸10 min。10 μL的PCR反应体系组成均为:3.9 μL无菌双蒸水,5 μL 2×PCR Mix,上下游引物各0.3 μL,模板0.5 μL。PCR扩增产物进行1%的琼脂糖凝胶电泳检测,产物切胶回收后送武汉擎科伟业生物科技有限公司进行测序。基因序列在GenBank上进行Blast比对,利用MAGA 5.05软件构建NJ系统进化树,进行分析。
1.6药敏试验
采用常规琼脂扩散(K-B)法进行测定。制备平板,接种,然后将药敏纸片贴在普通营养琼脂平板上,35 ℃培养18~24 h后,测定抑菌圈直径,根据美国CLSI标准中药敏试验抑菌圈直径判定标准,判定药敏结果。
1.7抑菌中草药的筛选
18种中草药各取20 g用300 mL蒸馏水浸泡30 min后煎煮,沸后用文火煎煮30 min,16层纱布过滤,重复1次,合并所得药液,浓缩至20 mL,使其终浓度相当于原药1 g/mL,灭菌,4 ℃保存待用。菌株接种于BHI液体培养基中,28 ℃培养18 h,调整浓度至108CFU/mL。采用两倍稀释法进行最小抑菌浓度测定,取试管11支,编号1~11,每管加入1 mL培养基。取编号1试管,加入药液1 mL,混匀;从1号试管取1 mL混合液加入2号试管,依次进行梯度稀释,直至9号试管,1~9号试管药液浓度分别为500、250、125、62.5、31.25、15.63、7.81、3.91、1.95 mg/mL。1~10号试管分别接种100 μL菌液,11号不加菌液,28 ℃震荡培养24 h,观察实验结果。10号试管细菌生长,11号管细菌不生长,试验方为有效。无菌生长试管中的最低药液浓度即为最低抑菌浓度(MIC)。吸取各种药物的MIC和高于MIC浓度的各个梯度的试管中的培养物0.1 mL,涂平板,28 ℃培养2 d后观察有无菌落形成,无菌落形成的相应试管中的最低药物浓度即为该种药物对菌株的最小杀菌浓度(MBC)。
2 结果
2.1病原菌分离纯化与形态学特征
从患病杂交鳢肝脏、脾脏、溃疡中分别得到一株优势菌命名为:L9,S8,M7,肾脏中没有分离得到菌株。其在BHI平板上28℃培养24 h,形成灰白色、表面光滑、边缘整齐、半透明状微隆的圆形菌落。对细菌进行革兰氏染色,在10×100油镜下均可观察到革兰氏阴性短杆菌,菌体直、两端钝圆、单个或者成对存在(图1)。

图1 分离菌株革兰氏染色Fig.1 Micrograph of the isolated bacterial strain (10×100)
2.2人工感染试验结果
以分离得到的菌株感染杂交鳢,注射菌株S8的组别出现死亡,而对照组没有死亡(表1);对死亡的杂交鳢进行细菌学分离检测,结果检出与S8形态及理化特征相似的细菌。取再次分离的菌株进行人工感染得到了一致的感染结果。

表1 分离菌株的人工感染试验Tab.2 Animal challenged with the isolated bacterial strains
2.3病原菌的生理生化特性
根据分离菌的生理生化特性结果,按照《常见细菌系统鉴定手册》(东秀珠,蔡妙英,2001)和《伯杰氏细菌鉴定手册》(第八版)的标准,鉴定该致病菌为温和气单胞菌(Aeromonassobria)(表2)。

表2 分离菌的生理生化特性Tab.2 Biochemical characterization of the isolated bacterial strain
注:表中符号“+”表示阳性;“-”表示阴性;“d”种间不同反应
2.416S rRNA和gyrB基因序列和系统发育分析
S8菌株16S rRNA基因与gyrB基因PCR产物经1%凝胶电泳检测后,得到预期大小、单一的条带(图2),纯化后的PCR产物经测序后分别得到1 440 bp和1 048 bp的片段序列,序列提交至NCBI获得GenBank登录号分别为KT 036666、KT 036667。利用MAGA 5.0软件采用Neighbor-Joining法,构建系统进化树(图3)。根据16S rRNA基因序列系统发育树,菌株S8与温和气单胞菌KF761305.1亲缘关系最近,相似性达97%;由gyrB基因序列系统发育树可知,菌株S8与温和气单胞菌AB473090.1亲缘关系最近,相似性达100%;结合形态、生理生化特性,分离菌株S8鉴定为A.sobria。
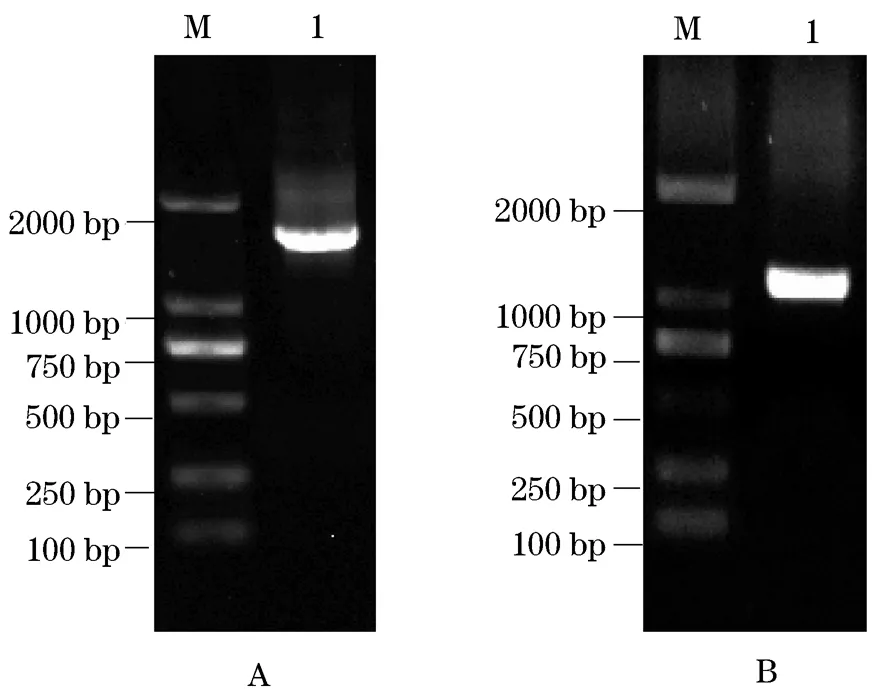
图2 分离菌株的16S rRNA (A)和gyrB (B)基因的 PCR扩增产物电泳图Fig.2 The electrophoresis production of the 16S rRNA gene (A) and gyrB gene (B) PCR amplification of the isolated bacterial strain M:DNA分子标准;1:PCR产物
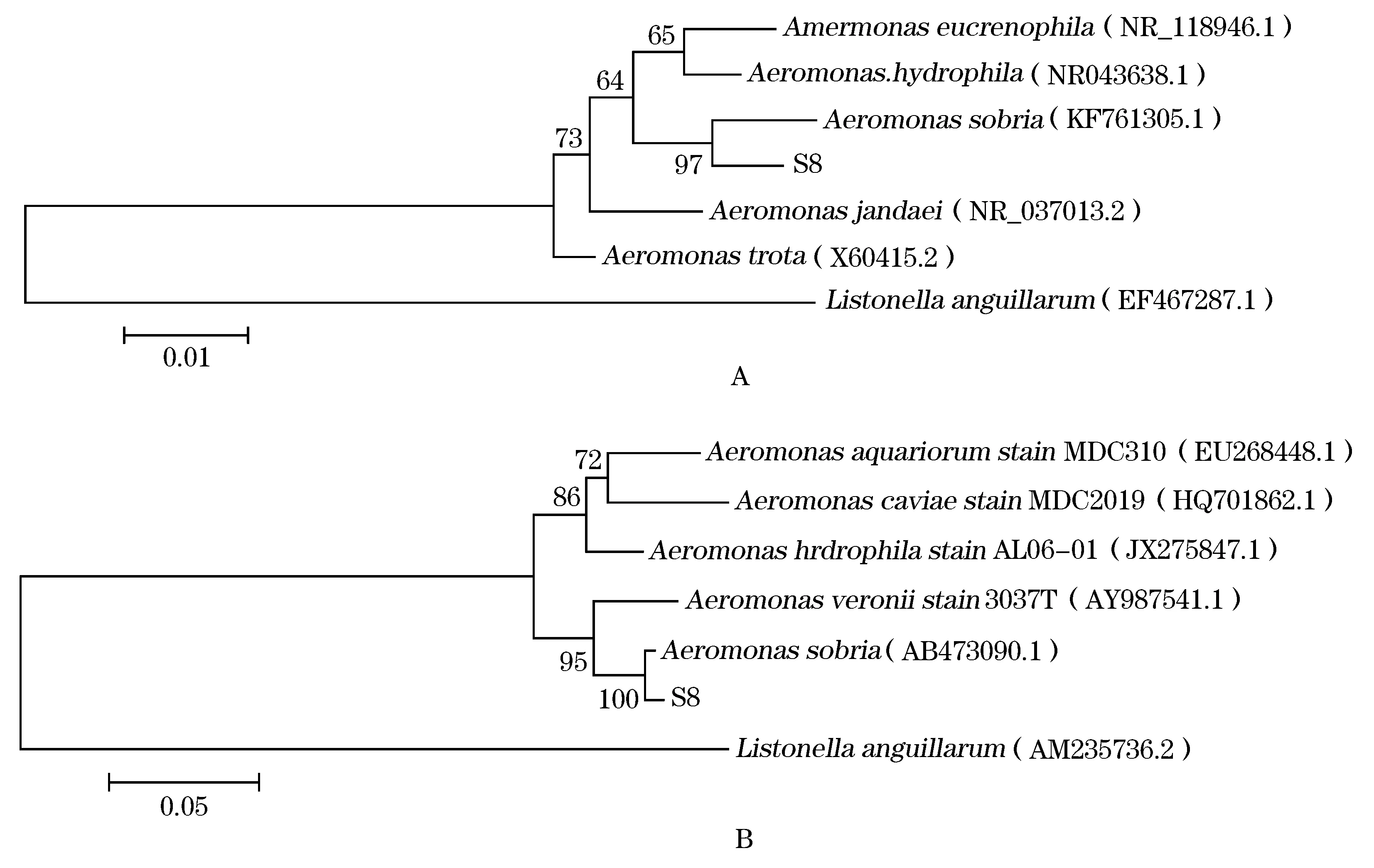
图3 分离菌株的16S rRNA基因序列(A)和gyrB基因序列(B)所构建的系统发育树Fig.3 Phylogenetic tree based on the 16S rRNA gene (A) and gyrB gene (B) of the isolated bacterial strain
2.5病原菌药敏性
采用常规琼脂扩散(K-B)法测定菌株S8对16种抗菌类药物的敏感性(表3)。结果表明:菌株S8对阿米卡星、头孢拉啶、左氟沙星、依诺沙星、诺氟沙星、氧氟沙星、四环素、呋喃妥因均高度敏感,对卡那霉素、链霉素、庆大霉素、新霉素、头孢曲松中度敏感,对头孢他啶、氨苄西林、复方新诺明耐药。
2.6抑菌中草药筛选结果
测定18种中草药对菌株S8的最低抑菌浓度和杀菌浓度,结果见表4。石榴皮、五倍子、黄芩对S8抑菌和杀菌效果最佳,MIC和MBC最低,分别为3.91 mg/mL和7.81 mg/mL;其次为山茱萸、地榆和芦荟,MIC和MBC分别为7.81 mg/mL和15.63 mg/mL;虎杖、白芍等对S8抑菌效果不佳。

表3 分离菌株的药敏特性Tab.3 The chemical susceptibility testing result of the isolated bacterial strain
注:表中符号“S”表示高度敏感;“I”表示中度敏感;“R”表示不敏感。
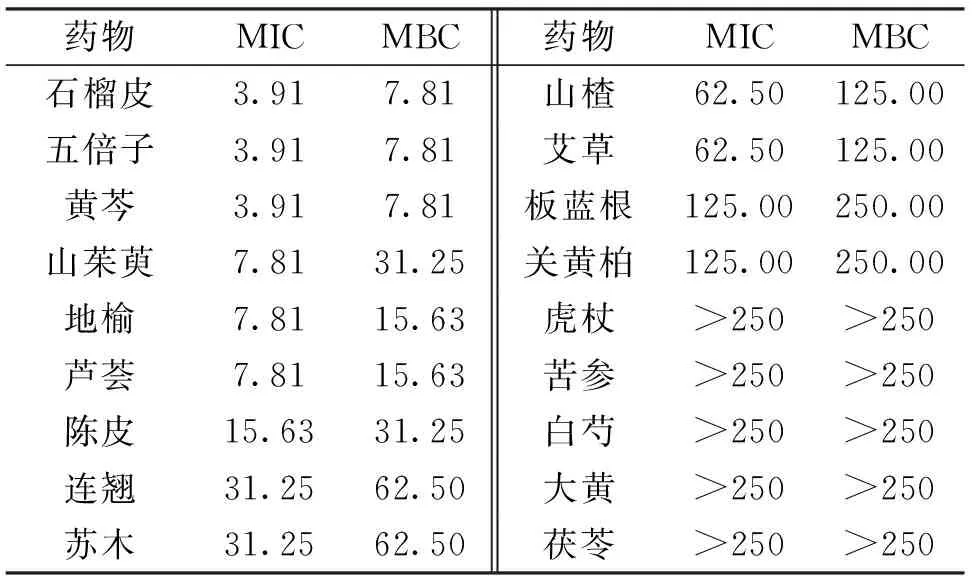
表4 18种中草药对分离菌株的最小抑菌浓度(MIC) 和最小杀菌浓度(MBC)Tab.4 The minimum inhibitory concentration (MIC) and minimal bactericidal concentration (MBC) of 18 kinds of Chinese herbal medicine to the isolated bacterial strain /(mg/mL)
3 讨论
鱼类溃疡病是一种全球流行的疾病,1971—1980年,在澳大利亚、亚太地区和北美地区等地迅速扩散[11-12],在亚洲的马来西亚、泰国、中国、印度等多个国家广泛传播[13]。温和气单胞菌广泛分布在自然界的水、土壤以及人和动物的粪便中,是一种人畜共患病原菌[14],能引起鱼类大规模的死亡。国内学者已证明温和气单胞菌能够引起黄鳝[8]、黄颡鱼[15]、黄沙鳖(Truogxsinensis)[16]、鲟(Sturgeon)[17]、鲤(Cyprinuscarpio)[18]、似鲇高原鳅(Triplophysasiluroides)[19]、泥鳅[20]、罗非鱼(Oreochromismossambicus)[21]等体表溃疡,但关于杂交鳢溃疡病的病原菌还未见报道。本实验从患病杂交鳢体内分离到一株致病菌,人工感染发现高剂量组杂交鳢全部死亡,通过形态学特征、生理生化特性和16S rRNA基因、gyrB基因系统进化树分析,确认该菌株为A.sobria,这是国内首次报道从患病杂交鳢中分离得到温和气单胞菌。
抗菌类药物在水产动物疾病的防治中有着重要的作用,药敏试验发现,A.sobria对诺氟沙新、依诺沙星、阿米卡星等8种药物高度敏感,对链霉素等5种药物中度敏感,对复方新诺明等3种药物耐药,与泥鳅[4]、黄颡鱼[6]、黄鳝[8]等患病个体中分离鉴定的A.sobria在药敏感性上略有差异,这可能与生产中各养殖场用药习惯不同等有关。抗生素的大量使用容易导致细菌耐药性的形成,在养殖过程中选择用药必须谨慎,必须建立在实验室细菌分离鉴定和药敏试验结果的基础上,针对性用药,要实行多种药物交叉使用,避免产生耐药性或抗药性。
天然中草药具有无毒、无残留、无污染等优势,近几年广泛应用于水产疾病防治[22-25]。本实验研究18种中草药对杂交鳢源温和气单胞菌的体外抑菌、杀菌效果,发现石榴皮、五倍子和黄芩效果最佳,MIC均为3.91 mg/mL,MBC均为7.81 mg/mL,与梁利国等[26]报道结果基本一致。彭金菊等[27]研究了30种中药的提取液对温和气单胞菌的抑制效果,五倍子水煎煮液抑菌效果最佳,MIC也为6.25 mg/mL,与本实验结果有所出入,可能与中草药质量及温和气单胞菌菌株间差异有关。五倍子、黄芩和石榴皮对温和气单胞菌具有较好的抑菌、杀菌效果,可能与这三种药物自身的特性有关。五倍子主要化学成分包括鞣质、没食子酸、五倍子油等[28],我国药典上收载的五倍子鞣质,称为鞣酸,又叫单宁酸,含量可达70%以上[29]。黄芩不仅具有清热解毒,能够抑制或杀灭细菌和病毒等致病原,具有较广的抗菌谱,还具有抗炎、抑制变态反应、降脂利胆保肝、抗氧化、抗肿瘤等多种功效[30],其化学成分主要为黄酮类化合物[31],包括黄芩甙、黄芩素等,其中黄芩苷具有多种药理作用,很大程度上取决了黄芩的功效,是黄芩的主要活性成分。石榴皮是石榴的干燥果皮,含有氨基酸、糖及其苷类、酚类和鞣质、黄酮类等化学成分[32],鞣质和生物碱是其主要的化学活性成分,研究表明石榴皮水提取物中的蹂质是一种具有沉淀蛋白质特性的水溶性多元酚类化合物,具有抗Ⅱ型单纯疱疹病毒的功效[33]。在实际生产应用上,中药往往以多种药物配伍的复方形式使用,下一步研究将对复方中草药对杂交鳢源温和气单胞菌的抑菌、杀菌效果进行验证。
[1]刘苏,朱新平,陈昆慈,等.斑鳢、乌鳢及其杂交种形态差异分析[J].华中农业大学学报,2011,30(4):488-493.
[2]邹礼根,冯晓宇,王宇希,等.杂交鳢(斑鳢♀×乌鳢♂)与乌鳢肌肉品质比较研究[J].上海海洋大学学报,2011,20(2):303-307.
[3]张岚岚,白俊杰.我国主要鱼类杂交种及其养殖状况[J].海洋渔业,2014,36(5):475-480.
[4]姚东瑞,邴旭文,朱明,等.泥鳅(Misgurnusanguillicaudatus)病原温和气单胞菌(Aeromonassobria)分子鉴定及耐药性研究[J].海洋与湖沼,2010,41(5):756-762.
[5]Liu H Z,Zheng F R,Sun X Q,et al.Identification of the pathogens associated with skin ulceration and peristome tumescence in cultured sea cucumbersApostichopusjaponicus (Selenka)[J].J Invertebr Pathol,2010,105(3):236-242.
[6]黄钧,温华成,施金谷,等.黄颡鱼体表溃疡病病原菌分离鉴定及药敏试验[J].南方农业学报,2012,43(1):107-112.
[7]邓国成,谢骏,李胜杰,等.大口黑鲈病毒性溃疡病病原的分离和鉴定[J].水产学报,2009,33(5):871-877.
[8]任红梅,何智,杨德英,等.黄鳝体表溃疡病病原菌的分离与鉴定[J].水生生物学报,2010,34(6):1106-1112.
[9]余银春,王锡波,彭程远,等.养殖乌鳢皮肤溃烂病的病原及血液病理研究[J].淡水渔业,2014,44(4):73-76.
[10]舒新华,曾慷,金燮理,等.乌鳢腐皮病病理形态学研究[J].淡水渔业,1999,29(8):8-10.
[11]Egusa S,Masuda N.A new fungal ofPlecoglossusaltivelis[J].Fish Pathol,1971,6(1):41-46.
[12]McKenzie R A,Hall W T K.Dermal ulceration of mullet (Mugilcephalus)[J].Aust Vet J,1976,52(5):230-231.
[13]John K R,George M R.Viruses associated with epizootic ulcerative syndrome:An update[J].Indian J Virol,2012,23(2):106-113.
[14]Tanoue N,Takahashi A,Okamoto K,et al.A pore-forming toxin produced byAeromonassobriaactivates cAMP-dependent Cl-secretory pathways to cause diarrhea[J].FEMS Microbiol Lett,2005,242(2):195-201.
[15]陈铭.黄颡鱼温和气单胞菌的特性研究及溶血素基因的克隆与表达[D].重庆:西南大学,2009.
[16]农新闻,黄艳华,龙苏,等.黄沙鳖致病性温和气单胞菌的分离鉴定及其毒力基因检测[J].南方农业学报,2015,46(7):1322-1328.
[17]肖艳翼,王斌,夏永涛,等.鲟病原性温和气单胞菌的分离鉴定及药敏试验[J].南方农业学报,2015,46(10):1909-1914.
[18]刘敏,韩英.鲤鱼温和气单胞菌的分离鉴定和药敏试验[J].东北农业大学学报,2005,36(4):486-489.
[19]徐敬钧,耿毅,汪开毓,等.似鲶高原鳅温和气单胞菌的分离鉴定及其感染的病理损伤[J].四川动物,2014,33(5):708-714.
[20]张晓君,邴旭文,姚东瑞,等.泥鳅溃疡病及病原温和气单胞菌生物学及分子特征研究[J].水产科学,2010,29(12):696-702.
[21]Li Y,Cai S H.Identification and pathogenicity ofAeromonassobriaon tail-rot disease in juvenile tilapiaOreochromisniloticus[J].Curr Microbiol,2011,62(2):623-627.
[22]张彬,黄婷,陈福艳,等.10种中草药及4种组方对罗非鱼致病性海豚链球菌体外抑菌试验[J].淡水渔业,2011,41(5):35-39.
[23]罗新,张其中.42种中草药对嗜水气单胞菌的体外抑菌试验[J].淡水渔业,2011,41(3):61-65.
[24]刘宏伟.养殖鳗鲡主要病原菌中草药复方的筛选[D].厦门:集美大学,2008.
[25]卢静,王振宁,陈锐,等.几种中药单体和抗生素对嗜水气单胞菌及温和气单胞菌的体外抑菌活性研究[J].水生生物学报,2013,37(6):1128-1132.
[26]梁利国,邴旭文,张晓君,等.18种中草药煎液对温和气单胞菌的抑、杀菌效果[J].淡水渔业,2010,40(1):66-69.
[27]彭金菊,马驿,梁淑鋅,等.30种中药及其复方对温和气单胞菌的抗菌作用[J].广东海洋大学学报,2009,29(6):42-45.
[28]李秀萍,李春远,渠桂荣,等.五倍子的研究概况[J].中医药学报,2002,30(3):72-74.
[29]傅春升,殷佳,朱青.五倍子的临床应用[J].中国药业,2000,9(6):28-29.
[30]王娜.中药黄芪、黄芩有效成分的体外抑菌作用研究[D].秦皇岛:燕山大学,2009.
[31]刘英学.黄芩的化学成分研究[D].沈阳:沈阳药科大学,2008.
[32]帕丽达阿布力孜,张笑颖,海里茜,等.新疆石榴皮和石榴籽化学成分预试验[J].海峡药学,2007,19(1):52-53.
[33]张杰,詹炳炎,姚学军,等.中药石榴皮鞣质成分抗生殖器疱疹病毒作用[J].中国中药杂志,1995,20(9):556-558.
(责任编辑:邓薇)
Isolation and identification of Aeromonas sobria S8 from hybrid snakehead (Channa maculate♀×Channa argus♂) with ulcerative disease and screening of Chinese herbal medicine for prevention and treatment
JIN Jie-nan1,SONG Chang-jiang2,WANG Li1,LI Jian1,HUANG Xiao-sheng2,ZHANG Xue-zhen1
(1.CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China;2.FisheriesTechnicalExtensionCenterofZhongshanCity,Zhongshan528403,Guangdong,China)
In 2014,ulcer disease incident occurred in a hybrid snakehead (Channamaculate♀×Channaargus♂) farm located in Zhongshan,Guangdong Province.A bacterial strain named S8 was isolated from the spleen of infected hybrid snakehead.The results of artificial infection test showed that dosage over 1.0×107CFU would cause 100% mortality of hybrid snakehead.The strain was gram-negative short bacilli,with a straight body and blunt ends.The artificial infection test,physiological and biochemical analysis,16S rRNA andgyrB genes sequence and phylogenetic analysis all showed that the strain belonged toAeromonassobria.Drug sensitivity test showed that S8 was highly sensitive toamikacinandcephradine,and was not sensitive toceftazidime,ampicillinandcotrimoxazole.The minimal inhibitory concentration and minimum bactericidal concentration of the 18 kinds of Chinese herb against S8 were determined by tube double dilution method.The results suggested that the best inhibitory and bactericidal effects were obtained byPunicagranatum,GallnutandRadixScutellariae,followed byFructusCorni,RadixSanguisorbaeandAloe.
hybrid snakehead (Channamaculate♀×Channa argus♂);ulcerative disease;Aeromonassobria; Chinese herbal medicine
2016-02-02;
2016-04-02
中山市水产技术推广中心站项目
金洁南(1991-),女,硕士研究生,专业方向为水产动物病害防治研究。E-mail:jjn911014@163.com
张学振。E-mail:xuezhen@mail.hzau.edu.cn
S943.199
A
1000-6907-(2016)05-0049-06
