黄鳝源嗜水气单胞菌DB01分离鉴定及药敏特性研究
2016-09-23杨移斌刘永涛杨秋红艾晓辉
杨移斌,董 靖,胥 宁,刘永涛,杨秋红,艾晓辉
(中国水产科学研究院长江水产研究所,淡水水产健康养殖湖北省协同创新中心,武汉 430223)
黄鳝源嗜水气单胞菌DB01分离鉴定及药敏特性研究
杨移斌,董靖,胥宁,刘永涛,杨秋红,艾晓辉
(中国水产科学研究院长江水产研究所,淡水水产健康养殖湖北省协同创新中心,武汉430223)
从患病的黄鳝(Monopterusalbus)体内分离到一株致病菌株DB01,对该菌株进行人工感染、生理生化鉴定及16S rDNA序列分析。结果显示:人工感染黄鳝出现与自然发病相同的症状,表明菌株DB01为发病黄鳝的病原菌。菌株DB01为革兰氏阴性杆菌,无芽孢和荚膜,在兔血平板上能形成明显的β-溶血。序列分析显示,菌株DB01与嗜水气单胞菌(Aeromonashydrophila)的同源性达99%。药敏试验结果显示,菌株DB01对诺氟沙星、左氧氟沙星、阿奇霉素及氟苯尼考等抗生素高度敏感,五倍子、黄柏、地榆及乌梅等中草药对菌株DB01抑菌作用强。
嗜水气单胞菌(Aeromonashydrophila);黄鳝(Monopterusalbus);药敏特性
黄鳝(Monopterusalbus)又名鳝鱼,属合鳃目(Synbranchiformes)合鳃科(Synbranchidae)黄鳝属,是我国重要的淡水经济鱼类[1]。黄鳝营养丰富,可食率较高,味道好,深受广大消费者的喜爱。为满足市场需求,养殖场加大养殖密度,提升养殖规模,形成了大规模高密度集约化的养殖态势[2]。高密度养殖导致黄鳝养殖环境急剧恶化,在养殖过程中常暴发大规模疾病[3-6],给养殖户造成较大经济损失。本研究针对安徽一黄鳝养殖场暴发的大规模鳝鱼死亡病例开展调查,通过现场诊断,采取病原分离纯化,人工感染及各种鉴定手段,确定了疾病病原菌种类,并研究了其药物敏感特性,以期丰富黄鳝疾病理论知识,供同行参考。
1 材料与方法
1.1材料
1.1.1实验材料
取安徽某特种水产养殖场具有典型出血症状濒临死亡的黄鳝,共10尾;人工感染用鱼亦取自该养殖场,共100尾,体重(20±5)g,健康活力强,无病无伤,暂养7 d后无异样后进行感染试验。
1.1.2实验试剂
营养肉汤、营养琼脂、水解酪蛋白、TSA、兔血营养琼脂平板等培养基购于北京路桥生物技术公司;细菌生化微量鉴定管购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒、PCR扩增细菌16S rDNA试剂盒,TaqDNA聚合酶均购自上海生工生物工程技术服务有限公司;药敏纸片购自杭州微生物试剂有限公司;革兰染料购自杭州微生物试剂有限公司;中草药购自上海中医大药房。
1.1.3主要仪器
恒温培养箱,冰箱,高压蒸汽灭菌锅,摇床,PCR仪,核酸电泳仪,显微镜,无菌操作台,恒温水浴锅,电子炉。
1.2方法
1.2.1临床诊断
疾病临床诊断针对安徽某特种水产养殖场发病情况进行调查,重点了解其发病的水质、水温及其他养殖环境情况;掌握黄鳝发病的典型症状及其活力,发病鳝鱼重量规格等,确定其发病率及死亡率;取具有此疾病典型症状的濒临死亡的黄鳝保存备用。
1.2.2病原菌分离
病原菌分离纯化在无菌状态下选取具有典型发病症状濒死的鳝鱼进行解剖观察,取鳝鱼肝脏、肾脏及少量血水,分别划线于普通营养琼脂平板上,置于恒温培养箱中28 ℃下培养18 h后,选择形态大小颜色基本一致,优势度很大的单个菌落再进行划线纯化,最后将分离纯化好的菌株置于4 ℃条件下备用。
1.2.3人工感染
人工感染将已分离纯化到的菌株接种于营养琼脂平板上,置于28 ℃培养18 h后,使用麦氏比浊法加无菌生理盐水调整菌株浓度,使得菌株最终浓度为5.5×107CFU/mL。
取暂养7 d后无异样的健康黄鳝100尾,平均分为ABCD四个组,其中A、B两组为试验组,C、D两组为对照组。试验组采取腹腔注射法,每尾鳝鱼注射0.2 mL的分离菌株;对照组注射等量的无菌生理盐水。在整个感染试验期间,保持持续溶氧供给,水温保持在24~26 ℃,保证良好的水质条件。定期观察试验用黄鳝的动态,对其可能的状态进行记录,并及时对濒临死亡的鳝鱼进行解剖观察及病原菌再分离。
1.2.4生理生化鉴定
将分离已纯化的菌株接种于普通营养琼脂平板及兔血平板上,置于28 ℃条件下培养18 h后观察菌落的大小、形态、颜色及是否有溶血等特点。并展开革兰氏染色,其他各项生理生化指标的测定参照文献[7]进行。
1.2.5病原菌16S rDNA序列分析
(1)PCR模板的制备:分离菌株使用营养肉汤培养基28 ℃培养18h后,12 000 r/min离心收集菌体,按细菌基因组DNA提取试剂盒说明书提取细菌总DNA,作为PCR的模板DNA。
(2)16S rDNA基因系列的扩增与测序:用于16S rDNA的PCR反应的引物由上海生工生物工程技术服务有限公司合成。
正向引物为27F:5′-AGAGTTTGATC (C/A)TGGCTCAG-3′(对应于E.coli的16S rRNA基因的第8~27 bp位置)。
反向引物1492R:5′-GGTTACCTTGTTACGA-CTT-3′(对应于E.coli的16S rRNA基因的第1492~1510 bp位置)。
PCR反应条件为:95 ℃变性3 min,94 ℃平衡35 s,55 ℃退火35 s,72℃延伸1 min,此阶段35个循环,72 ℃温育10 min。经PCR扩增后的产物进行1.0%的琼脂糖凝胶电泳检测以证明PCR 扩增得到的片段是否是目的片段后,将PCR的最终产物送上海生工生物工程技术服务有限公司进行纯化和序列测定。
(3)构建系统发育树:将分离菌株的16S rDNA序列用运用NCBI数据库中细菌的16S rDNA进行比对,从中选取数株与该株菌基因序列相似的菌株,采用Clustal w软件进行多序列匹配分析[8],用MEGA4.0软件包中的Neighbor-Joining法构建系统进化树[9],通过1 000次Bootstrap检验置信度。
1.2.6药物敏感特性研究
将购买的中草药用FW177粉碎机粉碎后充分烘干,称取中草药20 g,加300 mL蒸馏水,充分浸泡后开始煎熬,沸腾后文火煮20 min,过滤出滤液后继续煎煮,共3次,合并所得药液浓缩成浓度为1 g/mL[10],置于4 ℃条件下备用。使用6 mm打孔器将灭菌滤纸制成圆形纸片,分别浸入药液中,形成药敏纸片。
分离菌株药物敏感性试验通过使用通用的K-B法展开,将分离纯化菌株接种于营养琼脂肉汤培养基内28 ℃震荡培养18 h,使用涂布法取培养好的菌液200 μL涂布于水解酪蛋白琼脂平板上。分别把抗生素及中草药水提物的药敏纸片均匀贴于平板,每个平板贴5片,置28 ℃下培养24 h后测量抑菌圈直径。抗生素敏感程度根据杭州微生物试剂有限公司生产说明判定,中草药敏感程度根据文献[11]判定。
2 结果
2.1临床诊断结果
2013年6月安徽某特种水产养殖场暴发了一例严重疾病,引起了鳝鱼的大量死亡,笔者通过实地临床诊断,发现濒临死亡的鳝鱼外观呈现粘液增多,体表暗淡无光,体表无明细症状,生殖孔有血水流出;解剖发现体内腹腔中有大量血水,肝脏肾脏出现不同程度充血,体壁有出血点,肠道无食物,显微观察未发现寄生虫等微生物。发病较快,死亡率较高,引起了较大的经济损失。发病时水质情况较差,氨氮偏高,但不足以致病,水色呈现暗黑色,水温很高。
2.2病原菌分离纯化
在无菌条件下,取10尾具有典型出血症状的濒临死亡的鳝鱼的肝脏、肾脏及少量血水划线于普通营养琼脂平板上,经28℃恒温培养18 h后,获得一株优势度较高的菌株,编号DB01。分离纯化菌株在普通营养琼脂平板上生长良好。
2.3人工感染结果
试验A、B两组感染用鳝鱼在注射分离菌株12 h后出现躁动不安,疯狂游动等行为,生殖孔随即有红色液体流出,之后开始出现死亡,36 h内试验A、B组死亡率分别达到80%及85%,而对照C、D组则未出现异样。对濒临死亡的感染用鳝鱼解剖观察发现,其腹腔有大量的血水淤积,肝脏肾脏严重充血发黑,体壁有大量的出血点,表现出与自然发病类似症状,经过细菌再分离纯化及鉴定,得到与原始分离菌株DB01一致的菌株,表明分离菌株DB01为黄鳝此疾病的病原菌。
2.4病原菌生理生化反应特性
分离菌株DB01经革兰氏染色后观察确定为阴性菌,无芽胞与荚膜,在兔血营养琼脂平板能产生β-溶血,分离菌株部分生理生化特征见表1。

表1 DB01菌株部分生理生化特征Tab.1 Physiological and biochemical characteristics of DB01
注:“+”表示阳性,“-”表示阴性,“(+)”表示阳性反应超过24 h,“(-)”表示阴性反应超过24h,“d”表示11%~89%菌株为阳性。
2.5病原菌16S rDNA序列及系统发育分析
分离菌株DB01的16S rDNA基因片段经PCR扩增及测序后结果其大小为1 418 bp,将测序结果在NCBI中进行同源性比较,发现菌株DB01的16S rDNA基因片段与已经收录的嗜水气单胞菌(Aeromonashydrophila)同源性最高,均达到99%。通过Neighbor-Joining方法构建了系统发育树,发现分离菌株DB01与嗜水气单胞菌聚为一支(图1),因此判定分离菌株DB01为嗜水气单胞菌。
2.6药敏特性
由表2可知,菌株DB01对诺氟沙星、左氧氟沙星、阿奇霉素及氟苯尼考等13种抗生素高度敏感,对链霉素中度敏感,对万古霉素、多黏霉素B、麦迪霉素等7种抗生素不敏感;由表3可得出,五倍子、黄柏、地榆及乌梅等对菌株DB01抑菌作用强。在养殖生产过程中采用药物拌饵投喂方式进行疾病防控,发病时交替使用氟苯尼考、诺氟沙星等进行治疗,并同时在养殖过程中拌饵投喂黄柏、地榆等进行疾病预防,取得了较好的效果。
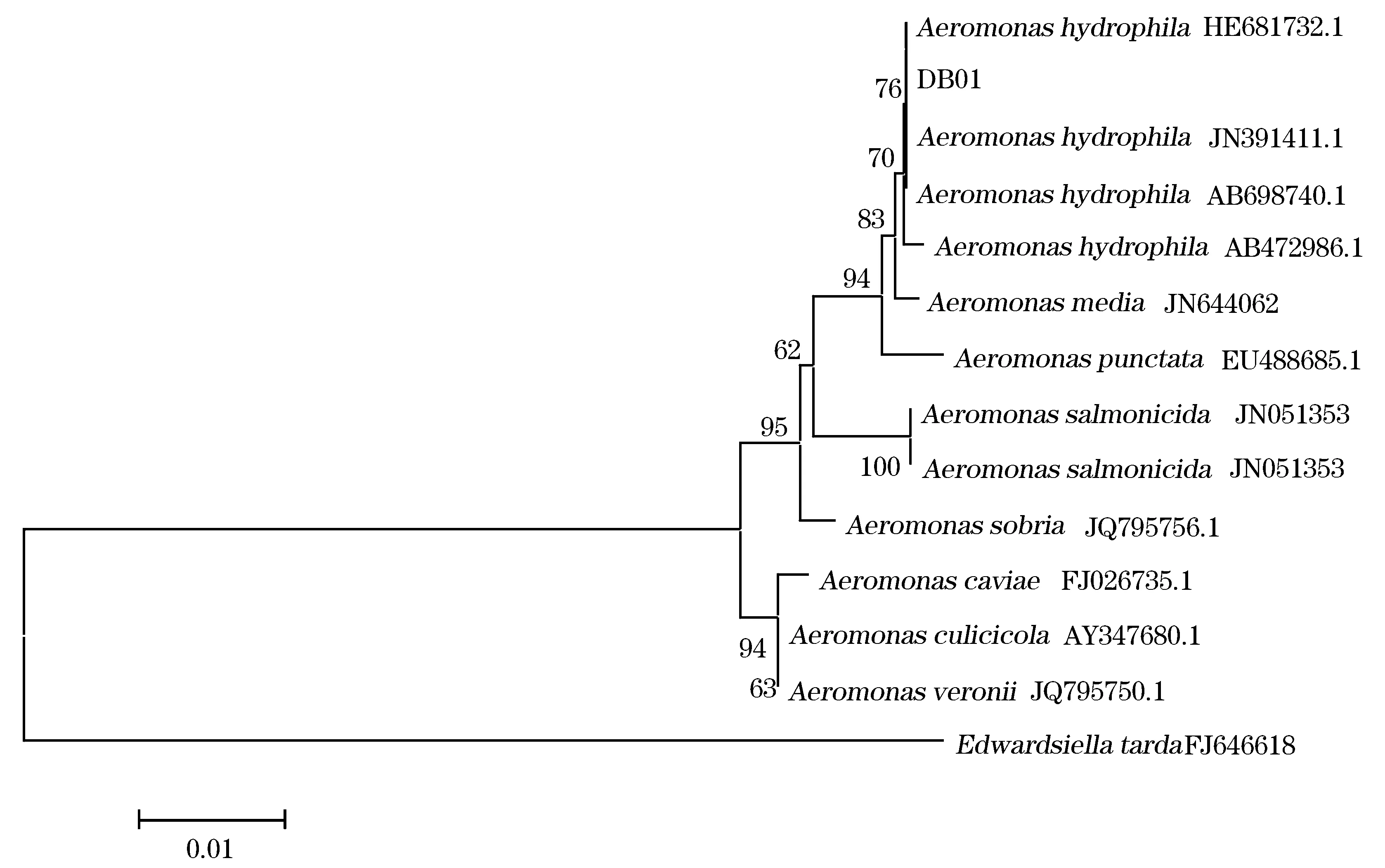
图1 根据16S rDNA基因序列同源性构建的系统发育树Fig.1 The phylogenetic tree based on 16S rDNA sequence homolog表2 DB01药敏试验结果Tab.2 Antibiotic sensitivity test of strain DB01

表3 中草药提取液对病原菌的抑菌效果Tab.3 Antibacterial activity of Chinese herbs on pathogenic bacteria
注:抑菌圈直径小于 10 mm 为无抑菌作用,用“-”表 示 ; 10~15 mm 为 抑 菌 作用弱,用“+”表示;15~20 mm 表示抑菌作用中等,用“++”表示;大于 20 mm 表示抑菌作用强,用“+++”表示。
3 讨论
嗜水气单胞菌大部分自然水域广泛存在[12],目前普遍认为其具有很强的致病性,能导致大部分水产养殖动物死亡,关于嗜水气单胞菌致病的报道很多,如嗜水气单胞菌可引起淡水鱼细菌性败血症,蛙类的红腿病,中华鳖的红脖子病、红底斑病、穿孔病、腐皮病等[13-14],常给水产养殖业带来巨大的经济损失。嗜水气单胞菌引起黄鳝发病死亡病例正在增多,陈怀青等[15]、周飞等[5]分别报到了江苏及四川黄鳝主养区嗜水气单胞菌致病实例,并开展了相关的药物敏感试验研究。但从药敏试验结果来看,不同地区分离的嗜水气单胞菌敏感程度不尽相同,究其原因很可能是因抗生素大量使用导致了耐药菌株的产生,为此警示一旦发现此类病原菌致病应及时进行药物敏感试验,以找到有效的抗生素进行应急治疗,最大程度减少经济损失。
本研究从安徽某特种水产养殖场分离纯化到一株优势度很高的细菌DB01,经过人感染后确定该菌株具有很强的致病性,经过生理生化鉴定、16S rDNA基因测序及系统发育分析,确定该高致病菌株为嗜水气单胞菌。对分离纯化到的病原菌展开药物敏感试验,通过K-B法研究了菌株DB01对22种抗生素及26种中草药的敏感程度,结果发现分离菌株对诺氟沙星、左氧氟沙星、阿奇霉素及氟苯尼考等抗生素高度敏感,五倍子、黄柏、地榆及乌梅等中草药对菌株DB01抑菌作用强。研究结果表明分离到的嗜水气单胞菌对一些常用药物产生耐药性,为此进行疾病防治时选择高度敏感药物轮换使用,并且尽可能防止滥用。
[1]王方雨,张世萍.黄鳝生物学研究进展[J].水利渔业,2004,24(6):1-3.
[2]凌天慧,盛竞,徐福南,等.黄鳝出血病的病理学研究[J].水产科技情报,1991,18(3):81-83.
[3]任红梅,何智,杨德英,等.黄鳝体表溃疡病病原菌的分离与鉴定[J].水生生物学报,2010,34(6):1106-1112.
[4]彭彬,杨光友,陈晓利,等.黄鳝藤黄微球菌的分离鉴定及药敏试验[J].上海海洋大学学报,2011,20(3):405-411.
[5]周飞,刘娟,黎德兵.黄鳝嗜水气单胞菌的分离鉴定及中药体外抑菌效果研究[J].中国畜牧兽医,2010,37(2):135-137.
[6]沈锦玉,刘问,钱冬,等.养殖黄鳝“出血病”病原的研究[J].浙江海洋学院学报(自然科学版),2001,20(2):120-122.
[7]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[8]Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTAL_X windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997,25(24):4876-4882.
[9]Saitou N,Nei M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4(4):406-425.
[10]肖辉,苏振霞,单娟娟,等.16种中草药提取物对嗜水气单胞菌的体外抑菌实验[J].水生态学杂志,2009,2(3):53-56.
[11]陈霞,张其中,李春涛.50种中草药体外抑杀嗜水气单胞菌的药效研究[J].中国预防兽医学报,2011,33(11):862-865.
[12]Daskalov H.The importance ofAeromonashydrophilain food safety[J].Food Control,2006,17(6):474-483.
[13]黄琪琰.水产动物疾病学[M].上海:上海科学技术出版社,2004:103-139.
[14]陆承平.致病性嗜水气单胞菌及其所致鱼病综述[J].水产学报,1992,16(3):282-288.
[15]陈怀青,陆承平.嗜水气单胞菌:黄鳝出血性败血症的病原[J].中国人兽共患病杂志,1991,7(4):21-23.
(责任编辑:邓薇)
Isolation and identification of Aeromonas hydrophila DB01 from Monopterus albus and its antibiotic sensitivity
YANG Yi-bin,DONG Jing,XU Ning,LIU Yong-tao,YANG Qiu-hong,AI Xiao-hui
(HubeiFreshwaterAquacultureCollaborativeInnovationCenter/YangtzeRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Wuhan430223,China;)
A pathogenic bacteria strain DB01 was isolated fromMonopterusalbussuffering diseases,and the strain expressed high pathogenicity.After artificial infection,physiological and biochemical identification and 16S rDNA sequence analysis,it was showed that tested fish had similar symptoms with that of natural infection,and the strain DB01 was the pathogen of theMonopterusalbusdisease.Strain DB01 was gram negative and no spore and capsule and it had β-hemolytic activity in rabbit blood agar.Sequence analysis showed that strain DB01 was identified asAeromonashydrophilawith 99% homology.Drug susceptibility test results showed that strain DB01 was highly sensitive to norfloxacin,levofloxacin,azithromycin,florfenicol,Rhuschinensis,Phellodendronchinense,SanguisorbaoffieinaliandPrunusmume.
Aeromonashydrophila;Monopterusalbus;antibiotic sensitivity
2015-11-03;
2016-04-01
公益性行业(农业)科研专项(201203085)
杨移斌(1988-),男,实习研究员,主要从事水生动物病害临床诊断及其防控技术研究。E-mail:yangyb1988@126.com
艾晓辉。E-mail:aixh@yfi.ac.cn
S943.131
A
1000-6907-(2016)05-0043-06
