探讨长期酒精暴露对视网膜的损伤
2016-09-23杨海霞张洪亮赵国强
杨海霞 张洪亮 吴 睿 赵国强
1)河南新密市郑州新华医院 新密 452370 2)河南省省直第二医院 郑州 450003 3)郑州大学第二附属医院 郑州 450014 4)郑州大学基础医学院 郑州 450001
探讨长期酒精暴露对视网膜的损伤
杨海霞1)张洪亮2)吴睿3)赵国强4)
1)河南新密市郑州新华医院新密4523702)河南省省直第二医院郑州 4500033)郑州大学第二附属医院郑州4500144)郑州大学基础医学院郑州450001
目的探讨患者长期酒精暴露对视网膜的损伤。方法选取野生型(wild type,WT)小鼠27只,酒精暴露建立动物模型,利用荧光抗体染色法观察视网膜胶质细胞的变化。结果长期酒精暴露后,小鼠视网膜胶质细胞出现损伤,如Müller细胞GS染色减弱、星形胶质细胞数量减少,并且呈剂量依赖性(P< 0.05)。结论长期酒精暴露可通过改变视网膜的胶质细胞Müller细胞和星形胶质细胞的数量和形态对视网膜造成损伤,且呈剂量依赖性。
酒精暴露;视网膜;胶质细胞;荧光抗体染色法
哺乳动物的中枢神经系统中,视网膜内含有丰富的谷氨酸,在生理情况下,它传递神经信号,是一种神经递质。正常情况下,视网膜细胞间质中的谷氨酸浓度较高,通过神经胶质细胞膜上的谷氨酸转运体转进入细胞内,经由谷氨酰胺合成酶(glutamine synthetase,GS)转化为谷氨酰胺,而使其毒性作用大大减弱或消失,从而保护神经节细胞免受谷氨酸的毒性损害作用。一些病理情况下,如眼外伤、高眼压、糖尿病等,视网膜内谷氨酸浓度异常升高,过度刺激神经节细胞表面的谷氨酸受体,从而进一步通过胞内信号传导通路,导致细胞膜内的钙离子通道开放,细胞内的钙离子升高超载,引起兴奋性的毒性作用,从而导致视网膜神经节细胞死亡及视网膜功能障碍。
在视网膜内,神经胶质细胞Müller细胞的作用非常重要,它维持视网膜内谷氨酸的平衡,进一步保护视网膜的神经节细胞,免受谷氨酸的兴奋性毒性作用;视网膜内的星形胶质细胞参与血-视网膜屏障的形成,是神经元同血管细胞之间的桥梁,也发挥着对神经元细胞活动的调节作用,另外还对一些大分子物质在胶质细胞间的扩散进行调节,且具有神经元营养保护作用。长期酒精暴露是否对视网膜Müller细胞和星形胶质细胞产生损伤,目前无明确报道。本研究探讨酒精暴露对视网膜的损伤情况,以利于临床有关疾患的诊治预防。
1 材料与方法
1.1动物标本选取成年小鼠(其基因型为C57BL/6J)。小鼠分区分笼饲养在标准化的条件下,小鼠可自由进食、饮水,昼夜节律是自然状态(小鼠和标准饲料均购自河南省实验动物中心)。所有的小鼠需要排除全身和眼部疾病。小鼠的垫料定期更换、动物实验室定期消毒。实验模型建立后,制作小时视网膜标本,其具体步骤:(1)通过腹腔注射异戊巴比妥钠(30 mg/kg)将小鼠麻醉;(2)经心灌流4%的多聚甲醛(pH 7.2),从而固定标本;(3)取出完整的双侧眼球;(4)一只眼球再用4%多聚甲醛继续浸泡固定0.5 h(4 ℃)后,去除角膜与晶状体,解剖取出完整的视网膜,以视盘为中心,呈放射状剪成四叶,4%的多聚甲醛固定1 d后,做成视网膜铺片,4 ℃保存备用;另一只眼球4%的多聚甲醛浸泡固定2 d(4 ℃),做成石蜡切片,4 ℃保存备用。
1.2主要仪器设备(1)荧光显微镜(Olympus,BX61,Japan);(2)振荡器(VG 3 S25,IKA,Germany);(3)石蜡切片机(LR 59590型,USA);(4)微量加样枪(Eppendorf Germany);(5)振荡切片机(LR 59590型,USA);(6)微量高速离心机(TG 16W型,长沙)。
1.3免疫组化试剂抗体稀释液和多聚赖氨酸,均购置于福州迈新生物技术有限公司;载玻片、盖玻片购置于郑州玻璃仪器厂;磷酸氢二钠(Na2HPO4)、氢氧化钠(NaOH)、磷酸二氢钠(NaH2PO4)、多聚甲醛、异戊巴比妥钠、乙醇均购于开封开化公司;鼠抗GS多抗和兔抗GFAP单抗购于Abcam公司;Alexa 568驴抗兔IgG、Alexa568驴抗鼠IgG、Alexa488驴抗鼠IgG购于Invitrogen公司。
1.4实验操作主要试剂的配制详见各说明书。选取27只成年C57BL/6J小鼠,随机分为3组,每组9只:(1)高剂量酒精组(high ethyl alcohol group,H-EtOH),每天每只小鼠胃饲浓度25%的酒精,4.0 g/kg,连续胃饲3个月;(2)低剂量酒精组(low ethyl alcohol group,L-EtOH),每天每只小鼠胃饲浓度25%的酒精,2.0 g/kg,连续胃饲3个月;(3)对照组(control group),每天每只小鼠胃饲蒸馏水,4.0 g/kg,连续胃饲3个月。视网膜石蜡切片、整体铺片、及免疫组化荧光染色等详见实验记录。
1.5统计学分析数据用Means±SD表示,采用SPSS 17.0 统计学软件单因素方差分析及随后的LSD检验高剂量酒精组、低剂量酒精组和对照组。P<0.05为差异有统计学意义。
2 结果
2.1长期酒精暴露对小鼠视网膜星形胶质细胞的影响星型胶质细胞的足板是血-视网膜屏障的重要组成部分[1]。视网膜铺片中,可观察到星型胶质细胞的免疫染色显示在视网膜表面,正常情况下,星形胶质细胞的染色强,胞体很小,分支较多,突起非常明显。低剂量酒精组小鼠视网膜内的星形胶质细胞GFAP(胶质纤维酸性蛋白)染色有所减弱,高剂量酒精组小鼠视网膜内的星形胶质细胞GFAP染色显著降低,同时,还伴胶质细胞肥大改变,胞体明显增粗,突起与分支减少(图1)。统计结果显示:酒精暴露可剂量依赖性地使视网膜内的星形胶质细胞形态改变和数量减少(图3,P<0.05)。
2.2长期酒精暴露对视网膜Müller细胞的影响视网膜中Müller细胞是一种特殊的神经胶质细胞,大致可分为胞体、内侧突起和外侧突起;胞体主要分布在内核层,胞体呈椭圆形或者多角形,核周胞质较少,胞体向内外两侧发出突起,占据从内界膜到外界膜整个视网膜厚度。低剂量酒精组小鼠视网膜Müller细胞GS染色减弱,高剂量酒精组小鼠视网膜Müller细胞GS染色明显降低(图2)。统计结果显示,酒精暴露可剂量依赖性地使视网膜Müller细胞数量减少(图4,P<0.05)。

图1 长期酒精暴露对小鼠视网膜星形胶质细胞数量的影响(GFAP标记)

图2 长期酒精暴露对小鼠视网膜Müller细胞数量的影响(GS标记)
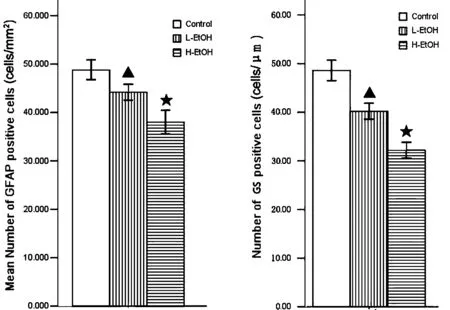
图3 长期酒精暴露对小鼠视网膜星形胶质细胞数量的影响 图4 长期酒精暴露对小鼠视网膜Müller细胞数量的影响
3 讨论
研究表明,脊椎动物的视网膜,主要是有三种不同的神经胶质细胞:Müller细胞、星形胶质细胞和小胶质细胞[2]。长期酒精暴露后,小鼠视网膜的胶质细胞,出现损伤,如Müller细胞和星形胶质细胞均减少,并伴有肥大改变,表现为胞体增粗与突起分支减少。
Müller细胞的分布,是从外界膜到内界膜的整个视网膜厚度,并其突起包绕与联系视网膜上之各类神经细胞,及与视网膜神经细胞的交互作用发生多种功能,参与形成血视网膜屏障。近年研究表明,Müller细胞是可以用来修复一些受损伤的神经元[3-4]。目前Müller细胞的具体功能尚未形成统一的定论,但传统研究认为:视网膜中Müller细胞,一般主要起支持和营养作用,作为神经元的起支架作用,保持视网膜的完整性及储存大量糖原,部分为神经元提供能量等。近期不断深入研究发现,Müller细胞不仅简单的起支持营养作用,且具有更为复杂的生理功能与病理意义[5]。近来,有大量研究发现,如果Müller细胞外面的谷氨酸浓度升高,则会造成神经元的损伤与死亡;并且视网膜中,Müller细胞是能够表达高亲和力的谷氨酸转运体,然后将细胞外高浓度的谷氨酸进一步转运至细胞内,通过谷氨酰胺合成酶,将其转化为谷氨酰胺,消除其对神经元细胞的毒性作用[6],进而可以减轻对视网膜的毒性作用。另外,Müller细胞也能够通过合成谷胱甘肽,从而消除自由基等对神经元的损伤作用[7]。
视网膜内的星形胶质细胞,则是可以参与血-视网膜屏障的形成,且能对其功能进行调控。星形胶质细胞也是神经元细胞同血管壁细胞等活动之间的桥梁,主要作用也是通过高效率的表达谷氨酸转运体,进一步参与谷氨酸的代谢,再通过产生的钙调节,发挥其对神经元细胞的活动的调节作用。另外星形胶质细胞还对一些大分子物质,在胶质细胞间的扩散进行调节。星形胶质细胞还具有神经元营养保护作用。因此认为,如视网膜内的星形胶质细胞发生损伤,那么视网膜内的血管与神经元细胞,则都会产生很大影响。GFAP(glial fibrillary acidic protein)是一种中间丝蛋白,正常情况下,在视网膜中,只有星形胶质细胞才可以表达,但是目前国内外,GFAP在视网膜中的功能,均无明确定论。通过对敲除GFAP基因的小鼠研究发现,在这些小鼠的大脑海马处,它们的突触传递发生了明显改变,且血-脑屏障也发生了一定程度的损害[8]。有研究发现,一些培养的大脑星形胶质细胞,其胶质纤维酸性蛋白(GFAP),可以参与细胞内谷氨酰胺含量的调节[9]。这说明,GFAP不仅可诱导大动脉的内皮细胞分化,进而形成血-脑屏障,同时GFAP还参与了β淀粉蛋白的反应性调节[10-11]。因此,如果视网膜星形胶质细胞中GFAP的表达减少,则表明其代谢功能已经发生了改变,其主要表现是诱导内皮细胞表达的血-视网膜屏障特性功能降低。本研究实验中发现,长期的酒精暴露后,能够剂量依赖性地使视网膜星形胶质细胞的数量明显减少,提示其对血-视网膜屏障造成了损伤。
综上,本实验表明,长期的酒精暴露能够造成视网膜Müller细胞和胶质细胞的呈剂量依赖性损伤,提示长期饮酒人员可能对视网膜的累积损伤及其影响。
[1]Ogden TE.Nerve fiber layer of the Primate retina:thiekness and glial content[J].Vision Res,1983,23(6):581-587.
[2]Hicks D,Courtois Y.The growth and behavior of rat retinal Muller cells in vitro.An improved method for isolation and culture[J].Exp Eye Res,1990,51(2):119-129.
[3]Yurco P,Cameron DA.Responses of Muller glia to retinal injury in adult zebra fish [J].Vision Res,2005,45(8):991-1 002.
[4]Fischera J,Reht A.Muller glia are a potential source of neural regeneration in the postnatal chicken retina[J].Nat Neurosci,2001,4(3):247-252.
[5]李树宁,王华.视网膜中的Muller细胞[J].眼科研究,2005,1(23):105-110.
[6]Barnett NL,Powd V.Antisense knock down of GLAST,a glial glutamate transporter,compromises retinalfunction[J].Invest Ophthalmol Vis Sci,2000,41(2):585-591.
[7]Schutte M,Werner P.Redistribution of glutathionein the ischemic rat retina[J].Neurosci Lett,1998,246(1):53-56.
[8]McCall MA,Gregg RG,Behringer RR,et al.Targeted delection in astrocyte intermediate filament(GFAP)alters neuronal Physiology[J].Proc Natl Acad Sci USA,1996,93(13):6 361-6 366.
[9]PeKny M,Eliasson C,Siushansian R,et al.The impact of genetic removal of GFAP and/or vimentin on glutamine levels and transport of glucose and ascorbate in astrocytes[J].Neurochem Res,1999,24(11):1 357-1 362.
[10]Pekny M,Stanness KA,Eliasson C,et al.Impaired induction of lood-bbrain barrier properties in aortic endothelial cells by astrocytes from GFAP-deficient mice[J].Glia,1998,22(4):390-400.
[11]Xu K,Malouf AT,Messing A,et al.Glial fibrillary acidic protein is necessary for mature astrocytes to beta-amyloid[J].Glial,1999,25(4):390-403.
(收稿2015-09-12)
R-332
B
1673-5110(2016)18-0067-03
