乌鲁木齐地区人群碘和硒营养状态与甲状腺癌相关性研究
2016-09-22杨雯雯
白 超, 魏 巍, 张 丽, 杨雯雯, 黄 婷
(新疆医科大学1第一附属医院血管甲状腺外科, 乌鲁木齐 830054; 2第二附属医院内分泌科, 乌鲁木齐 830028)
乌鲁木齐地区人群碘和硒营养状态与甲状腺癌相关性研究
白超1, 魏巍2, 张丽2, 杨雯雯2, 黄婷2
(新疆医科大学1第一附属医院血管甲状腺外科, 乌鲁木齐830054;2第二附属医院内分泌科, 乌鲁木齐830028)
目的探讨乌鲁木齐地区人群碘和硒营养状态与甲状腺癌的相关性。方法收集2014年3-12月新疆医科大学第一附属医院血管甲状腺外科甲状腺癌患者140例(甲状腺癌组)及良性甲状腺结节患者147例(甲状腺良性结节组),另收集同期于新疆医科大学第二附属医院行甲状腺超声提示甲状腺形态正常的健康体检者315例(甲状腺形态正常组),测定3组人群尿碘和血硒水平,并进行统计学分析。结果3组尿碘水平差异有统计学意义(Z=186.52,P<0.001),甲状腺癌组尿碘水平较甲状腺良性结节组和甲状腺形态正常组高。3组血硒水平差异有统计学意义(F=85.723,P<0.001)。甲状腺癌组血硒水平较甲状腺良性结节组和甲状腺形态正常组低。甲状腺癌在高尿碘合并低血硒的研究对象中所占的比例高于单纯高尿碘和单纯低血硒的研究对象,其与单纯高尿碘者的差异有统计学意义(χ2=11.322,P=0.001),与单纯低血硒者的差异无统计学意义(χ2=0.000 076,P=0.993)。结论新疆乌鲁木齐地区高尿碘和低血硒水平可能是甲状腺癌发病的相关因素,碘和硒在甲状腺癌的发生和发展中可能起着协同作用,可以通过控制碘摄入和提高硒营养状态来防治甲状腺结节,但需进一步研究确认乌鲁木齐地区硒的最适营养水平。
甲状腺癌; 硒; 碘
甲状腺癌是常见的内分泌系统恶性肿瘤,目前乌鲁木齐地区甲状腺癌的发病率逐年增高。碘和硒是人体必需的微量元素,碘是甲状腺激素合成的原料,而硒在甲状腺抗氧化系统、免疫系统以及甲状腺激素的合成、活化、代谢过程中发挥重要作用[1-2]。乌鲁木齐地区实行普遍食盐碘化后,大多数人群处于碘超足量状态,且乌鲁木齐地区属于低硒地区,碘过量和硒缺乏很可能是导致甲状腺癌流行的重要外部因素。尿碘和血硒水平测定是反映人群碘和硒营养状态的指标。碘营养状况评价标准100~199 μg/L为适宜,200~299 μg/L为超过适宜量,≥300 μg/L为过量[3]。血硒水平1.33~85.25 μg/L为硒缺乏。本研究收集2014年3-12月乌鲁木齐地区甲状腺癌及良性甲状腺结节患者与甲状腺形态正常人群的相关资料,检测尿碘和血硒水平,分析乌鲁木齐地区人群碘和硒的营养状况与甲状腺癌的关系,为本地区甲状腺癌的深入研究提供依据,并为乌鲁木齐地区人群科学摄入碘和硒提供指导。
1 资料与方法
1.1研究对象收集2014年3-12月新疆医科大学第一附属医院血管甲状腺外科手术治疗的甲状腺癌患者140例(甲状腺癌组),其中乳头状癌134例,滤泡状癌2例,髓样癌2例和未分化癌2例;良性甲状腺结节患者147例(甲状腺良性结节组),其中结节性甲状腺肿134例,结节性甲状腺肿伴腺瘤6例,甲状腺腺瘤5例,结节性甲状腺肿合并桥本氏甲状腺炎1例,异位甲状腺肿1例;另收集同期于新疆医科大学第二附属医院行甲状腺超声提示甲状腺形态正常的健康体检者315例(甲状腺形态正常组)。高尿碘合并低血硒的研究对象共有88例,高尿碘的研究对象共有239例,低血硒的研究对象共有 200例。诊断标准:(1)甲状腺癌和良性甲状腺结节为病理组织学检查;(2)甲状腺形态正常为甲状腺超声。纳入标准:(1)具有本地户口,均在乌鲁木齐地区居住时间≥10 a(以个人身份证为据);(2)检测前2周在乌鲁木齐地区居住且正常饮食;(3)既往均无甲状腺疾病史。排除标准:(1)半年内有服用硒酵母片等含硒药物者;(2)半年内有冠脉造影等使用碘造影剂者、服用胺碘酮等含碘药物者;(3)肝肾功能异常者;(4)妊娠妇女。所有研究对象均签署知情同意书。
1.2方法
1.2.1尿碘测定采集清晨空腹中段尿10 mL,置于清洁聚乙烯塑料中密封,送至新疆医科大学第二附属医院检验科,使用国家疾病预防控制中心提供的试剂,采用硫酸铵消化-砷铈催化分光光度法测定。尿碘正常参考值范围为100~300 μg/L。
1.2.2血硒测定采集清晨空腹静脉血4 mL,3 600 r/min离心5 min,取上层血清2 mL测定;所用实验器皿经稀释硝酸浸泡后再用无离子水清洗;取300 μL样品用浓硝酸4 mL和浓高氯酸1 mL消化;加热蒸干;用1%硝酸淋洗器皿,过滤3次,定容至10 mL;使用日本AAS240FS原子吸收仪器,采用石墨炉原子吸收光谱法测定。

2 结果
2.1一般情况甲状腺癌组和甲状腺良性结节组患者平均年龄高于甲状腺形态正常组,3组年龄比较差异有统计学意义(P<0.001),甲状腺癌组平均年龄明显低于甲状腺良性结节组,差异有统计学意义(t=4.848,P<0.05)。602例患者中男性277例,女性325例,男女性别比为1∶1.17。甲状腺癌组和甲状腺良性结节组女性多于男性,差异无统计学意义(χ2=0.018,P=0.893)。3组民族构成差异无统计学意义(P>0.05),见表1。
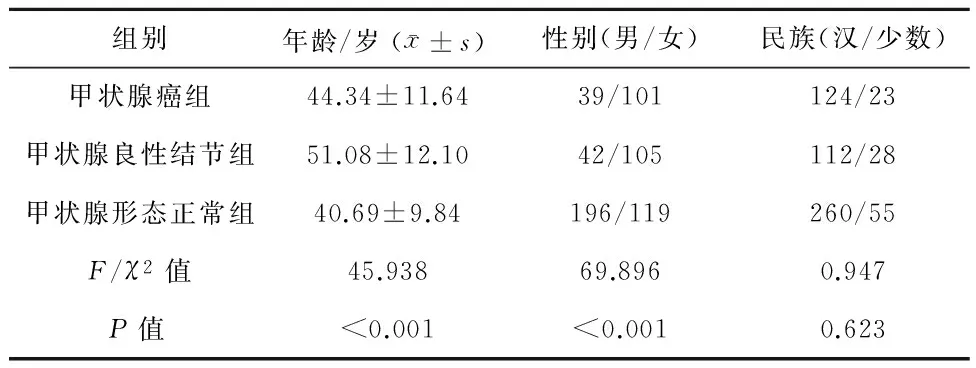
表1 3组一般情况比较
2.23组尿碘水平602例研究对象的尿碘值呈偏态分布,总体尿碘水平为261.25(179.53~396.45) μg/L,甲状腺癌组为341.15(206.88~554.43) μg/L,甲状腺良性结节组为253.60(159.60~437.00) μg/L,甲状腺形态正常组为252.60(179.38~346.10) μg/L,甲状腺癌组尿碘水平较甲状腺良性结节组和甲状腺形态正常组高,3组尿碘水平差异有统计学意义(Z=186.52,P<0.001)。
2.33组血硒水平602例研究对象的血硒水平为114.55(76.26~150.93) μg/L,甲状腺癌组为72.93(42.62~109.81) μg/L,甲状腺良性结节组为85.25(51.28~130.54) μg/L,甲状腺形态正常组为135.53(107.89~177.16) μg/L。甲状腺癌组血硒水平较甲状腺良性结节组和甲状腺形态正常组低,3组血硒水平差异有统计学意义(F=85.723,P<0.001)。
2.4高尿碘合并低血硒者甲状腺癌患病情况高尿碘合并低血硒的研究对象甲状腺癌所占比例为46.59%;单纯高尿碘的研究对象甲状腺癌所占的比例为32.22%;单纯低血硒的研究对象甲状腺癌所占的比例为41.50%。甲状腺癌在高尿碘合并低血硒的研究对象中所占的比例高于单纯高尿碘和单纯低血硒的研究对象,其与单纯高尿碘者比较,差异有统计学意义(χ2=11.322,P=0.001),与单纯低血硒者比较,差异无统计学意义(χ2=0.000 076,P=0.993)。在高尿碘的239例患者中,甲状腺癌组血硒水平为79.59(45.95~122.71) μg/L,良性结节组为82.75(55.53~131.45) μg/L,甲状腺形态正常组为132.53(99.23~182.48) μg/L,3组血硒水平差异有统计学意义(Z=46.284,P<0.001)。
3 讨论
甲状腺癌是常见的内分泌系统恶性肿瘤,发病率约占全部恶性肿瘤发病的1.7%[3-4]。在国内各肿瘤登记点甲状腺癌发病率均呈上升趋势[5-8]。甲状腺癌分为乳头状癌、滤泡状癌、髓样癌及未分化癌4类,不同的病理类型临床生物学特性差异很大,恶性程度较低的甲状腺癌有时可自然生存10 a以上,但恶性程度高的甲状腺癌可能在短期内死亡。故对于甲状腺结节性质的确定,对临床工作十分重要。
本研究结果显示,甲状腺癌组和甲状腺良性结节患者平均年龄高于甲状腺形态正常组,3组年龄差异有统计学意义(P<0.05),与周伟等[9]的研究结果并不一致,这可能由于纳入不同地点的不同人群所导致的。甲状腺疾病好发于女性,甲状腺癌也不例外,目前国内外绝大多数研究均提示,女性甲状腺癌发病率明显高于男性[8],本研究结果与前述研究结果一致。新疆是一个多民族聚居地区,汉族和少数民族甲状腺癌的发病率差异无统计学意义,表明民族与甲状腺疾病的发生与发展关系不大。
碘是甲状腺激素合成的必要原料,人体含碘总量为10~12 mg,碘可通过食物、饮水、食盐等途径进入体内。人体摄入的碘70%~80%浓集在甲状腺中,尿碘水平是目前公认的评价及监测人群碘营养状况的最适宜指标。碘摄入量与甲状腺癌的发生关系密切,缺碘和高碘地区的甲状腺癌发生率均明显高于碘正常地区[10-11]。碘缺乏地区的滤泡状癌发病率高;碘充足地区的甲状腺乳头状癌发病率高[12-13]。我国采取食盐加碘措施后, 乳头状癌发病率明显上升,滤泡状癌明显下降[14]。本研究结果显示,602例研究对象的尿碘值呈偏态分布,甲状腺癌组尿碘水平较甲状腺良性结节组和甲状腺形态正常组高,3组尿碘差异有统计学意义(P<0.001)。碘对甲状腺癌发生和发展的作用机制可能是高碘环境阻断甲状腺内碘有机化和激素合成,过量的TSH对甲状腺细胞形成过度刺激[15]。在人体中,高碘可促进凋亡突变的p21蛋白和蛋白Bcl-xl表达增加,这2种蛋白是碘与甲状腺癌类型转换过程的关键蛋白。碘还可以影响细胞外调节蛋白激酶1/2、p38、c-Jun氨基末端激酶1/2,上述3种蛋白激酶有抗凋亡作用,还可以调节p53、p21、Bcl-xl的表达[16]。
硒作为人体必需的微量元素,通过参与硒蛋白的合成在甲状腺抗氧化系统、免疫系统以及甲状腺激素的合成、活化、代谢过程中发挥重要作用[17]。硒的分布具有明显的地区性,人群硒营养状态受生活环境影响。有研究显示,硒在甲状腺癌、乳腺癌、宫颈癌、膀胱癌、直肠癌的发生和发展中起一定作用。本研究结果显示,甲状腺癌组患者血硒水平低于甲状腺良性结节患者,而甲状腺良性结节患者血硒水平低于甲状腺形态正常组,表明血硒可能在甲状腺结节的发生和发展中起一定作用。其可能途径有:第一,硒缺乏可引起谷胱甘肽过氧化物酶和硫氧还原蛋白还原酶系统的抗氧化作用减弱,氧自由基增多,损伤甲状腺腺细胞;第二,以硒代半胱氨酸形式存在的硒是甲状腺I型5′-脱碘酶活性中心所必需物质,若机体处于硒缺乏状态,Ⅰ型5′-脱碘酶的活性降低或表达产物数量减少,造成甲状腺激素代谢异常,使血清TSH和T4表达水平上升,T3下降[18-19],TSH可诱导细胞外调节蛋白激酶,在肿瘤侵袭和转移过程中起中介和放大信号作用[19];第三,硒半胱氨酸是谷胱甘肽过氧化物酶的活性中心,它能催化还原型谷胱甘肽变为氧化型谷胱甘肽,使过氧化物还原成羟基化合物,保护细胞膜的结构及功能,防止甲状腺组织损害;第四,甲状腺的硫氧还原蛋白还原酶与硫氧还蛋白、还原型辅酶Ⅱ共同构成了硫氧还蛋白系统,参与氧化还原调节、抗氧化防御、细胞解毒和蛋白折叠等作用[20]。
综上所述,碘和硒对甲状腺的生理功能起着协同作用,碘的过量和硒的缺乏可能与甲状腺癌的发生有关,可以通过控制碘摄入和提高硒营养状态来防治甲状腺结节,但需进一步研究确认乌鲁木齐地区硒的最适营养水平。
[1]Köhrle J, Gärtner R. Selenium and thyroid[J]. Best Pract Res Clin Endocrinol Metab, 2009,23(6):815-827.
[2]Kubasova ED, Kubasov RV. Effect of trace elements on thyroid structural and functional state[J]. Gig Sanit, 2008,5(5):79-81.
[3]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[4]Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010,127(12):2893-2917.
[5]王春艳,司润辉,米国莲,等.石家庄地区健康人群甲状腺结节流行状况调查及相关因素分析[J].河北医药,2012,34(7):1070-1072.
[6]杨昱,王志国,吴阳,等.南京市40岁以上人群甲状腺结节的流行病学调查[J].中华内分泌代谢杂志,2013,29(9):785-787.
[7]张旭刚,甄萍,彭晔,等.衡水市职工健康体检甲状腺结节流行状况调查及影响因素分析[J].河北医科大学学报,2014,35(6):717-720.
[8]李科,林国桢,周琴,等.2000-2011年广州市城区甲状腺癌的发病趋势分析[J].中华预防医学杂志,2015,49(2):142-146.
[9]周伟,马岩,方益荣.浙江省绍兴市2009年至2013年甲状腺癌检出率及时间趋势分析[J].中华内分泌代谢杂志,2014,30(1):4-9.
[10]Jema A, Siegel R, Xu J, et al.Cancer statistics,2010[J].CA Cancer J Clin,2009,60(5):277-300.
[11]Davies L, Welch HG. Increasing incidence of thyroid cancer in the United States, 1973-2002[J]. JAMA, 2006, 295(18):2164-2167.
[12]Lind P, Langsteger W, Molnar M, et al. Epidemiology of thyroid diseases in Iodine suffieieney[J].Thyroid, 1998,8(12):1179-1183.
[13]Knobel M, Medeiros-Neto G. Relevance of iodine intake as a reputed predisposing factor for thyroid cancer[J]. Arq Bras Endoerinol Metab, 2007, 51(5):701-712.
[14]关海霞,单忠艳,米小轶,等.普遍食盐碘化前后甲状腺癌发病变化的11年病理资料分析[J].中国医科大学学报,2006,35(3):255-284.
[15]钟红,杜江,王晓霞,等.乌鲁木齐地区甲状腺癌与尿碘关系病例对照研究[J].肿瘤研究与临床,2015,27(2):95-97.
[16]Liu XH, Chen GG, Vlantis AC, et al. Differentiated thyroid cancer and outcome in iodine deficiency[J]. Eur J Surg Oncol, 2014,30(3):325-331.
[17]Mehdi Y,Hornick JL,Istasse L,et al.Selenium in the enviro-nment,metabolism and involvement in body functions[J].Molecules,2013,18(3):3292-3311.
[18]Duntas LH. Selenium and the thyroid: a close-knit connection [J]. J Clin Endocrinol Metab, 2010,95(12):5180-5188.
[19]Roger PP, Van Staveren WC, Coulonval K, et al. Signal transd-uction in the human thyrocyte and its perversion in thyroid tumors[J]. Mol Cell Endocrinol,2010,321(1):3-19.
[20]刘莉,朱本章.硒缺乏与甲状腺疾病[J].国外医学内分泌学分册,2003,23(6):386-388.
(本文编辑王艳)
Urumqi region population iodine and selenium nutrition status with thyroid cancer relevant research
BAI Chao1, WEI Wei2, ZHANG Li2, YANG Wenwen2, HUANG Ting2
(1DepartmentofVascularandThyorid,theFirstAffiliatedHospital,XinjiangMedicalUniversity,Urumqi830054,China;2DepartmentofEndocrinology,theSecondAffiliatedHospital,XinjiangMedicalUniversity,Urumqi830028,China)
ObjectiveTo research the relevance between iodine,selenium nutrition status and thyroid carcinoma in patients with thyroid carcinoma in Urumqi. Methods140 patients with thyroid carcinoma and 147 patients with benign thyroid nodules were collected from March 2014 to December 2014 in the department of vascular and thyroid surgery in the First Affiliated Hospital of Xinjiang Medical University and 315 cases of normal thyroid from health examination were collected form the Second Affiliated Hospital of Xinjiang Medical Universitas control. The general information, urine iodine and blood selenium expression level were recorded for statistical analysis. ResultsThree groups of urine iodine level difference was statistically significant (Z=186.52, P<0.001). Compared with benign thyroid nodules group and thyroid normal group, thyroid cancer group urine iodine level were high,and the differences were statistically significant (Z=186.52, P<0.001). The differences of the blood selenium levels in three groups were were statistically significant (F=85.723, P<0.001).The blood selenium levels in thyroid cancer group and benign nodules group were lower than that in the normal thyroid group, and the differences were statistically significant (Z value of 10.681 and 8.459 respectively, P<0.001). The proportion of thyroid cancer in high urinary iodine with low blood selenium research objects were higher than that in the pure high urinary iodine (χ2=11.322, P=0.001). Compare with the pure low blood selenium objects,the proportion of thyroid cancer in high urinary iodine with low blood selenium research objects was not statistically significant (χ2=0.000 076, P=0.993). ConclusionIn Xinjiang Urumqi region,high urinary iodine with low blood selenium levels may be thyroid cancer related factors of the disease.Iodine and selenium may act synergistically in the occurrence and development of thyroid cancer, which can by controlling the iodine intake and increase selenium nutrition status to the prevention and treatment of thyroid nodules, but need further research to determine the optimum nutrition level of selenium in Urumqi region.
thyroid cancer; selenium; iodine
新疆维吾尔自治区自然科学基金(2013211A057)
白超(1981-),男,硕士,主治医师,讲师,研究方向:全身周围血管和甲状腺相关疾病。
张丽,女,博士,主任医师,副教授,研究方向:内分泌代谢相关疾病,E-mail: xingli0707@126.com。
R736.1
A
1009-5551(2016)09-1183-04
10.3969/j.issn.1009-5551.2016.09.027
2016-02-07]
