大鼠骨髓间充质干细胞分离培养及鉴定
2016-09-22苏力担卡扎仇曼何铁英郝晓文陈启龙
韩 玮, 苏力担卡扎·仇曼, 何铁英, 程 坤, 郝晓文, 王 松, 陈启龙
(新疆医科大学第一附属医院胰腺外科, 乌鲁木齐 830054)
大鼠骨髓间充质干细胞分离培养及鉴定
韩玮, 苏力担卡扎·仇曼, 何铁英, 程坤, 郝晓文, 王松, 陈启龙
(新疆医科大学第一附属医院胰腺外科, 乌鲁木齐830054)
目的探索大鼠骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)的分离、培养及鉴定方法。方法采用贴壁分离方法,分离纯化3~4周龄SD大鼠的骨髓间充质干细胞,观察细胞生长状况,分别用免疫荧光染色、流式细胞仪鉴定及4′,6-二脒基-2-苯基吲哚(DAPI)标记细胞核的方法鉴定BMSCs纯度及活性。结果原代BMSCs呈圆形、大小均一,透光性可,24 h后开始贴壁,2 d后开始长出伪足,7~8 d细胞融合达90%,纯化后BMSCs呈梭形,24 h 细胞贴壁率可达99%,前4代细胞传代周期为7 d,之后传代周期逐渐缩短。第3代BMSCs的表面标志物CD29阳性表达率为98.9%,CD44阳性表达率为73.3%。DAPI标记的BMSCs胞核可见明亮蓝色荧光,标记率达100%。结论贴壁分离法分离大鼠BMSCs,可得到纯度较高、活力强的BMSCs,第3代BMSCs生物学性状稳定。
骨髓间充质干细胞; 细胞培养; 大鼠
骨髓间充质干细胞(BMSCs)为非造血干细胞,存在于骨髓中,易于获得及分离培养,可诱导为多重细胞,分泌多重生长因子、酶及趋化因子,在组织器官的修复及促进组织器官生长过程中起到关键作用[1]。分离BMSCs的方法有 密度梯度离心法、全骨髓培养法、表型分离法、纤维蛋白微珠法、流式细胞仪分离法等[2]。目前分离大鼠BMSCs尚无统一的方法,获得高纯度、细胞形态稳定的大鼠BMSCs是进行后续实验的重要前提。为此本研究参照文献[3-4] ,采用贴壁生长法分离大鼠BMSCs,然后用胰蛋白酶消化传代BMSCs,去除混杂细胞,以获得纯度较高的BMSCs,现报道如下。
1 材料与方法
1.1实验动物3~4周龄SD大鼠,体质量250~300 g,由新疆医科大学动物中心提供(许可证号:SCXK新2011-0004)。SD大鼠由专人饲养,20~22℃恒定室温条件下分笼饲养,明暗交替12 h,自动空调通风,自由饮水并进食。实验过程中对动物处置符合动物伦理学标准。
1.2试剂及仪器胶原酶(Ⅴ型)、DAPI(SIGMA公司),优级胎牛血清(杭州四季青生物工程材料有限公司),DMEM (GIBCO公司),CD44、CD45、CD29(SIGMA公司),RPMI 1640细胞培养液(GIBCO公司)。倒置显微镜(DMI4000B,德国 Leica公司),CO2培养箱(香港力康生物医疗科技控股集团),流式细胞仪(FACScalibur,美国 Becton-Dickinson公司)。
1.3方法
1.3.1BMSCs原代培养大鼠腹部皮肤消毒,16%的水合氯醛,300 mg/kg体质量腹腔注射麻醉。剪开大鼠双下肢皮肤,顿、锐结合分离双侧髋关节,取出双下肢,用剪刀及纱布分离股骨及胫骨表面肌肉,游离出股骨及胫骨,尽量保持大鼠双股骨的完整性。0.9%生理盐水冲洗后将双侧股骨及胫骨置于盛有培养基平皿中,转移置超净工作台上。剪去股骨及胫骨的两端,5 mL注射器吸取20%胎牛血清的培养基(L- DMEM、100 U/mL青霉素、100 U/mL链霉素),反复冲洗骨髓腔,并同时用吸管将平皿中的细胞吹打混匀。将平皿中的细胞液移至离心管内,2 000 r/min离心5min。移去表面清液,50 mL 细胞培养瓶加入3 mL培养液,将离心后的细胞以1×108/L密度加入培养瓶中,置于细胞培养箱内培养,每日用显微镜观察细胞的生长状态。24 h后首次换液,去除未贴壁细胞,之后每3天换液1次。
1.3.2BMSCs传代显微镜观察原代细胞融合达90%时准备传代,移去培养瓶中培养液,用0.25%胰蛋白酶消化细胞(37℃ 2~3 min),用含10% 胎牛血清的培养液终止消化,终止后按1∶2比例传代,每3天换液1次,每日用显微镜观察细胞生长情况,待细胞铺满瓶底约90%时,显微镜拍照并再次传代,反复传代扩增,使BMSCs逐渐纯化。
1.3.3BMSCs鉴定
1.3.3.1免疫荧光染色当细胞传代至第3代时准备荧光染色。将细胞制备爬片,用10%多聚甲醛固定30 min,PBS液洗1 min,重复洗3次,3%H2O2孵育15 min,分为4份,3份中分别加入1∶200的CD29、CD44、CD45单克隆抗体,1份用DAPI染细胞核3 min,37℃避光孵育1 h,PBS洗1 min,重复3次后封片,荧光显微镜下照相。1.3.3.2流式细胞仪鉴定取第3代BMSCs,待细胞消化后PBS液清洗3次。计数3.9×105/L×4 mL,离心分装入4支离心管内,各100 μL,各管分别加入CD29、CD44、CD45抗体及空白对照,避光孵育30 min。分别加入PBS液1mL,2 000 r/min离心5 min,弃上清,用500 μL PBS液重悬,置入流式细胞仪,分别用流式细胞仪检测荧光标记的CD29+、CD44+、CD45-细胞纯度。重复该实验1次。专人检测,Cell-Quest软件分析结果。
2 结果
2.1原代细胞培养形态BMSCs接种后用显微镜观察,显示细胞呈圆形,透光性好,并混有其他深色造血细胞,易于鉴别。24 h开始贴壁,2 d后伸出伪足,长短不一(图1a)。4 d后细胞快速增长,伪足细长,呈梭形,并开始出现细胞集落排列,细胞形态较均一,细胞核清晰,包质丰富,包膜清晰(图1b)。之后细胞开始相互融合,7 d左右细胞逐渐融合成片,排列呈旋涡状。

b: 4 d

b: 4 d
图1BMSCs培养不同时间的细胞形态(×50)
2.2传代细胞观察传代后细胞BMSCs分布均匀,形态纤长。其生长过程分为3个时期:(1)潜伏期:第1~4天,因消化液的刺激,细胞伪足回缩,呈圆球形,逐渐适应环境后伪足逐渐伸出;(2)对数增长期:第3~5天,细胞快速增殖分裂,呈对数增殖;(3)停滞期:第6~7天,此时增殖基本停止,细胞陈集落分布,并排列一致,呈漩涡状或放射状。第1、2代细胞生长状态良好,但细胞分布不够均匀一致(图2a、2b)。第3代细胞形态规则,排列有序,BMSCs最多且分布最为均匀(图2c)。第4、5代细胞逐渐表现出老化迹象,细胞增殖速度减慢,仅在局部表现出集落分布(图2d、2e)。

a: 第1代 BMSCs
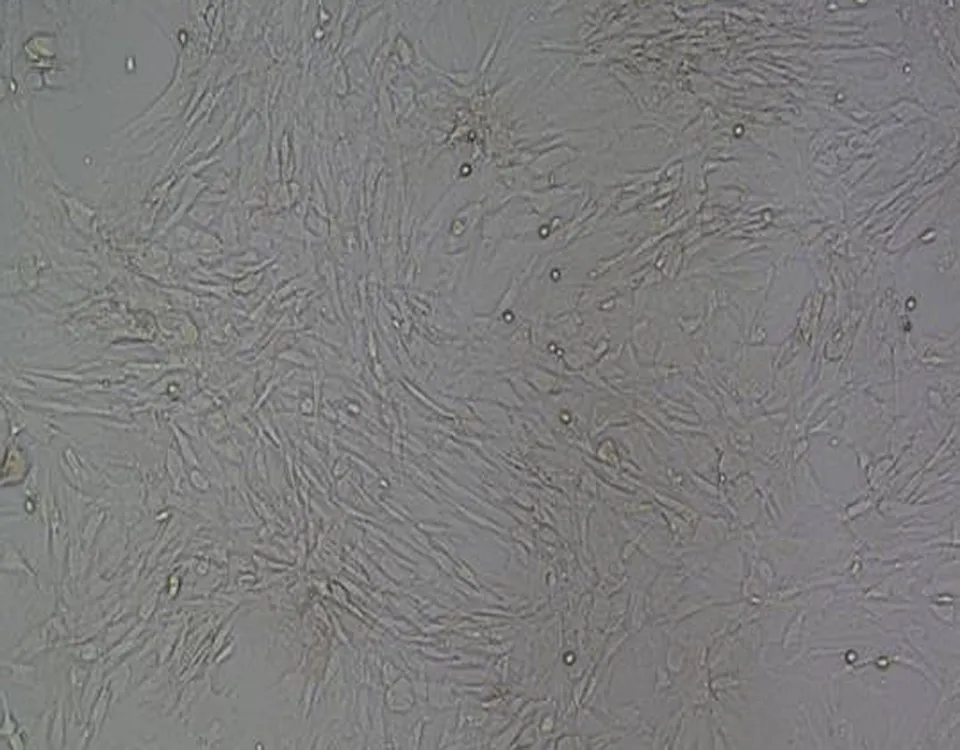
b: 第2代 BMSCs
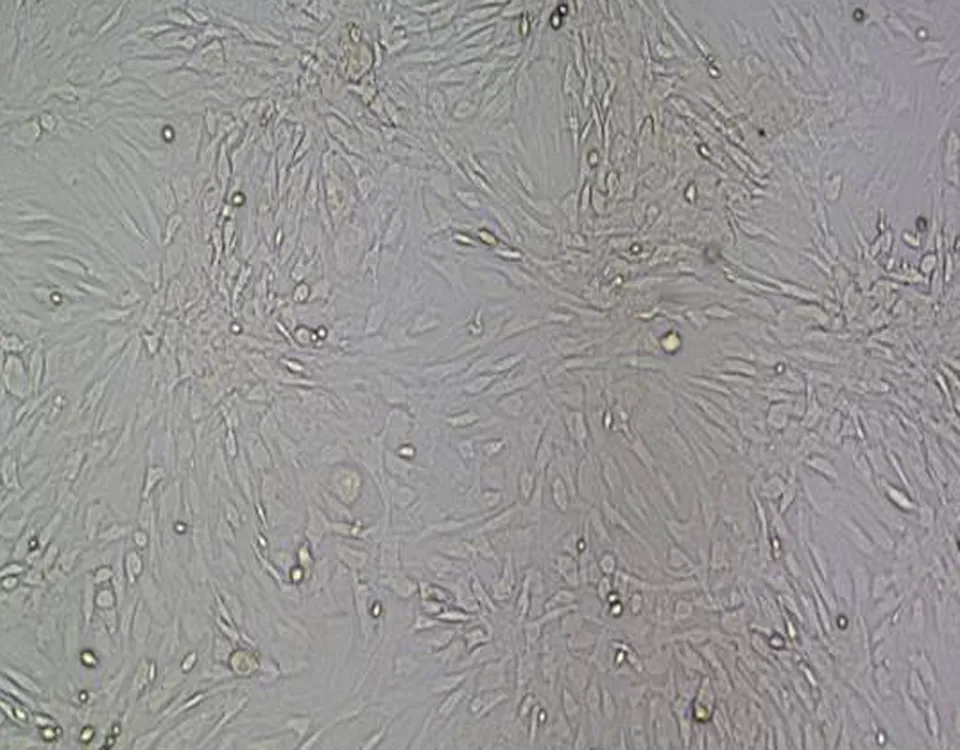
c: 第3代 BMSCs

d: 第4代 BMSCs

e: 第5代 BMSCs
2.3流式细胞仪检测和免疫荧光染色第3代BMSCs CD29表达率为98.9%,CD44表达率为73.3%(图3),提示所检测细胞是非造血干细胞。免疫荧光染色结果显示,DAPI标记的BMSCs胞核可见明亮蓝色荧光(图4a),标记率达100%,细胞活性较高。CD29、CD44、CD45染色细胞质呈绿色荧光,可观察细胞整体形态及分布状况(图4b~d)。
3 讨论
林楚伟等[5]采用全骨髓贴壁培养法分离并差速消化传代与密度梯度法比较,表明前者的BMSCs生长增殖活力高于后者。杨丽等[6]也报道贴壁培养法的效果优于密度梯度离心法。本实验利用BMSCs贴壁生长特性分离培养细胞,用培养液冲出大鼠骨髓后置于培养瓶中培养,骨髓中的BMSCs贴壁生长,更换培养液过程中可去除漂浮生长的造血系细胞,纯化BMSCs。其中取骨髓操作一定要熟练、迅速,否则会导致骨髓细胞凝固、死亡,无法达到预期实验目的。传代前还有与BMSCs一起贴壁生长的淋巴细胞等,淋巴细胞比BMSCs贴壁更为牢固,故传代时,需严格控制酶的量和消化时间,恰好能分离出BMSCs,细胞可得到进一步的纯化。本研究结果显示,培养的BMSCs第3代细胞形态最为稳定,之后再次传代后逐渐表现出细胞老化迹象,故进一步实验可选用第3代BMSCs,DAPI标记达100%,细胞活性较高。
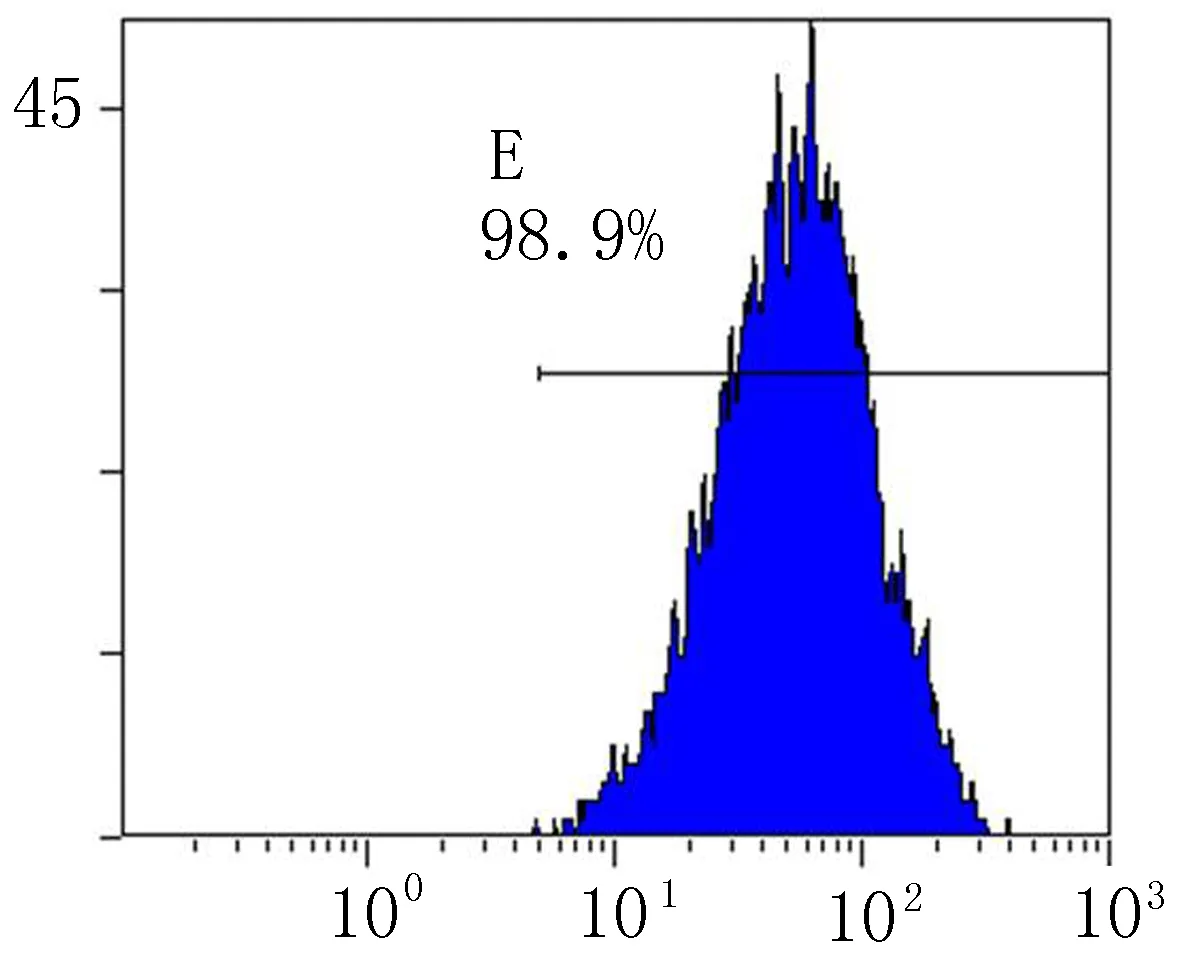
a: CD29+
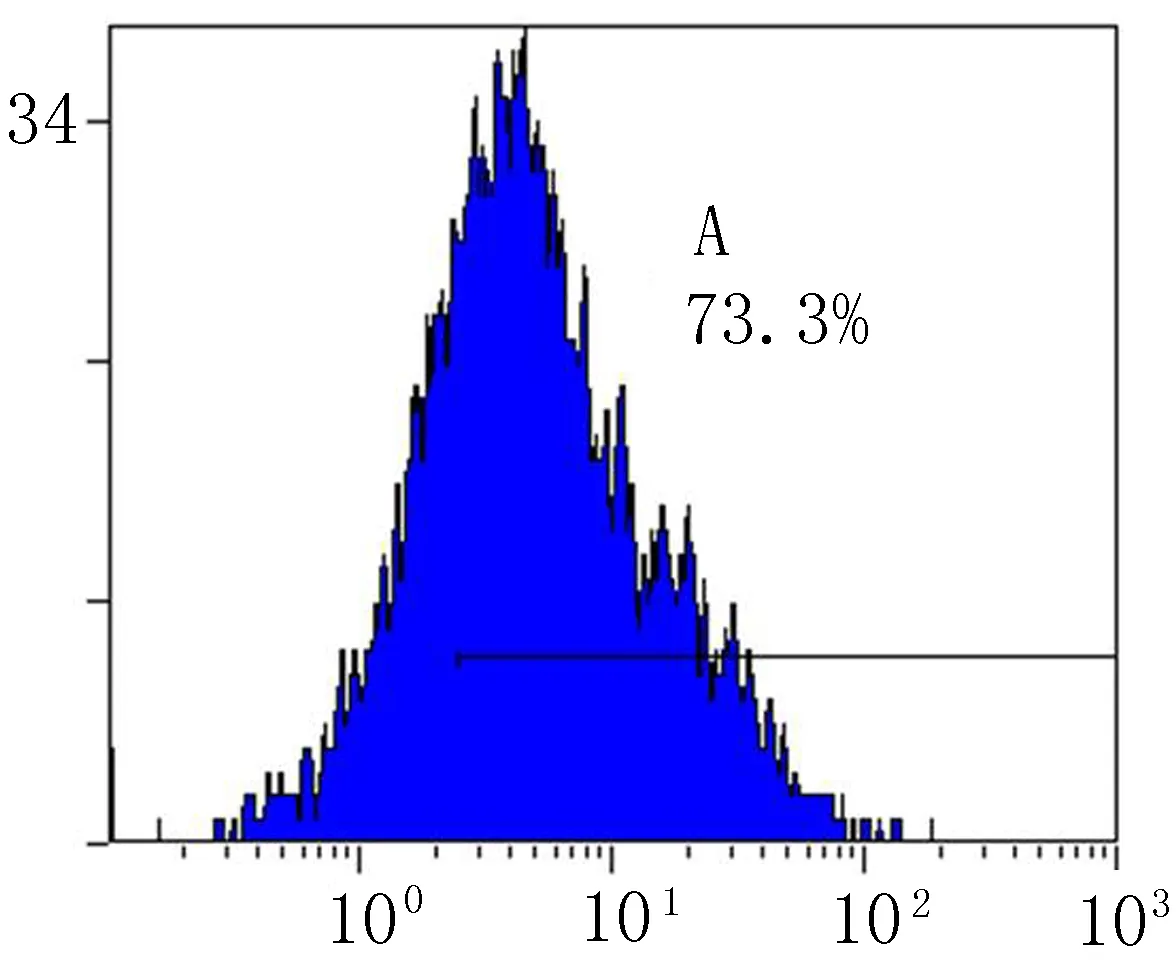
b: CD44+
图3流式细胞仪检测荧光标记的CD29+和CD44+
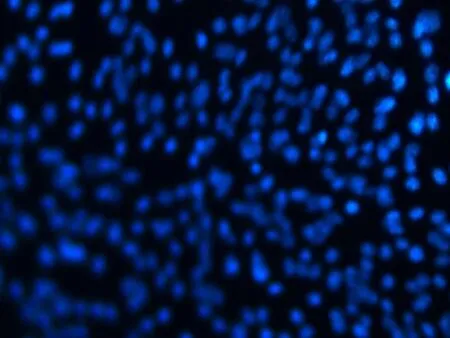
a: DAPI标记BMSCs(×100)

b: 免疫荧光染色CD29(×50)
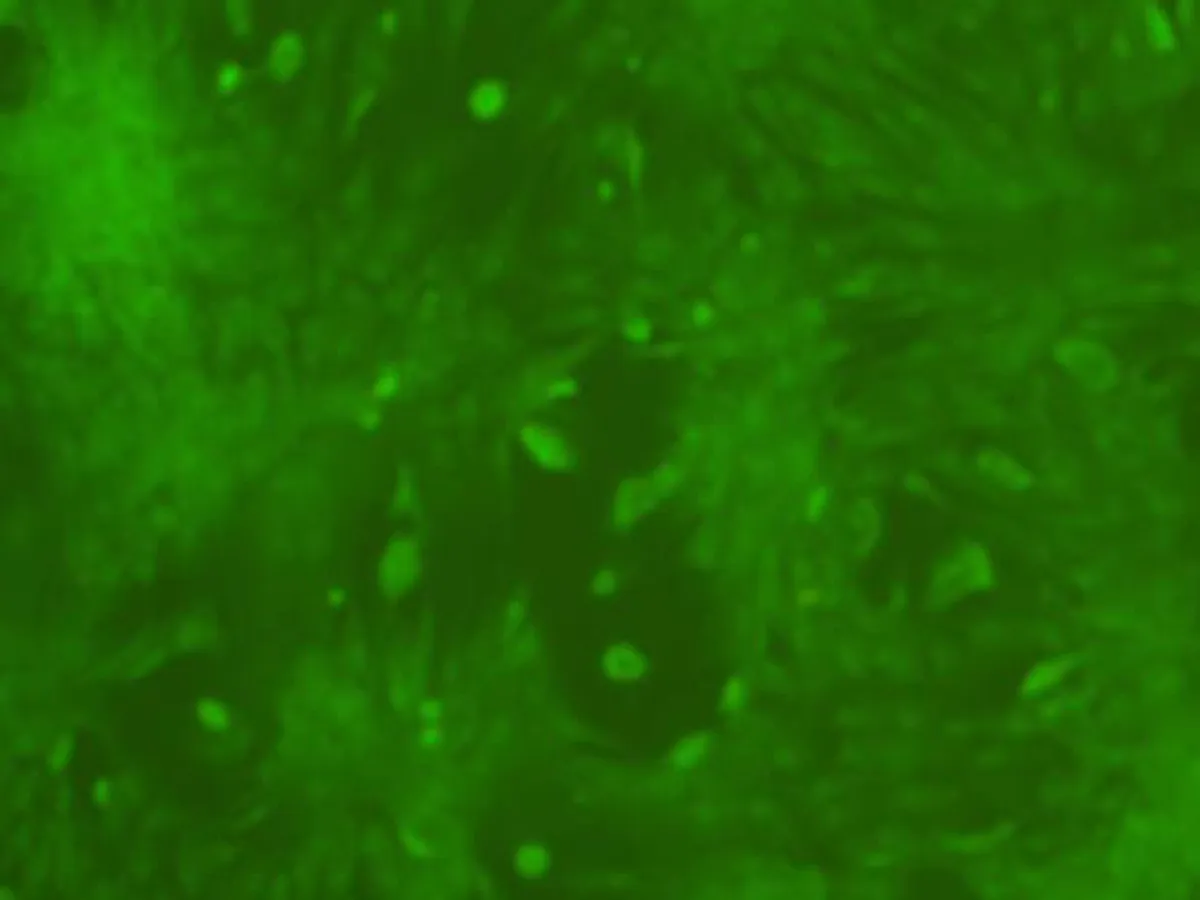
c: 免疫荧光染色CD44(×100)

d: 免疫荧光染色CD45(×100)
图4流式细胞仪检测和免疫荧光染色
BMSCs可以表达多种表面抗原标志,但没有特异性,目前认为CD29、CD44是鉴别BMSCs的重要标志抗原,CD34和CD45则是骨髓造血干细胞的重要标志抗原[7-8]。本实验培养的细胞通过流式细胞仪检测显示, CD29和CD44高表达,为阳性,CD45为阴性,这符合BMSCs的表面标志物特征,这也与上述研究报道结果一致,进一步验证了培养扩增的细胞为BMSCs。
细胞标记方法有酶联标记、3H-TdR标记、荧光标记、BrdU 标记及特定基因标记等[9-12]。本研究中BMSCs经CD29、CD44、CD45免疫荧光标记,细胞呈现出均一的绿色荧光,且可以观察细胞整体形态,DAPI荧光表现可见细胞核呈蓝色荧光,可了解BMSCs细胞活性。后续体内细胞移植中可以尝试此方法,以验证其在体内细胞标记的效果。
[1]Pawitan JA.Prospect of stem cell conditioned medium in regenerative medicine[J].Biomed Res Int,2014,965849.
[2]李鲁生,张涵,王成俊,等.骨髓间充质干细胞的分离方法和生物学特性.[J].中国组织工程研究与临床康复,2010,14(10):1869-1873.
[3]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版社.2004:177.
[4]Stein E,Blaimauer K,Bauer S,et al.High expression of integrin betal correlates with high proliferation capacity in oral keratinocytes[J]. Wien Klin Wochenschr,2007,119(9-10):318-322.
[5]林楚伟,周胜华,杜优优.全骨髓贴壁并差速传代分离纯化大鼠骨髓间充质干细胞:与密度梯度离心法的比较[J].中国组织工程研究与临床康复,2010,14(14):2508-2512.
[6]杨丽,张荣华,谢厚杰,等.建立大鼠骨髓间充质干细胞稳定分离培养体系与鉴定[J].中国组织工程研究与临床康复,2009,13(6):1064-1068.
[7]De Ugarte DA, Alfonso Z, Zuk PA, et al. Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissueand bone marrow[J]. Immunol Lett , 2003, 89(2-3): 267-270.
[8]Shahdadfar AI, Frønsdal K, Haug T, et al. In vitro expansion of human mesenchymal stem cells: choice of serum is a determinant of cell proliferation,differentiation, gene expression, and transcriptome stability[J]. Stem Cells, 2005, 23(9): 1357-1366.
[9]冯善伟,姚晓黎,李中,等.BrdU体外标记大鼠骨髓间充质干细胞的研究[J].第一军医大学学报,2005,25(2):184-186.
[10]宁寅宽,李强,蔡伟良,等.绿色荧光蛋白标记兔BMSCs 体外成骨的定量能谱分析[J].安徽医科大学学报,2015,50(4):415-418.
[11]李经伦,吕英姿,何晓英,等.3H-TdR 对骨髓间充质干细胞代谢的量效关系研究[J].泸州医学院学报,2013,36(3):211-215.
[12]路坦,尉娜,张超,等.微小RNA-124在骨髓间充质干细胞分化为神经源性细胞的作用及其对脊髓损伤修复的影响[J].中华实验外科杂志,2016,33(1):179-181.
(本文编辑周芳)
Study on separate culture and identification of rat bone marrow mesenchymal stem cells
HAN Wei, Sulidankazha Chouman, HE Tieyin, CHENG Kun, HAO Xiaowen,WANG Song, CHEN Qilong
(DepartmentofPancreaticSurgery,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
ObjectiveTo explore the methods of separate, culture and identification of rat bone marrow mesenchymal stem cells. MethodsBy adherent separation method, bone marrow mesenchymal stem cells were isolated and purified from 3-4 weeks old SD rat, then cell growth was observed, respectively by immunofluorescence staining, flow cytometry and DAPI nuclear staining method for identification of BMSCs purity and activity. ResultsPrimary BMSCs was round, uniform in size and light in transmission. After 24h begin to adherent, 2 d began to grow following pseudopodia, 90% of the cells were fused on 7-8 d, and purified BMSCs werefusiform. 24 h cell adherent rate was 99% and before the 4th generation cell cycle was 7 days. After subculture, cycle gradually shortened. The results of surface markers of the third generation MSCs showed thatthe positive rate of CD29 was 98.9%, and the positive rate of CD44 was 73.3%. DAPI labeled BMSCs, the nucleus can see bright blue fluorescence, labeling rate of 100%. ConclusionAdherent separation of rat BMSCs have high purity and strong vitality of BMSCs, and the third generation of BMSCs shows stable biological character.
bone marrow mesenchymal stem cells (BMSCs); cell culture; rats
新疆维吾尔自治区自然科学基金面上项目(2012211A072)
韩玮(1976-),男,博士,主任医师,副教授,研究方向:胰腺疾病。
陈启龙,男,教授,主任医师,研究方向,胰腺疾病,E-mail:chengqilong651003@sohu.com。
R33
A
1009-5551(2016)09-1155-04
10.3969/j.issn.1009-5551.2016.09.019
2016-04-10]
