Shh信号通路对结肠癌细胞侵袭转移的影响
2016-09-22孙亚超丁印鲁孙振强王琦三
孙亚超, 鲁 英, 丁印鲁, 金 博, 孙振强, 王琦三
(新疆医科大学1附属肿瘤医院腹外科, 2公共卫生学院, 乌鲁木齐 830011; 3山东大学第二医院普外科, 济南 250000)
Shh信号通路对结肠癌细胞侵袭转移的影响
孙亚超1, 鲁英2, 丁印鲁3, 金博1, 孙振强1, 王琦三1
(新疆医科大学1附属肿瘤医院腹外科,2公共卫生学院, 乌鲁木齐830011;3山东大学第二医院普外科, 济南250000)
目的探讨激活Shh信号通路对结肠癌细胞侵袭转移的影响。 方法常规培养结肠癌细胞株HT-29细胞,分设对照组(培养液中加入PBS)、信号通路活化组(培养液中加入重组Shh配体,实验组)、信号通路阻断组(培养液中加入Shh信号通路抑制剂KADD-cyclopamine);采用MTT实验、Transwell侵袭小室法,建立人结肠癌术后局部复发裸鼠动物模型、人结肠癌术后肝转移动物模型,分别经尾静脉注射PBS、Shh配体和KADD-cyclopamine,分析Shh配体及Shh信号通路抑制剂KADD-cyclopamine干预Shh信号通路对结肠癌术后局部复发和肝转移的影响。结果Shh配体激活Shh信号通路后检测到结肠癌细胞增殖、迁移及侵袭能力较对照组得到明显促进、增强且变化有统计学意义(P<0.05)。信号活化组与对照组和信号阻断组比较,裸鼠结肠癌术后复发率(50%比30%、30%,P<0.05)、肝转移率(100%比30%、23%,P<0.05)、平均肝转移瘤数目[(23.4±8.8)、(17.6±8.6)、(38.6±3.6)个,P<0.05]均显著升高。结论Shh信号通路参与了结肠癌转移过程,激活Shh信号通路能够促进结肠癌术后局部复发和肝转移;抑制Shh信号通路能够降低结肠癌术后局部复发和肝转移。
Shh信号通路; 结肠癌细胞侵袭转移; 上皮间充质化; KADD-cyclopamine
Hedgehog(Hh)基因于1980 年最初由Nǜsslein-Volhard等[1]在对选择可能导致果蝇突变的基因时发现,果蝇只存在一种Hh基因,研究发现在人类中存在3种,分别是Sonic Hedgehog(Shh)、Indian Hedgehog(Ihh)和Desert Hedgehog(Dhh)基因,这3种不同的Hh基因分别编码相应的蛋白,即Shh、Ihh 和Dhh 3种蛋白[2]。其中Shh蛋白分布最为广泛,其研究也最深入详尽,在哺乳动物的毛发、乳腺、前列腺、肺脏、神经系统及消化系统的发育过程中扮演着十分重要的角色,其过度表达则能够引起肿瘤的发生及肿瘤的侵袭与转移。Ohta等[3]报道,Shh信号通路的异常激活在多种恶性肿瘤的发生、发展过程中发挥着至关重要的作用,包括结肠癌在内的许多肿瘤组织中都能检测到Shh信号通路的异常激活及过度表达状态。另外,有研究发现Shh信号通路相关蛋白Smo、GLi-1的表达及作用与结肠癌的发生、发展及行结肠癌手术术后复发、转移有着密切联系[4-5]。肿瘤细胞的转移和复发是导致结肠癌治疗失败的主要原因,了解结肠癌的侵袭转移机制对抑制降低结肠癌术后的转移复发、提高患者的生存率和生存质量起重要作用。因此,本研究以结肠癌细胞株HT-29细胞为研究对象,采用多种实验方法,应用重组Shh配体及Shh信号通路抑制剂KADD-cyclopamine来激活、阻断结肠癌Shh信号通路,探讨Shh信号通路对结肠癌细胞侵袭转移潜能的影响,以期能为结肠癌细胞的靶向治疗提供理论基础依据,为结肠癌的综合治疗提供一种新的治疗思路。
1 资料和方法
1.1材料与试剂结肠癌细胞株HT-29、PBS溶液、Shh配体、Shh信号通路抑制剂KADD-cyclopamine、RPMI1640稀释的人工基质Matrigel、HE、RT-PCR试剂盒(FSK.100)TOYOBO公司,Westen-blot试剂盒(北京集思佳扬生物有限公司)。
1.2主要仪器CO2培养箱(美国THERMO ELECTRON公司),超净工作台(青岛海尔公司),显微镜(日本Olympus公司),SpectraMax 190连续波长酶标仪(美国MD公司),流式细胞仪(美国BD公司),超低温冰箱(美国THERMO ELECTRON公司),电热恒温水浴箱(上海跃进医疗器械厂),低温超速离心机和低速离心机(日本Hitachi公司),高压蒸汽灭菌器(上海申安医疗有限公司)。
1.3实验方法
1.3.1细胞增殖能力检测采用MTT法。取处于对数生长期的结肠癌细胞株HT-29细胞,密度为1×106/mL,接种于96孔板,每孔100 μL,常规培养12 h,约80%细胞贴壁后,分设对照组(培养液中加入PBS)、信号通路活化组(培养液中加入重组Shh配体,实验组)、信号通路阻断组(培养液中加入Shh信号通路抑制剂KADD-cyclopamine)。各组终体积200 μL。运用全自动酶标仪测定波长为570 nm处的3组细胞集吸光度值(A值)。每组设置为6个复孔,计算均值并记录。
1.3.2Transwell 侵袭和迁移实验
1.3.2.1Transwell 侵袭实验转染48 h 后,常规消化细胞,用PBS 洗涤2 遍,使用Opti-MEMI 培养基重悬。调整细胞密度至1×105个/mL。让后取细胞悬液200 μL 加入到已铺有Matrigel胶的8 μm 孔径Transwell 小室上室,将配置600 μL含10% 胎牛血清的RPMI-1640 培养基加入下室,温度调至37℃、于5% CO2培养16 h后,取出Transwell 小室,轻轻用棉签擦去室内未转移细胞, 95%酒精固定5 min,结晶紫溶液缓慢轻柔染色,PBS 洗涤2 遍,显微镜下观察,随机于显微镜下取上、下、左、右、中心5个视野,分别计数各组穿膜细胞数,采用每个视野的平均数来表示肿瘤细胞的侵袭能力。1.3.2.2Transwell 迁移实验Transwell小室不进行常规Matrigel胶包被,其余实验步骤与“1.3.2.1”项方法相同。随机于显微镜下取上、下、左、右、中心共5个视野,分别计数各组穿膜细胞数,采用每个视野的平均数表示结肠癌细胞的迁移能力。
1.4人结肠癌裸鼠术后复发模型的建立与观察取BALB/c小鼠30只,在小鼠右侧腹皮下接种0.2 mL瘤细胞悬液,3 d后肿瘤生长直径达3 mm后,轻柔推动肿块,于距离肿块边缘>5 mm处切除肿瘤,后行缝合伤口。然后将裸鼠随机分为3组,分别为对照组(培养液中加入PBS)、信号通路活化组(培养液中加入重组Shh配体)、信号通路阻断组(培养液中加入Shh信号通路抑制剂KADD-cyclopamine),每组10只,于手术切除后次日进行药物注射。对照组自尾静脉注射PBS 100 μL,信号通路活化组每日经尾静脉注射2.5 mg/kg体质量的重组Shh配体,阻断组每日经尾静脉注射2.5 mg/kg体质量的信号通路抑制剂KADD-cyclopamine,每日1次,连续14 d,于第8周时开始分别计数、记录各组原肿瘤切除部位出现局部复发的小鼠数目,计算各组肿瘤局部复发率。
1.5人结肠癌肝转移模型的建立和观察取BALB/C小鼠30只,按照40 mg/kg体质量的标准,分别取用1%戊巴比妥钠行腹腔内注射麻醉。术野进行常规皮肤消毒,于左上腹行纵行小切口,进腹后显露并切断胃短血管和胃脾韧带,完全游离脾脏,并将其小心搬出切口外。按照骆成玉[6]与丁印鲁等[7]的研究实验方法,由脾上极进针,缓慢地注入结肠癌细胞株HT-29单细胞悬液0.1 mL,细胞数量为1×106个,注射用时为1 min。之后轻轻按揉注射部位,时间至少达5 min,促使肿瘤细胞能够充分进入门静脉和脾静脉,然后结扎脾蒂,切除脾脏后并关腹。肿瘤细胞种植7 d后开始分别由腹腔缓慢注射生理盐水 (对照组)、重组Shh配体(2.5 mg/kg,信号通路活化组)、Shh信号通路抑制剂KADD-cyclopamine(2.5 mg/kg,信号通路阻断组),每组10只,1次/日,共计3 w。自第7周开始将3组所有裸鼠处死,剖腹探查并详细观察肿瘤转移状况,肉眼分别作肝脏表面肿瘤结节计数和光镜下肝脏剖面的计数并记录。然后摘除裸鼠肝脏,采用10%的中性甲醛溶液进行固定,行规范石蜡包埋,组织切片(厚度为4 μm),选取6个肝脏冠状切面,每一切面间距为0.4 cm,取最大冠状切面于显微镜下观察计数,把不同切面上出现的同一结节计数为一个结节。然后选择显微镜计数和肉眼计数之和为肝脏转移结节的数目,肉眼及镜下未发现转移结节的认为是肝脏转移阴性。
1.6统计学处理对实验记录的所有数据采用SPSS17.0统计软件进行分析,应用单向方差分析中多组样本均数的比较(LSD法),以P<0.05为差异有统计学意义。
2 结果
2.1细胞增殖能力检测结果对照组、信号通路活化组、信号通路阻断组在570 nm处的A值分别为(0.46±0.07)、(0.86±0.08)、(0.35 ±0.05),对照组、信号通路阻断组组间差异无统计学意义(P>0.05),但均显著低于信号通路活化组,差异也均有统计学意义(P<0.05)。提示信号通路活化组Shh配体激活Shh通路对HT-29细胞增殖具有明显的诱导增殖促进作用;然而在培养液中加入KADD-cyclopamine后HT-29细胞增殖数量变化不明显,可见阻断Shh信号通路对HT-29细胞增殖的诱导作用受到抑制。
2.2细胞趋化实验结果3组细胞均能够穿过聚碳酸酯微孔滤膜;对照组和信号通路活化组穿过滤膜细胞数目分别为(92.8±15.2)和(153.8±23.3),两组细胞数目相比差异有统计学意义(P<0.05);信号通路阻断组穿过滤膜的细胞数目为(90.6±16.4),与对照组比较,差异无统计学意义(P>0.05),而与信号通路活化组相比,差异有统计学意义(P<0.05),见图1~5。
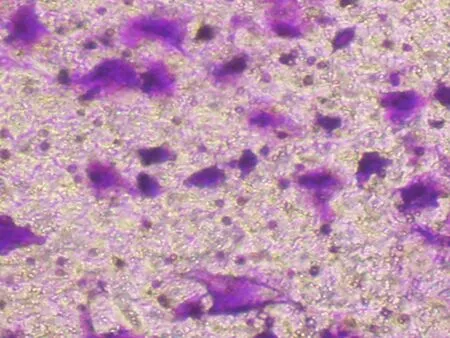
图1对照组细胞迁移

图2实验组细胞迁移

图3对照组细胞侵袭

图4实验组细胞侵袭
2.3Shh配体激活Shh通路对结肠癌术后局部复发的影响对照组和信号通路阻断组各有3只(30%)小鼠原肿瘤切除部位出现复发,而信号通路活化组见5例(50%)出现复发,Shh配体激活Shh信号通路后能够显著促进结肠癌术后的局部复发(P<0.05)(图6)。


2.43组裸鼠结肠癌肝转移的情况术后30只裸鼠全部都成活,术后第3天对裸鼠进行称测体质量,发现每组均有部分裸鼠体质量降低,至术后第7天时基本恢复到术前情况。术后第22天左右,信号通路活化组的部分裸鼠体型消瘦、体质量下降、行动迟缓,有2只出现恶液质表现,分别于24、26 d死亡。其余各组裸鼠均活动良好、饮食良好,平均体质量在实验结束时有所少许上升,每组裸鼠实验前后体质量的变化差异无统计学意义(P>0.05)。发现具有肝脏转移的裸鼠肝表面能够看到多发性的灰白色结节,大小不一,肝脏体积较前变小,质地较硬脆。另外,部分肝脏表面虽未观察到肿瘤结节,但冠状剖面上能够看到芝麻样般细小、大小不等的转移灶。正常肝脏质地柔软,颜色鲜红,剖面无结节,肉眼及显微镜下未能观察检测到转移结节。对照组、信号通路阻断组及信号通路活化组的肝转移率分别为30%、23%、100%,平均肝转移瘤数目分别为(23.4±8.8)、(17.6±8.6)、(38.6±3.6)个,信号通路活化组的肝转移率和平均肝转移数目均显著高于对照组,信号通路阻断组转移结节且较其他两组差异有统计学意义(P<0.05)。
3 讨论
恶性肿瘤的侵袭转移是一个多基因、多因素、多步骤的一系列连续序贯的复杂过程,肿瘤细胞间黏附力的减弱、接触面的缩小和迁移运动力的增强被认为是肿瘤细胞发生侵袭转移的重要基础[8]。Forbes等[9]研究者在1993年通过对果蝇基因的研究分析后,首次提出Hedgehog信号通路(Hedgehog signaling,Hh信号通路) 的概念报道。之后,对Hh信号通路的不断研究深入发现在人类中存在着3 种Hh 的同源基因: Sonic Hedgehog(Shh) India Hedgehog(Ihh) 和Desert Hedgehog(Dhh)。Sonic hedgehog(Shh)信号通路是人类胚胎发育的过程中调控细胞增殖和组织分化的重要信号通路之一,主要是由跨膜蛋白受体Ptch、分泌型信号糖蛋白Shh配体、跨膜蛋白Smo和下游转录因子Gli蛋白组成4种不同功能蛋白组成的复合物。当没有Shh配体信号的有效刺激时,Shh信号通路是处于失活状态,不能引起相应的生物效应 ;而当细胞中存在Shh配体时,Shh配体便能够与跨膜蛋白受体Ptch相结合,进而解除了Ptch对Smo的抑制作用,使得Smo进入胞浆内,触发细胞内信号向下传导,并通过激活下游转录因子Gli蛋白,进一步启动一系列多种靶基因的转录,产生相关生物学效应[10]。在整个Shh信号通路传导的过程中,Shh配体与Smo是Shh信号通路中的激动因子,Ptch是抑制因子,而转录因子Gli被认为是能够反映Shh信号传导通路活化水平的重要标志分子[11]。朱达坚等[12]研究发现Shh信号通路相关蛋白Gli-1、Smo的表达与结肠癌的发生、发展有着十分密切联系,其高表达能够促进结肠癌的发生。Douard等[13]研究报道在约86%的结直肠癌病例癌组织中存在着Shh mRNA的过表达,而Gli-l的表达与Shh密切相关。本研究发现,Shh配体通过激活Shh信号通路可以诱导结肠癌HT-29细胞显著增殖,而这种增殖作用也可以被Shh信号通路抑制剂KADD-cyclopamine所抑制,这表明Shh配体激活Shh信号通路能够对结肠癌HT-29细胞增殖具有促进调节作用,而这种增殖调节作用很有可能为癌细胞进一步向其他组织、器官迁移侵袭定植生长提供了转移细胞的基础。
与重组Shh配体相比,cyclopamine是一种类固醇植物碱,可以从百合花科类植物等当中提取利用,它是一种Hh信号通路的拮抗剂,作用于Smoothened(Smo),通过特异性对抗Smo来抑制hedgehog信号的活性[14]。近年来研究证实cyclopamine对肿瘤细胞hedgehog信号通路的阻断作用与smo突变作用密切相关,而这种突变存在于恶性肿瘤中的发生率较高,这也就是很多hedgehog信号活化的肿瘤细胞对cyclopamine不敏感的主要原因之一[15]。Shh信号通路抑制剂KADD-cyclopamine是cyclopamine的一种衍生物,和cyclopamine具有类似抗Smo的效果,同样能够通过抑制Smo的作用从而来发挥抗hedgehog信号的作用[16]。
本研究应用Shh信号通路抑制剂KADD-cyclopamine来阻断Shh信号通路,结果发现信号通路阻断组的小鼠结肠癌切除后局部复发率和肝转移率降低,表明KADD-cyclopamine可以通过作用Smo来抑制Shh信号通路的下传,进而抑制、降低结肠癌切除后肿瘤局部复发率和肝转移。
综上所述,本研究通过对3组不同处理水平的结肠癌细胞增殖、迁移及小鼠的肿瘤细胞复发、肝转移结节情况分析,发现运用重组Shh配体激活Shh信号通路能够调控结肠癌细胞增殖、增强促进细胞迁移及侵袭能力,同时也可以明显提高小鼠结肠癌切除后局部复发率和肝转移发生。而经KADD-cyclopamine抑制Shh信号通路后,发现结肠癌细胞的增殖能力与迁移侵袭能力减弱,结肠癌切除后局部复发率和肝转移机率也明显降低。由此推测,Shh信号通路的激活参与了结肠癌细胞的增殖、迁移侵袭及促进了包括术后肝转移在内的一系列过程,并在这一过程中发挥着重要作用。至于在Shh信号通路激活的状态下,肿瘤细胞侵袭转移的具体机制有待进一步科学实验研究。或许未来,可以通过抑制Shh信号通路来抑制结肠癌的复发与转移,从而为结肠癌的生物靶向治疗提供一种新的精准治疗思路与策略。
[1]Nüssleinvolhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila[J].Nature, 1980, 287:795-801.
[2]Stecca B,Mas C,Clement V,et al. Melanomas require HEDGE-HOG-GLI signaling regulated by interactions between GLI1 and the RAS-MEK/AKT pathways[J]. Proc Natl Acad Sci USA,2007,104(14):5895-5900.
[3]Ohta M,Tateishi K,Kanai F, et al.p53- Independent negative regulation of p21/cyclin dependent kinase-interacting protein 1 by the Sonic hedgehog-glioma-associated oncologenepathway in gastric carcinoma cells[J]. Cancer Res,2008,65(23):10822-10829.
[4]纪志鹏, 王琦三, 丁印鲁, 等. Smo基因在结肠癌组织中的表达及其与术后肝转移的关系[J]. 中国现代普通外科进展,2012,15(11):20-24.
[5]Ding Yl, Wang QS, Zhao WM, et al. Expression of smoothened protein in colon cancer and its prognostic value for postoperative liver metastasis[J]. Asian Pac J Cancer Prev,2012,13(8):3825-3829.
[6]骆成玉,赵丹宁,李世拥,等.内皮抑素对结肠癌肝转移的干预作用[J].中华外科杂志,2001,39(3):188-190.
[7]丁印鲁,傅勤烨,唐思锋,等.血管生成抑制剂SU6668联合5一Fu对人结肠癌裸鼠移植瘤肝转移的影响[J].山东大学学报:医学版,2007,45(2):168-170.
[8]Geiger TR, Peeper DS. Metastasis mechanisms[J]. Biochem Biophys Acta, 2009, 1976(2):293-300.
[9]Forbes AJ,Nakano Y,Taylor AM,et al. Genetic analysis 0f hedgehog signalling in the Drosophila embryo[J].Development Supplement,1993: 115-124.
[10]Kayed H,KLeeff J, Osman T,et al.Hedgehog signaling in the normal and diseased pancreas[J].Pancreas,2006,32:119-129.
[11]田孝东,杨尹默,汤坚强,等. Hedgehog信号通路对胰腺癌细胞增殖的影响[J].中华普通外科杂志,2008,23(2):129-132.
[12]朱达坚 .Smo蛋白及Glil蛋白在结直肠癌组织中的表达及其意义[J].广东医学,2009,30(50):757-759.
[13]Douard R,Moutereau S,Pernet P.Sonic Hedgehog-dependent proliferation in a series of patients with colorectal cancer[J].Surgery,2008,139(5):665-670.
[14]Chen JK,Taipale J,Cooper MK,et al.Inhibition of hedgehog signaling by direct binding of cyclopamjne to Smoothened[J].Genes Dev,2002,16:2743-2748.
[15]Huang S,He J,zhang X,et al.Activation of the hedgehog pathway in human hepatocellular carcinomas[J]. Carcinogenesis,2006,27:1334-1340.
[16]Taipale J,Chen JK,cooper MK,et al.Effects of oncogenic mutations in smoothened and Patched can be reversed by cyclopamine[J].Nature,2000,406:1005-1009.
(本文编辑张巧莲)
The effect of sonic hedgehog signaling pathway blocking on incursion and metastasis of colon cancer cell
SUN Yachao1, LU Ying2, DING Yinlu3, JIN Bo1, SUN Zhenqiang1, WANG Qisan1
(1DepartmentofAbdominalSurgery,AffiliatedTumorHospital,2CollegeofPublicHealth,XinjiangMedicalUniversity,Urumqi830011,China;3DepartmentofGeneralSurgery,TheSecondHospitalofShandongUniversiyt,Jinan250000,China)
ObjectivesTo assess the effect of sonic hedgehog (Shh) signaling pathway blocking on incursion and metastasis of colon cancer cell. MethodsRoutinely cultured colon cancer HT-29 cells were devided into three groups:control group (PBS in broth),signal pathway group (recombinant shh ligand in PBS ), signal pathway blocking group (adding Shh signaling pathway inhibitor KADD-cyclopamine in broth); MTT assay, Transwell Boyden chamber assay were used respectively. Local recurrence model and 1iver metastasis model of human colon cancer in nude mouse were constructed with injecting Saline, PBS, Shh ligand and Shh inhibitor KADD-cyclopamine via tail vein respectively.Analysze Shh and Shh signaling ligand blockade on KAAD-cyclopamine intervention Shh signaling in colon cancer local recurrence and hepatic metastasis. ResultsAfter the ligand-activated Shh Shh signaling pathway in colon cancer cells, proliferation, migration and invasion abilities promoted and enhanced ignificantlythan the control groups. After the ligand-activated Shh Shh signaling pathway in colon cancer cells to be detected (P<0.05). Compared with other two groups, tumor local recurrence rate (50% vs. 30% vs. 30%, P<0.05),live metastasis rate (100% vs. 30% vs. 23%, P<0.05) and mean live metastasis number [(23.4±8.8) vs (7.6±8.6) vs (38.6±3.6),P<0.05] were significantly increased in Signal pathway group. ConclusionShh signaling pathway is involved in colon cancer metastasis, activation of Shh signaling pathway can promote local recurrence and liver metastasis of colon cancer. Inhibition of Shh signaling pathway can reduce the local recurrence of colon cancer and liver metastases.
Shh signal pathway; colon cancer cell invasion and metastasis; epithelial-mesenchymal transition; KADD-cyclopamine
新疆维吾尔自治区自然科学基金(2013211A066)
孙亚超(1991-),男,在读硕士,研究方向:胃肠肿瘤的基础研究与防治。
王琦三,男,主任医师,副教授,硕士生导师,研究方向:胃肠肿瘤的基础研究与防治,E-mail:wangqisan2008@163.com。
R735.3+; R34
A
1009-5551(2016)09-1142-05
10.3969/j.issn.1009-5551.2016.09.016
2016-03-19]
