不同严重程度溃疡性结肠炎炎症因子表达水平的临床研究
2016-09-22熊真
熊真
不同严重程度溃疡性结肠炎炎症因子表达水平的临床研究
熊真
目的探究不同严重程度的溃疡性结肠炎血清CRP、PCT、TNF-α、IL-6、IL-8水平。方法收集2011年5月至2014年10月在我院消化内科治疗的90例UC患者及30例健康体检者,测定健康体检者、活动期与缓解期UC患者血清CRP、PCT、TNF-α、IL-6、IL-8水平,比较健康体检者、活动期与缓解期UC患者的炎症介质水平,比较不同严重程度活动期UC患者血清炎症介质水平。结果UC缓解期与健康者血清CRP、PCT、TNF-α、IL-6、IL-8水平无明显差异(P >0.05),而UC活动期血清炎症因子水平明显高于健康者与UC缓解期(P<0.05),轻度、中度、重度UC患者血清CRP、PCT、TNF-α、IL-6、IL-8水平差异均有统计学意义(P<0.05),其中重度UC患者血清炎症因子水平最高,中度UC患者次之,轻度UC患者最低。结论血清CRP、PCT、TNF-α、IL-6、IL-8等炎性介质在UC的发生与发展中有重要作用,可作为UC的病情严重程度、治疗效果及预后的重要评估手段。
溃疡性结肠炎;炎症;免疫;代谢
溃疡性结肠炎(UC)是一种累及结直肠黏膜、黏膜下层的慢性非特异性炎症,常发生于20~40岁的青年男女[1]。患者常表现为长期反复发作的腹痛、腹泻、粘液脓血便[2-3]。且UC病程长、病情复杂、可癌变、治愈难度大,已成为临床医师面临的非常棘手的疾病[4]。其发病机制目前尚未明确[5],研究显示遗传、免疫、感染、环境因素均与UC的发病相关,其中活化的炎性细胞及各种炎性介质如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等介导的肠道异常免疫反应在UC的发病中起重要作用[6-7]。本研究通过探究不同严重程度的UC炎症因子的表达水平,旨在进一步揭示UC的发病机制,为UC的临床治疗提供指导。
资料和方法
一、临床资料
收集2011年5月至2014年10月在我院消化内科治疗的90例UC患者的临床资料,依据Truelove-Witts标准将UC分为轻度、中度、重度,其中轻度25例,男14例、女11例,年龄22~53岁,平均(36.8±6.5)岁;中度35例,男20例、女15例,年龄28~59岁,平均(36.2±7.1)岁;重度30例,男18例、女12例,年龄25~55岁,平均(36.3±7.2)岁。根据中华医学会消化学分会2007年制定的UC诊断标准按疾病严重程度将UC患者分为活动期患者42例,UC缓解期患者48例。另取在我院健康体检者30例,所有体检者均无胃肠道疾病、免疫系统疾病、良恶性肿瘤、肝肾功能不全等,其中男17例、女13例,年龄27~65岁,平均(36.5±7.5)岁;各组年龄、性别等基线资料差异均无统计学意义(P>0.05),具有可比性。
二、入选标准
1.纳入标准
①患者均符合《对我国炎症性肠病诊断治疗规范的共识意见》[8]中关于UC诊断标准;②所有患者均有不同严重程度的临床表现,内镜及实验室检查确诊为UC;③未合并如放射性结肠炎、有癌变倾向的桂阳县结肠炎等对本研究结果有影响的疾病;④医学伦理委员会审核批准且病人及其家属知情同意。
2.排除标准
①近期服用糖皮质激素或免疫抑制剂治疗者;②孕妇或哺乳期妇女;③肝肾功能不全者及心力衰竭者;④合并结直肠良恶性肿瘤、类风湿性关节炎、系统性红斑狼疮等自身免疫疾病。
三、检测方法
所有患者及健康体检者于清晨空腹抽取10 mL血清,EDTA抗凝后置于-80℃冰箱保存,C反应蛋白(CRP)采用韩国艾可美免疫荧光分析仪和德国罗氏公司提供的试剂盒并通过免疫比浊法测定其血清水平;前降钙素(PCT)采用德国罗氏公司411电化学发光分析仪及其提供的试剂盒并通过固相免疫色谱法测定其血清水平;TNF-α、IL-6、IL-8采用军事医学科学院邦定生物公司提供的试剂盒并通过放射免疫法测定其血清水平。所有炎性介质血清水平的测定均严格按照相关仪器的操作标准及试剂盒的说明书严格执行。
四、统计分析
实验所得数据采用SPSS 20.0行统计学处理,计量资料以x±s来表示,组间比较采用方差分析,计数资料以%表示,采用χ2检验,P<0.05为差异有统计意义。
结果
一、UC患者与健康体检者血清炎症因子水平比较
健康体检者与UC缓解期患者血清CRP、PCT、TNF-α、IL-6、IL-8水平差异无统计学意义(P>0.05),UC活动期患者血清CRP、PCT、TNF-α、IL-6、IL-8水平明显高于健康体检者与UC缓解期患者,差异有统计学意义(P<0.05),见表1。
二、不同严重程度UC血清炎症因子水平比较
轻度、中度、重度UC患者血清CRP、PCT、TNF-α、IL-6、IL-8水平差异均有统计学意义(P<0.05),其中重度UC患者血清炎症因子水平最高,中度UC患者次之,轻度UC患者最低,见表2。
讨论
表1 UC患者与健康体检者血清炎症因子水平比较(±s)

表1 UC患者与健康体检者血清炎症因子水平比较(±s)
注:*与健康体检者比较,P<0.05。#与UC缓解期比较,P<0.05。
组别nCRP(mg/L)PCT(ng/L)TNF-α(ng/L)IL-6(ng/L)IL-8(ng/L)健康体检者302.82±0.760.03±0.0222.72±4.3724.88±5.9826.93±6.52 UC缓解期483.05±1.240.04±0.0323.35±5.2825.12±5.6727.23±6.74 UC活动期428.81±2.13*#0.16±0.10*#45.09±8.73*#53.11±6.52*#55.53±6.73*#F值-3.2192.8843.0253.1253.001 P值-0.0350.0430.0380.0360.039
表2 不同严重程度UC血清炎症因子水平比较±s)
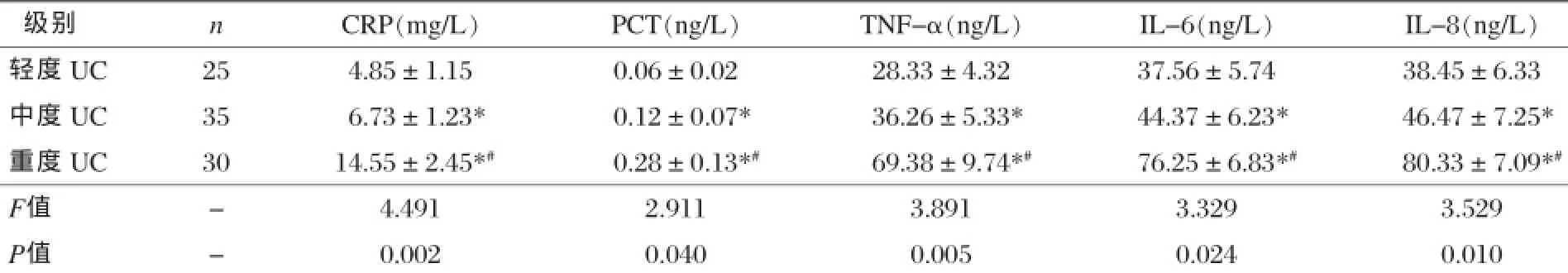
表2 不同严重程度UC血清炎症因子水平比较±s)
注:*与轻度UC比较,P<0.05。#与中度UC比较,P<0.05。
级别nCRP(mg/L)PCT(ng/L)TNF-α(ng/L)IL-6(ng/L)IL-8(ng/L)轻度UC254.85±1.150.06±0.0228.33±4.3237.56±5.7438.45±6.33中度UC356.73±1.23*0.12±0.07*36.26±5.33*44.37±6.23*46.47±7.25*重度UC3014.55±2.45*#0.28±0.13*#69.38±9.74*#76.25±6.83*#80.33±7.09*#F值-4.4912.9113.8913.3293.529 P值-0.0020.0400.0050.0240.010
UC发病机制复杂,UC肠道病理显示黏膜弥漫性炎症、溃疡、隐窝脓肿等,黏膜固有层伴有大量单核细胞、嗜酸性粒细胞、中性粒细胞、浆细胞、淋巴细胞等的浸润。目前普遍认为异常免疫反应是UC发病中关键环节之一,外界环境因素(如微生物感染等)作用于UC遗传易感人群,外界抗原的刺激激活了UC患者体内免疫系统,大量炎性细胞活化、炎症因子释放、黏附分子异常表达,结肠或直肠黏膜聚集大量炎性介质及细胞,诱发肠道弥漫性炎症及溃疡[9]。内镜检查是判断UC活动性及严重程度、评估治疗效果、监测癌前病变的金标准,然而内镜作为一种侵入性检查不易被患者接受,且内镜下肠道黏膜溃疡、弥漫性炎性细胞浸润、隐窝脓肿、黏膜血管及肉芽组织增多等表现均不是UC特异性诊断指标,UC的诊断及病情评估是依据内镜、血清炎症因子测定、粪便检查等综合性指标[10]。本研究通过探究不同严重程度UC患者血清炎症因子水平,结果提示UC缓解期与健康者血清CRP、PCT、TNF-α、IL-6、IL-8水平无明显差异,而UC活动期血清炎症因子水平明显高于健康者与UC缓解期,且随着UC病情加重,血清炎症因子水平逐渐增高,提示血清CRP、PCT、TNF-α、IL-6、IL-8水平可作为UC病情活动及严重程度的重要评估指标。
CRP是一种肝脏组织产生的急性期反应蛋白,正常状态下其血清水平极低,然而在炎症反应急性期、系统性红斑狼疮等免疫系统疾病、良恶性肿瘤状态下其血清水平明显增高。既往研究发现活动期UC患者CRP血清水平明显高于缓解期,且随着疾病严重程度而增高,经合理内科治疗后明显降低,与本研究结果相符[11]。PCT是细菌感染、内毒素刺激等多种因素作用下机体产生的炎性介质,慢性炎症及变态反应不会对血清PCT水平产生较大的影响,而急性炎症反应如严重细菌感染或脓毒症等则明显增加血清PCT水平,活动期UC患者血清PCT增高可能与微生物的刺激相关[12]。
TNF-α是由T细胞、巨噬细胞、单核细胞等产生的炎性介质,其能有效刺激巨噬细胞、平滑肌细胞、内皮细胞、纤维母细胞等产生蛋白酶、细胞因子及前列腺素等花生四烯酸代谢产物,TNF-α可刺激胃肠细胞吞噬补体片段产生坏死,加速结肠黏膜细胞凋亡,诱导间质蛋白破坏,加速局部水肿,协助干扰素改变肠道上皮细胞的屏障特性及形态结构,增加肠黏膜通透性,促进UC患者由缓解期向活动期转化,UC患者病情进展与血清TNF-α水平密切相关[13]。IL-6是由淋巴细胞、巨噬细胞、上皮细胞产生生物活性类似于IL-1β的炎性介质,其通过多种途径提高细胞间粘附分子水平的表达,增加肠道上皮细胞与中性粒细胞之间的相互作用,进而达到促进局部炎症进展的效应[14]。IL-8是单核细胞、淋巴细胞、上皮细胞、纤维母细胞等产生的中性粒细胞的趋化及活化因子[1 5],其能有效趋化中性粒细胞、嗜碱性粒细胞等炎性细胞,许多炎症因子如IL-6介导的炎症反应均与高血清水平的IL-8相关,血清IL-6、IL-8水平均可作为UC患者肠道炎症进展程度及病情判断指标之一。
综上所述,血清CRP、PCT、TNF-α、IL-6、IL-8等炎性介质在UC的发生与发展中有重要作用,可作为UC的病情严重程度、治疗效果及预后的重要评估手段。
[1]周艳利,刘丽,宋淑霞,等.核因子-E2相关因子2在溃疡性结肠炎中的表达及其与氧化应激的关系[J].中华消化杂志,2014,34 (6):401-403.
[2]Nirei T,Kazama S,Hiyoshi M,et al.Successful treatment of rectovaginal fistula complicating ulcerative colitis with infliximab:a case report and review of the literature[J].J Clin Med Res,2015,7 (1):59-61.
[3]Taghvaei T,Maleki I,Nagshvar F,et al.Fecal calprotectin and ulcerative colitis endoscopic activity index as indicators of mucosal healing in ulcerative colitis[J].Intern Emerg Med,2015,10(3):321-328.
[4]孙菁,袁耀宗.美沙拉秦缓释片治疗活动期溃疡性结肠炎的多中心、单盲、随机对照研究[J].中华消化杂志,2015,35(4):252-255.
[5]刘华龙,周嘉嘉,吴仙蓉.细胞因子对溃疡性结肠炎活动性的评价[J].中华临床医师杂志(电子版),2015,9(6):929-931.
[6]Matsumura K,Nakase H,Kosugi I,et al.Establishment of a novel mousemodelofulcerativecolitiswithconcomitantcytomegalovirus infection:in vivo identification of cytomegalovirus persistent infected cells[J].Inflamm Bowel Dis,2013,19(9):1951-1963.
[7]郭虹,曹蕾,王瑞芳.溃疡性结肠炎患者血清IL-1β和IL-18的表达和临床意义[J].中国急救医学,2015,35(7 Suppl):45-46.
[8]中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见(2007年,济南)[J].中华消化杂志,2007,27(8):545-550.
[9]Araki T,Okita Y,Fujikawa H,et al.Full mucosal proctectomy initiated below the dentate line may prevent the development of a perianal fistula after ileal pouch-anal anastomosis for ulcerative colitis[J].Dig Surg,2013,30(3):219-224.
[10]Aggarwal R,Gupta P,Chopra P,et al.Rectal cap polyposis masquerading as ulcerative colitis with pseudopolyposis and presenting as chronic anemia:a case study with review of literature[J].Saudi J Gastroenterol,2013,19(4):187-189.
[11]Stallmach A,Nickel L,Lehmann T,et al.Parameters of a severe disease course in ulcerative colitis[J].World J Gastroenterol,2014,20(35):12574-12580.
[12]Koido S,Ohkusa T,Takakura K,et al.Clinical significance of serum procalcitonin in patients with ulcerative colitis[J].World J Gastroenterol,2013,19(45):8335-8341.
[13]Meijs S,Gardenbroek T J,Sprangers M A,et al.Health-related quality of life and disability in patients with ulcerative colitis and proctocolectomy with ileoanal pouch versus treatment with anti-TNF agents[J].J Crohns Colitis,2014,8(7):686-692.
[14]Atreya R,Billmeier U,Rath T,et al.First case report of exacerbated ulcerative colitis after anti-interleukin-6R salvage therapy[J]. World J Gastroenterol,2015,21(45):12963-12969.
[15]Yu J,He S,Liu P,et al.Interleukin21 promotes the development of ulcerative colitis and regulates the proliferation and secretion of follicular T helper cells in the colitides microenvironment[J].Mol Med Rep,2015,11(2):1049-1056.
(本文编辑:吴保平)
10.3969/j.issn.1672-2159.2016.03.018
435500湖北省黄梅县骨科医院内科
2016-01-13)
