GLP-1对大肠肿瘤合并糖尿病机制的探讨
2016-09-22包艳春甘学军关秀军胡亚丹
包艳春 甘学军 关秀军 胡亚丹
GLP-1对大肠肿瘤合并糖尿病机制的探讨
包艳春甘学军关秀军胡亚丹
目的探讨胰高血糖素样肽-1(GLP-1)与大肠癌合并糖尿病患者的相关性,以及其对大肠癌合并糖尿病的诊治价值。方法以我院治疗的80例大肠癌合并糖尿病患者作为观察组,同期于我院进行健康体检的80例健康人为对照组,采用酶联免疫吸附法(ELISA)、免疫荧光等技术对两组血糖、GLP-1水平与肠道胰高血糖素-1免疫反应细胞(GLP-1IR)进行检测,并比较两组各项检测指标。结果观察组血糖水平明显高于对照组(P<0.05);观察组血清GLP-1水平明显低于对照组(P<0.05);观察组回盲部、升结肠、回肠、降结肠与直肠各部位的GLP-1IR细胞密度均明显低于对照组(P <0.05)。结论大肠肿瘤合并糖尿病患者血清GLP-1水平低于正常人群,且肠道各部位GLP-1IR细胞密度明显低于正常人群;大肠癌患者GLP-1与肠道GLP-1IR细胞减少可能是导致糖尿病发病的相关因素;对大肠癌合并糖尿病患者实施血清GLP-1水平与肠道GLP-1IR细胞检测、提前干预患者血糖水平,对减少并发症的发生,预防可能出现的难治性高危状况具有重要意义。
正常人;大肠癌;血糖;血清GLP-1;肠道GLP-1IR
流行病学研究发现,糖尿病与大肠癌存在一定相关性,但机制不详,随着对GLP-1研究的逐渐加深,发现其主要由直肠L细胞分泌,参与降糖作用[1],而大肠癌80%为直肠癌,那么GLP-1是否为大肠癌并发糖尿病的重要机制。本项目拟运用ELISA、免疫荧光等技术,通过对正常人与大肠癌患者血糖、GLP-1、肠道GLP-1IR进行测定,以明确大肠癌患者GLP-1变化及其对血糖异常的影响机制。
资料与方法
一、一般资料
以2013年12月至2015年12月于我院治疗的80例大肠癌合并糖尿病患者作为观察组,同期于我院进行健康体检的80例健康人为对照组。观察组男性51例,女性29例;年龄48~86岁,平均年龄(62.4±6.2)岁;病程3~11年,平均病程(5.3±2.1)年。对照组男性49例,女性31例;年龄43~82岁,平均年龄(63.2±5.9)岁。两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
二、方法
所有受试者于入院次日清晨抽取空腹肘静脉血4 mL,血标本用干燥肝素试管收集,保持环境温度维持在4℃左右,对血标本进行离心处理(转速:3 000 r/min;处理时间:15 min),取上清液,采用氧化酶法检测静脉血血糖;采用酶联免疫吸附法检测GLP-1。采用免疫荧光检测肠道GLP-1IR细胞:取所有受试者的消化道组织标本,并将标本制成石蜡切片,对切片进行脱蜡,免疫荧光染色处理后,在显微镜下(400倍)观察GLP-1IR细胞。
三、统计学处理
实验数据录入SPSS 14.0统计软件进行处理,计量资料以±s表示,采用t检验,计数资料以%表示,采用秩和检验,当P<0.05时,差异具有统计学意义。
结果
一、两组血糖与GLP-1水平比较
观察组血糖水平明显高于对照组;观察组血清GLP-1水平明显低于对照组;差异均具有统计学意义(P<0.05),见表1。
表1 两组血糖与GLP-1水平比较(±s)

表1 两组血糖与GLP-1水平比较(±s)
注:*与对照组比较,P<0.05。
组别n血糖水平(mmol/L)血清GLP-1(pmol/L)观察组807.59±0.35*26.34±5.25*对照组804.96±0.7535.76±4.95 t值-28.4211.67 P值-0.00000.0000
二、两组肠道各部位GLP-1IR比较
观察组回盲部、升结肠、回肠、降结肠与直肠各部位的GLP-1IR细胞密度均明显低于对照组(P<0.05),见表2。
三、肠道GLP-1IR细胞光镜下特点
直肠L细胞呈棕红色,且回盲部、升结肠、回肠、降结肠与直肠各部位的L细胞密度不同,散在分布于肠腺柱状上皮细胞间,以肠腺基底部最多,形状与圆锥体相似,细胞尖端部位指向肠腺腔内。
讨论
结直肠癌发病率呈逐年上升趋势,对人类的健康造成严重威胁。与此同时,由于人们生活水平不断提高,饮食结构的改变与老年人口的增加,糖尿病患者也逐年增加,成为继肿瘤、心血管疾病之后的又一严重威胁大众生命健康的慢性疾病[2]。有文献[3]报道,约有95%以上的糖尿病患者为2型糖尿病。结直肠癌与2型糖尿病两者之间的关系引起了国内外学者的重视,目前,国外已有研究表明,结直肠癌的发生、发展与2型糖尿病具有密切的关系[3]。除此之外,也有研究显示,大肠癌合并糖尿病的发病率逐年增加。并认为2型糖尿病对结直肠癌的预后存在一定程度的影响,长期高血糖、胰岛素抵抗、胰岛素生长因子-1与高胰岛素血症等是影响结直肠癌预后的主要因素[4]。随着人们对GLP-1研究的逐渐加深,发现其主要由直肠L细胞分泌,参与降糖作用,这提示我们,血清GLP-1水平的变化可能与大肠癌合并糖尿病的发病有关[5]。
表2 两组各肠道部位GLP-1IR比较±s,细胞数/400倍视野)
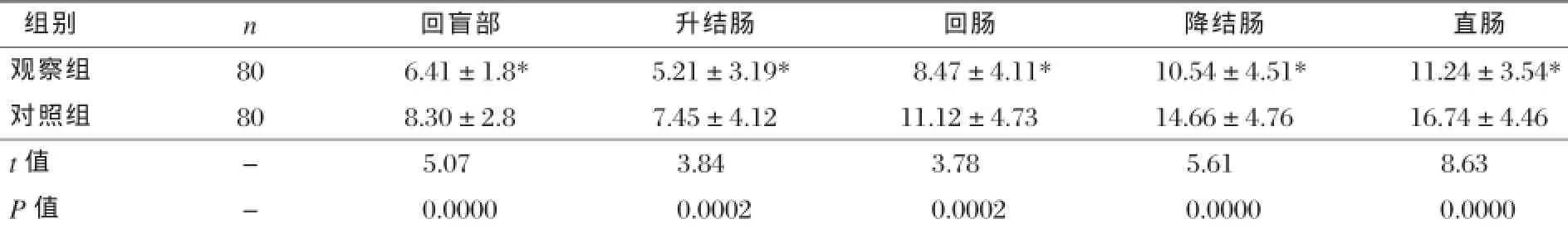
表2 两组各肠道部位GLP-1IR比较±s,细胞数/400倍视野)
注:*与对照组比较,P<0.05。
组别n回盲部升结肠回肠降结肠直肠观察组806.41±1.8*5.21±3.19*8.47±4.11*10.54±4.51*11.24±3.54*对照组808.30±2.87.45±4.1211.12±4.7314.66±4.7616.74±4.46 t值-5.073.843.785.618.63 P值-0.00000.00020.00020.00000.0000
通过对DNA与cDNA片断序列的分析,使人们对高血糖相关肽有了进一步的了解。GLP-1不但可抑制β细胞的凋亡,同时还具有促进胰岛β细胞增殖的作用,从而使胰岛β细胞的数量增加,并使β细胞的功能得到改善,对葡萄糖的敏感性增加[6-7]。GLP-1还能够刺激胰岛α与δ细胞,起到抑制胰高血糖素生成与释放的作用,从而使胰岛素分泌,达到降低血糖的目的[8]。在本次研究中,观察组血糖水平高于对照组,而血清GLP-1水平低于对照组,差异具有统计学意义(P <0.05)。说明,大肠癌合并糖尿病患者血糖水平高于正常人群,而GLP-1水平低于正常人群,大肠癌合并糖尿病患者血糖浓度上升可能与其血清GLP-1水平降低有关。GLP-1属于一种强降血糖肽,由L细胞分泌,分泌量受碳水化合物与脂类等营养物质的影响[9]。GLP-1促胰岛素分泌作用与血糖浓度有关,当血糖水平处于正常范围时,GLP-1不会发挥促胰岛素分泌作用,使血糖水平降低;当血糖水平较高时,GLP-1才能发挥促胰岛素分泌作用,使血糖水平降低[10]。GLP-1上述特性对预防低血糖的发生具有重要意义。已有研究证实,糖尿病患者GLP-1分泌减少,导致血糖进一步上升,而高浓度血糖作为肿瘤的主要能量来源,有助于肿瘤细胞的生长,而且,长期高血糖对毛细血管造成影响,阻碍血管对氧的运输,肿瘤细胞对无氧耐受性较高,这促使正常细胞诱变为肿瘤细胞[11]。可见,大肠癌与血糖是相互影响的。在本次研究中,观察组回盲部、升结肠、回肠、降结肠与直肠各部位的GLP-1IR细胞密度均明显低于对照组,差异具有统计学意义(P<0.05),这与Koole C等[12]研究结果一致。说明大肠癌合并糖尿病患者直肠各部位的L细胞存在的GLP-1IR细胞减少,这可能与肿瘤导致大肠病变有关。
综上所述,大肠肿瘤合并糖尿病患者血清GLP-1水平低于正常人群,且肠道各部位GLP-1IR细胞密度明显低于正常人群;大肠癌患者GLP-1与肠道GLP-1IR细胞减少可能是导致糖尿病发病的相关因素;对大肠癌合并糖尿病患者实施血清GLP-1水平与肠道GLP-1IR细胞检测、提前干预患者血糖水平,对减少并发症的发生,预防可能出现的难治性高危状况具有重要意义。
[1]吕丰香,魏良洲,田字彬,等.迷走神经复合体注射GLP-1对糖尿病大鼠下丘脑GLP-1受体表达及胃排空的影响[J].胃肠病学和肝病学杂志,2013,22(4):333-336.
[2]Koshiyama A,Ichibangase T,Imai K,et al.Comprehensive fluorogenic derivatization-liquid chromatography/tandem mass spectrometry proteomic analysis of colorectal cancer cell to identify biomarker candidate[J].Biomed Chromatogr,2013,27(4):440-450.
[3]Luo J,Lin HC,He K,et al.Diabetes and prognosis in older persons with colorectal cancer[J].Br J Cancer,2014,110(7):1847-1854.
[4]马凤丽,王新颖,彭亮,等.CCR2在结直肠癌的表达及意义[J].现代消化及介入诊疗,2012,17(2):78-80.
[5]Lee KS,Shin JS,Kwon YS,et al.Suppression of Cancer Progression and Metastasis in HT-29 Human Colorectal Adenocarcinomas by Deep Sea Water[J].Biotechnology and Bioprocess Engineering,2013,18(1):194-200.
[6]王冲.治疗糖尿病的中国药物专利分析--以胰高血糖素样肽-1 (GLP-1)类药物为例[J].科技管理研究,2014,34(3):146-152.
[7]刘艳,田秀标,韩颖,等.GLP-1受体激动剂呈葡萄糖依赖性刺激胰岛β细胞胰岛素分泌的机制[J].国际内分泌代谢杂志,2015,35(1):66-69.
[8]胡潇红,沙卫红,林锋,等.大肠癌干细胞基因Bmi-1的表达及临床病理意义[J].现代消化及介入诊疗,2011,16(1):1-5.
[9]Kim S,Lee S,Maeng YH,et al.Study of Metabolic Profiling Changes in Colorectal Cancer Tissues Using 1D 1H HR-MAS NMR Spectroscopy[J].Bulletin of the Korean Chemical Society,2013,34(5):1467-1472.
[10]翁建平.人胰高血糖素样肽-1受体激动剂的作用机制[J].中国老年学杂志,2015,35(20):5981-5983.
[11]Chen Y,Chen G,Feng S,et al,Label-free serum ribonucleic acid analysis for colorectal cancer detection by surface-enhanced Raman spectroscopy and multivariate analysis[J].J Biomed Opt,2012,17(6):067003.
[12]Koole C,Wootten D,Simms J,et al.Second extracellular loop of human glucagon-like peptide-1 receptor(GLP-1R)has a critical role in GLP-1 peptide binding and receptor activation[J].J Biol Chem,2012,287(6):3642-3658.
(本文编辑:任玥欣)
10.3969/j.issn.1672-2159.2016.03.015
430000武汉市第八医院内二科
胡亚丹
武汉市卫生局科研项目(WX14Z01)
2016-02-24)
