联合门静脉/肠系膜上静脉切除重建的胰十二指肠切除术治疗胰腺癌疗效分析
2016-09-21房炯泽陆才德黄斌吴胜东
房炯泽,陆才德,黄斌,吴胜东
联合门静脉/肠系膜上静脉切除重建的胰十二指肠切除术治疗胰腺癌疗效分析
房炯泽,陆才德,黄斌,吴胜东
目的探讨胰十二指肠切除联合门静脉(PV)或肠系膜上静脉(SMV)切除重建治疗胰腺癌的疗效。方法行胰腺癌根治切除的158例患者,按有无联合PV/SMV切除分成两组,无血管切除组99例(对照组),联合PV/ SMV切除重建组59例(观察组)。比较分析两组患者的术前、手术和随访资料,重点分析联合PV/SMV切除重建对术后并发症和生存状况的影响。结果两组术前CA199阳性率观察组(83.1%)显著高于对照组(64.6%)(<0.05)。两组手术时间及手术出血量差异均有统计学意义(均<0.01)。两组患者围手术期均无死亡病例,各种并发症发生率差异均无统计学意义(均>0.05)。两组中位生存时间差异无统计学意义(=0.710)。结论对胰腺癌合并PV/SMV侵犯的患者应严格掌握其手术指证,充分评估其体力状况,如能根治切除有一定价值。
胰腺肿瘤;癌;联合静脉切除重建;并发症;预后
胰腺癌是一种进展快及恶性程度高的消化系统恶性肿瘤,手术切除目前被公认为是无远处转移的早期和局部进展期胰腺癌患者的首选治疗。由于局部解剖毗邻关系,胰腺癌易侵犯门静脉/肠系膜上静脉(PV/SMV),这加大了手术切除难度和发生严重并发症的可能。随着外科技术的进步,侵犯PV/SMV的胰腺癌已不是手术禁区[1]。本文拟探讨联合PV/SMV切除重建的胰十二指肠切除术治疗胰腺癌的疗效,报道如下。
1 资料与方法
1.1一般资料收集2009年1月至2014年3月宁波市医疗中心李惠利医院收治的行胰腺癌根治切除术患者158例,病理均证实为上皮来源恶性肿瘤,排除非上皮来源恶性肿瘤、转移性癌及术中发现腹膜或肝等远处转移患者。其中男102例,女56例;年龄30~83岁,中位年龄63岁。术前诊断依靠中上腹增强CT和/或增强MRI,结合肿瘤标记物。胰腺导管腺癌153例,其他5例。按照治疗方法的不同将158例患者分为观察组及对照组,观察组59例,行联合PV/ SMV切除重建的胰十二指肠切除术治疗;对照组99例,未行血管切除。
1.2手术方式158例患者中行胰十二指肠切除(PD)135例,全胰十二指肠切除(TPD)23例,TPD和DP通常联合脾切除,胰消化道重建较多采用自行设计嵌入式胰胃吻合术式[4]。
血管切除重建方式:肿瘤血管是否侵犯及侵犯程度依据术前影像学检查结合术中探查判定。除少数肿瘤侵犯PV/ SMV血管周径不到1/3者采用楔形切除修补外,对于 PV/SMV受侵周径≥1/3,均常规切除受侵血管,端端吻合。血管切除术式均采用动脉优先入路,将PV/SMV的切断放在标本切除的最后阶段。先解剖悬吊肝总动脉(CHA)和肠系膜上动脉(SMA),清扫肝总动脉周围,腹腔动脉(CA)和SMA之间及其右侧的脂肪淋巴神经结缔组织,结扎内含的动脉小分支和胰十二指肠下动脉,充分游离显露肿瘤浸润上下端静脉,切断周围其他脏器和组织与标本的联系,使待切除标本仅通过肿瘤浸润部位连接在PV/SMV上。然后静脉阻断钳阻断后切断PV/SMV,移去标本,切除静脉上下端送快速切片。静脉吻合采用5-0或6-0proline线连续吻合重建(1点支持端端吻合),打结前松开阻断钳,先开放近端,待吻合口充分膨胀,血凝块和空气随血液涌出后开放远端,再缓缓打结,无需预留“扩张环”。静脉切除长度≤4.0 cm多能原位重建,张力较大时静脉上下端充分游离,必要时松解肝镰状韧带和右结肠侧腹膜直至回盲部(小肠系膜根部)以减少张力。静脉切除长度>4.0 cm,或经上述松解后仍张力较大时,颈内静脉或人工血管间置重建。
1.3观察指标随访采用门诊复查结合电话询问的方式,随访时间截止2014 年9月。158例中13例在术后6~8个月失访,随防率为91.7%,中位随访时间28个月(6~62个月)。主要观察两组并发症发生情况[2-3]:(1)胰瘘:按国际胰腺外科研究组(ISGPS)关于胰瘘的定义,分为A、B及C 3级;(2)胆瘘:手术3d以后,胆汁样引流液胆红素定量超过血浆水平或经引流管造影证实;(3)胃排空延迟(DGE):鼻胃管术后7 d仍不能拔除或术后3 d再次置入并经消化道造影证实;(4)腹内出血或消化道出血[4]:术后腹内或消化道出血致血压波动,需输血400 ml或以上(或输红细胞悬液≥2 U);(5)切口感染或裂开:切口浓性分泌物,经开放引流,延期愈合或裂开需再缝合;(6)腹腔感染:术后5 d仍持续发热,白细胞升高,影像学提示腹腔内局部病灶;(7)乳糜瘘:术后3 d,腹腔引流管内乳糜样液≥30 ml或乳糜试验阳性;(8)顽固性腹泻:术后1周每天腹泻超过5次,持续3 d。术后住院死亡或30d内死亡者,计作术后病死率。
1.4统计方法数据采用SPSS19.0软件处理,计量资料采用均数±标准差表示,采用t检验;计数资料采用2检验;生存时间从手术当天开始计算,直至患者死亡或失访。Kaplan-Meier法绘制生存曲线,生存分析采用log-rank检验。<0.05为差异有统计学意义。
2 结果
2.1一般资料比较两组年龄、性别、糖尿病例数、黄疸例数、病理分期、术前清蛋白水平及总胆红素量差异均无统计学意义(均>0.05)。手术时间、手术出血量、术后住院时间及CA199阳性率差异均有统计学意义(均<0.05)。见表1~2。

表1 术前和手术一般资料比较
2.2PV/SMV切除重建观察组3例为侧壁切除修补,另56例为PV/SMV部分切除,切除静脉长度为1~5cm,其中颈内静脉间置重建各1例,余均原位端端吻合重建成功,无静脉血管栓塞或血管狭窄发生。在PV/SMV切除重建病例中联合脾静脉切断结扎25例,其中联合脾动脉结扎2例,无术后脾梗死或局限性门高压发生。
2.3术后并发症比较两组患者围手术期均无死亡病例,各种并发症发生率差异均无统计学意义(均>0.05),见表3。2.4生存情况分析本研究158例患者中位生存期为15个月,总1、3和5年存活率分别为67.0%、24.1%和14.7%。两组中位生存时间分别为15及17个月,差异无统计学意义(=0.710),见图1。
3 讨论
在消化道肿瘤中,胰腺癌预后极差。Wood等[5]报道,胰腺癌总体切除率仅为20%。尽管Fortner[6]早在1973年就提出了联合胰周大血管和广泛软组织清扫的胰腺癌区域扩大切除技术,但由于创伤大、病死率高且预后无明显改善而未被多数胰腺外科学者接受。上世纪90年代开始,不少学者相继报道与标准的胰腺癌根治切除术相比,联合PV/SMV切除重建胰腺癌扩大根治切除术的并发症发生率和病死率并无显著增加,中位生存期亦可与前者相媲美[7-8]。目前多个国内外专家共识和指南对联合PV/SMV切除均持较为积极的态度[9-10]。联合PV/SMV切除重建是否能改善患者的预后水平也存在争议。Nakagohri等[11]根据术后病理将联合PV/SMV切除患者分为血管壁确系肿瘤侵犯者和血管壁无肿瘤侵犯者,随访结果发现前者预后显著差于后者。实际临床实践中发现如有门静脉内癌栓形成者或门静脉全层浸润者,术后往往很快发生肝转移。但是在未切除血管之前很难真正判断血管壁是否肿瘤浸润,而其中有相当一部分实系血管周围组织浸润或血管外膜受侵,或仅为炎性粘连。目前国内外胰腺癌诊治指南均将术前影像学检查PV/SMV局限受累,狭窄、扭曲或闭塞,但远近端正常,可切除重建者归类为可能切除。术前加强阅片,开展PV/SMV受累影像学表现分级与病理学肿瘤浸润程度和切缘阳性关系的研究,选择合适的患者进行新辅助化疗将是改善胰腺癌患者预后的重要途径。
本研究中发现观察组手术时间及术中出血量上均多于对照组,但两组围手术期病死率及术后1、3及5年生存率差异均无统计学意义(均>0.05)。以上说明尽管联合静脉切除重建手术难度增加,手术时间延长,术中出血增多,但可显著提高切除率,延长术后生存时间。
对于PV/SMV切除后,有报道称[12]缺损达7~8cm仍可以直接吻合,而在实践中发现,当缺损血管≤4.0 cm时,一般仍可以原位重建,但当缺损>4.0 cm时,要游离肝脏及小肠系膜,甚至离断脾静脉来增加两断端活动度达到无张力吻合,或采取异体或自体血管架桥吻合。本研究中一共有25例患者离断脾静脉,无术后脾梗死或局限性门高压发生,所以笔者认为离断脾静脉是安全的,但仍需要大样本的研究验证。
综上所述,对于单纯侵犯PV/SMV的胰腺癌实行联合PV/SMV切除重建在内的扩大切除术,需要充分评估患者的体力及营养状况,判断其能否耐受术后并发症,在手术风险及远期生存获益中间权衡利弊。在谨慎选择合适患者的前提下,PV/SMV切除重建安全可行,能提高切除率,延长患者的存活时间。
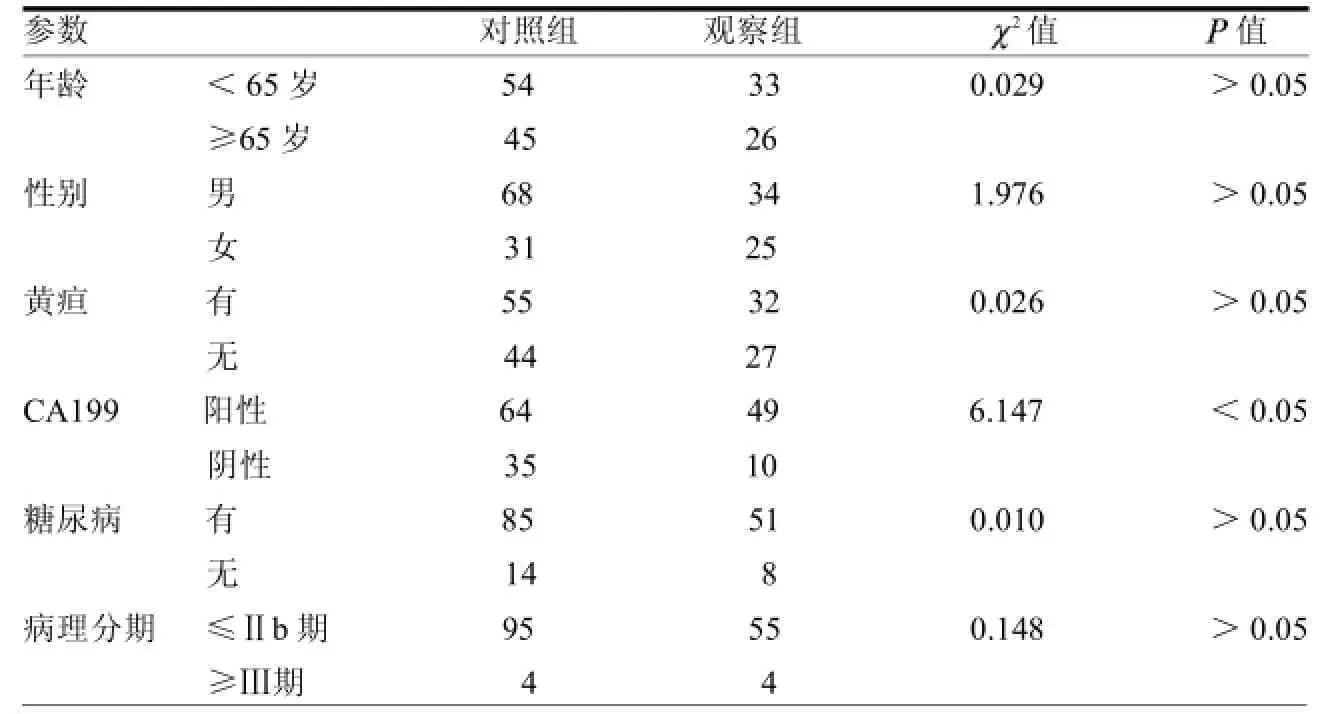
表2 术前和手术一般资料比较 例
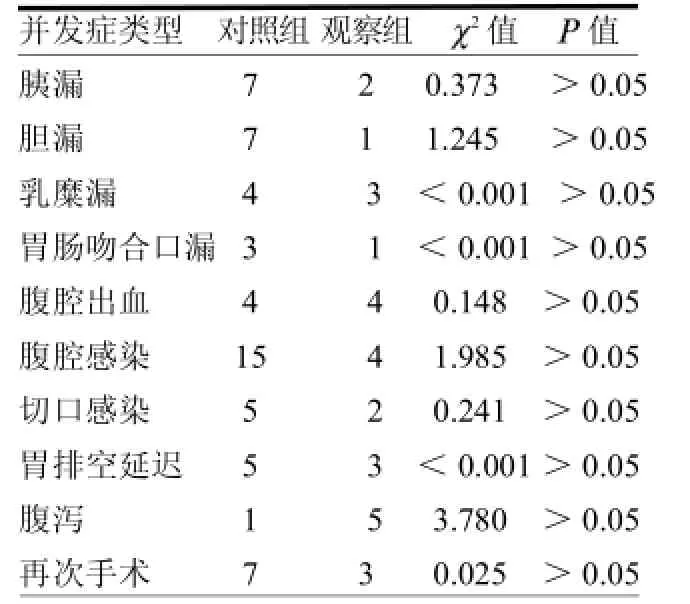
表3 两组术后并发症比较 例
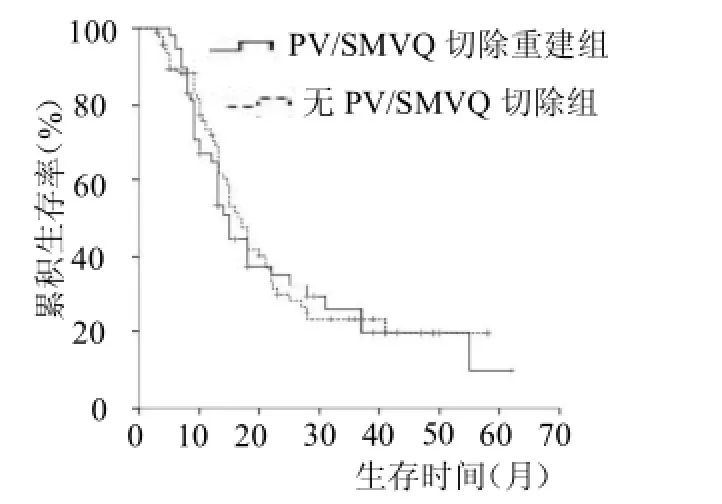
图1 两组生存曲线
[1]WangWL,YeS,YanS,etal.Pancreaticoduodenectomy with portal vein/superior mesenteric veinresection for patientswith pancreatic cancer with venous invasion[J]. Hepatobiliary Pancreat Dis Int,2015,14 (4):429-435.
[2]中华医学会外科学分会胰腺外科学组,中华外科杂志编辑部.胰腺术后外科常见并发症预防及治疗的专家共识(2010)[J].中华外科杂志,2010,48(18):1365-1368.
[3]Bassi C,Dervenis C,Butturini G,et al. Postoperative pancreatic fistula:an international study group(ISGPF)definition[J]. Surgery,2005,138(1):8-13.
[4]陆才德,吴丹,裘丰,等.胰十二指肠切除术及保留十二指肠的胰头(颈)切除术后出血原因及处理[J].中华普通外科杂志, 2007,22(12):899-901.
[5]Wood HE,GuptaS,Kang JY,et al.PancreaticcancerinEnglandandWales1975-2000: patterns and trends in incidence,survival and mortality[J].Aliment Pharmacol Ther, 2006,23(8):1205-1214.
[6]Fortner JG.Regional resection of cancer of the pancreas:a new surgical approach[J]. Surgery,1973,73(2):307-320.
[7]Fuhrman GM,Leach SD,StaleyCA,et al. Rationale for en bloc vein resection in the treatment of pancreatic adenocarcinoma adherent to the superior mesenteric-portal vein confluence.Pancreatic Tumor Study Group[J].Ann Surg,1996,223(2):154-162.
[8]Harrison LE,Klimstra DS,Brennan MF. Isolated portal vein involvement in pancreatic adenocarcinoma.A contraindication for resection[J]?Ann Surg,1996,224 (3):342-349.
[9]中华医学会外科学分会胰腺外科学组.胰腺癌诊治指南(2014)[J].中国实用外科杂志,2014,34(11):1011-1014.
[10]赵玉沛.2011年《NCCN胰腺癌临床实践指南》(中国版)解读[J].中华外科杂志, 2011,49(9):771-773.
[11]Nakagohri T,Kinoshita T,Konishi M,et al.Survival benefits of portal vein resec-tion for pancreatic cancer[J].Am J Surg, 2003,186(2):149-153.
[12]Mascoli C,D'Ambra M,Casadei R,et al. Portal/Superior mesenteric vein reconstruction during pancreatic resection using a cryopreserved arterial homograft[J]. Dig Surg,2015,32(4):284-290.
10.3969/j.issn.1671-0800.2016.02.013
R735.9
A
1671-0800(2016)02-0167-04
2015-11-13
(本文编辑:钟美春)
宁波市肝胆胰肿瘤多学科诊治和转化医学创新团队项目(2013B82010)
315041宁波,宁波市医疗中心李惠利医院
陆才德,Email:lucaide@nbu.edu.cn
