胰岛素依赖型糖尿病大鼠Chock血管扩增的观察研究
2016-09-21魏鹏陈薇薇王建红胡斯旺吴东方唐茂林丁茂超梅劲章伟文
魏鹏,陈薇薇,王建红,胡斯旺,吴东方,唐茂林,丁茂超,梅劲,章伟文
胰岛素依赖型糖尿病大鼠Chock血管扩增的观察研究
魏鹏,陈薇薇,王建红,胡斯旺,吴东方,唐茂林,丁茂超,梅劲,章伟文
目的通过新型大鼠皮肤血管实时观察窗套件(皮窗)直视下观察糖尿病大鼠和正常大鼠背部穿支体区间Choke血管密度变化情况,以探讨糖尿病对大鼠皮瓣Choke血管扩增产生的影响。方法40只成年SD大鼠随机分两组,对照组20只(正常大鼠),实验组20只[腹腔注射链脲佐菌素(STZ)诱导糖尿病模型]。两组大鼠均选择左、右髂腰动脉穿支体区间的微血管吻合(即Choke血管)区为目标观察区制作皮瓣模型,分时间点进行灌注、摄X线片,在Scion Image Beta 4.02中测量各时间点穿支体区间Choke血管的灰度值和穿支体区血管的灰度值,并计算它们的比值(谷-峰比),通过对比总结糖尿病对体区间Choke血管变化规律的影响。结果两组Choke区皮窗内血管数目、血管直径、血流速度、血管扩增率及灰度值的谷-峰比差异均有统计学意义(均。结论大鼠背部Choke体区及Choke体区间血管血管扩增成一定时程差异,糖尿病大鼠亦有此规律,但患糖尿病的大鼠Choke血管生长受到很大影响。
糖尿病;皮瓣;大鼠;Choke血管;血管扩增
1987年Taylor等[1]首先提出了“血管体”概念,并将全身体表划分为40多个“血管体区”。Cormack 等[2]通过分析相邻血管体之间的关系,将皮肤的血管供区依次分为3个层次:解剖学供区、血流动力学供区及潜在供区。在不同供区之间均有丰富的吻合血管(称为Chokevessels[1-3])。唐茂林等[4]解剖学研究显示,Choke vessels是血管体区之间的连接系统,经此一条源动脉可以跨过其直接的边界去营养邻近的皮肤区域。
对糖尿病患者而言,其溃疡形成的基本病理机制“三因素”中,周围血管病变是始动因素,动脉闭塞性病变是造成糖尿病溃疡的重要原因[5]。糖尿病对Chokevessels扩增是否产生影响或产生怎样的影响仍没有具体的相关报道。本研究拟以大鼠为研究对象,选择其左、右髂腰动脉穿支体及其之间的吻合血管(Choke血管)为目标观察区,结合“皮窗直视血流示踪模型”观测胰岛素依赖型糖尿病大鼠Choke血管区的正常开放血管与潜在开放血管进行比较,探讨糖尿病对大鼠皮瓣Choke血管扩增产生的影响。报道如下。
1 资料与方法
1.1动物及分组本实验所有的步骤严格遵循现行动物实验法的规则。取40只300 g左右的成年SD雄性大鼠,温州医科大学实验动物中心提供。室温控制在24℃,大鼠经过12 h光照,喂养标准大鼠饲料和水1周。然后随机分为对照组和实验组,各20只。实验组建立胰岛素依赖型糖尿病模型。
1.2胰岛素依赖型糖尿病模型测量实验组大鼠的初始体质量和基本血糖水平,然后按照相应体质量腹腔注射链脲佐菌素(STZ)来造模。70 mg/kg的STZ溶于0.1molpH值为4.5的柠檬酸钠溶液中,30 min内腹腔注射入大鼠体内。同时,对照组大鼠行无STZ柠檬酸钠溶液腹腔注射。注射72 h后,通过尾静脉测量大鼠的血糖水平。每周用快速血糖仪(瑞迪恩)通过大鼠的尾静脉血测量血糖水平。测量血糖之前禁食8 h,不禁水。
鼠族血糖正常水平为50~135mg/100ml[6]。本研究中,大鼠的空腹血糖水平>16.8mmol/L认定为糖尿病。注射11周后通过测量血糖确定了实验组大鼠的高血糖状态后,并再次称体质量。
1.3安装新型大鼠皮肤血管实时观察窗套件(皮窗)[7-8],体视显微镜观察-指标记录计算取两组大鼠各10只,均腹腔注射戊巴比妥进行麻醉,剂量为40~50 mg/kg。伸展大鼠四肢固定在平板上,背部手术区域先剪去毛,然后用脱毛膏去干净毛根。背部去毛后,根据大鼠背部主要穿支动脉分布特点,选取左髂腰动脉穿支体之间的Choke血管作为观察对象并设计皮瓣模型,依据实验需要,设计皮窗(窗口为圆形,直径1 cm,材料为塑料)。安装时不切取皮瓣及离断穿支以免影响正常血流,手术时皮窗观察窗要对准Choke区(封二彩图4)。用直径1.5 mm微型螺钉、4个0缝线进行缝合固定,然后单笼饲养,给大鼠饲料和水。所有手术操作都由同一个术者完成。
术后1 h,仍在麻醉状态下,应用尾外侧静脉注射1 m1 2%的伊文思蓝(Evans blue,Sigma公司)方法,体视显微镜(Leica-DFC320,莱卡公司)10倍目镜下活体直视观察(每次观测时,采用相同放大倍数)。用数码相机摄片记录Choke血管区的数目、直径、曲度、血流速度及血管扩增率等指标。在两只通过尾外侧静脉注射伊文思蓝的大鼠身上,通过皮窗,Choke区完整的动静脉循环都能通过视频完整的记录下来。通过测量某一段动脉的长度及从视频读出伊文思蓝流过这段动脉的时间,便能算出任一节段内动脉的血流速度。封二彩图5为伊文思蓝第1次经过皮窗内血管网的4张截图。在显微镜活体直视皮窗中测量红色箭头标志的血管的长度,从视频可以读出伊文思蓝从这段动脉的起点到端点共花费的时间,从而可以算出这段动脉内的血流速度。再分4个视野拍照后重新合成,统一视野大小和像素,导入Scion Image Beta 4.02内,每个象限内任意挑选2个较为固定的血管测量点(Choke动脉),术后1h测量Choke血管相对直径(以像素表示)。
1.4谷-峰比计算另取两组大鼠各10只,麻醉后开胸、腹腔,经左心室插灌胃针,37℃0.9%氯化钠注射液灌洗体循环后,以20%明胶(Sigma BY12100,Boyun Biotech)-氧化铅(国药集团上海化学试剂有限公司)混悬液(容重比为1∶1),按100 ml/kg体质量的剂量行体循环动脉灌注,再将大鼠置于-20℃的冰柜中,2 h后取下大鼠整块皮肤,摄X线片(摄片参数:球管高度105cm,电压75kV,曝光时间250ms,曝光方式100mA大焦)。将所得X线片导入Scion Image Beta 4.02内,截选左、右髂腰动脉穿支体及之间的区域,绘制灰度值的地图及其线性渐变图,读取两穿支体区灰度值(以峰值主体部分读数),即为VP1、VP2,以及穿支体区之间微血管吻合区的灰度值VV,计算“VV/[(VP1+VP2)/2]”,即为灰度值的“谷-峰比”(封三彩图1)
1.5统计方法数据采用SPSS16.0软件处理,计量资料采用均数±标准差表示,采用t检验。为差异有统计学意义。
2 结果
两组Choke区皮窗内血管数目、血管直径、血流速度、血管扩增率及灰度值的谷-峰比差异均有统计学意义(均见表1。
3 讨论
3.1Choke血管研究中应用的2个重要参数[7-8]
3.1.1谷-峰比本文谷-峰比实验中的对象为活体SD大鼠,经左心室作主动脉插管、以37℃0.9%氯化钠注射液充分灌洗体循环后,明胶-氧化铅混悬液填充动脉并能进级的微血管,氧化铅颗粒对微血管充填效果良好,摄X线片不但能显示较粗动脉,还能显示大体视野中肉眼不能见的微血管,未见微血管显影不连续。因此,基于X线灰度值计算得出的谷-峰比,更能体现“穿支体区间的微血管总量”和“穿支体区血管总量”的比率,其变化曲线反映了穿支体区间微血管总密度的变化情况。
3.1.2扩增率实验过程中,在体视显微镜下选定为固定测量点的血管,在观察视野中多相对较粗的choke血管,计算所得的扩增率呈时相性变化,可以体现相对较粗choke血管的扩增规律(其形成第二个扩增高峰的原因也还有待研究)。但细微的choke血管信息却未被涵盖在其中,该指标也就不能反映细微choke血管的变化规律。
3.2糖尿病对Choke血管影响的分析
3.2.1糖尿病对Choke血管血流的影响本实验结果显示糖尿病大鼠Choke区皮窗内血管的血流速度相比对照组缓慢。皮瓣存活最重要的因素是皮瓣微循环有足够的血流量来提供营养,而糖尿病血管病变的始动因素是内皮功能受损导致的血管炎症反应。糖尿病高血糖、高胰岛素以及氧化应激等因素引起内皮细胞结构和功能改变,进而导致血管损害[9]。Loomans等[10]和Tepper等[11]分别通过研究证明糖尿病患者内皮祖细胞(EPCs)的数量下降、功能降低,无论1型还是2型糖尿病,其EPCs的增殖、黏附、整合入血管结构以及成血管能力均显著下降,表明糖尿病患者血管修复、血管生成能力降低。
同时糖尿病患者,由于组织生长、再生和修复过程中的改变,其蛋白质合成降低的同时代谢增强,成纤维细胞减少,这就导致愈合功能的降低。Rendell 等[12]报道糖尿病大鼠背部和尾部的血流在第4周降低,这与糖血红蛋白的升高是一致的。糖尿病期间[13],营养皮肤、肌肉的血循环降低,内皮增生,增加了血小板的黏附性和聚集性,促进血栓素的产生,引起脂蛋白机制的变化。糖尿病导致的高血糖症导致静脉回流障碍。所有这些效应引起高凝结状态[14],导致皮瓣微循环血流减慢、血流量减少。
3.2.2糖尿病对 Choke血管扩增率和谷-峰值的影响本实验中,对照组Choke血管扩增率和谷-峰值与胡斯旺等曾报道的结果基本一致,不同时间段左、右髂腰动脉穿支体区间的Choke血管扩增规律为:在第1天即逐渐增粗,至第4~6天达高峰,然后逐渐下降,第10~16天时再次出现增粗[8]。谷-峰比值基本都在第3天达到峰值[7]。实验组Choke血管扩增率和谷-峰值与对照组比较也呈现一定的时程差异,但是在各个对应时间点上数值明显减小,而且差异有统计学意义(均。说明糖尿病组大鼠Choke血管受到某种程度的损害及其再生受到一定程度的限制。
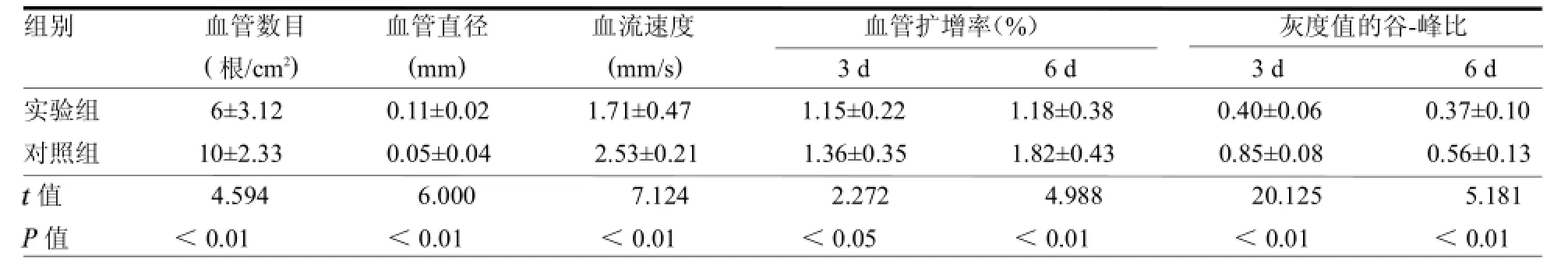
表1 两组Choke区皮窗内观察指标比较
综上所述,通过皮窗直视下观察大鼠背部Choke血管密度变化情况得知大鼠背部 Choke体区及Choke体区间血管血管扩增成一定时程差异,糖尿病大鼠亦有此规律,但是患糖尿病的大鼠Choke血管生长受到很大影响,即糖尿病对Choke血管在某种程度影响了其正常生长。至于糖尿病具体通过何机制影响Choke血管的生长及采取何种方法减小这种影响有待于进一步研究。
[1]Taylor GI,Palmer JH.The vascular territories(Angiosome)of the body:experimental study and clinical applications[J].Br J Plast Surg,1987,40(2):113-141.
[2]Cormack GC,Lamberty BG.The arterial anatomy of skin flaps[J]. Br J Plast Surg,1986,39(3):300-306.
[3]Taylor GI,Minabe T.The angiosomes of the mammals and other vertebrates[J].Plast Reconstr Surg,1992,89(2):181-215.
[4]Tang M,Yin Z,Morris SF.A pilot study on three-dimensional visualization of perforator flaps by using angiography in cadavers[J].Plast Reconstr Surg,2008.122(2):429-437.
[5]管珩,刘志民,李光伟,等.50岁以上糖尿病人群周围动脉闭塞性疾病相关因素分析[J].中华医学杂志,2007.87(1):23-27.
[6]Kamal K,Powell RJ,Sumpio BE.The pathobiology of diabetes mellitus:implications for surgeons[J].J Am Coll Surg,1996,183 (3):271-289.
[7]胡斯旺,毛海蛟,庄跃宏,等.再探大鼠背部穿支体区间choke血管变化规律[J].中国临床解剖学杂志,2014,32(6):690-693.
[8]胡斯旺,庄跃宏,崔怀瑞,等.大鼠背部穿支体区间choke血管变化规律初探[J].中国临床解剖学杂志,2014,32(5):580-584,589.
[9]Nassar T,Kadery B,Lotan C,et al.Effects of the superoxide dismutase mimetic compound tempol on endothelial dysfunction in streptozotocin induced diabetic rats[J].Eur J Pharmacol,2002, 436(1/2):111-118.
[10]Loomans C,Koning E,Staal F,et al.Endothelial progenitor cell dysfunction a novel concept in the pathogenesis of vascular complications of type 1 diabetes[J].Diabetes,2004,53(1):195-199.
[11]Tepper OM,Galiano RD,Capla JM,et al.Human endothelial progenitor cells from type 2 diabeties exhibit impaired proliferation, adhesion,and incorporation into vascular structures[J].Circulation,2002,106(22):2781-2788.
[12]Rendell MS,Kelly ST,Finney D,et al.Decreased skin blood flow early in the course of streptozotocin-induced diabetes mellitus in the rat[J].Diabetologia,1993.36(10):907-911.
[13]Kassab JP,Guillot R,Andre J,et al.Renal and microvascular effects of an aldose reductase inhibitor in experimental diabetes.Biochemical,functional and ultrastructural studies[J].Biochem Pharmacol,1994,48(5):1003-1008.
[14]Colwell JA,Nair RM,Halushka PV,et al.Platelet adhesion and aggregation in diabetes mellitus[J].Metabolism,1979,28(4 Suppl 1):394-400.
(本文编辑:钟美春)
Observation on enlargement of choke vessels among insulin dependent diabetic rats
【Abstract】ObjectiveTo observe the change of density of choke vessels between bilateral iliolumbar perforators in insulin dependent diabetic rats and normalrats to explore the influence to the enlargement ofchoke vessels caused by diabetes mellitus(DM).MethodsForty adult SD rats were divided into two groups randomly;20 normal rats were in the control group,and the others were in the experimental group which were induced by intraperitoneal injection of STZ to be diabetic models.Microvascular anastomoses(choke vessels)were chosen,with the target area designed as the flap model in rats,which was located between the left and right iliac lumbar perforating branches;then gelatinlead oxide angiography was performed.The grey values of choke vessels area(V-valley)and perforasomes(V-peak) were measured in Scion Image Betta 4.02,then the ratio of them was calculated in various time points to summarize the lawofchange ofdensity of choke vessels caused by DM.ResultsThere were significantdifferences in number ofchokevessels,thediameterofchokevessels,the blood velocity,the enlargementratioofchokevesselsandthe ratio of V-valley and V-peak of grey values of choke vessels(all<0.05).ConclusionsThe enlargement of vessels between choke vessels and the perforasomevessels variesfrom time to time,as well asthe insulin dependentdiabetic rats. However,the growth of choke vessels of DM rats is limited.
Diabetes mellitus;Flap;Rat;Choke vessel;Enlargement of vessel
·病例报告·
·论 著·
10.3969/j.issn.1671-0800.2016.02.004
R332
A
1671-0800(2016)02-0150-04
2015-11-17
宁波市自然基金资助项目(2013A610264,2015A610207);宁波大学校级科研项目(xyy15026)
315100宁波,宁波市第六医院(魏鹏、章伟文);宁波大学医学院附属医院(陈薇薇、王建红、胡斯旺);温州医科大学解剖教研室(唐茂林、梅劲、丁茂超、吴东方)
章伟文,Email:673362776@qq.com
