运用新型Briggs-Rauscher化学振荡测定橙皮素
2016-09-20宋继梅沈效峰
陈 娟,胡 刚*,张 宇,宋继梅,沈效峰,胡 林
(1.安徽大学 化学化工学院,安徽 合肥 230601; 2.华东交通大学 应用化学研究所,江西 南昌 330013)
运用新型Briggs-Rauscher化学振荡测定橙皮素
陈娟1,胡刚1*,张宇1,宋继梅1,沈效峰1,胡林2
(1.安徽大学 化学化工学院,安徽 合肥 230601; 2.华东交通大学 应用化学研究所,江西 南昌 330013)
利用橙皮素对四氮杂大环镍催化的Briggs-Rauscher(BR) 化学振荡体系(KIO3-[NiL](ClO4)2-H2SO4-H2O2-MA) 的扰动建立测定橙皮素的新方法.其中,四氮杂大环镍配合物[NiL](ClO4)2中的配体L为5,7,7,12,14,14-六甲基-1,4,8,11-四氮杂环-4,11,-二烯.分析结果表明, 当橙皮素的浓度在1.5×10-6~1.58×10-4mol·L-1之间时,抑制时间与加入橙皮素浓度之间有良好的线性关系.文章对各组分浓度的影响进行探讨, 从而获得最佳检测浓度,同时运用循环伏安对其扰动机制进行了探讨.
Briggs-Rauscher;化学振荡;四氮杂大环配合物;橙皮素
近年来,越来越多的化学振荡实验用于分析检测的文章见于报道,如Belousov-Zhabotinsky(BZ)体系检测酪氨酸[1]、氨基水杨酸[2]、龙胆酸[3]和维生素B6[4].而Mn2+或Ce3+催化的Briggs-Rauscher(BR)振荡反应开始应用于分析检测领域,某些物质的检测限可达到10-6~10-5mol·L-1的数量级,如对邻苯二酚、香草酸、大头异黄酮、阿魏酸、橄榄苦苷[5]等物质的检测.BR化学振荡体系在分析天然抗氧化物的抗氧化性能上,也显示出优势[6-10].随着人们对健康的重视,天然抗氧化剂成了医学领域的热点[11],抗氧化剂可以用来预防各种由自由基引起的疾病,对其的检测也是热门的研究领域.
橙皮素是一种天然抗氧化剂, 它存在于芸香科柑橘属植物果实中,所以橙皮素的主要是从芸香科植物枸橘的果实中进行提取.橙皮素由于其具有抗氧化特性,一直以来备受一些化妆品商家的喜爱,如CLARINS(娇韵诗)的化妆品中就含有橙皮素.通常测量橙皮素的方法主要是通过高效液相色谱法[12],但这种方法操作比较复杂且检测历时较长.
笔者实验小组在运用BZ和BR体系检测领域的工作中已经形成了一系列的成果[13-20].该文中笔者用于分析测定的BR体系为KIO3-[NiL](ClO4)2-H2SO4-H2O2-MA(其中L为,7,7,12,14,14-六甲基-1,4,8,11,-四氮环杂十四-4,11-二烯).笔者就是通过橙皮素对该体系的扰动从而达到检测橙皮素的目的.该实验方法与高效液相色谱法相比,具有操作简便容易并且检测下限较低、灵敏度高等优点.笔者使用的大环金属配合物NiL同Mn2+或Ce3+金属离子NiL相比,大环金属配合物所含有的大π结构能使电子传递得更快[21].由于化学振荡与生物体系中的生物振荡具有相似性,且实验中所用的NiL为四氮杂大环二烯镍,它与生物体中的酶具有相似的卟啉环结构,因此通过分析一些天然抗氧化剂对化学振荡反应的干扰,可更好地了解生化振荡规律.
1 材料与方法
1.1仪器与试剂
213型铂电极,上海仪电科学仪器股份有限公司;217-01型参比电极,上海仪电科学仪器股份有限公司;DZCS-IIC超级恒温水浴,南京大展科教实验研究所;79-3型恒温磁力加热搅拌器,江苏金坛国胜仪器厂;ZNHW-II型电子节能控温仪,巩义市予华仪器有限责任公司;AB204~N型电子分析天平,梅特勒-托利多仪器上海有限公司;INA-BTA仪器放大器,Go!Link数据采集器.
实验所用试剂KIO3、MA、98%H2SO4、H2O2、橙皮素均为分析纯,[NiL](ClO4)2按照文献[22]合成,溶液均用二次蒸馏水配制,而橙皮素用乙醇配成0.01mol·L-1,使用前按要求稀释.
1.2实验方法
参比电极和铂电极通过仪器放大器(InstrumentAmplifier)连接到数据采集器(GO!LINK),然后再连接到电脑.调节搅拌器的转速为500r·min-1左右. 冰浴环境下控制温度在4 ℃左右.振荡实验开始前,打开loggerlite程序,进行如下操作:点击实验→数据采集→取样速度改为0.5s/次,采集长度(时间)设为3 000s.
在50mL烧杯中用移液管按如下顺序加入不同体积的以下各溶液:0.14mol·L-1的KIO3溶液,6mL;0.0173M的NiL[NiL](ClO4)2,2mL;2M的MA,3mL;1mol·L-1的H2SO4溶液,1mL;并加入14mL的二次蒸馏水,然后插入铂电极(工作电极)和甘汞电极(参比电极).最后加入4mol·L-1的H2O2溶液14mL,使总体积保持在40mL.此时溶液中各项浓度为:KIO3为0.021mol·L-1;NiL为0.865mmol·L-1;MA为0.15mol·L-1;H2O2为1.4mol·L-1;H2SO4为0.025mol·L-1,迅速点击开始键,电脑开始自动记录实验数据.图1是电脑所记录的以MA为底物、四氮杂大环镍配合物为NiL的典型BR化学振荡的图形.此时会观察到溶液的颜色和电势均呈现周期性的变化.
由图1可知,BR振荡经过一段时间的诱导期后出现振荡现象,并且随着时间的推移,化学振荡趋于稳定.因橙皮素需溶解在乙醇中,为了探讨乙醇对体系的影响,故取少量乙醇加入体系中(各物质浓度与经典振荡体系中浓度相同)如图2b所示,可以发现乙醇对BR体系基本无影响.重新建立BR振荡体系,其各组分浓度与空白对照组相同,在振荡的第6个振荡电位最低点处加入一定量的溶解于乙醇的橙皮素溶液,所获得的振荡响应图谱如图2c所示.
由图2a~b可知,乙醇对经典BR化学振荡体系基本没有影响.因为橙皮素是溶解在乙醇中来作为待测物,以上实验排除了溶剂乙醇对测定橙皮素的影响.图2c显示,橙皮素确实对经典BR化学振荡体系存在一定的扰动,具体表现在当橙皮素加入体系之后,电势下降然后出现一定时间的抑制期,因此记录抑制时间标记为ΔT,从而讨论抑制时间与橙皮素浓度之间的关系.作者进一步探讨了各组分浓度及一些常见离子对分析测定龙胆酸浓度的影响.
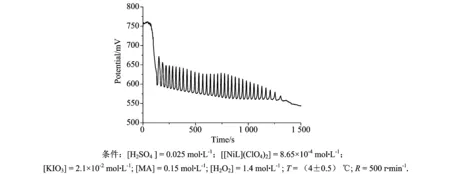
图1 典型振荡图形Fig.1 Typical oscillation profiles
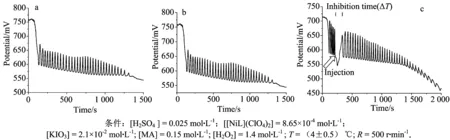
图2 水溶液中铂电极的振荡轨迹(a);10% 无水乙醇/水 (v/v)中铂电极振荡轨迹(b);外加1.5×10-5 mol·L-1的橙皮素后铂电极的振荡轨迹(c)Fig.2 Recording of the oscillations of the bright-Pt potential in aqueous solution (a) ; in mixed 10% EtOH/H2 O (b); in the presence of 1.5×10-5 mol·L-1hesperitin (c)
2 结果与讨论
2.1各组分浓度对测定橙皮素的影响
作为体系中各个组成部分,每个组分的改变对体系的稳定性各方面都产生一定的影响,所以应对该实验各个组分浓度进行逐一分析,探讨不同组分的不同浓度对体系检测橙皮素的影响.实验中采用控制变量法,保持实验温度和其他4种初始溶液浓度不变,只改变某一个组分的浓度,然后根据抑制时间和振荡寿命等各个方面的因素来判断检测橙皮素的最优浓度.
保持实验温度和其他4种初始溶液浓度不变,溶液中KIO3的浓度在0.017 5~0.026 25mol·L-1间变化.由图3a可知,随着KIO3浓度的增加,抑制时间是逐步减小的.但是当KIO3浓度为0.017 5mol·L-1时振荡体系具有较大的抑制时间,其恢复振荡后振荡周期变大,寿命较短,并且不稳定.但是当KIO3浓度高于0.021mol·L-1时,虽然恢复振荡后,振荡周期较短,但是振荡寿命较短,且抑制时间较短.当KIO3浓度为0.021mol·L-1时,振荡周期较长并且振荡较稳定,且抑制时间的长短也很合理,于是选择KIO3浓度为0.021mol·L-1作为检测橙皮素的最佳浓度.
同样,探讨MA对体系的影响,控制温度等其他4个组分浓度不变,MA浓度在0.1~0.225mol·L-1之间变化.由图3b可知,随着MA浓度的增加,抑制时间也随之增加.但是当MA达到0.2mol·L-1时,抑制时间虽然较长,但是振荡恢复后振荡极不稳定,且寿命较短.而当MA浓度小于0.15mol·L-1时,虽然振荡周期较长,且振荡寿命也较为合理,但是抑制时间较短.但当MA浓度为0.15mol·L-1时,结合振荡周期、振荡寿命、振荡稳定性和抑制时间等各方面因素考虑都是合理的.因此,选择MA浓度为0.15mol·L-1作为检测橙皮素的最佳浓度.

图3 各组分浓度对化学测定的影响Fig.3 Influence of the concentrations of different compositions on the oscillation system
实验中所运用的NiL是近年来关注的焦点——四氮杂大环配合物.因为其具有含大π键的卟啉环结构,更利于电子的传递.探讨NiL对体系的影响,同样是控制温度等其他4个组分浓度不变,NiL浓度在4.325×10-4~1.297 5×10-3mol·L-1范围内改变.由图3c可知随着NiL浓度的升高,向BR化学振荡体系中加入相同量的橙皮素会得到逐渐减小的抑制时间.通过振荡图谱观察,可知,NiL浓度大于6.48×10-3mol·L-1时虽然具有较长的抑制时间,但是其振荡恢复后,振荡周期变大,且振荡不稳定,振荡个数很少,因此不能选择其作为最佳浓度去检测橙皮素.当NiL浓度为6.48×10-3mol·L-1时,其抑制时间也较长,振荡寿命和振荡周期个数也合理,所以最终选择NiL浓度6.48×10-3mol·L-1作为检测橙皮素的最佳浓度.
酸度是影响BR化学振荡最主要的关键因素.当酸度过低时,振荡会趋于不稳定;但是当酸度较高时,BR振荡体系将不会发生振荡现象.所以对酸浓度的探讨很有意义.探讨H2SO4对体系的影响时控制温度等其他4个组分浓度不变,H2SO4浓度在0.012 5~0.037 5mol·L-1范围内改变.由图3d可知,随着H2SO4浓度的增加抑制时间减小.当H2SO4浓度小于0.025mol·L-1时,体系具有较长抑制时间,但是可以观察到体系在抑制期之前和之后的振幅变化较大,且刚开始恢复振荡时,前面两个振荡周期较大且不是很稳定.而当H2SO4浓度大于0.025mol·L-1时,在振荡恢复后可以看到,振荡振幅下降较快,且振荡周期变大,振荡寿命较之前的较短.综合振荡周期、抑制时间、振荡稳定性、振荡寿命等各个方面的考虑,选择H2SO4浓度为0.025mol·L-1作为检测橙皮素的最佳浓度.
探讨H2O2对体系的影响时控制温度等其他4个组分浓度不变,H2O2浓度在1.0~2.0mol·L-1范围内改变.由图3e可以看出,当H2O2的浓度在1.0~2.0mol·L-1之间变化时,体系的抑制时间是随着H2O2的浓度的增加而减小的.而当H2O2从1.0mol·L-1变为1.2mol·L-1时,可以看到抑制时间突然下降,而后抑制时间则较为平缓地改变.当H2O2浓度为1.0mol·L-1时,体系需要较长的诱导期才会开始振荡,而经过抑制期当系统恢复振荡的时候,振荡体系极不稳定、振荡寿命较为短暂并且伴随着极少的振荡个数.综合振荡周期、振荡恢复后的稳定性、振荡寿命、振荡恢复后的振荡体系的振荡个数,以及诱导期等各个方面的因素,选择H2O2浓度1.4mol·L-1为测量橙皮素的最佳浓度.
2.2橙皮素的分析测定
在上述确定的最佳条件下,利用振荡体系KIO3-[NiL](ClO4)2-H2SO4-H2O2-MA分析测定橙皮素.在振荡体系反应稳定后加入不同浓度的橙皮素,观察不同浓度的橙皮素对振荡体系的扰动.可以发现随着加入的橙皮素的浓度的不断升高,抑制时间也是逐渐增加的,这说明抑制时间对橙皮素的浓度变化有一定的响应.在实验中发现,当橙皮素浓度在1.5×10-6~1.58×10-4mol·L-1时,抑制时间(ΔT)与体系中加入的橙皮素浓度呈线性关系.线性关系如图4所示.据此,可以建立检测橙皮素的方法,从而应用到橙皮素的检测工作当中.
线性关系方程式
ΔT = 2.14×106[hesperetin]+95.68 ( R = 0.983, n = 13) .
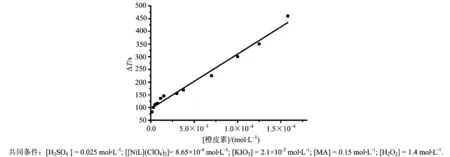
图4 橙皮素浓度与抑制时间的线性关系(浓度范围1.5×10-6~1.58×10-4 mol·L-1)Fig.4 Thelinearship between the concentration of hesperetin and the inhibition time (range 1.5×10-6-1.58×10-4 mol·L-1)
2.3干扰离子的测定
在其他条件都相同的情况下,做重复性实验,会得到近乎相同的结果,这说明橙皮素对BR振荡体系的干扰重复性是良好的,但是化学振荡体系是开放的,所以必须考虑可能对体系产生影响的各种金属离子以及一些无机离子.实验前了解这些离子对体系的可能的影响,尽量避免其干扰,保证实验结果的准确性,一些干扰离子的测定结果如表1所示.

表1 干扰离子的影响
从表1 中看出,Al3+,K2+,Ni+,Na+,Li+对测定几乎没有影响,而F-,Ag+,Cu2+,I-对分析测定橙皮素的干扰很大.而干扰较大的离子都是氧化性或还原性相对较强的离子,它们可能与振荡体系中的某种反应物或生成的某种中间体发生了反应,从而影响了分析测定,所以用振荡体系分析测定物质时,要尽量除去这些干扰性较强的离子.
2.4可能的反应机制
随着BR振荡研究的深入,BR化学振荡机制的探究也在不断进步中,1982年,Noyes和Furrow最先提出BR振荡机制NF[23]模型用以解释BR化学振荡,Furrow[24]在已有的NF模型和DE[25]模型基础上提出了新的FCA模型,此次新的机制主要是加入了H2O2自由基.
基于文献已报道的FCA[26]机制,推测该体系四氮杂大环二烯镍催化的BR化学振荡的可能机制如下:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
MA ↔ MA(enol)
(11)
I2+ MA(enol) → MAI(IMAI) + H2O
(12)
在该实验体系中看到有一定的抑制期,这可能是因为橙皮素的加入扰动了BR化学振荡体系.橙皮素的消耗可能是因为发生了氧化或者碘代反应,橙皮素除了可以和体系中的中间物质发生反应,还可以和溶液组分中的某种反应物发生一定的反应.为了更好地证明橙皮素究竟是跟哪一种或者是哪几种物质反应,作者做了4组循环伏安实验:(Ⅰ)H2SO4+KIO3, (Ⅱ)H2SO4+ [NiL]2+, (Ⅲ)H2SO4+MA, (Ⅳ)H2SO4+H2O2.实验结果显示,橙皮素可以和溶液中的KIO3和四氮杂大环配合物发生反应,如图5所示.

图5 橙皮素与各反应物的循环伏安图Fig.5 Cyclic voltammograms of the reactions between hesperetin and reactants obtained
由图5a可以看出,在酸性KIO3溶液中,当体系中加入橙皮素之后,还原电势会随着加入橙皮素浓度的增加而减小,而氧化峰电势也会随之有些许偏移,这说明橙皮素可以与KIO3溶液发生氧化还原反应.由图5b可以看出,在酸性四氮杂大环镍配合物的溶液中,随着橙皮素浓度的增加,氧化和还原峰均有些许的增大和减小,这说明在酸性四氮杂环镍配合物中,橙皮素可以与四氮杂环镍配合物发生氧化还原反应.
如果橙皮素与四氮杂大环镍配合物或者KIO3反应,那么,反应一定是在瞬间完成,因为橙皮素的浓度极小,瞬间即被氧化.而实验过程中可以发现,抑制时间由几十秒到几百秒不等.假设橙皮素与四氮杂大环镍配合物或者KIO3反应,不能解释几十秒到几百秒的抑制时间.因此,将橙皮素与体系的中间产物反应的可能性纳入考虑范围.抑制期的产生可能是因为橙皮素中的羟基与H2O2自由基反应从而中断了反应链,继而产生几十秒到几百秒的抑制时间.反应如下所示:
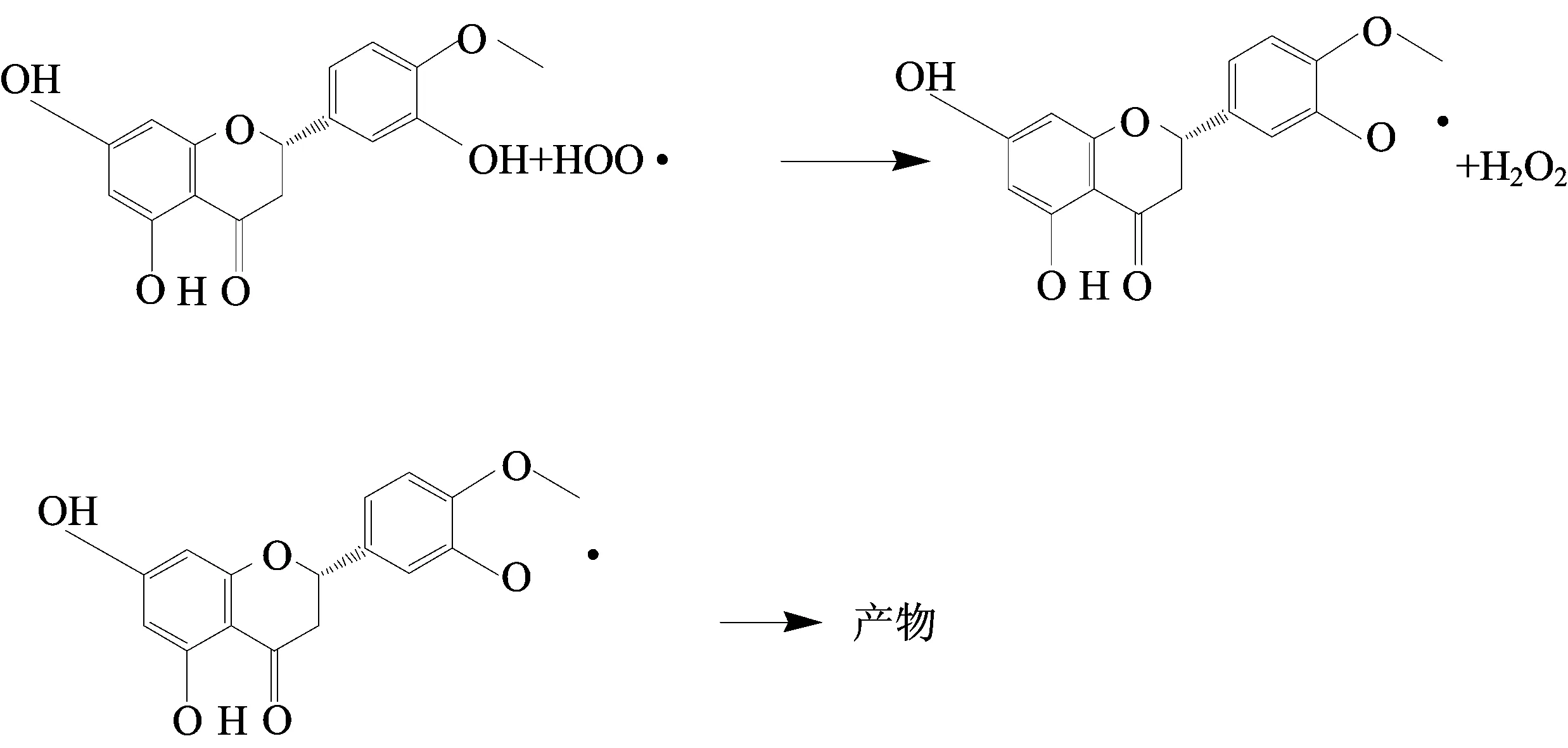
此反应消耗H2O2自由基,根据反应平衡条件可知,当H2O2自由基被消耗时,导致反应(10)步骤中的IO2·的量有所减少,当IO2·减少以后,根据化学平衡原理,反应(8)平衡向左移动,致使溶液中[NiL]3+的量减小,从而使得以下反应不能继续从而中断了反应链.而加入的橙皮素都是微量的,与溶液中各个组分均相差很大,很容易被消耗,当橙皮素被消耗完毕之后,H2O2自由基又可以重新参与反应,可以使反应链继续反应,振荡得以恢复.
3 结束语
笔者主要介绍了一种用四氮杂大环二烯镍催化的新型BR化学振荡检测橙皮素的方法,橙皮素主要来源于植物提取中,在日常生活中有很重大的应用,因此对于橙皮素的检测有重要的实际意义.该方法的提出可以比以往检测橙皮素的方法有很大改善,其操作简单、便宜.因乙醇对该体系并无影响,而绝大部分的有机物均可溶解在乙醇中,所以该方法可以用于检测一些非水溶性的物质.在以往的检测过程中,必须考虑溶剂各方面的影响,而该体系可以不必担心此问题.而且橙皮素浓度在1.5×10-6~1.58×10-4mol·L-1时,其抑制时间又有很好的响应关系,因此该方法可以运用在实际工作当中.
[1]沈慧, 张祖德, 胡刚. 利用溴酸钠-苹果酸-[CuL](ClO4)2-H2SO4化学振荡体系分析测定酪氨酸[J]. 中国科学技术大学学报, 2010, 40 (7): 686-693.
[2]孟敏, 郭咪咪, 胡刚, 等.BZ化学振荡法测定对氨基水杨酸钠[J]. 化学试剂, 2012, 34 (5): 429-431.
[3]王勤, 胡刚, 孟敏. 龙胆酸对B-Z化学振荡反应的影响及其分析测定[J]. 安徽大学学报 (自然科学版), 2012, 36 (3): 79-84.
[4]郭咪咪, 刘海燕, 胡刚. 左旋多巴对四氮杂大环铜配合物催化的化学振荡反应的影响[J]. 淮南师范学院学报, 2010, 12 (3): 14-15.
[5]RINALDOC,CECILIAR,MARIAC,etal.EvaluationofantioxidantactivityofsomenaturalpolyphenoliccompoundsusingtheBriggs-Rauscherreaetionmethod[J].AgricFoodChem, 2002, 50: 7504-7509.
[6]CERVELLATIR,CRESPIPN,FURROWSD,etal.InhibitoryeffectsbysoyantioxidantsontheoscillationsoftheBriggs-Rauscherreaction[J].HelvChimActa, 2000, 83 (12): 3179-3190.
[7]CERVELLATIR,HöNERK,FURROWSD,etal.TheBriggs-Rauscherreactionasatesttomeasuretheactivityofantioxidants[J].HelvChimActa, 2001, 84 (12): 3533-3547.
[8]FURROWSD,HöNERK,CERVELLATIR.AnexperimentalandmechanisticinvestigationofthecomplexitiesarisingduringinhibitionoftheBriggs-Rauscherreactionbyantioxidants[J].HelvChimActa, 2004, 87 (1): 135-155.
[9]GADOKJ,S,KRUHAKI,et.al.ApplicationofBriggs-RauscherreactionformeasurementofantioxidantcapacityofCroatianwines[J].ActaAlimentHung, 2005, 34 (4): 483-492.
[10]HUG,ZENGQL,HUYY,etal.DeterminationofeugenolbyusingaBriggs-Rauschersystemcatalyzedbyamacrocyclicnickel(II)complex[J].ElectrochimicaActa, 2014, 136 (8): 33-40.
[11]ROSSETTOM,VANZANIP,ZENNAROL,etal.Stablefreeradicalsandperoxylradicaltrappingcapacityinredwines[J].JAgricFoodChem, 2004, 52: 6151-6155.
[12]万丽丽, 张剑萍, 孙习鹏, 等.HPLC法测定大鼠血浆中橙皮素和柚皮素的浓度[J]. 中国药师, 2009, 12 (11): 1521-1523.
[13]HUG,ZHANGZD,HUL,etal.AnewoscillatingreactionoftheBelousov-Zhabotinskii-typewithamacrocycliccopper(II)complexascatalyst[J].TransitMetalChem, 2005, 30 (7): 856-860.
[14]HUG,HUL,NISS,etal.Oscillatoryreactionsinthelacticacid/acidicbromatesystemwithatetraazamacrocyclicnickel(ii)complexascatalyst[J].ReactKinetCatalLett, 2006, 88 (2): 349-355.
[15]HUG,ZHANGZD.Anewchemicaloscillatorwithamacrocycliccopper(II)complexascatalystandlacticacidasthesubstrate[J].ChemLett, 2006, 10 (35): 1154-1155.
[16]HUL,HUG,XUHH.KineticdeterminationofAg+usinganovelBelousov-Zhabotinskiioscillatingsystemcatalyzedbyamacrocycliccomplex[J].JAnalChem, 2006, 61 (10): 1021-1025.
[17]CHENP,HUG,WANGW,etal.Determinationofcatecholbasedonanoscillatingchemicalreactioninvolvingamacrocycliccomplexascatalyst[J].JApplElectrochem, 2008, 38 (12): 1779-1783.
[18]CHENL,HUG,ZHANGJ,etal.Kineticdeterminationofcalciumpantothenatebya[CuL](ClO4)2-catalyzedoscillatingsystem[J].MendeleevCommun, 2009, 4 (19): 224-226.
[19]HUG,CHENL,ZHANGJ,etal.DeterminationofalizarinredSusinganovelB-Zoscillationsystemcatalyzedbyatetraazamacrocycliccomplex[J].CentEurJChem, 2009, 7 (3): 291-297.
[20]HUG,CHENP,WANGW,etal.Kineticdeterminationofpyrogallolbyanoveloscillatingchemicalreactioncatalyzedbyatetraazamacrocycliccomplex[J].ElectrochimActa, 2007, 52 (28): 7996-8002.
[21]CERVELLATIR,HöNERK,FURROWSD,etal.InhibitoryeffectsbyantioxidantsontheoscillationsoftheBriggs-RauscherreactioninmixedEtOH/H2Omedium[J].HelvChimActa, 2002, 85 (8): 2523-2537.
[22]HUG,ZHUL.InhibitoryeffectsofrifampicinonaBriggs-Rauscheroscillatingsystem[J].AsianJournalofChemistry, 2010, 22 (8): 6393-6396.
[23]CERVELLATIR,CRESPI-PERELLINON,FURROWSD,etal.InhibitoryeffectsbysoyantioxidantsontheoscillationsoftheBriggs-Rauscherreaction[J].HelvChimActa, 2000, 83 (12): 3179-3190.
[24]FURROWSD,HöNERK,CERVELLATIR.InhibitoryeffectsbyascorbicacidontheoscillationsoftheBriggs-Rauscherreaction[J].HelvChimActa, 2004, 87 (3): 735-741.
[25]KEPPERPD,EPSTEINIR.MechanisticstudyofoscillationsandbistabilityintheBriggs-Rauscherreaction[J].JAmChemSoc, 1982, 104 (1): 49-55.
[26]NOYESRM,FURROWSD.TheoscillatoryBriggs-Rauscherreaction. 3.Askeletonmechanismforoscillations[J].JAmChemSoc, 1982, 104 (1): 45-48.
(责任编辑于敏)
DeterminationofhesperetinbyusingthenewBriggs-RauscheroscillatingsystemCHENJuan1,HUGang1*,ZHANGYu1,SONGJimei1,SHENXiaofeng1,HULin2
(1.CollegeofChemistryandChemicalEngineering,AnhuiUniversity,Hefei230601,China;2.InstituteofAppliedChemistry,EastChinaJiaotongUniversity,Nanchang330013,China)
ThepaperreportedanewmethodtodetecthesperetinbasedontheBriggs-Rauscher(BR)oscillatingsystem(KIO3-[NiL](ClO4)2-H2SO4-H2O2-malonicacid)catalyzedbyanewmacrocyclicnickelcomplexes.TheligandLinthecomplex[NiL](ClO4)2is5,7,7,12,14,14-hexamethyl-1,4,8,11-tetraazacyclotetradeca4,11-diene.Theauthorsdefinetheinhibitiontimeasaparametertodiscusstheinfluence.Asaresult,whentheconcentrationofhesperetinisfrom1.5×10-6to1.58×10-4mol·L-1thereisalinearrelationshipbetweentheconcentrationandtheinhibitiontime.Inordertofindtheoptimumconditiontotestthehesperetinthecontrolvariablemethodwasused.Andthroughthemethodofcyclicvoltammetry,theycanexplorethemechanismaboutthesystem.
Briggs-Rauscher;chemicaloscillatingreaction;macrocycliccomplex;hesperetin
10.3969/j.issn.1000-2162.2016.02.017
2015-06-19
国家自然科学基金资助项目(21171002)
陈娟(1989-),女,安徽亳州人,安徽大学硕士研究生; *胡刚(通信作者),安徽大学教授,博士生导师,E-mail:hugang@ustc.edu.
O643.12
A
1000-2162(2016)02-0101-08
